R : Principes fondamentaux de la physique et de la chimie importants pour la microbiologie
- Page ID
- 187846
Comme toutes les autres matières, la matière qui comprend les microorganismes est régie par les lois de la chimie et de la physique. Les propriétés chimiques et physiques des agents pathogènes microbiens, tant cellulaires qu'acellulaires, dictent leur habitat, contrôlent leurs processus métaboliques et déterminent la façon dont ils interagissent avec le corps humain. Cette annexe passe en revue certains des principes fondamentaux de la chimie et de la physique qui sont essentiels à la compréhension de la microbiologie. De nombreux chapitres de ce texte, en particulier la biochimie microbienne et le métabolisme microbien, supposent que le lecteur comprend déjà les concepts examinés ici.
Structure atomique
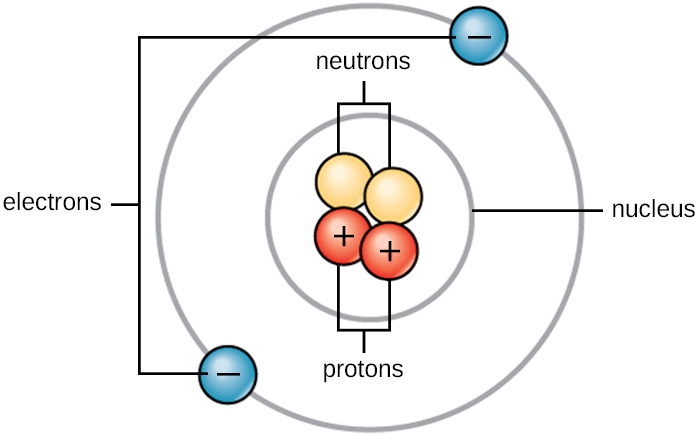
La vie est faite de matière. La matière occupe l'espace et possède une masse. Toute matière est composée d'atomes. Tous les atomes contiennent des protons, des électrons et des neutrons (Figure\(\PageIndex{1}\)). La seule exception est l'hydrogène (H), qui est composé d'un proton et d'un électron. Un proton est une particule chargée positivement qui réside dans le noyau (le cœur de l'atome) d'un atome et qui a une masse de 1 unité de masse atomique (amu) et une charge de +1. Un électron est une particule chargée négativement qui se déplace dans l'espace entourant le noyau. Les électrons sont répartis dans différents niveaux d'énergie appelés couches d'électrons. Les électrons ont une masse négligeable et une charge de -1. Les neutrons, comme les protons, se trouvent dans le noyau d'un atome. Ils ont une masse de 1 amu et sont sans charge (neutres). Les charges positives (protons) et négatives (électrons) s'équilibrent dans un atome neutre, qui a une charge nette nulle. Comme les protons et les neutrons ont chacun une masse de 1 amu, la masse d'un atome est égale au nombre de protons et de neutrons de cet atome. Le nombre d'électrons n'entre pas en ligne de compte dans la masse globale parce que la masse des électrons est si petite.
Éléments chimiques
Toute matière est composée d'atomes d'éléments. Les éléments ont des propriétés physiques et chimiques uniques et sont des substances qui ne peuvent pas être facilement transformées physiquement ou chimiquement en d'autres substances. Chaque élément a reçu un nom, généralement dérivé du latin ou de l'anglais. Les éléments comportent également des symboles d'une ou deux lettres représentant le nom ; par exemple, le sodium (Na), l'or (Au) et l'argent (Ag) ont des abréviations dérivées de leurs noms latins d'origine natrium, aurum et argentum, respectivement. Les exemples d'abréviations anglaises sont le carbone (C), l'hydrogène (H), l'oxygène (O) et l'azote (N). Au total, 118 éléments différents (dont 92 sont naturels) ont été identifiés et organisés dans le tableau périodique des éléments. Parmi les éléments naturels, moins de 30 se trouvent dans les organismes de la Terre, et quatre d'entre eux (C, H, O et N) constituent environ 96 % de la masse d'un organisme. 1
Chaque élément unique est identifié par le nombre de protons dans son noyau atomique. Outre les protons, le noyau atomique de chaque élément contient un nombre égal ou supérieur de neutrons (à l'exception de l'hydrogène, qui ne possède qu'un seul proton). Le nombre total de protons par élément est décrit comme le numéro atomique, et la masse combinée de protons et de neutrons est appelée masse atomique ou numéro de masse. Il est donc possible de déterminer le nombre de neutrons en soustrayant le numéro atomique du nombre de masse.
Les isotopes sont des formes différentes d'un même élément qui contiennent le même nombre de protons, mais un nombre différent de neutrons. De nombreux éléments possèdent plusieurs isotopes, dont un ou deux isotopes courants dans la nature. Par exemple, le carbone 12 (12 C), l'isotope du carbone le plus courant (98,6 % de tout le carbone présent sur Terre), 2 contient six protons et six neutrons. Il a donc un nombre de masse de 12 (6 protons + 6 neutrons) et un numéro atomique de 6.
Il existe deux autres types d'isotopes dans la nature : les isotopes lourds et les radio-isotopes. Les isotopes lourds contiennent un ou plusieurs neutrons supplémentaires tout en maintenant un noyau atomique stable. Le carbone 13 (13 C) (1,1 % de tout le carbone) est un exemple d'isotope lourd. 3 13 C a un nombre de masse de 13 (6 protons + 7 neutrons). Comme le numéro atomique de 13 C est 6, il s'agit toujours de l'élément carbone ; cependant, il a plus de masse que la forme la plus courante de l'élément, 12 C, en raison de la présence de neutrons supplémentaires dans le noyau. Le carbone 14 (14 C) (0,0001 % de tout le carbone) 4 est un exemple de radio-isotope. Le 14 C a un nombre de masse de 14 (6 protons et 8 neutrons) ; toutefois, les neutrons supplémentaires dans le 14 C entraînent un noyau instable. Cette instabilité entraîne le processus de désintégration radioactive. La désintégration radioactive implique la perte d'un ou de plusieurs neutrons et la libération d'énergie sous forme de rayons gamma, de particules alpha ou de particules bêta (selon l'isotope).
Les isotopes lourds et les radio-isotopes du carbone et d'autres éléments se sont révélés utiles dans la recherche, l'industrie et la médecine.
Liaisons chimiques
Trois types de liaisons chimiques sont importants pour décrire l'interaction des atomes à la fois au sein des molécules et entre celles-ci en microbiologie : (1) les liaisons covalentes, qui peuvent être polaires ou non polaires, (2) les liaisons ioniques et (3) les liaisons hydrogène. D'autres types d'interactions, tels que les forces de dispersion de Londres et les forces de Van der Waals, pourraient également être abordés lors de la description des propriétés physiques et chimiques des interactions intermoléculaires des atomes, mais nous n'inclurons pas de description de ces forces ici.
La liaison chimique est déterminée par la couche d'électrons la plus externe, appelée électrons de valence (VE), d'un atome. Le nombre de VE est important pour déterminer le nombre et le type de liaisons chimiques qu'un atome va former.
Liaisons covalentes
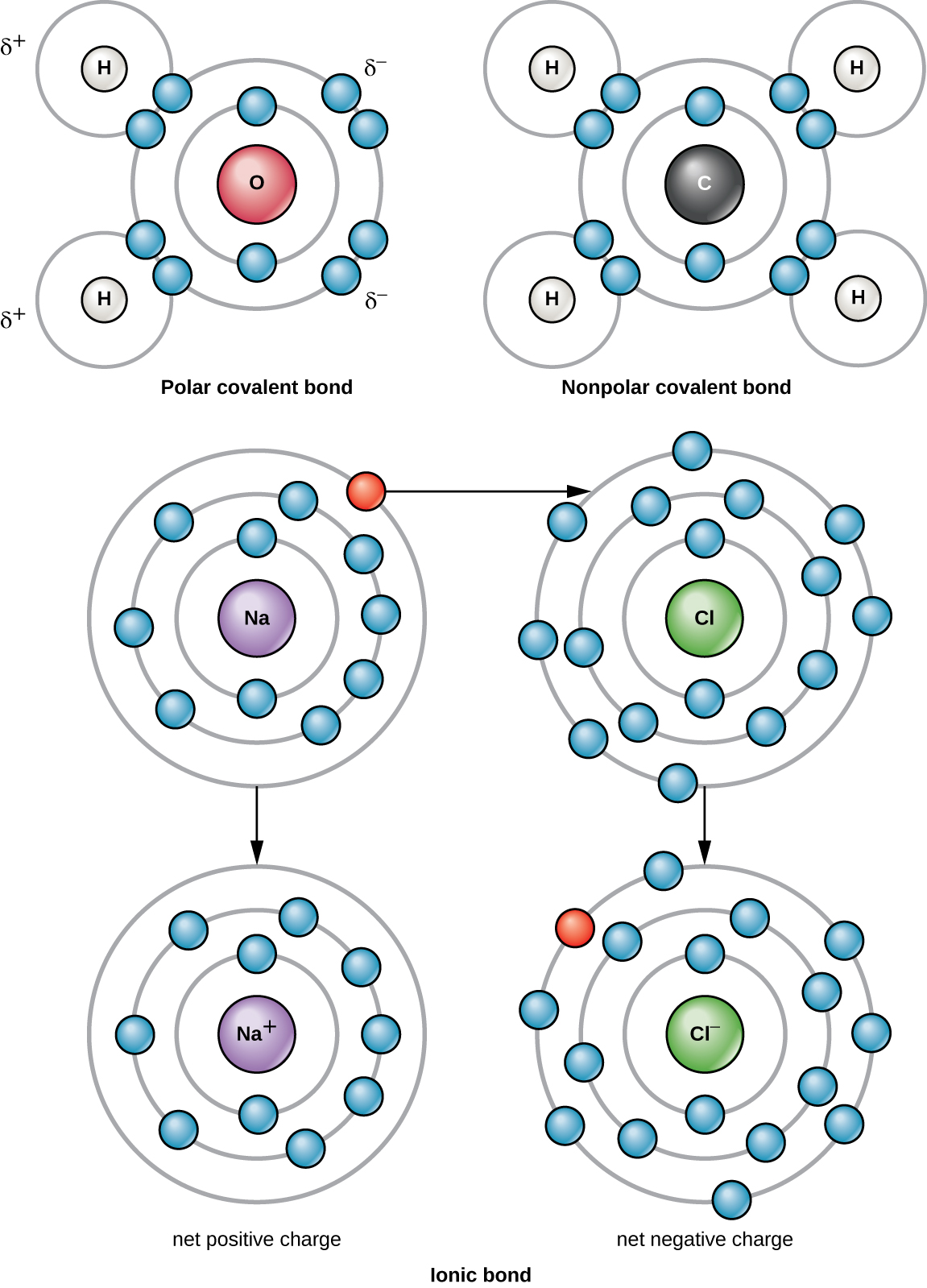
La liaison chimique la plus forte entre deux atomes ou plus est une liaison covalente. Ces liaisons se forment lorsqu'un électron est partagé entre deux atomes, et il s'agit de la forme de liaison chimique la plus courante chez les organismes vivants. Des liaisons covalentes se forment entre les atomes des éléments qui constituent les molécules biologiques de nos cellules. Un exemple de molécule simple formée par des liaisons covalentes est l'eau, H 2 O, avec un VE par atome d'H et 6 VE par atome d'O. En raison de la configuration VE, chaque atome H est capable d'accepter un VE supplémentaire et chaque atome d'O est capable d'accepter deux VE supplémentaires. Lors du partage d'électrons, les atomes d'hydrogène et d'oxygène qui se combinent pour former des molécules d'eau sont liés entre eux par des liaisons covalentes (Figure\(\PageIndex{2}\)). L'électron de l'atome d'hydrogène divise son temps entre la couche électronique externe de l'atome d'hydrogène et la couche électronique la plus externe de l'atome d'oxygène. Pour remplir complètement l'enveloppe extérieure d'un atome d'oxygène, deux électrons provenant de deux atomes d'hydrogène sont nécessaires, d'où l'indice « 2 » indiquant deux atomes de H dans une molécule de H 2 O. Ce partage est un état énergétique plus faible pour tous les atomes impliqués que s'ils existaient sans que leur enveloppe extérieure ne soit remplie.
Il existe deux types de liaisons covalentes : polaires et non polaires. Des liaisons covalentes non polaires se forment entre deux atomes d'éléments identiques ou différents qui partagent les électrons de manière égale (Figure\(\PageIndex{2}\)). Dans une liaison covalente polaire, les électrons partagés par les atomes passent plus de temps à proximité d'un noyau que de l'autre noyau. En raison de la distribution inégale des électrons entre les différents noyaux, une charge légèrement positive (δ+) ou légèrement négative (δ—) se développe. L'eau est un exemple de molécule formée par des liaisons covalentes polaires (Figure\(\PageIndex{2}\)).
Ions et liaisons ioniques
Lorsqu'un atome ne contient pas le même nombre de protons et d'électrons, on parle d'ion. Comme le nombre d'électrons n'est pas égal au nombre de protons, chaque ion possède une charge nette. Les ions positifs se forment en perdant des électrons et sont appelés cations. Les ions négatifs se forment en gagnant des électrons et sont appelés anions.
Par exemple, un atome de sodium ne possède qu'un seul électron dans sa couche la plus externe. L'atome de sodium a besoin de moins d'énergie pour donner cet électron que pour en accepter sept autres, dont il aurait besoin pour remplir son enveloppe extérieure. Si l'atome de sodium perd un électron, il possède désormais 11 protons et seulement 10 électrons, ce qui lui laisse une charge globale de +1. On l'appelle maintenant ion sodium (Na +).
Un atome de chlore possède sept électrons dans sa couche externe. Encore une fois, il est plus économe en énergie pour l'atome de chlore de gagner un électron que d'en perdre sept. Il est donc plus probable qu'il gagne un électron pour former un ion composé de 17 protons et 18 électrons, ce qui lui donnera une charge négative nette (-1). On l'appelle maintenant ion chlorure (Cl —). Ce mouvement d'électrons d'un atome à un autre est appelé transfert d'électrons. Comme les charges positives et négatives s'attirent, ces ions restent ensemble et forment une liaison ionique, ou une liaison entre les ions. Lorsque les ions Na + et Cl — se combinent pour produire du NaCl, un électron d'un atome de sodium reste avec les sept autres de l'atome de chlore, et les ions sodium et chlorure s'attirent mutuellement dans un réseau d'ions avec une charge nette nulle (Figure\(\PageIndex{2}\)).
Les ions polyatomiques sont constitués de plusieurs atomes reliés par des liaisons covalentes ; mais contrairement à une molécule, un ion polyatomique possède une charge positive ou négative. Il se comporte comme un cation ou un anion et peut donc former des liaisons ioniques avec d'autres ions pour former des composés ioniques. Les atomes d'un ion polyatomique peuvent provenir du même élément ou de différents éléments.
Le tableau\(\PageIndex{1}\) répertorie certains cations et anions couramment présents en microbiologie. Notez que ce tableau inclut les ions monoatomiques et polyatomiques.
| Cations | Anions | ||
|---|---|---|---|
| sodium | Na + | chlorure | Cl — |
| hydrogène | H + | bicarbonate | \(\ce{HCO3-}\) |
| potassium | K + | carbonate | \(\ce{CO3^2-}\) |
| ammonium | \(\ce{NH4+}\) | sulfate d'hydrogène | \(\ce{H2SO4^2-}\) |
| cuivre (I) | Coupe + | sulfure d'hydrogène | HS — |
| cuivre (II) | Cu 2+ | hydroxyde | OH... |
| fer (II) | Fe 2+ | hypochlorite | ClO — |
| fer (III) | Fé 3+ | nitrite | \(\ce{NO2-}\) |
| nitrate | \(\ce{NO3-}\) | ||
| peroxyde | \(\ce{O2^2-}\) | ||
| phosphate | \(\ce{PO4^3-}\) | ||
| pyrophosphate | \(\ce{P2O7^4-}\) | ||
| sulfite | \(\ce{SO3^2-}\) | ||
| thiosulfate | \(\ce{S2O3^2-}\) | ||
Formule moléculaire, masse moléculaire et taupe
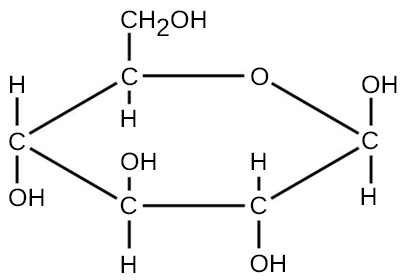
Pour les molécules formées par des liaisons covalentes, la formule moléculaire représente le nombre et les types d'atomes élémentaires qui composent la molécule. À titre d'exemple, prenons une molécule de glucose dont la formule moléculaire est C 6 H 12 O 6. Cette formule moléculaire indique qu'une seule molécule de glucose est formée de six atomes de carbone, de douze atomes d'hydrogène et de six atomes d'oxygène.
La masse moléculaire d'une molécule peut être calculée à l'aide de la formule moléculaire et de la masse atomique de chaque élément de la molécule. Le nombre de chaque type d'atome est multiplié par la masse atomique, puis les produits sont ajoutés pour obtenir la masse moléculaire. Par exemple, la masse moléculaire du glucose, C 6 H 12 O 6 (Figure\(\PageIndex{3}\)), est calculée comme suit :
\ [\ begin {array} {l}
\ text {masse de carbone} & =12 \ : \ frac {\ mathrm {amu}} {\ mathrm {atom}} \ times 6 \ text {atomes} =72 \ text {amu} \ \ \ text {masse d'hydrogène} & =1
\ : \ frac {\ mathrm {amu}} {\ mathrm {amu}} {\ mathrm {} atome} \ times 12 \ text {atomes} =12 \ text {amu} \
\ \ text {masse d'oxygène} et ; =16 \ : \ frac {\ mathrm {amu}} {\ mathrm {atom}} \ times 6 \ text {atomes} =96 \ text {amu} \ \ \ text {masse moléculaire du glucose} & =72
\ text {amu} +12 \ text {amu} +96 \ text {amu} =180 \ text {amu} \ end {amu} +12 \ text {amu} +12 \ text {amu} +12 \ text {amu}
\ end {array} \]
Le nombre d'entités composant une mole a été déterminé expérimentalement à 6,022 × 10 23, une constante fondamentale appelée nombre d'Avogadro (NA) ou constante d'Avogadro. Cette constante est correctement indiquée avec une unité explicite de « par mole ».
Énergie
La thermodynamique fait référence à l'étude de l'énergie et du transfert d'énergie impliquant de la matière physique.
La matière participant à un cas particulier de transfert d'énergie est appelée système, et tout ce qui se trouve en dehors de cette matière est appelé environnement. Il existe deux types de systèmes : ouverts et fermés. Dans un système ouvert, l'énergie peut être échangée avec son environnement. Un système fermé ne peut pas échanger d'énergie avec son environnement. Les organismes biologiques sont des systèmes ouverts. L'énergie est échangée entre eux et leur environnement lorsqu'ils utilisent l'énergie du soleil pour effectuer la photosynthèse ou consomment des molécules qui stockent de l'énergie et libèrent de l'énergie dans l'environnement en travaillant et en libérant de la chaleur. Comme toutes les choses du monde physique, l'énergie est soumise à des lois physiques. En général, l'énergie est définie comme la capacité de travailler ou de créer une sorte de changement. L'énergie existe sous différentes formes. Par exemple, l'énergie électrique, l'énergie lumineuse et l'énergie thermique sont toutes des types d'énergie différents. La première loi de la thermodynamique, souvent appelée loi de conservation de l'énergie, stipule que la quantité totale d'énergie dans l'univers est constante et conservée. L'énergie existe sous de nombreuses formes différentes. Selon la première loi de la thermodynamique, l'énergie peut être transférée d'un endroit à l'autre ou transformée sous différentes formes, mais elle ne peut être ni créée ni détruite.
Le défi pour tous les organismes vivants est d'obtenir de l'énergie de leur environnement sous des formes qu'ils peuvent transférer ou transformer en énergie utilisable pour leur travail. Les microorganismes ont évolué pour relever ce défi. L'énergie chimique stockée dans les molécules organiques telles que les sucres et les graisses est transférée et transformée par une série de réactions chimiques cellulaires en énergie au sein des molécules d'ATP. L'énergie contenue dans les molécules d'ATP est facilement accessible pour travailler. Parmi les types de travail que les cellules doivent effectuer, citons la construction de molécules complexes, le transport de matériaux, la stimulation du mouvement des cils ou des flagelles et la contraction des fibres musculaires pour créer du mouvement.
Les principales tâches d'un microorganisme, qui consistent à obtenir, transformer et utiliser de l'énergie pour effectuer son travail, peuvent sembler simples. Cependant, la deuxième loi de la thermodynamique explique pourquoi ces tâches sont plus difficiles qu'il n'y paraît. Tous les transferts et transformations d'énergie ne sont jamais totalement efficaces. Lors de chaque transfert d'énergie, une certaine quantité d'énergie est perdue sous une forme inutilisable. Dans la plupart des cas, cette forme est l'énergie thermique. Sur le plan thermodynamique, l'énergie thermique est définie comme l'énergie transférée d'un système à un autre qui ne fonctionne pas. Par exemple, une partie de l'énergie est perdue sous forme d'énergie thermique lors de réactions métaboliques cellulaires.
Plus un système perd de l'énergie dans son environnement, moins il est ordonné et aléatoire. Les scientifiques appellent entropie la mesure du caractère aléatoire ou du désordre au sein d'un système. Une entropie élevée signifie un désordre élevé et une faible énergie. Les molécules et les réactions chimiques ont également une entropie variable. Par exemple, l'entropie augmente à mesure que les molécules à forte concentration se diffusent et s'étalent en un seul endroit. La deuxième loi de la thermodynamique dit que l'énergie sera toujours perdue sous forme de chaleur lors des transferts ou des transformations d'énergie. Les microorganismes sont très ordonnés et nécessitent un apport énergétique constant pour être maintenus dans un état de faible entropie.
Réactions chimiques
Les réactions chimiques se produisent lorsque deux atomes ou plus se lient pour former des molécules ou lorsque des atomes liés sont séparés. Les substances utilisées dans une réaction chimique sont appelées réactifs (généralement situées sur le côté gauche d'une équation chimique), et les substances produites par la réaction sont appelées produits (généralement situées sur le côté droit d'une équation chimique). Une flèche est généralement tracée entre les réactifs et les produits pour indiquer la direction de la réaction chimique ; cette direction n'est pas toujours une « voie à sens unique ».
Un exemple de réaction chimique simple est la décomposition de molécules de peroxyde d'hydrogène, chacune étant constituée de deux atomes d'hydrogène liés à deux atomes d'oxygène (H 2 O 2). Le peroxyde d'hydrogène réactif est décomposé en eau, contenant un atome d'oxygène lié à deux atomes d'hydrogène (H 2 O), et en oxygène, qui se compose de deux atomes d'oxygène liés (O 2). Dans l'équation ci-dessous, la réaction inclut deux molécules de peroxyde d'hydrogène et deux molécules d'eau. Voici un exemple d'équation chimique équilibrée, dans laquelle le nombre d'atomes de chaque élément est le même de chaque côté de l'équation. Selon la loi de conservation de la matière, le nombre d'atomes avant et après une réaction chimique doit être égal, de telle sorte qu'aucun atome ne soit, dans des circonstances normales, créé ou détruit.
\[\ce{2H2O2\:(hydrogen\: peroxide)⟶2H2O\:(water) + O2\:(oxygen)}\]
Certaines réactions chimiques, comme celle présentée ci-dessus, peuvent se produire dans une seule direction jusqu'à ce que tous les réactifs soient épuisés. Les équations qui décrivent ces réactions contiennent une flèche unidirectionnelle et sont irréversibles. Les réactions réversibles sont celles qui peuvent aller dans les deux sens. Dans les réactions réversibles, les réactifs sont transformés en produits, mais lorsque la concentration du produit dépasse un certain seuil (caractéristique de la réaction en question), certains de ces produits sont reconvertis en réactifs ; à ce stade, les désignations des produits et des réactifs sont inversées. Les changements de concentration se poursuivent jusqu'à ce qu'un certain équilibre relatif de la concentration entre les réactifs et les produits se produise, un état appelé équilibre chimique. À ce stade, les réactions directe et inverse continuent de se produire, mais elles le font au même rythme, de sorte que les concentrations de réactifs et de produits ne changent pas. Ces situations de réactions réversibles sont souvent désignées par une équation chimique avec une double flèche pointant à la fois vers les réactifs et les produits. Par exemple, lorsque le dioxyde de carbone se dissout dans l'eau, il peut le faire sous forme de gaz dissous dans l'eau ou en réagissant avec l'eau pour produire de l'acide carbonique. Dans les cellules de certains microorganismes, le taux de production d'acide carbonique est accéléré par l'enzyme anhydrase carbonique, comme indiqué dans l'équation suivante :
\[\ce{CO2 + H2O \stackrel{carbonic}{\stackrel{anhydrase}{\rightleftharpoons}} H2CO3 \rightleftharpoons H+ + HCO3-}\]
Propriétés de l'eau et des solutions
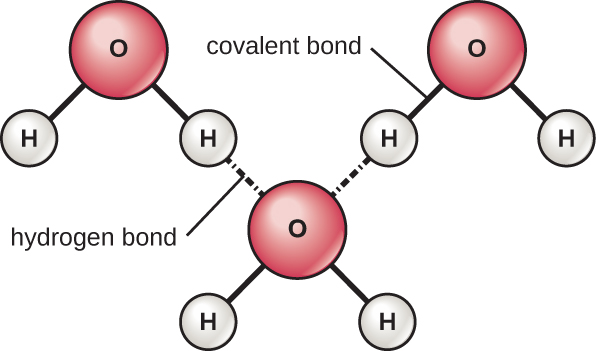
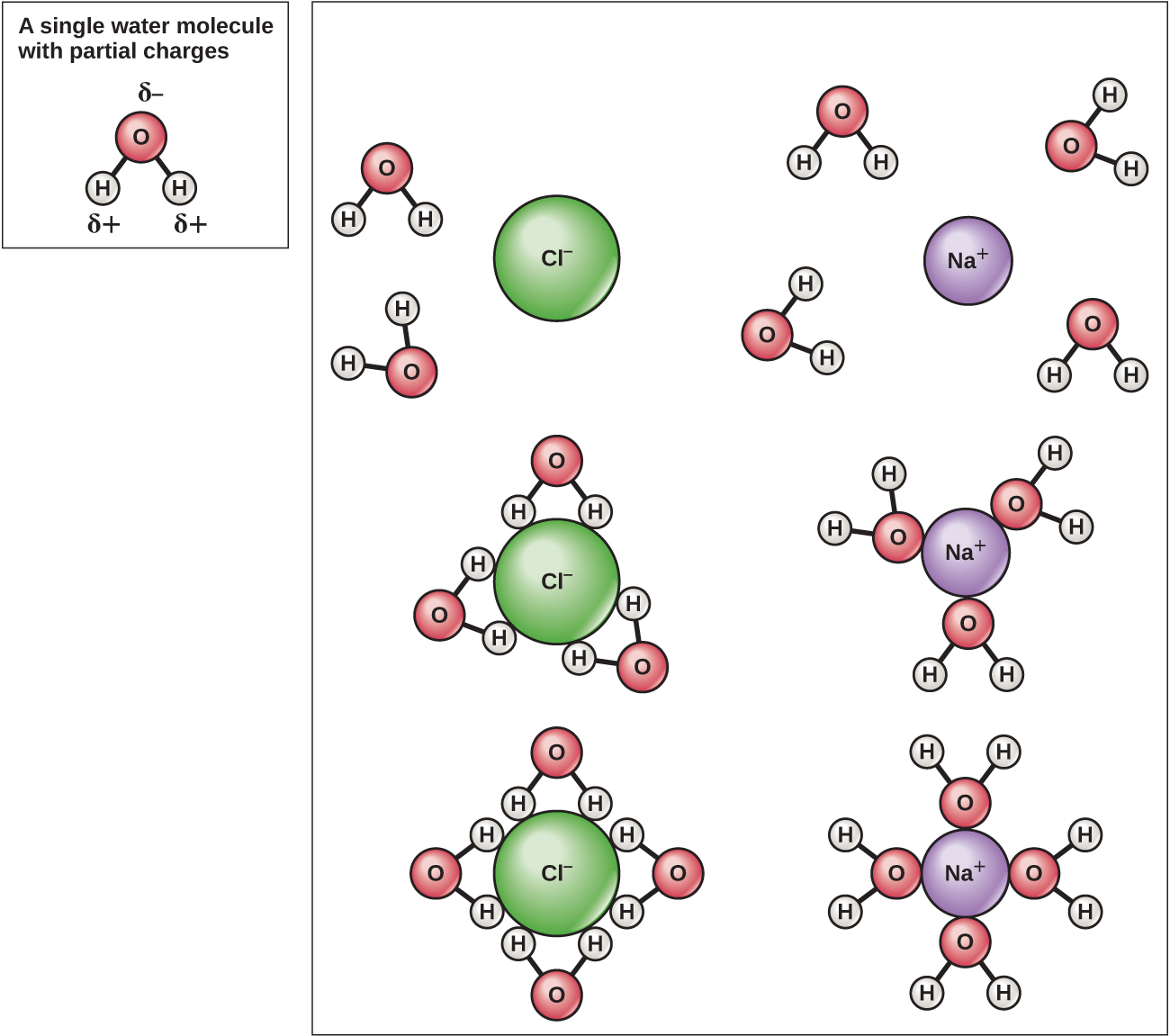
Les atomes d'hydrogène et d'oxygène des molécules d'eau forment des liaisons covalentes polaires. Il n'y a pas de charge globale pour une molécule d'eau, mais il y a un « + » sur chaque atome d'hydrogène et deux « — » sur l'atome d'oxygène. Chaque molécule d'eau attire d'autres molécules d'eau en raison des charges positives et négatives dans les différentes parties de la molécule (Figure\(\PageIndex{4}\)). L'eau attire également d'autres molécules polaires (comme les sucres), formant des liaisons hydrogène. Lorsqu'une substance forme facilement des liaisons hydrogènes avec l'eau, elle peut se dissoudre dans l'eau et est qualifiée d'hydrophile (« aimant l'eau »). Les liaisons hydrogène ne se forment pas facilement avec des substances non polaires telles que les huiles et les graisses. Ces composés non polaires sont hydrophobes (« craignant l'eau ») et s'éloignent de l'eau et l'évitent.
Les liaisons hydrogène de l'eau lui permettent d'absorber et de libérer de l'énergie thermique plus lentement que de nombreuses autres substances. Cela signifie que l'eau atténue les changements de température au sein des organismes et de leur environnement. À mesure que l'apport d'énergie se poursuit, l'équilibre entre la formation de liaisons hydrogène et leur rupture oscille vers une diminution du nombre de liaisons hydrogène : plus de liaisons sont brisées que de liaisons formées. Ce processus entraîne la libération de molécules d'eau individuelles à la surface du liquide (comme un plan d'eau, les feuilles d'une plante ou la peau d'un organisme) dans le cadre d'un processus appelé évaporation.
Inversement, à mesure que le mouvement moléculaire diminue et que les températures baissent, moins d'énergie est présente pour rompre les liaisons hydrogène entre les molécules d'eau. Ces liaisons restent intactes et commencent à former une structure rigide semblable à un réseau (par exemple, de la glace). Lorsqu'elle est gelée, la glace est moins dense (les molécules sont plus éloignées les unes des autres) que l'eau liquide. Cela signifie que de la glace flotte à la surface d'un plan d'eau. Dans les lacs, les étangs et les océans, de la glace se forme à la surface de l'eau, créant une barrière isolante qui protège les animaux et les plantes sous-jacents du gel dans l'eau. Si cela ne se produisait pas, les plantes et les animaux vivant dans l'eau gèleraient dans un bloc de glace et ne pourraient plus se déplacer librement, rendant la vie par temps froid difficile, voire impossible.
Comme l'eau est polaire, avec de légères charges positives et négatives, les composés ioniques et les molécules polaires peuvent facilement s'y dissoudre. L'eau est donc ce que l'on appelle un solvant, une substance capable de dissoudre une autre substance. Les particules chargées formeront des liaisons hydrogène avec la couche environnante de molécules d'eau. C'est ce que l'on appelle une sphère d'hydratation et sert à maintenir les ions séparés ou dispersés dans l'eau (Figure\(\PageIndex{5}\)). Ces sphères d'hydratation sont également appelées coques d'hydratation. La polarité de la molécule d'eau en fait un solvant efficace et joue un rôle important dans ses nombreux rôles dans les systèmes vivants.
La capacité des insectes à flotter et à patiner sur l'eau des étangs résulte de leur propriété de cohésion. Lors de la cohésion, les molécules d'eau sont attirées les unes vers les autres (en raison de la liaison hydrogène), ce qui permet de maintenir les molécules ensemble à l'interface liquide-air (gaz). La cohésion engendre une tension superficielle, c'est-à-dire la capacité d'une substance à résister à la rupture lorsqu'elle est mise sous tension ou sous contrainte.
Ces forces de cohésion sont également liées à la propriété d'adhésion de l'eau, ou à l'attraction entre les molécules d'eau et d'autres molécules. Cela se produit lorsque l'eau « grimpe » sur une paille placée dans un verre d'eau. Vous remarquerez que l'eau semble être plus haute sur les côtés de la paille qu'au milieu. En effet, les molécules d'eau sont attirées par la paille et y adhèrent donc.
La cohésion et l'adhésion jouent également un rôle dans la formation de colonies bactériennes et de biofilms. La cohésion maintient la colonie intacte (l'aide à « adhérer » à une surface), tandis que l'adhésion permet aux cellules d'adhérer les unes aux autres. Les forces de cohésion et d'adhérence sont importantes pour maintenir la vie. Par exemple, en raison de ces forces, l'eau présente dans l'environnement naturel fournit les conditions nécessaires pour permettre aux cellules bactériennes et archéologiques d'adhérer et de s'accumuler sur les surfaces.
Acides et bases
Le pH d'une solution est une mesure des concentrations d'ions hydrogène (H +) et d'ions hydroxyde (OH —) et est décrit comme une acidité ou une alcalinité, respectivement. L'acidité et l'alcalinité (également appelées basicité) peuvent être mesurées et calculées. Le pH peut être simplement représenté par l'équation mathématique\(\mathrm{pH=-\log_{10}[H^+]}\). Sur le côté gauche de l'équation, le « p » signifie « le logarithme négatif de » et le H représente le [H +]. Sur le côté droit de l'équation, [H +] est la concentration de H + en moles/L. Ce qui n'est pas représenté dans cette simple équation, c'est la contribution de l'OH —, qui participe également à l'acidité ou à l'alcalinité. Le calcul du pH aboutit à une plage numérique de 0 à 14 appelée échelle de pH (Figure\(\PageIndex{6}\)). Une valeur de pH comprise entre 0 et 6,9 indique un acide. Il est également appelé faible pH, en raison d'une concentration élevée de [H +] et d'une faible concentration de [OH —]. Une valeur de pH comprise entre 7,1 et 14 indique un alcali ou une base. Il est également appelé pH élevé, en raison d'une faible concentration de [H +] et d'une concentration élevée de [OH —]. Un pH de 7 est décrit comme un pH neutre et se produit lorsque [H +] est égal à [OH —].

Un changement d'une unité sur l'échelle du pH représente une modification du [H +] d'un facteur 10, un changement de deux unités représente un changement du [H +] d'un facteur 100. Ainsi, de faibles variations du pH représentent des variations importantes de [H +].
Notes
- 1 Schrijver, Karel et Iris Schrijver. Vivre avec les étoiles : comment le corps humain est connecté aux cycles de vie de la Terre, des planètes et des étoiles. Oxford University Press, États-Unis, 2015.
- 2 National Oceanic and Atmospheric Administration, « Isotopes stables et radiocarbonés du dioxyde de carbone ». Page Web. Consulté le 19 février 2016 [http://www.esrl.noaa.gov/gmd/outreac...hemistry.html]
- 3 ibid.
- 4 ibid.


