25.4 : Infections parasitaires des systèmes circulatoire et lymphatique
- Page ID
- 187861
Objectifs d'apprentissage
- Identifier les parasites courants qui causent des infections des systèmes circulatoire et lymphatique
- Comparer les principales caractéristiques de maladies parasitaires spécifiques affectant les systèmes circulatoire et lymphatique
Certains protozoaires et douves parasites sont également capables de provoquer des infections du système circulatoire humain. Bien que ces infections soient rares aux États-Unis, elles continuent de provoquer de nombreuses souffrances dans les pays en développement aujourd'hui. Les infections fongiques du système circulatoire sont très rares. Ils ne sont donc pas abordés dans ce chapitre.
Le paludisme
Malgré plus d'un siècle de recherches intensives et de progrès cliniques, le paludisme demeure l'une des maladies infectieuses les plus importantes au monde aujourd'hui. Sa vaste distribution met en danger plus de la moitié de la population mondiale. En 2015, l'OMS a estimé qu'il y avait environ 214 millions de cas de paludisme dans le monde, entraînant environ 438 000 décès ; environ 88 % des cas et 91 % des décès sont survenus en Afrique. 1 Bien que le paludisme ne constitue pas actuellement une menace majeure aux États-Unis, la possibilité de sa réintroduction est préoccupante. Le paludisme est causé par plusieurs protozoaires parasites du genre Plasmodium : P. falciparum, P. knowlesi, P. malariae, P. ovale et P. vivax. Le plasmodium infecte principalement les globules rouges et se transmet par la piqûre de moustiques anophèles.
À l'heure actuelle, P. falciparum est la cause la plus courante et la plus mortelle du paludisme, souvent appelé paludisme à falciparum. Le paludisme à Falciparum est répandu dans les régions très peuplées d'Afrique et d'Asie, exposant de nombreuses personnes à la forme la plus grave de la maladie.
Les signes et symptômes classiques du paludisme sont des cycles de fièvre extrême et de frissons. Les symptômes soudains et violents du paludisme commencent par un malaise, des frissons brusques et de la fièvre (39—41 °C [102,2—105,8 °F]), un pouls rapide et faible, une polyurie, des maux de tête, des myalgies, des nausées et des vomissements. Après 2 à 6 heures d'apparition de ces symptômes, la fièvre diminue et une transpiration abondante se produit pendant 2 à 3 heures, suivie d'une fatigue extrême. Ces symptômes sont le résultat de l'émergence synchrone de plasmodium des globules rouges, entraînant la rupture simultanée d'un grand nombre de globules rouges, entraînant des lésions de la rate, du foie, des ganglions lymphatiques et de la moelle osseuse. Les dommages organiques résultant de l'hémolyse entraînent chez les patients à développer du sang boueux (c'est-à-dire du sang dans lequel les globules rouges s'agglutinent en amas), ce qui peut entraîner un manque d'oxygène, une nécrose des vaisseaux sanguins, une défaillance organique et la mort.
Dans les cas d'infections établies, des cycles paludiques de fièvre et de frissons apparaissent généralement tous les deux jours dans le cas de la maladie décrite sous le nom de paludisme tertien, qui est causée par P. vivax et P. ovale. Les cycles se produisent tous les 3 jours dans le cas de la maladie décrite sous le nom de paludisme quartan, qui est causée par P. malariae. Ces intervalles peuvent varier selon les cas.
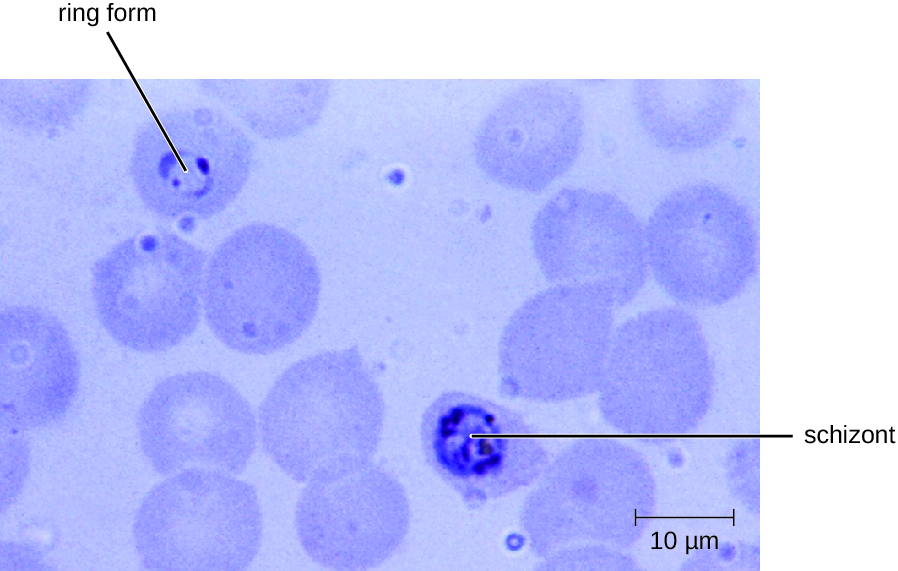
Le plasmodium a un cycle de vie complexe qui comprend plusieurs stades de développement produits alternativement chez les moustiques et les humains (Figure\(\PageIndex{1}\)). Lorsqu'un moustique infecté prend un repas de sang, des sporozoïtes présents dans la glande salivaire du moustique sont injectés dans le sang de l'hôte. Ces parasites circulent vers le foie, où ils se transforment en schizontes. Les schizontes subissent ensuite une schizophogonie, ce qui entraîne la libération de nombreux mérozoïtes à la fois. Les mérozoïtes se déplacent vers la circulation sanguine et infectent les globules rouges. À l'intérieur des globules rouges, les mérozoïtes se transforment en trophozoïtes qui produisent davantage de mérozoïtes. La libération synchrone de mérozoïtes par les globules rouges le soir entraîne les symptômes du paludisme.
De plus, certains trophozoïtes se développent alternativement en gamétocytes mâles et femelles. Les gamétocytes sont absorbés lorsque le moustique prend un repas de sang provenant d'une personne infectée. La sporogonie sexuelle se produit dans l'intestin du moustique. Les gamétocytes fusionnent pour former des zygotes dans l'intestin de l'insecte. Les zygotes deviennent mobiles et s'allongent pour former un ookinète. Cette forme pénètre dans la paroi de l'intestin moyen et se transforme en oocyste. Enfin, l'oocyste libère de nouveaux sporozoïtes qui migrent vers les glandes salivaires des moustiques pour terminer leur cycle de vie.
Le diagnostic du paludisme repose sur l'observation microscopique des formes développementales de Plasmodium dans des frottis sanguins et par des tests rapides d'EIA qui détectent les antigènes ou les enzymes du Plasmodium (Figure\(\PageIndex{2}\)). Des médicaments tels que la chloroquine, l'atovaquone, l'artéméther et la luméfantrine peuvent être prescrits à la fois pour le traitement aigu et prophylactique, bien que certaines espèces de Plasmodium se soient révélées résistantes aux antipaludiques. L'utilisation d'insecticides et de moustiquaires imprégnées d'insecticide peut limiter la propagation du paludisme. Malgré les efforts visant à mettre au point un vaccin contre le paludisme, aucun vaccin n'est actuellement disponible.
![Cycle de vie du plasmodium. [Stades hépatiques humains] 1 — Le moustique prend un repas sanguin et injecte du plasmodium à un humain. 2 — Le plasmodium infecte les cellules hépatiques. 3 — Le plasmodium se multiplie dans les cellules hépatiques. [Stades sanguins humains] 4 — Le plasmodium pénètre dans le sang. Un stade annulaire immature ressemble à une chevalière dans un globule rouge. Ce stade devient un stade annulaire mature et subit une mitose pour produire des schizontes qui sont libérés par rupture des globules rouges. 5 — Gamètes (1n) produits par la méiose. [Stades du moustique] 6 - Le moustique prend un repas sanguin et ingère des gamètes. 7 — Les microgamètes fertilisent le macrogamète. 8 — Le zygote (2n) se forme. 9 — Le zygote subit une mitose. 10 — Le parasite se différencie et pénètre dans la salive du moustique.](https://bio.libretexts.org/@api/deki/files/9172/OSC_Microbio_25_04_Malaria.jpg)
La campagne Nothing But Nets, une initiative de la Fondation pour les Nations Unies, s'est associée à la Fondation Bill et Melinda Gates pour mettre des moustiquaires à disposition dans les pays en développement d'Afrique. Visitez leur site Web pour en savoir plus sur leurs efforts de prévention du paludisme.
Exercice\(\PageIndex{1}\)
Pourquoi le paludisme est-il l'une des maladies infectieuses les plus importantes ?
Toxoplasmose
La toxoplasmose est causée par le protozoaire Toxoplasma gondii. T. gondii est présent chez une grande variété d'oiseaux et de mammifères, 2 et les infections humaines sont courantes. Les Centers for Disease Control and Prevention (CDC) estiment que 22,5 % de la population âgée de 12 ans et plus a été infectée par T. gondii, mais les personnes immunocompétentes sont généralement asymptomatiques. 3 Les chats domestiques sont les seuls hôtes définitifs connus pour les stades sexuels de T. gondii et constituent donc les principaux réservoirs d'infection. Les chats infectés excrètent des oocystes de T. gondii dans leurs matières fécales, qui se propagent généralement aux humains par contact avec les matières fécales présentes sur le corps des chats, dans les bacs à litière ou dans les parterres de jardin où les chats déféquent à l'extérieur.
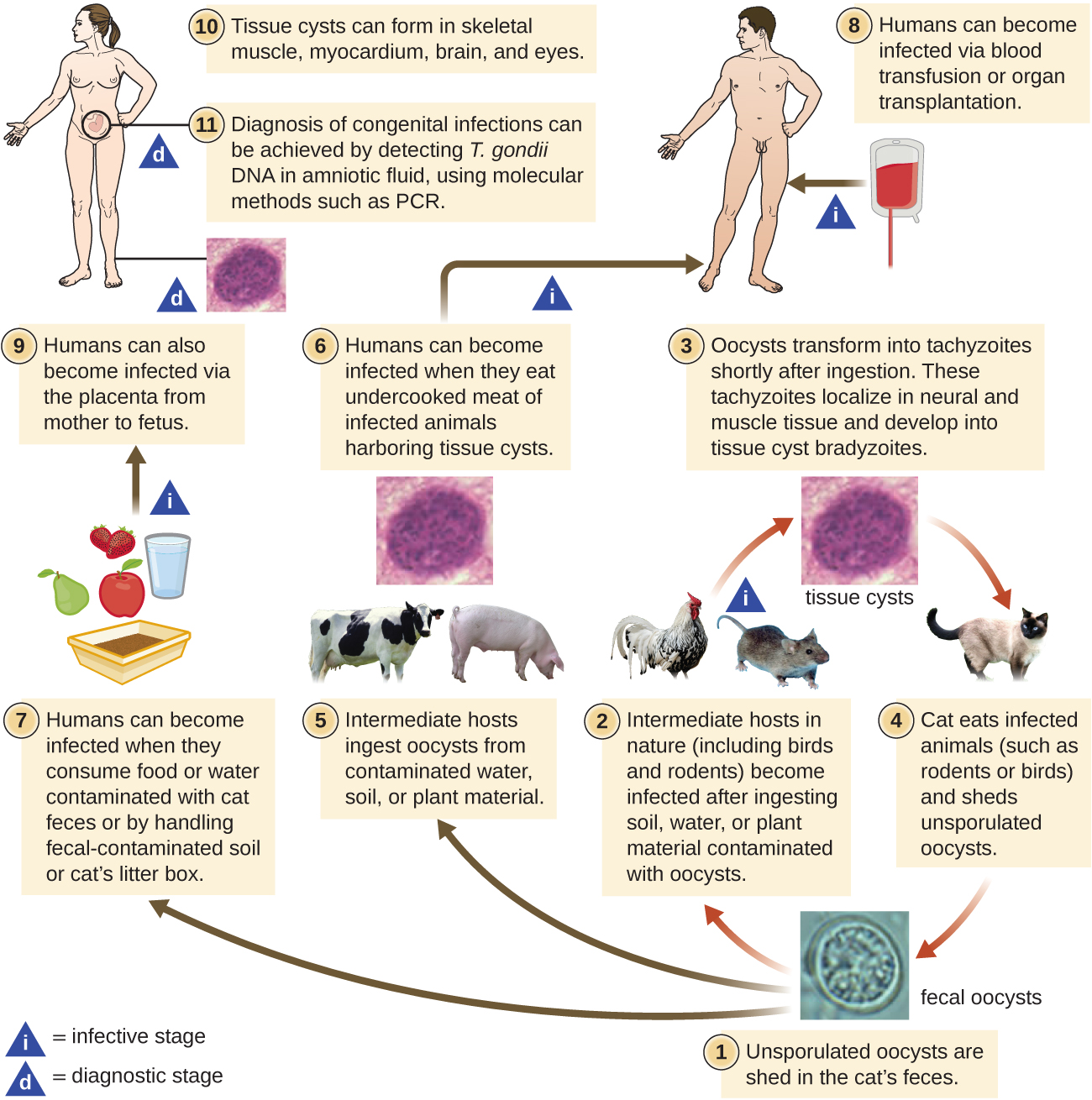
Le cycle biologique de T. gondii est complexe et implique de multiples hôtes. Le cycle de vie de T. gondii commence lorsque des oocystes non sporulés sont excrétés dans les excréments du chat. Ces oocystes mettent 1 à 5 jours à sporuler dans l'environnement et à devenir infectieux. Les hôtes intermédiaires présents dans la nature comprennent les oiseaux et les rongeurs, qui s'infectent après avoir ingéré de la terre, de l'eau ou du matériel végétal contaminés par des oocystes infectieux. Une fois ingérés, les oocystes se transforment en tachyzoïtes qui se localisent dans les tissus nerveux et musculaires des oiseaux ou des rongeurs, où ils se transforment en kystes tissulaires. Les chats peuvent être infectés après avoir consommé des oiseaux et des rongeurs porteurs de kystes tissulaires. Les chats et autres animaux peuvent également être infectés directement par l'ingestion d'oocystes sporulés dans l'environnement. Il est intéressant de noter que l'infection au toxoplasme semble être en mesure de modifier le comportement de l'hôte. Les souris infectées par Toxoplasme perdent leur peur des phéromones de chat. Ils deviennent ainsi des proies plus faciles pour les chats, facilitant ainsi la transmission du parasite à l'hôte définitif 4 du chat (Figure\(\PageIndex{3}\)).
Les infections à toxoplasmes chez l'homme sont extrêmement courantes, mais la plupart des personnes infectées sont asymptomatiques ou présentent des symptômes subcliniques. Certaines études suggèrent que le parasite pourrait influencer la personnalité et les performances psychomotrices des humains infectés, de la même manière qu'il modifie le comportement d'autres mammifères. 5 Lorsque des symptômes apparaissent, ils ont tendance à être légers et similaires à ceux de la mononucléose. Cependant, la toxoplasmose asymptomatique peut devenir problématique dans certaines situations. Les kystes peuvent se loger dans divers tissus humains et rester dormants pendant des années. La réactivation de ces infections quiescentes peut survenir chez les patients immunodéprimés à la suite d'une transplantation, d'un traitement anticancéreux ou de l'apparition d'un trouble immunitaire tel que le SIDA. Chez les patients atteints du SIDA atteints de toxoplasmose, le système immunitaire ne peut pas lutter contre la croissance de T. gondii dans les tissus corporels ; par conséquent, ces kystes peuvent provoquer une encéphalite, une rétinite, une pneumonie, des troubles cognitifs et des convulsions qui peuvent éventuellement être fatales.
La toxoplasmose peut également présenter un risque pendant la grossesse, car les tachyzoïtes peuvent traverser le placenta et provoquer de graves infections chez le fœtus en développement. L'étendue des lésions foetales causées par la toxoplasmose dépend de la gravité de la maladie maternelle, des dommages causés au placenta, de l'âge gestationnel du fœtus au moment de l'infection et de la virulence de l'organisme. La toxoplasmose congénitale entraîne souvent la perte du fœtus ou une naissance prématurée et peut entraîner des lésions du système nerveux central, se manifestant par un retard mental, une surdité ou une cécité. Par conséquent, les CDC conseillent aux femmes enceintes de faire particulièrement attention à la préparation de la viande, au jardinage et au soin des chats de compagnie. 6 Le diagnostic de l'infection par la toxoplasmose pendant la grossesse est généralement effectué par sérologie, y compris le test TORCH (le « T » dans TORCH signifie toxoplasmose). Le diagnostic des infections congénitales peut également être réalisé en détectant l'ADN de T. gondii dans le liquide amniotique, à l'aide de méthodes moléculaires telles que la PCR.
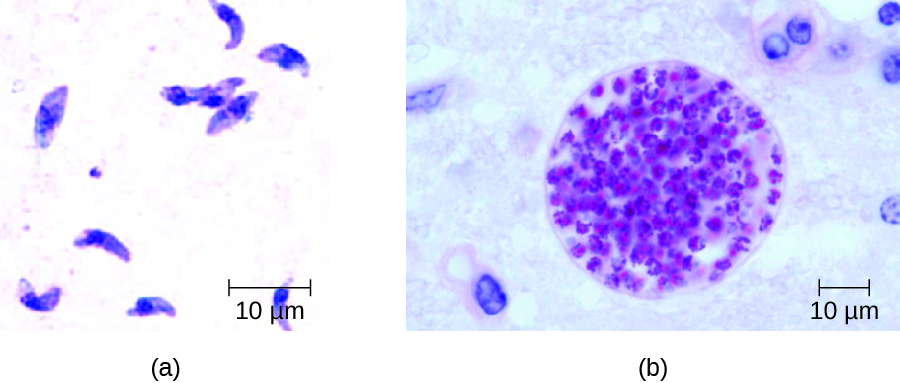
Chez l'adulte, le diagnostic de la toxoplasmose peut inclure l'observation de kystes tissulaires dans des échantillons de tissus. Des kystes tissulaires peuvent être observés dans des échantillons de biopsie colorés à Giemsa ou Wright, et la tomodensitométrie, l'imagerie par résonance magnétique et la ponction lombaire peuvent également être utilisées pour confirmer l'infection (Figure\(\PageIndex{4}\)).
La prévention des infections est la meilleure défense de première intention contre la toxoplasmose. Les mesures préventives consistent notamment à se laver soigneusement les mains après avoir manipulé de la viande crue, de la terre ou de la litière pour chats, et à éviter de consommer des légumes potentiellement contaminés par Toutes les viandes doivent être cuites à une température interne de 73,9 à 76,7 °C (165 à 170 °F).
La plupart des patients immunocompétents n'ont pas besoin d'intervention clinique pour les infections à toxoplasme. Cependant, les nouveau-nés, les femmes enceintes et les patients immunodéprimés peuvent être traités à la pyriméthamine et à la sulfadiazine, sauf pendant le premier trimestre de la grossesse, car ces médicaments peuvent provoquer des malformations congénitales. La spiramycine a été utilisée en toute sécurité pour réduire la transmission chez les femmes enceintes présentant une infection primaire au cours du premier trimestre, car elle ne traverse pas le placenta.
Exercice\(\PageIndex{2}\)
Comment T. gondii infecte-t-il les humains ?
Babésiose
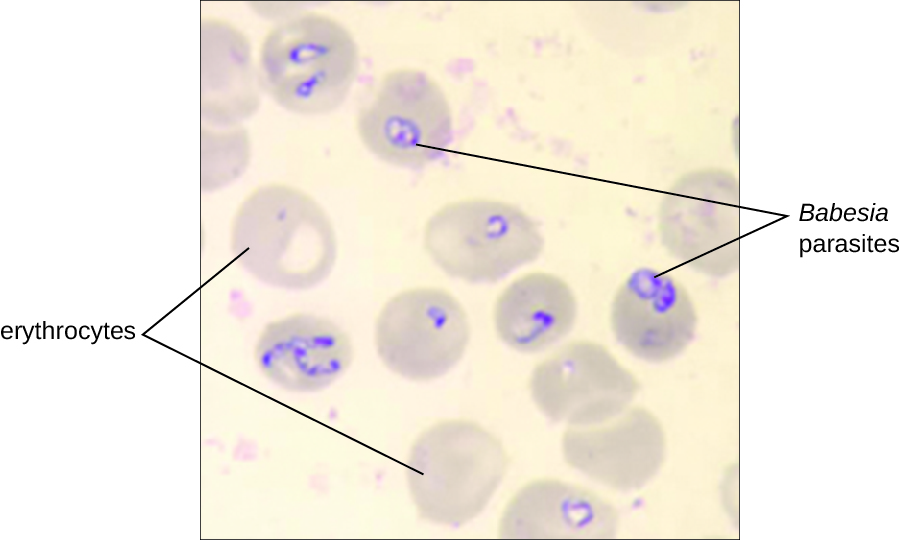
La babésiose est une maladie infectieuse zoonotique rare causée par Babesia spp. Ces protozoaires parasites infectent divers animaux sauvages et domestiques et peuvent être transmis à l'homme par les tiques Ixodes à pattes noires. Chez l'homme, les babésies infectent les globules rouges et se répliquent à l'intérieur de la cellule jusqu'à sa rupture. Les babésies libérées par la rupture des globules rouges poursuivent le cycle de croissance en envahissant d'autres globules rouges. Les patients peuvent être asymptomatiques, mais ceux qui présentent des symptômes souffrent souvent au début de malaise, de fatigue, de frissons, de fièvre, de maux de tête, de myalgie et d'arthralgie. Dans de rares cas, en particulier chez les patients aspléniques (absence de rate), les personnes âgées et les patients atteints du SIDA, la babésiose peut ressembler au paludisme à falciparum, avec une forte fièvre, une anémie hémolytique, une hémoglobinurie (hémoglobine ou sang dans les urines), une jaunisse et une insuffisance rénale, et l'infection peut être fatale. Une infection à Babesia asymptomatique acquise antérieurement peut devenir symptomatique en cas de splénectomie.
Le diagnostic repose principalement sur l'observation microscopique des parasites dans les frottis sanguins (Figure\(\PageIndex{5}\)). La détection sérologique et d'anticorps par l'IFA peut également être réalisée et des tests basés sur la PCR sont disponibles. De nombreuses personnes n'ont pas besoin d'intervention clinique pour les infections à Babesia, mais les infections graves peuvent être éliminées par une association d'atovaquone et d'azithromycine ou par une association de clindamycine et de quinine.
Maladie de Chagas
Également appelée trypanosomiase américaine, la maladie de Chagas est une zoonose classée dans la catégorie des maladies tropicales négligées (MTN). Elle est causée par le protozoaire flagellé Trypanosoma cruzi et se transmet le plus souvent aux animaux et aux humains par les matières fécales de punaises triatomines. La punaise triatomine est surnommée la punaise des baisers parce qu'elle mord fréquemment les humains sur le visage ou autour des yeux ; l'insecte défèque souvent près de la morsure et les matières fécales infectées peuvent être frottées sur la plaie par la morsure par la personne mordue (Figure\(\PageIndex{6}\)). La morsure elle-même est indolore et, au début, de nombreuses personnes ne présentent aucun signe de la maladie. Les autres modes de transmission incluent les transfusions sanguines contaminées, les greffes d'organes provenant de donneurs infectés et la transmission congénitale de la mère au foetus.
La maladie de Chagas est endémique dans une grande partie du Mexique, de l'Amérique centrale et de l'Amérique du Sud, où, selon l'OMS, entre 6 et 7 millions de personnes sont infectées. 7 À l'heure actuelle, la maladie de Chagas n'est pas endémique aux États-Unis, même si des triatomines sont présentes dans la moitié sud du pays.
Les triatomines sont généralement actives la nuit, lorsqu'elles prennent des repas de sang en mordant le visage et les lèvres des personnes ou des animaux pendant leur sommeil et qu'elles déféquent souvent près du site de la morsure. L'infection se produit lorsque l'hôte frotte les matières fécales sur ses yeux, sa bouche, la morsure ou une autre lésion de la peau. Le protozoaire pénètre ensuite dans le sang et envahit les tissus du cœur et du système nerveux central, ainsi que les macrophages et les monocytes. Les réservoirs non humains des parasites T. cruzi comprennent les animaux sauvages et domestiques tels que les chiens et les chats, qui agissent également comme des réservoirs du pathogène. 8
La maladie de Chagas comporte trois phases : aiguë, intermédiaire et chronique. Ces phases peuvent être asymptomatiques ou mettre la vie en danger, selon l'état d'immunocompétence du patient.
En phase aiguë, les symptômes incluent de la fièvre, des maux de tête, des myalgies, des éruptions cutanées, des vomissements, de la diarrhée et une hypertrophie de la rate, du foie et des ganglions lymphatiques. De plus, un nodule localisé appelé chagome peut se former à la porte d'entrée et un gonflement des paupières ou du côté du visage, appelé signe de Romaña, peut apparaître près de la morsure. Les symptômes de la phase aiguë peuvent disparaître spontanément, mais si elle n'est pas traitée, l'infection peut persister dans les tissus, provoquant des dommages irréversibles au cœur ou au cerveau. Dans de rares cas, les jeunes enfants peuvent mourir d'une myocardite ou d'une méningo-encéphalite pendant la phase aiguë de la maladie de Chagas.
La phase aiguë suit une phase intermédiaire prolongée au cours de laquelle peu ou pas de parasites sont détectés dans le sang et la plupart des personnes sont asymptomatiques. De nombreux patients resteront asymptomatiques à vie ; toutefois, des décennies après l'exposition, on estime que 20 % à 30 % des personnes infectées développeront une maladie chronique qui peut être invalidante et parfois mettre leur vie en danger. Au cours de la phase chronique, les patients peuvent développer un gonflement douloureux du côlon, entraînant de graves torsions, de la constipation et une occlusion intestinale ; un gonflement douloureux de l'œsophage, entraînant une dysphagie et une malnutrition ; et une cardiomégalie flasque (hypertrophie du cœur), qui peut entraîner une insuffisance cardiaque et une mort subite .
Le diagnostic peut être confirmé par différents tests, y compris l'observation microscopique directe des trypanosomes dans le sang, l'IFA, les EIE, la PCR et la culture en milieu artificiel. Dans les régions endémiques, des xénodiagnostics peuvent être utilisés ; cette méthode consiste à laisser des punaises non infectées se nourrir du patient, puis à examiner leurs matières fécales pour détecter la présence de T. cruzi.
Les médicaments nifurtimox et benznidazole sont des traitements efficaces pendant la phase aiguë de la maladie de Chagas. L'efficacité de ces médicaments est beaucoup plus faible lorsque la maladie est en phase chronique. Éviter l'exposition à l'agent pathogène par le biais de la lutte antivectorielle est la méthode la plus efficace pour limiter cette maladie.
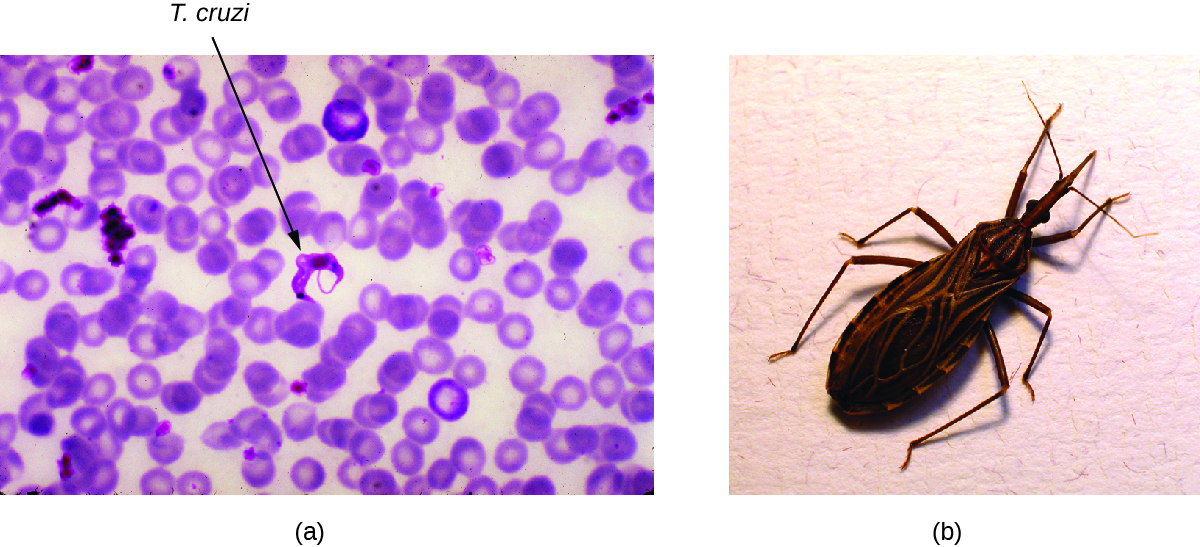
Exercice\(\PageIndex{3}\)
Comment les insectes qui s'embrassent infectent-ils les humains avec Trypanosoma cruzi ?
Leishmaniose
Bien qu'elle soit classée comme une MTN, la leishmaniose est relativement répandue dans les régions tropicales et subtropicales, touchant des personnes dans plus de 90 pays. Elle est causée par environ 20 espèces différentes de Leishmania, des protozoaires parasites transmis par des phlébotomes vecteurs tels que Phlebotomus spp. et Lutzomyia spp. Les chiens, les chats, les moutons, les chevaux, les bovins, les rongeurs et les humains peuvent tous servir de réservoirs.
Le protozoaire de Leishmania est phagocyté par les macrophages mais utilise des facteurs de virulence pour éviter sa destruction au sein du phagolysosome. Les facteurs de virulence inhibent les enzymes phagolysosomiques qui détruiraient autrement le parasite. Le parasite se reproduit dans le macrophage, le lyse et la progéniture infecte de nouveaux macrophages (voir Micro Connections : When phagocytosis Fails).
Les trois principales formes cliniques de leishmaniose sont cutanées (plaie orientale, ébullition de Delhi, ébullition d'Alep), viscérale (kala-azar, fièvre Dumdum) et muqueuse (espundia). La forme de maladie la plus courante est la leishmaniose cutanée, qui se caractérise par la formation de plaies au site de la piqûre d'insecte qui peuvent prendre la forme de papules ou de nodules avant de devenir de gros ulcères (Figure\(\PageIndex{7}\)).
La leishmaniose viscérale peut prendre des mois, voire des années, pour se développer, entraînant une hypertrophie des ganglions lymphatiques, du foie, de la rate et de la moelle osseuse. Les dommages causés à ces sites corporels provoquent de la fièvre, une perte de poids et un gonflement de la rate et du foie. Elle entraîne également une diminution du nombre de globules rouges (anémie), de globules blancs (leucopénie) et de plaquettes (thrombocytopénie), ce qui rend le patient immunodéprimé et plus vulnérable aux infections mortelles des poumons et du tractus gastro-intestinal.
La forme muqueuse de la leishmaniose est l'une des formes les moins courantes de la maladie. Elle provoque une lésion similaire à la forme cutanée, mais la leishmaniose des muqueuses est associée aux muqueuses de la bouche, des narines ou du pharynx et peut être destructrice et défigurante. La leishmaniose des muqueuses est moins fréquente lorsque l'infection cutanée (cutanée) initiale est traitée rapidement.
Le diagnostic définitif de la leishmaniose est posé en visualisant les organismes dans des frottis colorés au Giemsa, en isolant les protozoaires de Leishmania dans des cultures ou en effectuant des tests par PCR sur des aspirats provenant de tissus infectés. Des sondes d'ADN spécifiques ou l'analyse de parasites en culture peuvent aider à distinguer les espèces de Leishmania responsables de la leishmaniose cutanée simple de celles capables de provoquer la leishmaniose des muqueuses.
La leishmaniose cutanée n'est généralement pas traitée. Les lésions disparaîtront après des semaines (voire plusieurs mois), mais elles peuvent entraîner la formation de cicatrices. Les taux de récidive de cette maladie sont faibles. Les infections plus graves peuvent être traitées avec le stibogluconate (gluconate d'antimoine), l'amphotéricine B et la miltéfosine.

Exercice\(\PageIndex{4}\)
Comparez les formes muqueuses et cutanées de la leishmaniose.
Schistosomiase
La schistosomiase (bilharziose) est une MTN causée par des douves sanguines appartenant au genre Schistosoma, originaire des Caraïbes, d'Amérique du Sud, du Moyen-Orient, d'Asie et d'Afrique. La plupart des cas de schistosomiase humaine sont causés par Schistosoma mansoni, S. haematobium ou S. japonicum. Les schistosomes sont les seuls trématodes qui envahissent la peau ; tous les autres trématodes s'infectent par ingestion. L'OMS estime qu'au moins 258 millions de personnes ont eu besoin d'un traitement préventif contre la schistosomiase en 2014. 9
Les hôtes humains infectés excrètent des œufs de schistosomes dans l'urine et les matières fécales, ce qui peut contaminer les habitats d'eau douce des escargots qui servent d'hôtes intermédiaires. Les œufs éclosent dans l'eau et libèrent des miracidies, un stade de croissance intermédiaire du schistosome qui infecte les escargots. Les miracidies arrivent à maturité et se multiplient à l'intérieur des escargots, se transformant en cercaires qui quittent l'escargot et pénètrent dans l'eau, où elles peuvent pénétrer la peau des nageurs et des baigneurs. Les cercaires migrent à travers les tissus humains et pénètrent dans la circulation sanguine, où ils deviennent des vers mâles et femelles adultes qui s'accouplent et libèrent des œufs fécondés. Les œufs se déplacent dans la circulation sanguine et pénètrent dans divers sites du corps, y compris la vessie ou l'intestin, d'où ils sont excrétés dans l'urine ou les selles pour recommencer leur cycle de vie (Figure 5.2.4).
Quelques jours après l'infection, les patients peuvent développer une éruption cutanée ou des démangeaisons cutanées associées au site de pénétration de la cercarie. Dans les 1 à 2 mois suivant l'infection, des symptômes peuvent apparaître, notamment de la fièvre, des frissons, de la toux et des myalgies, car les œufs qui ne sont pas excrétés circulent dans l'organisme. Après des années d'infection, les ovules se logent dans les tissus et déclenchent une inflammation et des cicatrices qui peuvent endommager le foie, le système nerveux central, les intestins, la rate, les poumons et la vessie. Cela peut provoquer des douleurs abdominales, une hypertrophie du foie, du sang dans les urines ou les selles et des problèmes urinaires. Un risque accru de cancer de la vessie est également associé à une infection chronique à schistosomes. De plus, les enfants infectés à plusieurs reprises peuvent développer de la malnutrition, de l'anémie et des difficultés d'apprentissage.
Le diagnostic de la schistosomiase est posé par l'observation microscopique d'œufs dans les matières fécales ou l'urine, d'échantillons de tissus de l'intestin ou de la vessie, ou par des tests sérologiques. Le praziquantel est efficace pour le traitement de toutes les infections à schistosomes. L'amélioration de la gestion des eaux usées et l'éducation des populations à risque afin de limiter leur exposition à l'eau contaminée peuvent aider à contrôler la propagation de la maladie.
Dermatite cercarienne
Les cercaires de certaines espèces de schistosomes ne peuvent se transformer en vers adultes et terminer leur cycle de vie que chez les animaux hôtes tels que les oiseaux migrateurs et les mammifères. Les cercaires de ces vers sont toujours capables de pénétrer dans la peau humaine, mais ils sont incapables d'établir une infection productive dans les tissus humains. Néanmoins, la présence de la cercarie dans les petits vaisseaux sanguins déclenche une réponse immunitaire, qui provoque des démangeaisons appelées dermatite cercarienne (également connue sous le nom de démangeaison du nageur ou démangeaison du chercheur de palourdes). Bien qu'elle soit inconfortable, la dermatite cercarienne est généralement spontanément résolutive et rarement grave. Les antihistaminiques et les antiprurigineux peuvent être utilisés pour limiter l'inflammation et les démangeaisons, respectivement.
Exercice\(\PageIndex{5}\)
Comment se produisent les infections à schistosomes chez l'homme ?
Agents pathogènes eucaryotes courants de l'appareil circulatoire humain
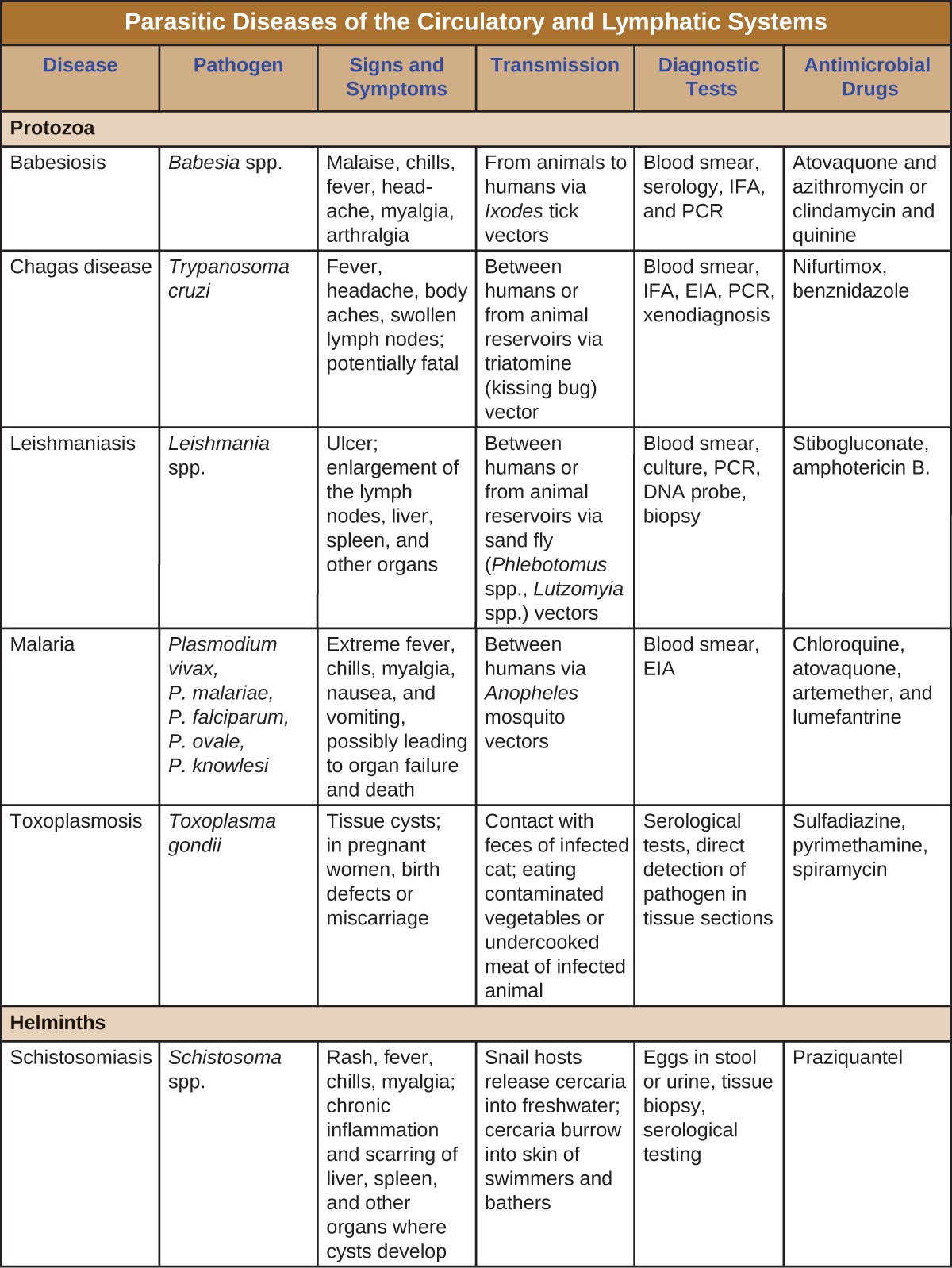
Les infections à protozoaires et helminthiques sont répandues dans les pays en développement. Quelques-unes des infections parasitaires les plus importantes sont résumées dans la Figure\(\PageIndex{8}\).
Orientation clinique : résolution
Malgré la poursuite du traitement antibiotique et le retrait du cathéter veineux, l'état de Barbara a continué de se dégrader. Elle a commencé à montrer des signes de choc et sa tension artérielle a chuté à 77/50 mmHg. Des anti-inflammatoires et de la drotrécogine-α ont été administrés pour combattre la septicémie. Cependant, au septième jour d'hospitalisation, Barbara a souffert d'insuffisance hépatique et rénale et est décédée.
Staphylococcus aureus a probablement formé un biofilm à la surface du cathéter de Barbara. À partir de là, la bactérie a été excrétée de façon chronique dans sa circulation et a produit les premiers symptômes cliniques. Les traitements chimiothérapeutiques ont échoué en grande partie à cause de l'isolat de SARM résistant aux médicaments. Des facteurs de virulence tels que la leucocidine et les hémolysines ont également interféré avec sa réponse immunitaire. Le déclin final de Barbara est peut-être dû à la production d'entérotoxines et de toxines du syndrome du choc toxique (TSST), qui peuvent provoquer un choc toxique.
Les cathéters veineux sont des interventions vitales courantes pour de nombreux patients nécessitant l'administration à long terme de médicaments ou de liquides. Cependant, ils sont également des sites courants d'infections de la circulation sanguine. L'Organisation mondiale de la santé estime qu'il y a jusqu'à 80 000 infections de la circulation sanguine liées aux cathéters chaque année aux États-Unis, entraînant environ 20 000 décès. 10
Concepts clés et résumé
- Le paludisme est un parasite protozoaire qui demeure une cause importante de décès, principalement sous les tropiques. Plusieurs espèces du genre Plasmodium sont responsables du paludisme et toutes sont transmises par des moustiques anophèles. Le plasmodium infecte et détruit les globules rouges humains, entraînant des lésions organiques, une anémie, une nécrose des vaisseaux sanguins et la mort. Le paludisme peut être traité à l'aide de divers médicaments antipaludiques et évité grâce à la lutte antivectorielle.
- La toxoplasmose est une infection protozoaire répandue qui peut provoquer de graves infections chez les sujets immunodéprimés et les fœtus en développement. Les chats domestiques sont l'hôte définitif.
- La babésiose est une infection généralement asymptomatique des globules rouges qui peut provoquer des symptômes semblables à ceux du paludisme chez les patients âgés, immunodéprimés ou aspléniques.
- La maladie de Chagas est une maladie tropicale transmise par des punaises triatomiques. Le trypanosome infecte le cœur, les tissus neuraux, les monocytes et les phagocytes, restant souvent latent pendant de nombreuses années avant de provoquer des lésions graves et parfois mortelles au système digestif et au cœur.
- La leishmaniose est causée par le protozoaire Leishmania et est transmise par les phlébotomes. Les symptômes sont généralement légers, mais les cas graves peuvent provoquer des lésions organiques, de l'anémie et une perte de compétence immunitaire.
- La schistosomiase est causée par une douve transmise par des escargots. La douve se déplace dans tout le corps dans la circulation sanguine et infecte de façon chronique divers tissus, endommageant ainsi les organes.
Notes
- 1 Organisation mondiale de la santé. « Rapport mondial sur le paludisme 2015 : résumé ». 2015. http://www.who.int/malaria/publicati...015/report/en/. Consulté le 28 juillet 2016.
- 2 heures du matin Tenter et coll. « Toxoplasma gondii : des animaux aux humains. » Journal international de parasitologie 30 n° 12-13 (2000) :1217—1258.
- 3 centres pour le contrôle et la prévention des maladies. « Parasites - Toxoplasmose (infection à toxoplasmes). Épidémiologie et facteurs de risque. » 2015 http://www.cdc.gov/parasites/toxoplasmosis/epi.html. Consulté le 28 juillet 2016.
- 4 J. Flegr. « Effets du toxoplasme sur le comportement humain. » Bulletin sur la schizophrénie 33, n° 3 (2007) :757-760.
- 5 Ibidem
- 6 centres pour le contrôle et la prévention des maladies. « Parasites - Toxoplasmose (infection à toxoplasme). Questions fréquemment posées (FAQ) sur la toxoplasmose. » 2013. http://www.cdc.gov/parasites/toxopla...info/faqs.html. Consulté le 28 juillet 2016.
- 7 Organisation mondiale de la santé. « Maladie de Chagas (trypanosomiase américaine). Fiche d'information. » 2016. http://www.who.int/mediacentre/factsheets/fs340/en/. Consulté le 29 juillet 2016.
- 8 C.E. Reisenman et coll. « Infection de punaises qui s'embrassent par Trypanosoma cruzi, Tucson, Arizona, États-Unis. » Maladies infectieuses émergentes 16 no 3 (2010) :400—405.
- 9 Organisation mondiale de la santé. « Schistosomiase. Fiche d'information. » 2016. http://www.who.int/mediacentre/factsheets/fs115/en/. Consulté le 29 juillet 2016.
- 10 Organisation mondiale de la santé. « Sécurité des patients, prévention des infections de la circulation sanguine causées par les cathéters veineux centraux ». 2016. www.who.int/patientsafety/imp... tation/bsi/en/. Consulté le 29 juillet 2016.


