25.2 : Infections bactériennes des systèmes circulatoire et lymphatique
- Page ID
- 187875
Objectifs d'apprentissage
- Identifier et comparer les bactéries qui causent le plus souvent des infections des systèmes circulatoire et lymphatique
- Comparer les principales caractéristiques de maladies bactériennes spécifiques affectant les systèmes circulatoire et lymphatique
Les bactéries peuvent pénétrer dans les systèmes circulatoire et lymphatique à la suite d'infections aiguës ou de brèches de la barrière cutanée ou de la muqueuse. Les brèches peuvent survenir à la suite d'événements assez courants, tels que des piqûres d'insectes ou de petites blessures. Même le fait de se brosser les dents, qui peut provoquer de petites ruptures des gencives, peut introduire des bactéries dans le système circulatoire. Dans la plupart des cas, la bactériémie résultant de ces expositions courantes est transitoire et reste inférieure au seuil de détection. Dans les cas graves, la bactériémie peut entraîner une septicémie accompagnée de complications dangereuses telles que la toxémie, la septicémie et le choc septique. Dans ces situations, c'est souvent la réponse immunitaire à l'infection qui provoque les signes et symptômes cliniques plutôt que les microbes eux-mêmes.
Septicémie bactérienne, choc septique et toxique
À de faibles concentrations, les cytokines pro-inflammatoires telles que l'interleukine 1 (IL-1) et le facteur de nécrose tumorale α (TNF-α) jouent un rôle important dans les défenses immunitaires de l'hôte. Cependant, lorsqu'ils circulent de manière systémique en plus grande quantité, la réponse immunitaire qui en résulte peut mettre la vie en danger. L'IL-1 induit une vasodilatation (élargissement des vaisseaux sanguins) et réduit les jonctions serrées entre les cellules endothéliales vasculaires, ce qui entraîne un œdème généralisé. Lorsque les liquides sortent de la circulation et pénètrent dans les tissus, la pression artérielle commence à chuter. Si elle n'est pas contrôlée, la pression artérielle peut chuter en dessous du niveau nécessaire au maintien d'une fonction rénale et respiratoire adéquate, une condition connue sous le nom de choc septique. De plus, la libération excessive de cytokines lors de la réponse inflammatoire peut entraîner la formation de caillots sanguins. La perte de tension artérielle et la formation de caillots sanguins peuvent entraîner la défaillance de plusieurs organes et la mort.
Les bactéries sont les agents pathogènes les plus courants associés au développement de la septicémie et du choc septique. 1 L'infection la plus courante associée à la septicémie est la pneumonie bactérienne (voir Infections bactériennes des voies respiratoires), qui représente environ la moitié des cas, suivie des infections intra-abdominales (infections bactériennes du tractus gastro-intestinal) et des infections urinaires infections des voies (infections bactériennes du système urinaire). 2 Les infections associées à des plaies superficielles, à des morsures d'animaux et à des cathéters intérieurs peuvent également entraîner une septicémie et un choc septique.
Ces infections localisées initialement mineures peuvent être causées par un large éventail de bactéries différentes, notamment les staphylocoques, les streptocoques, les pseudomonas, les pasteurelles, les acinetobactériacées et les membres des entérobactéries. Cependant, si elles ne sont pas traitées, les infections causées par ces agents pathogènes gram-positifs et gram-négatifs peuvent potentiellement évoluer vers une septicémie, un choc et la mort.
Syndrome de choc toxique et syndrome de type choc toxique streptococcique
La toxémie associée aux infections causées par Staphylococcus aureus peut provoquer le syndrome de choc toxique (TSS) staphylococcique. Certaines souches de S. aureus produisent un superantigène appelé toxine-1 du syndrome de choc toxique (TSST-1). Le SCT peut survenir en tant que complication d'autres infections localisées ou systémiques telles que la pneumonie, l'ostéomyélite, la sinusite et les plaies cutanées (chirurgicales, traumatiques ou brûlures). Les personnes les plus à risque de contracter le SCT staphylococcique sont les femmes présentant une colonisation vaginale préexistante par S. aureus qui laissent des tampons, des éponges contraceptives, des diaphragmes ou d'autres dispositifs dans le vagin plus longtemps que la durée recommandée.
Le SCT staphylococcique se caractérise par l'apparition soudaine de vomissements, de diarrhée, de myalgie, par une température corporelle supérieure à 38,9 °C (102,0 °F) et par une hypotension rapide avec une pression artérielle systolique inférieure à 90 mm Hg chez les adultes ; une éruption érythémateuse diffuse qui entraîne une desquamation et une perte de peau 1 à 2 semaines après apparition ; et atteinte supplémentaire de trois systèmes organiques ou plus. 3 Le taux de mortalité associé au SCT staphylococcique est inférieur à 3 % des cas.
Le diagnostic du SCT staphylococcique repose sur les signes cliniques, les symptômes, les tests sérologiques visant à confirmer l'espèce bactérienne et la détection de la production de toxines à partir d'isolats de staphylocoques. Les cultures de peau et de sang sont souvent négatives ; moins de 5 % sont positives en cas de TSS staphylococcique. Le traitement du SCT staphylococcique comprend la décontamination, le débridement, l'utilisation de vasopresseurs pour élever la tension artérielle et l'antibiothérapie à la clindamycine associée à la vancomycine ou à la daptomycine en attendant les résultats de sensibilité.
Un syndrome présentant des signes et des symptômes similaires à ceux du SCT staphylococcique peut être causé par Streptococcus pyogenes. Cette affection, appelée syndrome de choc toxique streptococcique (STSS), se caractérise par une physiopathologie plus sévère que le SCT staphylococcique4, environ 50 % des patients présentant une bactériémie à S. pyogenes et une fasciite nécrosante. Contrairement au SCT staphylococcique, le STSS est plus susceptible de provoquer le syndrome de détresse respiratoire aiguë (SDRA), une maladie à évolution rapide caractérisée par une accumulation de liquide dans les poumons qui inhibe la respiration et provoque une hypoxémie (faible taux d'oxygène dans le sang). Le STSS est associé à un taux de mortalité plus élevé (20 % à 60 %), même en cas de traitement agressif. Le STSS apparaît généralement chez les patients atteints d'une infection streptococcique des tissus mous, telle qu'une cellulite bactérienne, une fasciite nécrosante, une pyomyosite (formation de pus dans les muscles causée par une infection), une infection récente par la grippe A ou la varicelle.
Exercice\(\PageIndex{1}\)
Comment de grandes quantités de cytokines pro-inflammatoires peuvent-elles provoquer un choc septique ?
Orientation clinique : partie 2
Malgré le traitement à l'oxacilline, l'état de Barbara a continué de s'aggraver au cours des jours suivants. Sa fièvre a atteint 40,1 °C (104,2 °F) et elle a commencé à ressentir des frissons, une respiration rapide et de la confusion. Son médecin a soupçonné une bactériémie due à une bactérie résistante aux médicaments et a admis Barbara à l'hôpital. Des cultures du site chirurgical et du sang ont révélé la présence de Staphylococcus aureus. Des tests de sensibilité aux antibiotiques ont confirmé que l'isolat était résistant à la méthicilline (SARM). En réponse, le médecin de Barbara a remplacé son antibiothérapie par de la vancomycine et a pris des dispositions pour que l'orifice et le cathéter veineux soient retirés.
Exercice\(\PageIndex{2}\)
- Pourquoi l'infection de Barbara n'a-t-elle pas répondu au traitement à l'oxacilline ?
- Pourquoi le médecin a-t-il fait retirer le port et le cathéter ?
- Sur la base des signes et symptômes décrits, quels sont les diagnostics possibles de la maladie de Barbara ?
Septicémie puerpérale
Un type de septicémie appelé septicémie puerpérale, également appelée infection puerpérale, fièvre puerpérale ou fièvre du lit d'enfant, est une infection nosocomiale associée à la période de puerpéralité, c'est-à-dire la période suivant l'accouchement pendant laquelle le système reproducteur de la mère revient à un état non enceinte. Ces infections peuvent provenir du tractus génital, du sein, des voies urinaires ou d'une plaie chirurgicale. Au début, l'infection peut se limiter à l'utérus ou à un autre site d'infection local, mais elle peut se propager rapidement, entraînant une péritonite, une septicémie et la mort. Avant les travaux d'Ignaz Semmelweis au XIXe siècle et l'acceptation généralisée de la théorie des germes (voir Fondements modernes de la théorie cellulaire), la septicémie puerpérale était l'une des principales causes de mortalité chez les nouvelles mères dans les premiers jours suivant l'accouchement.
La septicémie puerpérale est souvent associée à Streptococcus pyogenes, mais de nombreuses autres bactéries peuvent également en être responsables. Les exemples incluent les bactéries gram-positives (par exemple Streptococcus spp., Staphylococcus spp. et Enterococcus spp.), les bactéries gram-négatives (par exemple Chlamydia spp., Escherichia coli, Klebsiella spp. et Proteus spp.), comme ainsi que des anaérobies tels que Peptostreptococcus spp., Bacteroides spp. et Clostridium spp. Dans les cas causés par S. pyogenes, la bactérie se fixe aux tissus de l'hôte à l'aide de la protéine M et produit une capsule glucidique pour éviter la phagocytose. S. pyogenes produit également diverses exotoxines, comme les exotoxines pyrogènes streptococciques A et B, qui sont associées à la virulence et peuvent fonctionner comme des superantigènes.
Le diagnostic de la fièvre puerpérale repose sur le moment et l'étendue de la fièvre, sur l'isolement et sur l'identification de l'agent étiologique dans des échantillons de sang, de plaie ou d'urine. Comme il existe de nombreuses causes possibles, des tests de sensibilité aux antimicrobiens doivent être utilisés pour déterminer le meilleur antibiotique pour le traitement. L'incidence nosocomiale de la fièvre puerpérale peut être considérablement réduite grâce à l'utilisation d'antiseptiques pendant l'accouchement et au strict respect des protocoles de lavage des mains par les médecins, les sages-femmes et les infirmières.
Arthrite infectieuse
Également appelée arthrite septique, l'arthrite infectieuse peut être une affection aiguë ou chronique. L'arthrite infectieuse se caractérise par une inflammation des tissus articulaires et est le plus souvent causée par des agents pathogènes bactériens. La plupart des cas d'arthrite infectieuse aiguë sont secondaires à une bactériémie, avec l'apparition rapide de douleurs articulaires modérées à sévères et d'un gonflement qui limitent le mouvement de l'articulation touchée. Chez les adultes et les jeunes enfants, l'agent pathogène infectieux est le plus souvent introduit directement par une blessure, telle qu'une blessure ou un site chirurgical, et introduit dans l'articulation par le système circulatoire. Des infections aiguës peuvent également survenir après une arthroplastie. L'arthrite infectieuse aiguë survient souvent chez des patients dont le système immunitaire est affaibli par d'autres infections virales et bactériennes. S. aureus est la cause la plus fréquente d'arthrite septique aiguë dans la population générale des adultes et des jeunes enfants. Neisseria gonorrhoeae est une cause importante d'arthrite infectieuse aiguë chez les personnes sexuellement actives.
L'arthrite infectieuse chronique est responsable de 5 % de tous les cas d'arthrite infectieuse et est plus susceptible de survenir chez les patients atteints d'autres maladies ou affections. Les patients à risque incluent ceux qui ont une infection au VIH, une infection bactérienne ou fongique, des prothèses articulaires, la polyarthrite rhumatoïde (PR) ou ceux qui suivent une chimiothérapie immunosuppressive. Il apparaît souvent dans une seule articulation ; la douleur peut être faible ou nulle, la douleur peut être légère, un gonflement progressif, une chaleur légère et une rougeur minimale ou nulle de la région articulaire.
Le diagnostic de l'arthrite infectieuse nécessite l'aspiration d'une petite quantité de liquide synovial provenant de l'articulation atteinte. L'évaluation microscopique directe, la culture, les tests de sensibilité aux antimicrobiens et les analyses par réaction en chaîne par polymérase (PCR) du liquide synovial sont utilisés pour identifier le pathogène potentiel. Le traitement typique comprend l'administration de médicaments antimicrobiens appropriés sur la base de tests de sensibilité aux antimicrobiens. Pour les souches bactériennes non résistantes aux médicaments, les β-lactamines tels que l'oxacilline et la céfazoline sont souvent prescrits pour les infections staphylococciques. Les céphalosporines de troisième génération (par exemple, la ceftriaxone) sont utilisées pour traiter les infections à Neisseria résistantes aux β-lactamines de plus en plus fréquentes. Les infections causées par Mycobacterium spp. ou par des champignons sont traitées par un traitement antimicrobien approprié à long terme. Même avec un traitement, le pronostic est souvent mauvais pour les personnes infectées. Environ 40 % des patients atteints d'arthrite infectieuse non gonnococcique souffriront de lésions articulaires permanentes et les taux de mortalité varient de 5 % à 20 %. 5 Les taux de mortalité sont plus élevés chez les personnes âgées. 6
Ostéomyélite
L'ostéomyélite est une inflammation des tissus osseux causée le plus souvent par une infection. Ces infections peuvent être aiguës ou chroniques et peuvent impliquer une variété de bactéries différentes. L'agent causal le plus fréquent de l'ostéomyélite est S. aureus. Cependant, M. tuberculosis, Pseudomonas aeruginosa, Streptococcus pyogenes, S. agalactiae, des espèces appartenant aux entérobactériacées et d'autres microorganismes peuvent également provoquer une ostéomyélite, selon les os concernés. Chez les adultes, les bactéries ont généralement un accès direct aux tissus osseux à la suite d'un traumatisme ou d'une intervention chirurgicale impliquant des prothèses articulaires. Chez les enfants, la bactérie est souvent introduite par la circulation sanguine et peut se propager à la suite d'infections focales. Les os longs, tels que le fémur, sont plus fréquemment atteints chez les enfants en raison de la vascularisation plus importante des os chez les jeunes. 7
Les signes et symptômes de l'ostéomyélite incluent de la fièvre, une douleur localisée, un gonflement dû à un œdème et des ulcères des tissus mous à proximité du site de l'infection. L'inflammation qui en résulte peut entraîner des lésions tissulaires et une perte osseuse. De plus, l'infection peut se propager aux articulations, provoquant une arthrite infectieuse, ou se propager dans le sang, entraînant une septicémie et une thrombose (formation de caillots sanguins). Comme l'arthrite septique, l'ostéomyélite est généralement diagnostiquée par une combinaison de radiographie, d'imagerie et d'identification de bactéries à partir d'hémocultures, ou à partir d'hémocultures si les hémocultures sont négatives. L'antibiothérapie parentérale est généralement utilisée pour traiter l'ostéomyélite. Cependant, en raison du nombre d'agents étiologiques possibles, divers médicaments peuvent être utilisés. Des médicaments antibactériens à large spectre tels que la nafcilline, l'oxacilline ou la céphalosporine sont généralement prescrits pour l'ostéomyélite aiguë, et l'ampicilline et la pipéracilline/tazobactam pour l'ostéomyélite chronique. En cas de résistance aux antibiotiques, un traitement à la vancomycine est parfois nécessaire pour contrôler l'infection. Dans les cas graves, une intervention chirurgicale pour enlever le site de l'infection peut être nécessaire. Les autres formes de traitement incluent l'oxygénothérapie hyperbare (voir Utilisation de méthodes physiques pour contrôler les microorganismes) et l'implantation de billes ou de pompes antibiotiques.
Exercice\(\PageIndex{3}\)
Quelle bactérie est la cause la plus fréquente de l'arthrite septique et de l'ostéomyélite ?
Fièvre rhumatismale
Les infections à S. pyogenes présentent diverses manifestations et complications généralement appelées séquelles. Comme mentionné précédemment, la bactérie peut provoquer des infections suppuratives comme la fièvre puerpérale. Cependant, ce microbe peut également provoquer des séquelles non suppuratives sous forme de rhumatisme articulaire aigu (ARF), qui peuvent entraîner une cardiopathie rhumatismale, affectant ainsi le système circulatoire. Le rhumatisme articulaire aigu survient principalement chez les enfants au moins 2 à 3 semaines après un épisode de pharyngite non traitée ou mal traitée (voir Infections bactériennes des voies respiratoires). À une époque, le rhumatisme articulaire aigu était l'une des principales causes de mortalité chez les enfants aux États-Unis ; aujourd'hui, il est toutefois rare aux États-Unis en raison du diagnostic précoce et du traitement de la pharyngite streptococcique par des antibiotiques. Dans les régions du monde où le diagnostic et le traitement ne sont pas facilement disponibles, le rhumatisme articulaire aigu et les cardiopathies rhumatismales restent les principales causes de mortalité chez les enfants. 8
Le rhumatisme articulaire aigu se caractérise par divers signes et symptômes diagnostiques causés par des lésions immunitaires non suppuratives résultant d'une réaction croisée entre les anticorps des patients dirigés contre les protéines de surface bactériennes et des protéines similaires présentes dans les tissus cardiaques, neuronaux et synoviaux. Les lésions du tissu nerveux ou des articulations, qui entraînent des douleurs et un gonflement des articulations, sont réversibles. Cependant, les dommages aux valvules cardiaques peuvent être irréversibles et sont aggravés par des épisodes répétés de rhumatisme articulaire aigu, en particulier au cours des 3 à 5 premières années suivant la première crise de rhumatisme articulaire aigu. L'inflammation des valvules cardiaques provoquée par des anticorps à réaction croisée entraîne la formation de cicatrices et une raideur des feuillets valvulaires. Ceci, à son tour, produit un souffle cardiaque caractéristique. Les patients qui ont déjà développé un rhumatisme articulaire aigu et qui développent ensuite une pharyngite récidivante due à S. pyogenes présentent un risque élevé de crises récurrentes de rhumatisme articulaire aigu.
L'American Heart Association recommande 9 un schéma thérapeutique composé de benzathine benzylpénicilline toutes les 3 ou 4 semaines, en fonction du risque de réinfection du patient. Un traitement antibiotique prophylactique supplémentaire peut être recommandé en fonction de l'âge du patient et du risque de réinfection.
Endocardite et péricardite bactériennes
L'endocarde est une couche de tissu qui tapisse les muscles et les valves du cœur. Ce tissu peut être infecté par diverses bactéries, y compris des cocci à Gram positif tels que Staphylococcus aureus, viridans, streptocoques viridans et Enterococcus faecalis, et les bacilles à Gram négatif dits HACEK : Haemophilus spp., Actinobacillus actinomycetemcomitans, Cardiobacterium hominis, Eikenella corrodens et Kingella kingae. L'inflammation qui en résulte est appelée endocardite, qui peut être décrite comme aiguë ou subaiguë. Les agents responsables pénètrent généralement dans la circulation sanguine lors de violations accidentelles ou intentionnelles des défenses normales (par exemple, interventions dentaires, piercings corporels, cathétérisme, blessures). Les personnes présentant des lésions cardiaques préexistantes, des prothèses valvulaires et d'autres dispositifs cardiaques, ainsi que celles ayant des antécédents de rhumatisme articulaire aigu courent un risque plus élevé d'endocardite. Cette maladie peut rapidement détruire les valvules cardiaques et, si elle n'est pas traitée, entraîner la mort en quelques jours seulement.
Dans les cas d'endocardite bactérienne subaiguë, les dommages aux valvules cardiaques se produisent lentement sur une période de plusieurs mois. Pendant ce temps, des caillots sanguins se forment dans le cœur et protègent les bactéries des phagocytes. Ces plaques de bactéries associées aux tissus sont appelées végétations. Les dommages au cœur qui en résultent, en partie à cause de la réponse immunitaire provoquant la fibrose des valves cardiaques, peuvent nécessiter le remplacement de la valve cardiaque (Figure\(\PageIndex{1}\)). Les signes extérieurs d'une endocardite subaiguë peuvent inclure de la fièvre.
Le diagnostic de l'endocardite infectieuse est déterminé à l'aide d'une combinaison d'hémocultures, d'échocardiogramme et de symptômes cliniques. Dans les cas d'endocardite aiguë et subaiguë, le traitement implique généralement des doses relativement élevées d'antibiotiques intraveineux, telles que déterminées par des tests de sensibilité aux antimicrobiens. L'endocardite aiguë est souvent traitée avec une combinaison d'ampicilline, de nafcilline et de gentamicine pour une couverture synergique de Staphylococcus spp. et de Streptococcus spp. L'endocardite valvulaire prothétique est souvent traitée par une combinaison de vancomycine, de rifampicine et de gentamicine. La rifampicine est nécessaire pour traiter les personnes infectées par des prothèses valvulaires ou d'autres corps étrangers, car la rifampicine peut pénétrer dans le biofilm de la plupart des agents pathogènes qui infectent ces dispositifs.
Staphylcoccus spp. et Streptococcus spp. peuvent également infecter et provoquer une inflammation des tissus entourant le cœur, une affection appelée péricardite aiguë. La péricardite se caractérise par des douleurs thoraciques, des difficultés respiratoires et une toux sèche. Dans la plupart des cas, la péricardite est spontanément résolutive et aucune intervention clinique n'est nécessaire. Le diagnostic est posé à l'aide d'une radiographie pulmonaire, d'un électrocardiogramme, d'un échocardiogramme, d'une aspiration de liquide péricardique ou d'une biopsie du péricarde. Des médicaments antibactériens peuvent être prescrits pour les infections associées à la péricardite ; toutefois, la péricardite peut également être causée par d'autres agents pathogènes, notamment des virus (par exemple, échovirus, virus de la grippe), des champignons (par exemple Histoplasma spp., Coccidioides spp.) et des parasites eucaryotes (par exemple, Toxoplasma spp.).
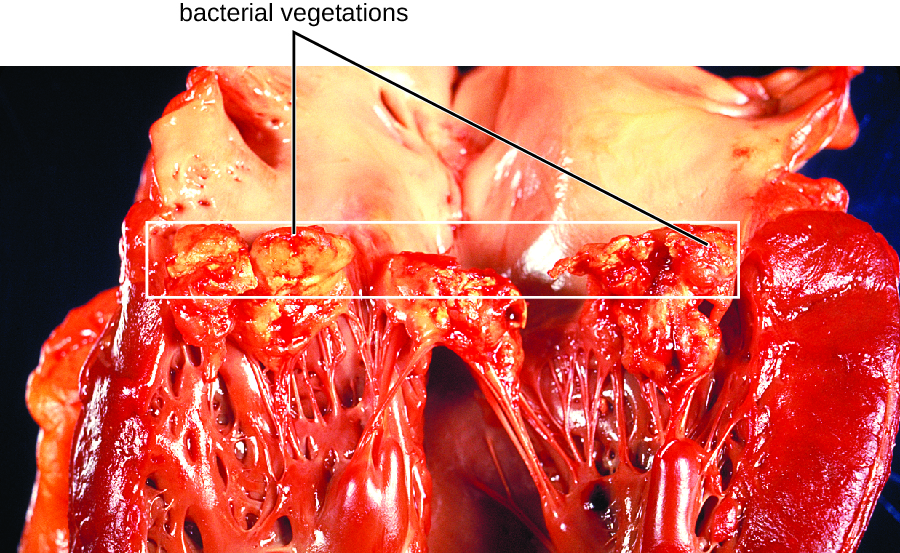
Exercice\(\PageIndex{4}\)
Comparez les endocardites bactériennes aiguës et subaiguës.
Gangrène gazeuse
Les blessures traumatiques ou certaines affections médicales, comme le diabète, peuvent endommager les vaisseaux sanguins, interrompant ainsi la circulation sanguine vers une région du corps. Lorsque le flux sanguin est interrompu, les tissus commencent à mourir, créant ainsi un environnement anaérobie dans lequel les bactéries anaérobies peuvent se développer. Cette affection est appelée ischémie. Les endospores de la bactérie anaérobie Clostridium perfringens (ainsi que d'un certain nombre d'autres Clostridium spp. provenant de l'intestin) peuvent facilement germer dans les tissus ischémiques et coloniser les tissus anaérobies.
L'infection qui en résulte, appelée gangrène gazeuse, se caractérise par une myonécrose (mort du tissu musculaire) qui se propage rapidement. Le patient ressent soudainement une douleur atroce au site de l'infection et le développement rapide d'une plaie malodorante contenant des bulles de gaz et un mince écoulement jaunâtre teinté d'une petite quantité de sang. Au fur et à mesure que l'infection progresse, un œdème et des cloques cutanées contenant du liquide bleu-violet se forment. Le tissu infecté se liquéfie et commence à se détacher. La marge entre les tissus nécrotiques et sains augmente souvent de plusieurs centimètres par heure, même avec une antibiothérapie. Un choc septique et une défaillance organique accompagnent fréquemment la gangrène gazeuse ; lorsque les patients développent une septicémie, le taux de mortalité est supérieur à 50 %.
La toxine α et la toxine thêta (θ) sont les principaux facteurs de virulence de C. perfringens impliqués dans la gangrène gazeuse. L'α-toxine est une lipase responsable de la dégradation des membranes cellulaires ; elle provoque également la formation de thrombus (caillots sanguins) dans les vaisseaux sanguins, contribuant ainsi à la propagation de l'ischémie. La toxine θ se forme pores dans les membranes cellulaires du patient, provoquant une lyse cellulaire. Le gaz associé à la gangrène gazeuse est produit par la fermentation de l'acide butyrique par Clostridium, qui produit de l'hydrogène et du dioxyde de carbone qui sont libérés lorsque les bactéries se multiplient, formant des poches de gaz dans les tissus (Figure\(\PageIndex{2}\)).
La gangrène gazeuse est initialement diagnostiquée en fonction de la présence des signes et symptômes cliniques décrits plus haut dans cette section. Le diagnostic peut être confirmé par coloration de Gram et culture anaérobie d'exsudat de plaie (drainage) et d'échantillons de tissus sur gélose sanguine. Le traitement implique généralement le débridement chirurgical de tout tissu nécrotique ; les cas avancés peuvent nécessiter une amputation. Les chirurgiens peuvent également utiliser la fermeture assistée par vide (VAC), une technique chirurgicale dans laquelle le drainage assisté par vide est utilisé pour prélever du sang ou du liquide séreux d'une plaie ou d'un site chirurgical afin d'accélérer le rétablissement. Les traitements antibiotiques les plus courants sont la pénicilline G et la clindamycine. Certains cas sont également traités par oxygénothérapie hyperbare, car les Clostridium spp. sont incapables de survivre dans des environnements riches en oxygène.
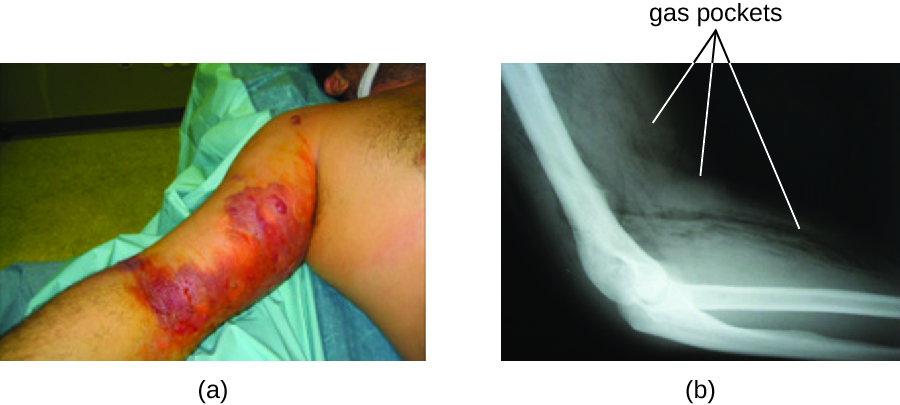
Tularémie
L'infection par la bactérie gram-négative Francisella tularensis provoque la tularémie (ou fièvre du lapin), une infection zoonotique chez l'homme. F. tularensis est un parasite intracellulaire facultatif qui cause principalement des maladies chez les lapins, bien qu'une grande variété d'animaux domestiques soient également sensibles à l'infection. Les humains peuvent être infectés par l'ingestion de viande contaminée ou, plus généralement, par la manipulation de tissus animaux infectés (par exemple, la peau d'un lapin infecté). La tularémie peut également être transmise par les morsures d'arthropodes infectés, notamment la tique canine (Dermacentor variabilis), la tique étoile solitaire (Amblyomma americanum), la tique des bois (Dermacentor andersoni) et les mouches à chevreuil (Chrysops spp.). Bien que la maladie ne soit pas directement transmissible entre humains, l'exposition à des aérosols de F. tularensis peut provoquer des infections potentiellement mortelles. F. tularensis est très contagieux, avec une dose infectieuse d'à peine 10 cellules bactériennes. De plus, les infections pulmonaires ont un taux de mortalité de 30 à 60 % si elles ne sont pas traitées. 10 Pour ces raisons, le F. tularensis est actuellement classé et doit être manipulé en tant qu'organisme de biosécurité de niveau 3 (BSL-3) et en tant qu'agent de guerre biologique potentiel.
Après leur introduction par une fracture de la peau, les bactéries se déplacent d'abord vers les ganglions lymphatiques, où elles sont ingérées par les phagocytes. Après s'être échappées du phagosome, les bactéries se développent et se multiplient de manière intracellulaire dans le cytoplasme des phagocytes. Ils peuvent ensuite être disséminés par le sang vers d'autres organes tels que le foie, les poumons et la rate, où ils produisent des masses de tissus appelées granulomes (Figure\(\PageIndex{3}\)). Après une période d'incubation d'environ 3 jours, des lésions cutanées se développent au site de l'infection. Les autres signes et symptômes incluent de la fièvre, des frissons, des maux de tête et des ganglions lymphatiques enflés et douloureux.
Le diagnostic direct de la tularémie est difficile en raison de sa contagiosité. Une fois qu'un diagnostic présomptif de tularémie est posé, une manipulation spéciale est requise pour collecter et traiter les échantillons des patients afin de prévenir l'infection des agents de santé. Les échantillons soupçonnés de contenir F. tularensis ne peuvent être manipulés que par les laboratoires BSL-2 ou BSL-3 enregistrés auprès du Federal Select Agent Program, et les personnes manipulant les échantillons doivent porter un équipement de protection et utiliser une armoire de sécurité biologique de classe II.
La tularémie est relativement rare aux États-Unis, et ses signes et symptômes sont similaires à ceux de diverses autres infections dont il peut être nécessaire d'éliminer la possibilité avant de poser un diagnostic. L'examen microscopique direct par anticorps fluorescents (DFA) à l'aide d'anticorps spécifiques à F. tularensis permet de confirmer rapidement la présence de ce pathogène. La culture de ce microbe est difficile en raison de ses besoins en cystéine, un acide aminé qui doit être fourni en tant que nutriment supplémentaire dans les milieux de culture. Des tests sérologiques sont disponibles pour détecter une réponse immunitaire contre le pathogène bactérien. Chez les patients soupçonnés d'être infectés, des prélèvements de sérum en phase aiguë et en phase de convalescence sont nécessaires pour confirmer une infection active. Les tests basés sur la PCR peuvent également être utilisés pour l'identification clinique d'échantillons provenant directement de fluides ou de tissus corporels ainsi que d'échantillons de culture. Dans la plupart des cas, le diagnostic repose sur les résultats cliniques et les incidents probables d'exposition à la bactérie. Les antibiotiques streptomycine, gentamycine, doxycycline et ciprofloxacine sont efficaces pour traiter la tularémie.
Brucellose
Les espèces du genre Brucella sont des agents pathogènes intracellulaires facultatifs à Gram négatif qui se présentent sous forme de coccobacilles. Plusieurs espèces provoquent des infections zoonotiques chez les animaux et les humains, dont quatre ont une pathogénicité importante pour l'homme : B. abortus chez les bovins et les buffles, B. canis chez les chiens, B. suis chez les porcs et B. melitensis chez les chèvres, les moutons et les chameaux. Les infections causées par ces agents pathogènes sont appelées brucellose, également appelée fièvre ondulante, « fièvre méditerranéenne » ou « fièvre de Malte ». La vaccination des animaux a fait de la brucellose une maladie rare aux États-Unis, mais elle est toujours courante en Méditerranée, en Asie du Sud et centrale, en Amérique centrale et du Sud et dans les Caraïbes. Les infections humaines sont principalement associées à l'ingestion de viande ou de produits laitiers non pasteurisés provenant d'animaux infectés. L'infection peut également se produire par inhalation de bactéries présentes dans des aérosols lors de la manipulation de produits d'origine animale ou par contact direct avec des plaies cutanées. Aux États-Unis, la plupart des cas de brucellose concernent des personnes exposées de manière intensive à des animaux potentiellement infectés (par exemple, les employés des abattoirs, les vétérinaires).
Deux facteurs de virulence importants produits par Brucella spp. sont l'uréase, qui permet aux bactéries ingérées d'éviter leur destruction par l'acide gastrique, et le lipopolysaccharide (LPS), qui permet aux bactéries de survivre dans les phagocytes. Après avoir pénétré dans les tissus, les bactéries sont phagocytées par les neutrophiles et les macrophages de l'hôte. Les bactéries s'échappent ensuite du phagosome et se développent dans le cytoplasme de la cellule. Les bactéries phagocytées par les macrophages sont disséminées dans tout l'organisme. Cela entraîne la formation de granulomes dans de nombreux sites du corps, notamment les os, le foie, la rate, les poumons, les voies génito-urinaires, le cerveau, le cœur, les yeux et la peau. Les infections aiguës peuvent provoquer une fièvre ondulante (récurrente), mais les infections non traitées se transforment en une maladie chronique qui se manifeste généralement par une maladie fébrile aiguë (fièvre de 40 à 41 °C [104 à 105,8 °F]) accompagnée de signes et de symptômes pseudo-grippaux récurrents.
La brucella n'est détectée de manière fiable dans le sang qu'au stade de la fièvre aiguë ; elle est difficile à diagnostiquer par culture. De plus, la brucella est considérée comme un agent pathogène BSL-3 et est dangereuse à manipuler en laboratoire clinique sans vêtements de protection et sans au moins une armoire de sécurité biologique de classe II. Les tests d'agglutination sont le plus souvent utilisés pour le sérodiagnostic. De plus, des tests immunoenzymatiques (ELISA) sont disponibles pour déterminer l'exposition à l'organisme. Les antibiotiques doxycycline ou ciprofloxacine sont généralement prescrits en association avec la rifampicine ; la gentamicine, la streptomycine et le triméthoprime-sulfaméthoxazole (TMP-SMZ) sont également efficaces contre les infections à Brucella et peuvent être utilisés si nécessaire.
Exercice\(\PageIndex{5}\)
Comparez la pathogenèse de la tularémie et de la brucellose.
Maladie des griffures du chat
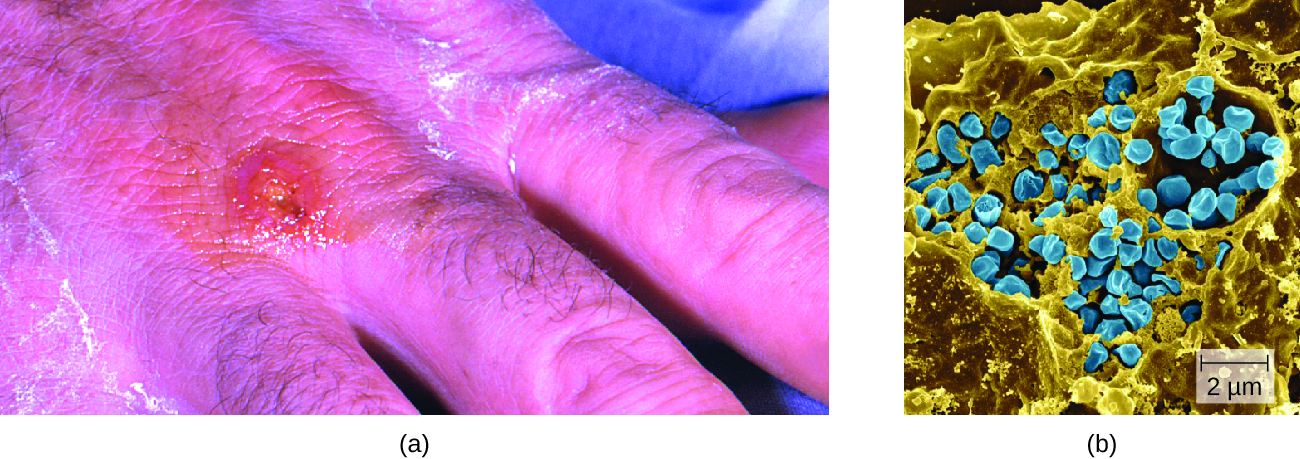
La zoonose des griffures du chat (CSD) (ou fièvre des griffures du chat) est une infection bactérienne qui peut être introduite dans les ganglions lymphatiques lorsqu'un être humain est mordu ou griffé par un chat. Elle est causée par la bactérie gram-négative intracellulaire facultative Bartonella henselae. Les chats peuvent être infectés par les excréments de puces contenant B. henselae qu'ils ingèrent pendant le toilettage. Les humains sont infectés lorsque des excréments de puces ou de la salive de chat (provenant de griffes ou de léchage) contenant B. henselae sont introduits sur le site d'une morsure ou d'une égratignure. Une fois introduit dans une plaie, B. henselae infecte les globules rouges.
L'invasion des globules rouges par B. henselae est facilitée par les adhésines associées aux protéines de la membrane externe et par un système de sécrétion qui assure le transport des facteurs de virulence dans la cellule hôte. Des signes d'infection sont indiqués si un petit nodule contenant du pus se forme à l'endroit de l'égratignure 1 à 3 semaines après la blessure initiale. Les bactéries migrent ensuite vers les ganglions lymphatiques les plus proches, où elles provoquent de l'enflure et de la douleur. Les signes et symptômes peuvent également inclure de la fièvre, des frissons et de la fatigue. La plupart des infections sont bénignes et tendent à disparaître spontanément. Cependant, les patients immunodéprimés peuvent développer une angiomatose bacillaire (BA), caractérisée par la prolifération de vaisseaux sanguins, entraînant la formation de masses ressemblant à des tumeurs dans la peau et les organes internes ; ou une péliose bacillaire (PA), caractérisée par de multiples cavités hépatiques remplies de sang ressemblant à des kystes et rate. La plupart des cas de CSD peuvent être évités en gardant les chats exempts de puces et en nettoyant rapidement les griffures d'un chat avec du savon et de l'eau chaude.
Le diagnostic de la CSD est difficile car la bactérie ne se développe pas facilement en laboratoire. Si nécessaire, une immunofluorescence, des tests sérologiques, une PCR et un séquençage génique peuvent être effectués pour identifier les espèces bactériennes. Compte tenu de la nature limitée de ces infections, les antibiotiques ne sont normalement pas prescrits. Pour les patients immunodéprimés, la rifampicine, l'azithromycine, la ciprofloxacine, la gentamicine (par voie intramusculaire) ou le TMP-SMZ sont généralement les options les plus efficaces.
Fièvre par morsure de rat
L'infection zoonotique (fièvre par morsure de rat) peut être causée par deux bactéries gram-négatives différentes : Streptobacillus moniliformis, plus répandu en Amérique du Nord, et Spirillum minor, plus fréquent en Asie. En raison des efforts sanitaires modernes, les morsures de rats sont rares aux États-Unis. Cependant, le contact avec des matières fécales ou des fluides corporels de rats, des aliments ou de l'eau contaminés par des matières fécales ou des liquides corporels peut Les signes et symptômes de la fièvre due aux morsures de rat incluent de la fièvre, des vomissements, des myalgies (douleurs musculaires), des arthralgies (douleurs articulaires) et une éruption maculopapuleuse sur les mains et les pieds. Un ulcère peut également se former sur le site de la morsure, ainsi qu'un gonflement des ganglions lymphatiques voisins. Dans la plupart des cas, l'infection est spontanément résolutive. On sait peu de choses sur les facteurs de virulence qui contribuent à ces signes et symptômes de la maladie.
La culture cellulaire, la spectrométrie de masse MALDI-TOF, la PCR ou l'ELISA peuvent être utilisées pour identifier Streptobacillus moniliformis. Le diagnostic de Spirillum minor peut être confirmé par l'observation microscopique directe des agents pathogènes présents dans le sang à l'aide de colorants Giemsa ou Wright, ou par la microscopie sur fond noir. Des tests sérologiques peuvent être utilisés pour détecter une réponse immunitaire de l'hôte aux agents pathogènes après environ 10 jours. Les antibiotiques les plus couramment utilisés pour traiter ces infections sont la pénicilline ou la doxycycline.
Peste
Le bacille à Gram négatif Yersinia pestis est à l'origine de la peste zoonotique. Cette bactérie provoque une maladie fébrile aiguë chez les animaux, généralement des rongeurs ou d'autres petits mammifères, et chez les humains. La maladie est associée à un taux de mortalité élevé si elle n'est pas traitée. Historiquement, Y. pestis a été responsable de plusieurs pandémies dévastatrices qui ont fait des millions de morts (voir Micro Connections : The History of the Plague). Il existe trois formes de peste : la peste bubonique (la forme la plus courante, représentant environ 80 % des cas), la peste pneumonique et la peste septicémique. Ces formes se différencient par le mode de transmission et le site initial de l'infection. La figure\(\PageIndex{4}\) illustre ces différents modes de transmission et d'infection entre les animaux et les humains.
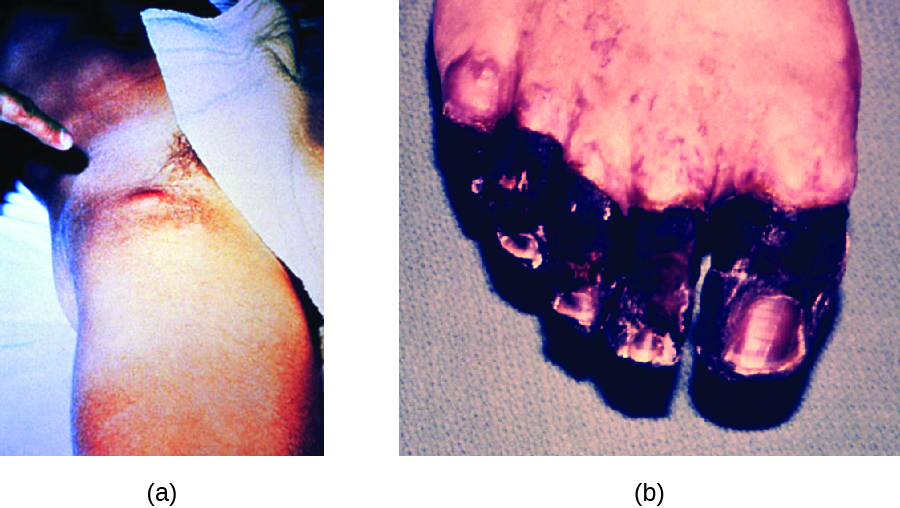
Dans le cas de la peste bubonique, Y. pestis est transmis par la piqûre de puces infectées. Comme la plupart des piqûres de puces se produisent sur les jambes et les chevilles, Y. pestis est souvent introduit dans les tissus et la circulation sanguine des membres inférieurs. Après une période d'incubation de 2 à 6 jours, les patients présentent une fièvre soudaine (39,5 à 41 °C [103,1 à 105,8 °F]), des maux de tête, une hypotension et des frissons. L'agent pathogène se localise dans les ganglions lymphatiques, où il provoque une inflammation, un gonflement et une hémorragie qui se traduisent par des bubons violets (Figure\(\PageIndex{5}\)). Les bubons se forment souvent dans les ganglions lymphatiques de l'aine, d'abord parce que ce sont les ganglions associés aux membres inférieurs ; finalement, par la circulation sanguine et lymphatique, les ganglions lymphatiques de tout le corps s'infectent et forment des bubons. Le taux de mortalité moyen pour la peste bubonique est d'environ 55 % si elle n'est pas traitée et d'environ 10 % avec un traitement antibiotique.
La peste septicémique survient lorsque Y. pestis est introduit directement dans la circulation sanguine par une coupure ou une blessure et circule dans tout le corps. La période d'incubation de la peste septicémique est de 1 à 3 jours, après quoi les patients développent de la fièvre, des frissons, une faiblesse extrême, des douleurs abdominales et un choc. Une coagulation intravasculaire disséminée (DIC) peut également se produire, entraînant la formation de thrombus qui obstruent les vaisseaux sanguins et favorisent l'ischémie et la nécrose dans les tissus environnants (Figure\(\PageIndex{5}\)). La nécrose survient le plus souvent au niveau des extrémités, comme les doigts et les orteils, qui deviennent noircies. La peste septicémique peut rapidement entraîner la mort, avec un taux de mortalité proche de 100 % lorsqu'elle n'est pas traitée. Même avec un traitement antibiotique, le taux de mortalité est d'environ 50 %.
La peste pneumonique survient lorsque Y. pestis provoque une infection des poumons. Cela peut se produire par inhalation de gouttelettes aérosolisées provenant d'une personne infectée ou lorsque l'infection se propage aux poumons à partir d'autres parties du corps chez des patients atteints de peste bubonique ou septicémique. Après une période d'incubation de 1 à 3 jours, les signes et symptômes incluent de la fièvre, des maux de tête, une faiblesse et une pneumonie à évolution rapide accompagnée d'essoufflement, de douleurs thoraciques et de toux produisant du mucus sanglant ou aqueux. La pneumonie peut provoquer une insuffisance respiratoire rapide et un choc. La peste pneumonique est la seule forme de peste qui peut se transmettre d'une personne à l'autre par des gouttelettes d'aérosol infectieuses. En l'absence de traitement, le taux de mortalité avoisine les 100 % ; avec un traitement antibiotique, le taux de mortalité est d'environ 50 %.
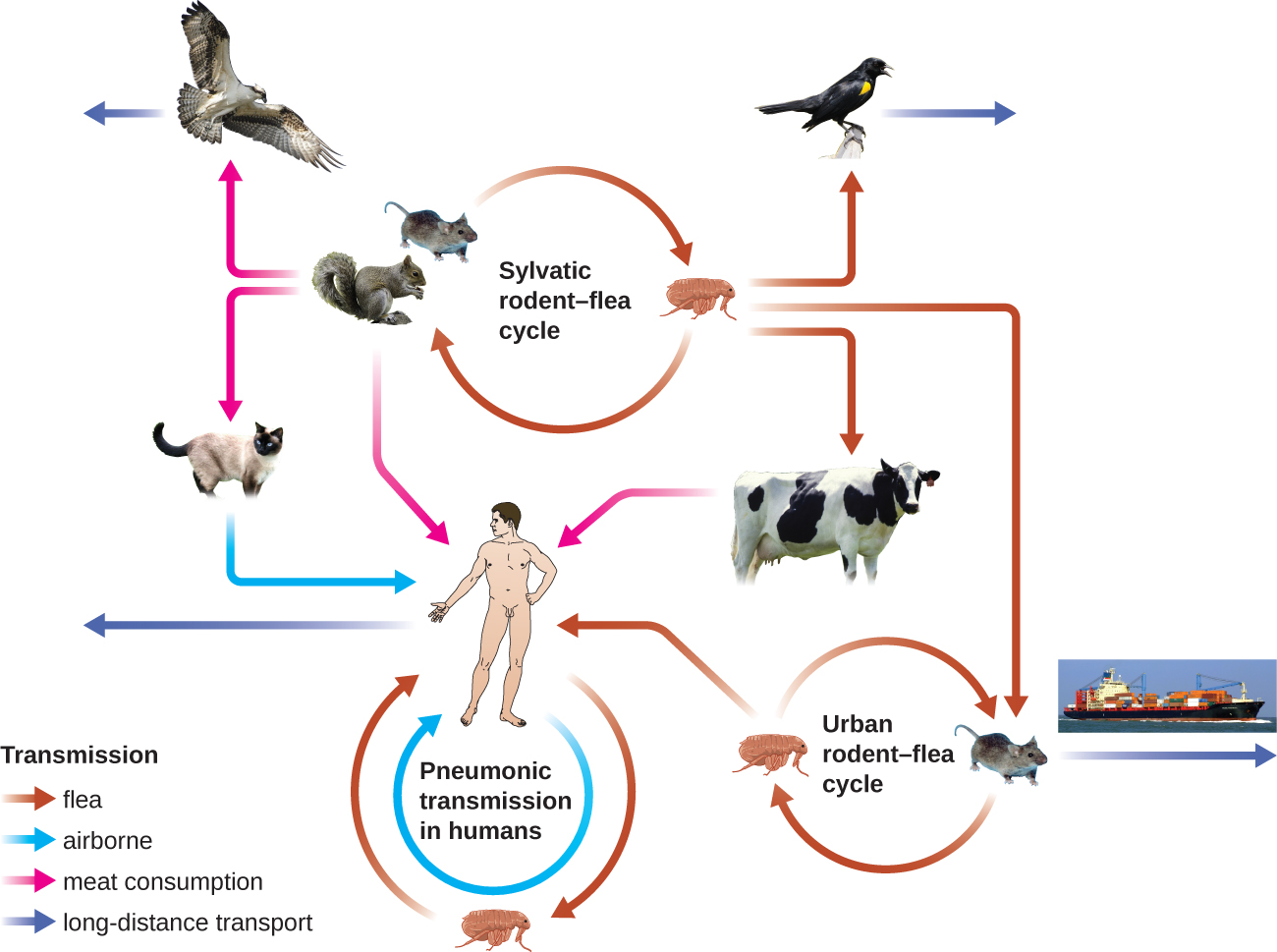
Le taux de mortalité élevé dû à la peste est en partie dû au fait qu'elle est exceptionnellement bien équipée en facteurs de virulence. À ce jour, au moins 15 facteurs de virulence majeurs ont été identifiés chez Y. pestis, dont huit sont impliqués dans l'adhérence aux cellules hôtes. De plus, le composant F1 de la capsule de Y. pestis est un facteur de virulence qui permet à la bactérie d'éviter la phagocytose. La F1 est produite en grande quantité lors d'une infection chez les mammifères et constitue le composant le plus immunogène. 11 L'utilisation efficace de facteurs de virulence permet aux bacilles de se disséminer de la zone de la morsure vers les ganglions lymphatiques régionaux et finalement vers l'ensemble du sang et du système lymphatique.
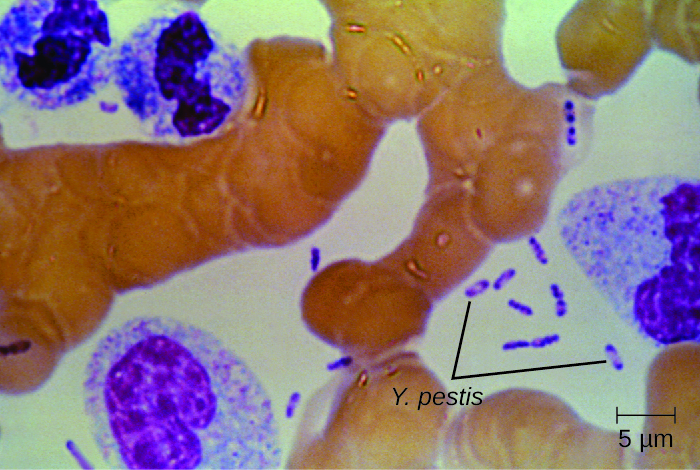
La culture et l'examen microscopique direct d'un échantillon de liquide prélevé dans un bubo, du sang ou des expectorations constituent le meilleur moyen d'identifier Y. pestis et de confirmer un diagnostic présomptif de peste. Les spécimens peuvent être colorés à l'aide de la technique de coloration de Gram, Giemsa, Wright ou Wayson (Figure\(\PageIndex{6}\)). Les bactéries présentent un schéma de coloration bipolaire caractéristique, ressemblant à des épingles de sûreté, qui facilite l'identification présomptive. Des tests d'anticorps fluorescents directs (test rapide des antigènes de la membrane externe) et des tests sérologiques tels que l'ELISA peuvent être utilisés pour confirmer le diagnostic. La méthode de confirmation pour identifier les isolats de Y. pestis aux États-Unis est la lyse des bactériophages.
Une antibiothérapie rapide peut résoudre la plupart des cas de peste bubonique, mais la peste septicémique et la peste pneumonique sont plus difficiles à traiter en raison de leurs stades d'incubation plus courts. La survie dépend souvent d'un diagnostic précoce et précis et d'un choix approprié d'antibiothérapie. Aux États-Unis, les antibiotiques les plus couramment utilisés pour traiter les patients atteints de peste sont la gentamicine, les fluoroquinolones, la streptomycine, la lévofloxacine, la ciprofloxacine et la doxycycline.
Exercice\(\PageIndex{6}\)
Comparez la peste bubonique, la peste septicémique et la peste pneumonique.
Micro Connections : L'histoire de la peste
La première pandémie de peste enregistrée, la peste Justinienne, s'est produite au VIe siècle de notre ère. On pense qu'il est originaire d'Afrique centrale et s'est propagé vers la Méditerranée par les routes commerciales. À son apogée, plus de 5 000 personnes sont mortes chaque jour rien qu'à Constantinople. Finalement, un tiers de la population de cette ville a succombé à la peste. 12 L'impact de cette épidémie a probablement contribué à la chute ultérieure de l'empereur Justinien.
La deuxième grande pandémie, surnommée la peste noire, s'est produite au XIVe siècle. Cette fois, on pense que les infections sont originaires de quelque part en Asie avant d'être transportées en Europe par des commerçants, des soldats et des réfugiés de guerre. Cette épidémie a tué environ un quart de la population européenne (25 millions, principalement dans les grandes villes). En outre, au moins 25 millions de personnes supplémentaires auraient été tuées en Asie et en Afrique. 13 Cette deuxième pandémie, associée à la souche Yersinia pestis biovar Medievalis, a sévi pendant encore 300 ans en Europe et en Grande-Bretagne, et a été baptisée la Grande Peste dans les années 1660.
La plus récente pandémie s'est produite dans les années 1890 avec Yersinia pestis biovar Orientalis. Cette épidémie a pris naissance dans la province chinoise du Yunnan et s'est propagée dans le monde entier grâce au commerce. C'est à cette époque que la peste s'est répandue aux États-Unis. L'agent étiologique de la peste a également été découvert par Alexandre Yersin (1863-1943) lors de cette épidémie. Le nombre total de décès était inférieur à celui des épidémies précédentes, peut-être en raison de l'amélioration des installations sanitaires et du soutien médical. 14 La plupart des décès attribués à cette dernière pandémie sont survenus en Inde.
Cliquez sur ce lien pour consulter un article décrivant à quel point le génome de la bactérie Black Death est similaire à celui des souches actuelles de peste bubonique.
Maladies fébriles zoonotiques
Une grande variété de maladies fébriles zoonotiques (maladies qui provoquent de la fièvre) sont causées par des bactéries pathogènes qui ont besoin d'arthropodes vecteurs. Ces agents pathogènes sont soit des espèces intracellulaires obligatoires d'Anaplasma, Bartonella, Ehrlichia, Orientia et Rickettsia, soit des spirochètes du genre Borrelia. Il est préférable d'isoler et d'identifier les agents pathogènes de ce groupe dans les laboratoires BSL-3 en raison de la faible dose infectieuse associée aux maladies.
Anaplasmose
L'anaplasmose granulocytaire humaine (HGA), maladie zoonotique transmise par les tiques, est causée par le pathogène intracellulaire obligatoire Anaplasma phagocytophilum. L'HGA est endémique principalement dans le centre et le nord-est des États-Unis ainsi que dans les pays d'Europe et d'Asie.
L'HGA est généralement une maladie fébrile bénigne qui provoque des symptômes semblables à ceux de la grippe chez les patients immunocompétents ; toutefois, les symptômes sont suffisamment graves pour nécessiter une hospitalisation dans au moins 50 % des infections et, parmi ces patients, moins de 1 % décèderont des suites de l'HGA. 15 De petits mammifères tels que les souris à pattes blanches, les tamias et les campagnols ont été identifiés comme des réservoirs d'A. phagocytophilum, qui est transmis par la morsure d'une tique Ixodes. Cinq principaux facteurs de virulence 16 ont été signalés chez Anaplasma ; trois sont des facteurs d'adhérence et deux sont des facteurs qui permettent au pathogène d'éviter la réponse immunitaire humaine. Les approches diagnostiques incluent la localisation de microcolonies intracellulaires d'Anaplasma par examen microscopique de neutrophiles ou d'éosinophiles colorés par Giemsa ou Wright, par PCR pour la détection d'A. phagocytophilum et par des tests sérologiques pour détecter les titres d'anticorps contre le agents pathogènes. Le principal antibiotique utilisé pour le traitement est la doxycycline.
Ehrlichiose
L'ehrlichiose monocytotrope humaine (HME) est une zoonose transmise par les tiques causée par le BSL-2, un agent pathogène intracellulaire obligatoire Ehrlichia chaffeensis. Actuellement, la distribution géographique de l'HME se situe principalement dans la moitié est des États-Unis, avec quelques cas signalés dans l'Ouest, ce qui correspond à la distribution géographique connue du vecteur principal, la tique étoile solitaire (Amblyomma americanum). Les symptômes de l'HME sont similaires aux symptômes pseudo-grippaux observés dans l'anaplasmose, mais les éruptions cutanées sont plus fréquentes, 60 % des enfants et moins de 30 % des adultes présentant des éruptions pétéchiales, maculopapuleuses et maculopapuleuses. 17 Les facteurs de virulence permettent à E. chaffeensis d'adhérer aux monocytes et de les infecter, formant ainsi des microcolonies intracellulaires dans les monocytes qui permettent de diagnostiquer l'HME. Le diagnostic de l'HME peut être confirmé par la PCR et des tests sérologiques. Le traitement de première intention pour les adultes et les enfants de tous âges atteints d'HME est la doxycycline.
Épidémie de typhus
L'épidémie de typhus est causée par Rickettsia prowazekii et est transmise par des poux, Pediculus humanus. Les polatouches sont des réservoirs de R. prowazekii en Amérique du Nord et peuvent également être des sources de poux capables de transmettre le pathogène. L'épidémie de typhus se caractérise par une forte fièvre et des courbatures qui durent environ 2 semaines. Une éruption cutanée apparaît sur l'abdomen et la poitrine et irradie vers les extrémités. Les cas graves peuvent entraîner la mort à la suite d'un choc ou de lésions des tissus cardiaques et cérébraux. Les humains infectés constituent un réservoir important pour cette bactérie, car R. prowazekii est la seule rickettsie capable d'établir un état porteur chronique chez l'homme.
L'épidémie de typhus a joué un rôle important dans l'histoire de l'humanité, provoquant de grandes épidémies avec des taux de mortalité élevés en temps de guerre ou d'adversité. Pendant la Première Guerre mondiale, l'épidémie de typhus a tué plus de 3 millions de personnes sur le front de l'Est. 18 Avec l'arrivée d'insecticides efficaces et l'amélioration de l'hygiène personnelle, l'épidémie de typhus est désormais assez rare aux États-Unis. Dans les pays en développement, toutefois, les épidémies peuvent entraîner des taux de mortalité allant jusqu'à 40 % en l'absence de traitement. 19 Ces dernières années, la plupart des épidémies se sont produites au Burundi, en Éthiopie et au Rwanda. Par exemple, une épidémie dans des camps de réfugiés burundais en 1997 a provoqué 45 000 maladies chez une population d'environ 760 000 personnes. 20
Un diagnostic rapide est difficile en raison de la similitude des symptômes primaires avec ceux de nombreuses autres maladies. Les tests diagnostiques moléculaires et immunohistochimiques sont les méthodes les plus utiles pour établir un diagnostic au stade aigu de la maladie, lorsque les décisions thérapeutiques sont cruciales. La PCR, qui permet de détecter des gènes distincts de R. prowazekii, peut être utilisée pour confirmer le diagnostic d'une épidémie de typhus, ainsi que pour colorer par immunofluorescence des échantillons de biopsie tissulaire. La sérologie est généralement utilisée pour identifier les infections à rickettsies. Cependant, des titres d'anticorps adéquats mettent jusqu'à 10 jours à se développer. L'antibiothérapie commence généralement avant que le diagnostic ne soit terminé. Les médicaments les plus couramment utilisés pour traiter les patients atteints de typhus épidémique sont la doxycycline ou le chloramphénicol.
Typhus murin (endémique)
Le typhus murin (également connu sous le nom de typhus endémique) est causé par Rickettsia typhi et se transmet par la piqûre de la puce du rat, Xenopsylla cheopis, dont le principal réservoir est le rat infecté. Les signes et symptômes cliniques du typhus murin incluent une éruption cutanée et des frissons accompagnés de maux de tête et de fièvre qui durent environ 12 jours. Certains patients présentent également une toux et des symptômes semblables à ceux d'une pneumonie. Une maladie grave peut se développer chez les patients immunodéprimés, avec des convulsions, un coma et une insuffisance rénale et respiratoire.
Le diagnostic clinique du typhus murin peut être confirmé par un échantillon de biopsie prélevé sur l'éruption cutanée. Les tests diagnostiques comprennent la coloration indirecte aux anticorps immunofluorescents (IFA), la PCR pour R. typhi et des tests sérologiques de phase aiguë et de convalescence. Le traitement principal est la doxycycline, le chloramphénicol étant le deuxième choix.
Fièvre maculée des Rocheuses
La fièvre maculée des Rocheuses (RMSF) est causée par Rickettsia rickettsii et se transmet par la morsure d'une tique à corps dur telle que la tique du chien d'Amérique (Dermacentor variabilis), la tique des bois des Rocheuses (D. andersoni) ou la tique brune du chien ( Rhipicephalus sanguineus).
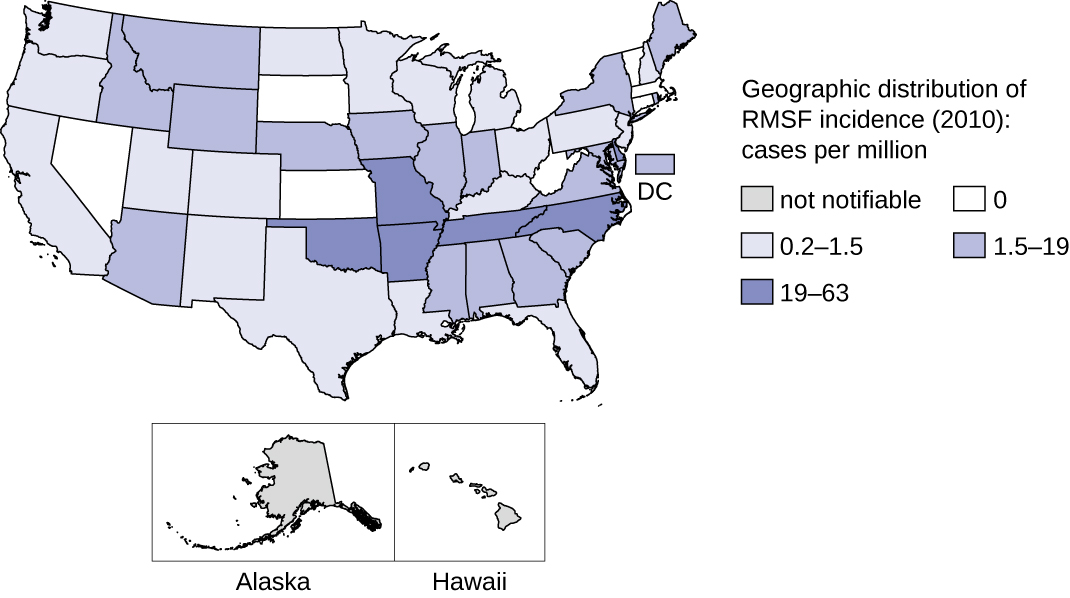
Cette maladie est endémique en Amérique du Nord et du Sud et son incidence coïncide avec la gamme des vecteurs arthropodes. Malgré son nom, la plupart des cas aux États-Unis ne se produisent pas dans la région des Rocheuses mais dans le sud-est ; la Caroline du Nord, l'Oklahoma, l'Arkansas, le Tennessee et le Missouri représentent plus de 60 % de tous les cas. 21 La carte de la figure\(\PageIndex{7}\) montre la distribution de la prévalence aux États-Unis en 2010.
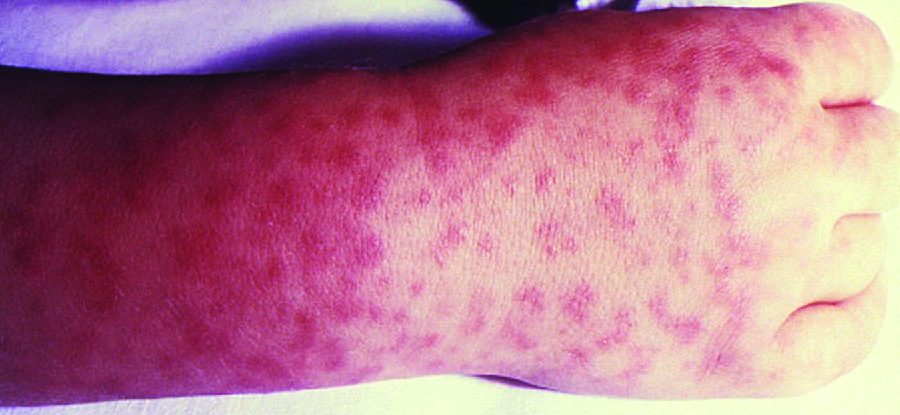
Les signes et symptômes de la RMSF incluent une forte fièvre, des maux de tête, des courbatures, des nausées et des vomissements. Une éruption pétéchiale (semblable à celle de la rougeole) commence sur les mains et les poignets et se propage au tronc, au visage et aux extrémités (Figure\(\PageIndex{8}\)). Si elle n'est pas traitée, la RMSF est une maladie grave qui peut être fatale au cours des 8 premiers jours, même chez des patients par ailleurs en bonne santé. Idéalement, le traitement doit commencer avant l'apparition des pétéchies, car cela indique une évolution vers une maladie grave ; toutefois, l'éruption cutanée n'apparaît généralement que 6 jours ou plus tard après l'apparition des symptômes et ne survient que chez 35 % à 60 % des patients infectés. L'augmentation de la perméabilité vasculaire associée à la formation de pétéchies peut entraîner des taux de mortalité de 3 % ou plus, même en présence de preuves cliniques. La plupart des décès sont dus à une hypotension et à un arrêt cardiaque ou à une ischémie consécutive à une coagulation sanguine.
Le diagnostic peut être difficile car la maladie imite plusieurs autres maladies plus répandues. Le diagnostic de la RMSF repose sur les symptômes, la coloration aux anticorps fluorescents d'un échantillon prélevé sur l'éruption cutanée par biopsie, la PCR pour détecter les rickettsies rickettsies et les tests sérologiques de phase aiguë et de convalescence. Le traitement principal est la doxycycline, le chloramphénicol étant le deuxième choix.
Maladie de Lyme
La maladie de Lyme est causée par le spirochète Borrelia burgdorferi qui se transmet par la piqûre d'une tique Ixodes au corps dur et aux pattes noires. I. scapularis est le vecteur biologique transmettant B. burgdorferi dans l'est et le centre-nord des États-Unis et I. pacificus transmet B. burgdorferi dans l'ouest des États-Unis (Figure\(\PageIndex{10}\)). Différentes espèces de tiques Ixodes sont responsables de la transmission de B. burgdorferi en Asie et en Europe. Aux États-Unis, la maladie de Lyme est la maladie à transmission vectorielle la plus fréquemment signalée. En 2014, il s'agissait de la cinquième maladie à déclaration obligatoire au niveau national la plus courante. 22
Les tiques Ixodes ont des cycles de vie complexes et les cerfs, les souris et même les oiseaux peuvent agir comme des réservoirs. En deux ans, les tiques passent par quatre stades de développement et nécessitent un repas sanguin de la part de l'hôte à chaque stade. Au printemps, les œufs de tiques éclosent en larves à six pattes. Ces larves ne sont pas porteuses de B. burgdorferi au départ. Ils peuvent contracter le spirochète lorsqu'ils prennent leur premier repas de sang (généralement à partir d'une souris). Les larves passent ensuite l'hiver et muent en nymphes à huit pattes au printemps suivant. Les nymphes se nourrissent principalement de petits rongeurs, mais elles peuvent aussi se nourrir d'humains en s'enfouissant dans la peau. La période d'alimentation peut durer de plusieurs jours à une semaine, et il faut généralement 24 heures pour qu'une nymphe infectée transmette suffisamment de B. burgdorferi pour provoquer une infection chez un hôte humain. Les nymphes finissent par devenir des tiques adultes mâles et femelles, qui ont tendance à se nourrir de gros animaux comme les cerfs ou, parfois, les humains. Les adultes s'accouplent ensuite et produisent des œufs pour poursuivre le cycle (Figure\(\PageIndex{9}\)).
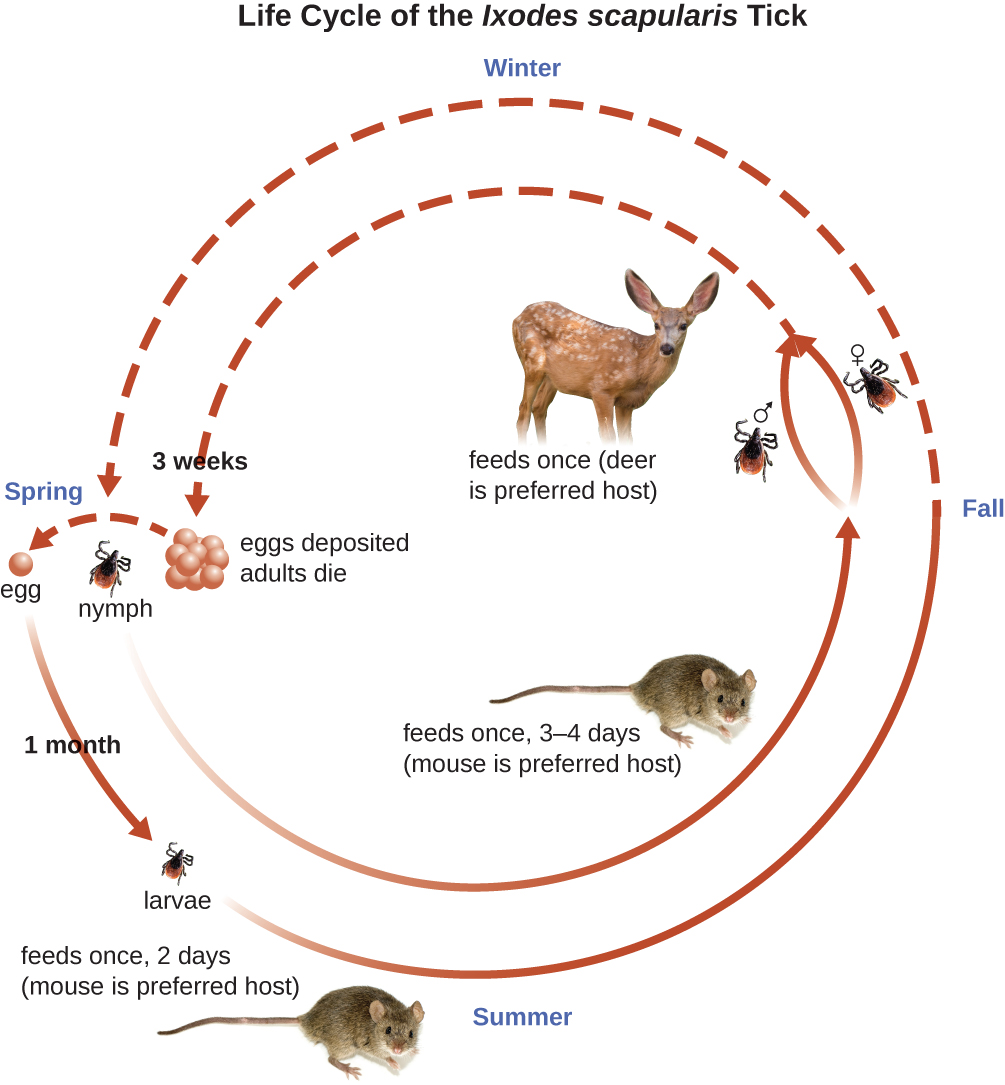
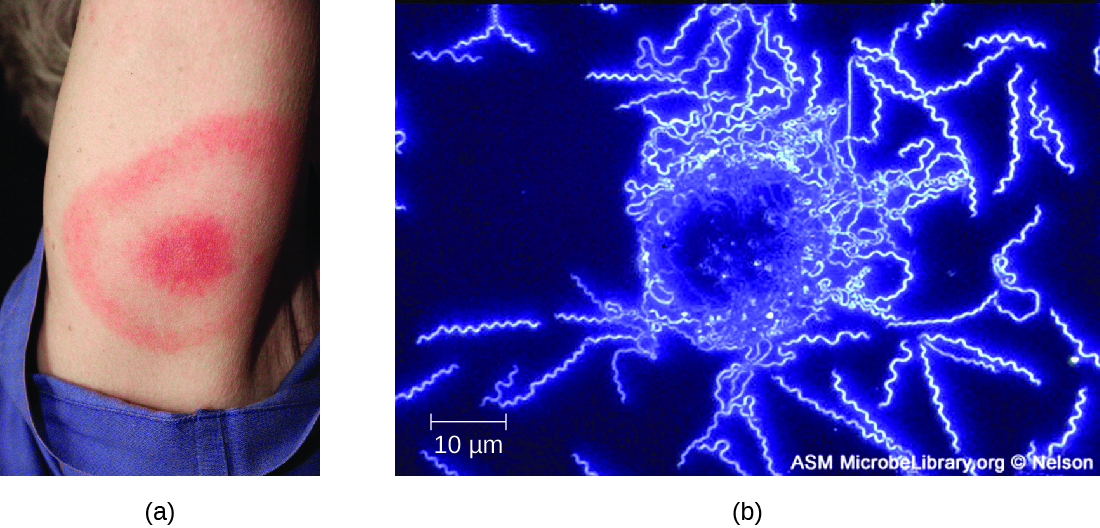
Les symptômes de la maladie de Lyme se présentent en trois étapes : localisation précoce, dissémination précoce et stade avancé. Au stade de localisation précoce, environ 70 % à 80 %23 des cas peuvent être caractérisés par une éruption cutanée appelée érythème migrant, au site de la morsure initiale de tique. L'éruption apparaît 3 à 30 jours après la morsure de la tique (7 jours en moyenne) et peut également être chaude au toucher (Figure\(\PageIndex{10}\)). 24 Ce signe diagnostique est souvent négligé si la morsure de tique se produit sur le cuir chevelu ou à un autre endroit moins visible. Les autres symptômes précoces incluent des symptômes pseudo-grippaux tels que malaise, maux de tête, fièvre et raideur musculaire. Si le patient n'est pas traité, le deuxième stade de dissémination précoce de la maladie survient quelques jours, voire des semaines plus tard. Les symptômes à ce stade peuvent inclure de graves maux de tête, une raideur de la nuque, une paralysie faciale, une arthrite et une cardite. Les manifestations à un stade avancé de la maladie peuvent survenir des années après l'exposition. L'inflammation chronique cause des dommages qui peuvent éventuellement provoquer une arthrite sévère, une méningite, une encéphalite et une altération de l'état mental. La maladie peut être fatale si elle n'est pas traitée.
Un diagnostic présomptif de la maladie de Lyme peut être posé uniquement sur la base de la présence d'une éruption cutanée oculaire sur le site de l'infection, si elle est présente, en plus d'autres symptômes associés (Figure\(\PageIndex{10}\)). De plus, le marquage indirect par anticorps immunofluorescents (IFA) peut être utilisé pour visualiser les bactéries à partir d'échantillons de sang ou de biopsie cutanée. Des tests sérologiques tels que l'ELISA peuvent également être utilisés pour détecter les anticorps sériques produits en réponse à une infection. Au stade précoce de l'infection (environ 30 jours), les médicaments antibactériens tels que l'amoxicilline et la doxycycline sont efficaces. Aux derniers stades, la pénicilline G, le chloramphénicol ou la ceftriaxone peuvent être administrés par voie intraveineuse.
Fièvre récurrente
Borrelia spp. peut également provoquer une fièvre récurrente. Deux des espèces les plus communes sont B. recurrentis, qui provoque des épidémies de fièvre récurrente transmise par les poux, et B. hermsii, qui provoque des fièvres récurrentes transmises par les tiques. Ces espèces de Borrelia sont transmises respectivement par le pou Pediculus humanus et la tique à corps mou Ornithodoros hermsi. Les poux se procurent les spirochètes dans les réservoirs humains, tandis que les tiques s'en procurent dans les réservoirs des rongeurs. Les spirochètes infectent les humains lorsque les borrélies présentes dans la salive ou les excréments du vecteur pénètrent rapidement dans la peau lorsque le vecteur mord.
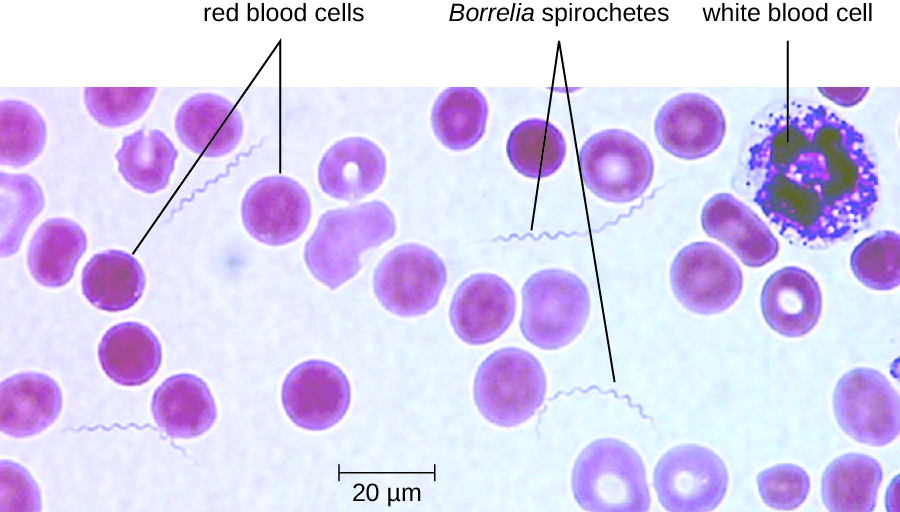
Dans les cas de fièvre récurrente transmise par les poux et les tiques, la bactériémie survient généralement après l'exposition initiale, entraînant une forte fièvre soudaine (39—43 °C [102,2 à 109,4 °F]) généralement accompagnée de maux de tête et de douleurs musculaires. Après environ 3 jours, ces symptômes disparaissent généralement, pour réapparaître au bout d'une semaine environ. Après 3 jours supplémentaires, les symptômes disparaissent à nouveau mais réapparaissent une semaine plus tard, et ce cycle peut se répéter plusieurs fois à moins qu'il ne soit perturbé par un traitement antibiotique. L'évasion immunitaire par le biais de variations antigéniques bactériennes est responsable de la nature cyclique des symptômes de ces maladies.
Le diagnostic de fièvre récurrente peut être posé par l'observation de spirochètes dans le sang, à l'aide de la microscopie à fond noir (Figure\(\PageIndex{11}\)). La doxycycline ou l'érythromycine sont les antibiotiques de première intention pour les cas de fièvre récurrente véhiculée par des poux. Pour la fièvre récurrente transmise par les tiques, la tétracycline ou l'érythromycine sont les antibiotiques de première intention.
Fièvre des tranchées
La fièvre des tranchées, une maladie transmise par le poux, a été caractérisée pour la première fois comme une maladie spécifique pendant la Première Guerre mondiale, lorsqu'environ un million de soldats ont été infectés. Aujourd'hui, elle se limite principalement aux régions du monde en développement où de mauvaises conditions sanitaires et d'hygiène entraînent des infestations de poux (par exemple, les zones urbaines surpeuplées et les camps de réfugiés). La fièvre des tranchées est causée par la bactérie gram-négative Bartonella quintana, qui se transmet lorsque les matières fécales de poux infectés, Pediculus humanus var corporis, sont frottées sur la morsure du pou, la peau abrasée ou la conjonctive. Les symptômes suivent généralement une évolution de 5 jours marquée par une forte fièvre, des courbatures, une conjonctivite, des douleurs oculaires, de graves maux de tête et de fortes douleurs osseuses au niveau des tibias, du cou et du dos. Le diagnostic peut être établi à l'aide d'hémocultures ; des tests sérologiques tels que l'ELISA peuvent être utilisés pour détecter les titres d'anticorps dirigés contre le pathogène et la PCR peut également être utilisée. Les antibiotiques de première intention sont la doxycycline, les antibiotiques macrolides et la ceftriaxone.
Exercice\(\PageIndex{7}\)
- Quel est le vecteur associé à l'épidémie de typhus ?
- Décrivez le cycle de vie de la tique chevreuil et la façon dont elle transmet la maladie de Lyme.
Astuces à cocher
De nombreuses maladies abordées dans ce chapitre impliquent des vecteurs arthropodes. Parmi celles-ci, les tiques sont probablement les plus fréquemment rencontrées aux États-Unis. Les tiques adultes ont huit pattes et deux segments du corps, le céphalothorax et la tête (Figure\(\PageIndex{12}\)). Elles mesurent généralement de 2 mm à 4 mm de long et se nourrissent du sang de l'hôte en se fixant à la peau.
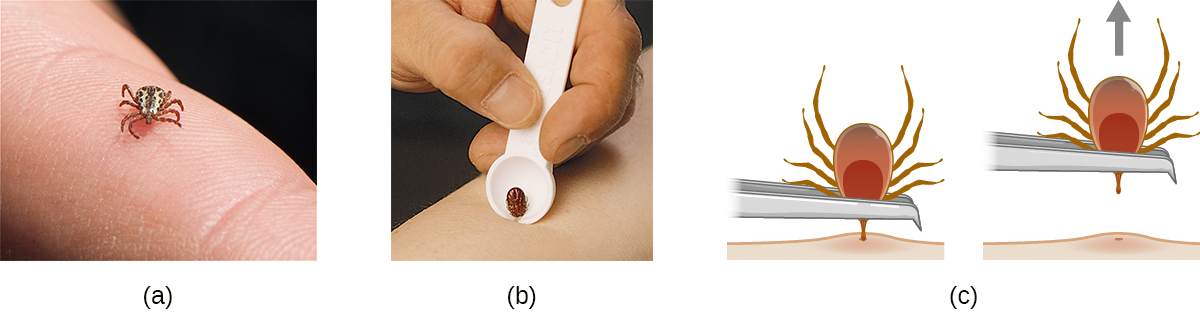
Les tiques non attachées doivent être retirées et éliminées dès qu'elles sont découvertes. Lorsque vous retirez une tique déjà attachée, gardez à l'esprit les directives suivantes afin de réduire les risques d'exposition à des agents pathogènes :
- Utilisez une pince à épiler émoussée pour tirer doucement près du point d'attache jusqu'à ce que la tique relâche son emprise sur la peau.
- Évitez d'écraser le corps de la tique et ne manipulez pas la tique à doigts nus. Cela pourrait libérer des agents pathogènes bactériens et augmenter votre exposition. La tique peut être tuée par noyade dans l'eau ou l'alcool, ou congelée si elle est nécessaire ultérieurement à des fins d'identification et d'analyse.
- Désinfectez soigneusement la zone en l'écouvillonnant avec un antiseptique tel que l'isopropanol.
- Surveillez le site de la morsure pour détecter toute éruption cutanée ou tout autre signe d'infection.
De nombreux remèdes maison mal avisés pour éliminer les tiques sont devenus populaires ces dernières années, diffusés par les réseaux sociaux et le pseudojournalisme. Les professionnels de santé devraient décourager les patients de recourir à l'une des méthodes suivantes, qui ne sont PAS recommandées :
- utiliser des produits chimiques (par exemple de la vaseline ou du vernis à ongles) pour déloger une tique attachée, car cela peut provoquer la libération de liquide par la tique, ce qui peut augmenter le risque d'infection
- utiliser des objets chauds (allumettes ou mégots de cigarettes) pour déloger une tique attachée
- serrer le corps de la tique avec les doigts ou une pince à épiler
Infections bactériennes des systèmes circulatoire et lymphatique
Bien que le système circulatoire soit un système fermé, les bactéries peuvent pénétrer dans la circulation sanguine par plusieurs voies. Les blessures, morsures d'animaux ou autres lésions de la peau et des muqueuses peuvent entraîner la dissémination rapide de bactéries pathogènes dans tout le corps. Les infections localisées peuvent également se propager à la circulation sanguine, provoquant des infections systémiques graves et souvent mortelles. La figure\(\PageIndex{13}\) et la figure\(\PageIndex{14}\) résument les principales caractéristiques des infections bactériennes des systèmes circulatoire et lymphatique.
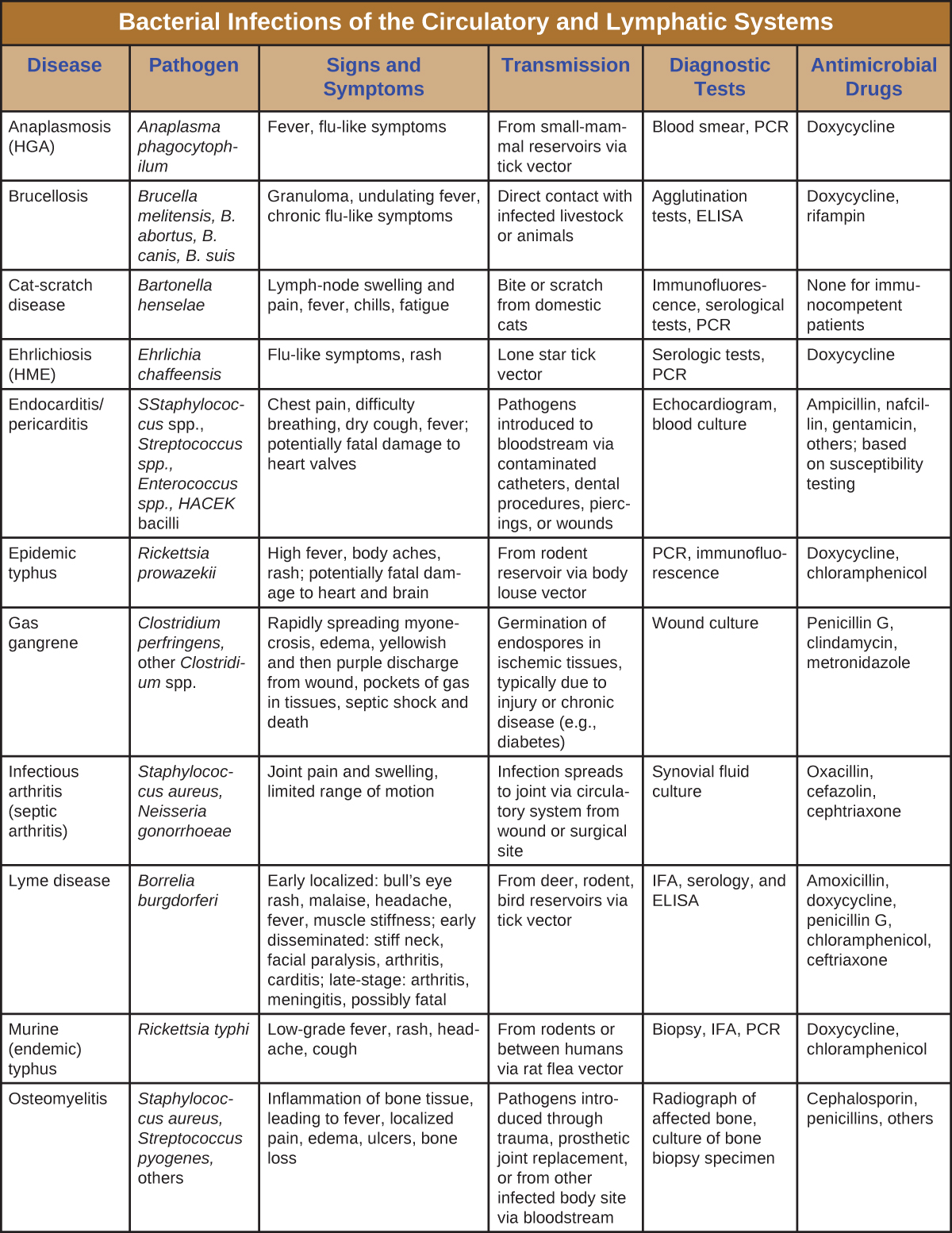
![Tableau intitulé : Infections bactériennes des systèmes circulatoire et lymphatique (suite). Chroniques : Maladie, agent pathogène, signes et symptômes, transmission, tests diagnostiques, médicaments antimicrobiens. Peste ; Yersinia pestis ; Bubonique : bubons, fièvre, hémorragie interne ; septicémique : fièvre, douleurs abdominales, choc, DIC, nécrose des extrémités ; pneumonique : pneumonie aiguë, insuffisance respiratoire, choc. Toutes les formes présentent des taux de mortalité élevés. Transmission à partir de réservoirs de mammifères par des puces ou par la consommation d'animaux infectés ; transmission de la peste pneumonique entre humains par aérosols respiratoires ; culture de bactéries à partir d'échantillons de lymphe, de sang ou de crachats ; DFA, ELISA ; gentamycine, fluoroquinolones, etc. Septicémie puerpérale ; Streptococcus pyogenes, bien d'autres ; Fièvre à apparition rapide, choc et décès ; Agents pathogènes introduits pendant ou immédiatement après l'accouchement ; Plaie, urine ou hémoculture ; Selon les tests de sensibilité. Fièvre par morsure de rat ; Streptobacillus moniliformis, Spirillum minor ; Fièvre, douleurs musculaires et articulaires, éruption cutanée, ulcère ; Morsure de rat infecté ou exposition à des matières fécales ou à des fluides corporels de rats contenus dans des aliments ou de l'eau contaminés ; Observation de l'organisme à partir d'échantillons et de tests d'anticorps ; pénicilline. Fièvre récurrente ; Borrelia recurrentis, B. hermsii, autres Borrelia spp. ; Fièvre récurrente, maux de tête, douleurs musculaires ; Provenant d'un rongeur ou d'un réservoir humain via un vecteur de poux ou de tiques ; microscopie Darkfield ; Doxycycline, tétracycline, érythromycine. Rhumatisme articulaire aigu ; Streptococcus pyogenes ; Douleur et gonflement des articulations, inflammation et cicatrisation des valvules cardiaques, souffle cardiaque ; séquelles d'une pharyngite streptococcique ; sérologie, électrocardiogramme, échocardiogramme ; benzathine benzylpénicilline. Fièvre pourprée des Rocheuses ; rickettsie rickettsie ; fièvre élevée, maux de tête, courbatures, nausées et vomissements, éruption pétéchiale ; hypotension et ischémie potentiellement mortelles dues à la coagulation sanguine ; À partir d'un réservoir de rongeurs via des vecteurs de tiques ; Biopsie, sérologie, PCR ; Doxycycline, chloramphénicol. Syndrome de choc toxique (TSS) ; Staphylococcus aureus ; fièvre soudaine, vomissements, diarrhée, hypotension, décèsDes agents pathogènes d'une infection localisée se propagent à la circulation sanguine ; agents pathogènes introduits sur des tampons ou d'autres produits intravaginaux ; sérologie, identification des toxines à partir d'isolats ; clindamycine, vancomycine. Syndrome de choc toxique (STSS) ; Streptococcus pyogenes ; fièvre soudaine, vomissements, diarrhée, syndrome de détresse respiratoire aiguë (SDRA), hypoxémie, fasciite nécrosante, décès ; séquelle d'infection streptococcique de la peau ou des tissus mous ; [MANQUANT] ; pénicilline, céphalosporine. Fièvre des tranchées ; Bartonella Quintana ; Fièvre élevée, conjonctivite, douleurs oculaires, maux de tête, douleurs intenses dans les os des tibias, du cou et du dos ; Entre humains via un vecteur de poux corporels ; hémoculture, ELISA, PCR ; Doxycycline, antibiotiques macrolides, ceftriaxone. Tularémie (fièvre du lapin) ; Francisella tularensis Lésions cutanées, fièvre, frissons, maux de tête, bubons ; consommation ou manipulation de lapins infectés ; transmission par un animal infecté par un vecteur de tique ou de mouche ; transmission par aérosol (en laboratoire ou comme arme biologique) ; DFA ; streptomycine, gentamycine, autres.](https://bio.libretexts.org/@api/deki/files/9163/OSC_Microbio_25_02_BactCircDP_Part2.jpg)
Concepts clés et résumé
- Les infections bactériennes de l'appareil circulatoire sont presque universellement graves. Si elles ne sont pas traitées, la plupart présentent des taux de mortalité élevés.
- Les agents pathogènes bactériens ont généralement besoin d'une brèche dans les défenses immunitaires pour coloniser le système circulatoire. Le plus souvent, il s'agit d'une blessure ou de la morsure d'un vecteur arthropode, mais cela peut également survenir en milieu hospitalier et entraîner des infections nosocomiales.
- La septicémie causée par des bactéries gram-négatives et grampositives, la fièvre puerpérale, le rhumatisme articulaire aigu, l'endocardite, la gangrène gazeuse, l'ostéomyélite et le syndrome de choc toxique sont généralement le résultat d'une blessure ou de l'introduction de bactéries par une intervention médicale ou chirurgicale.
- La tularémie, la brucellose, la fièvre des griffures de chat, la fièvre par morsure de rat et la peste bubonique sont des zoonoses transmises par des vecteurs biologiques
- L'ehrlichiose, l'anaplasmose, le typhus endémique et murin, la fièvre pointue des Rocheuses, la maladie de Lyme, la fièvre récurrente et la fièvre des tranchées sont transmises par des vecteurs arthropodes.
- Comme leurs symptômes sont très similaires à ceux d'autres maladies, de nombreuses infections bactériennes du système circulatoire sont difficiles à diagnostiquer.
- Les antibiotiques classiques sont efficaces pour le traitement de la plupart des infections bactériennes de l'appareil circulatoire, sauf si la bactérie est résistante, auquel cas un traitement synergique peut être nécessaire.
- La réponse immunitaire systémique à une bactériémie, qui implique la libération de quantités excessives de cytokines, peut parfois être plus dommageable pour l'hôte que l'infection elle-même.
Notes
- 1 SP. LaRosa. « Septicémie ». 2010. http://www.clevelandclinicmeded.com/...isease/sepsis/.
- 2 D.C. Angus, T. Van der Poll. « Septicémie sévère et choc septique. » Journal de médecine de la Nouvelle-Angleterre 369, n° 9 (2013) :840—851.
- 3 centres pour le contrôle et la prévention des maladies. « Définition de cas du syndrome de choc toxique (autre que streptococcique) (TSS) 2011. » https://wwwn.cdc.gov/nndss/condition...finition/2011/. Consulté le 25 juillet 2016.
- 4 centres pour le contrôle et la prévention des maladies. « Définition du cas du syndrome de choc toxique streptococcique (STSS) (Streptococcus pyogenes) 2010. » https://wwwn.cdc.gov/nndss/condition...finition/2010/. Consulté le 25 juillet 2016.
- 5 M. E. Shirtliff, Mader J.T. « Arthrite septique aiguë. » Revues de microbiologie clinique 15 no 4 (2002) :527—544.
- 6 J.R. Maneiro et coll. « Prédicteurs de l'échec du traitement et de la mortalité dans l'arthrite septique native ». Rhumatologie clinique 34, n° 11 (2015) : 1961-1967.
- 7. M. Vazquez. « L'ostéomyélite chez les enfants. » Opinion actuelle en pédiatrie 14, no. 1 (2002) :112—115.
- 8 A. Beaudoin et coll. « Fièvre rhumatismale aiguë et cardiopathie rhumatismale chez les enfants — Samoa américaines, 2011-2012. » Rapport hebdomadaire sur la morbidité et la mortalité 64 no 20 (2015) :555—558.
- 9 M. A. Gerber et coll. « Prévention du rhumatisme articulaire aigu et diagnostic et traitement de la pharyngite streptococcique aiguë : déclaration scientifique du comité sur le rhumatisme articulaire aigu, l'endocardite et la maladie de Kawasaki de l'American Heart Association du Conseil sur les maladies cardiovasculaires chez les jeunes, le Conseil interdisciplinaire sur les fonctions La génomique et la biologie translationnelle et le Conseil interdisciplinaire sur la qualité des soins et les résultats de la recherche : approuvés par l'American Academy of Pediatrics. » Circulation 119, n° 11 (2009) : 1541—1551.
- 10 Organisation mondiale de la santé. « Lignes directrices de l'OMS sur la tularémie ». 2007. http://www.cdc.gov/tularemia/resources/whotularemiamanual.pdf. Consulté le 26 juillet 2016.
- 11 Laboratoire clé du MOH pour la biologie des systèmes des agents pathogènes. « Facteurs de virulence des bactéries pathogènes, Yersinia. » http://www.mgc.ac.cn/cgi-bin/VFs/gen...Genus=Yersinia. Consulté le 9 septembre 2016.
- 12 Rosen, William. La puce de Justinien : peste, empire et naissance de l'Europe. Viking Adult ; page 3 ; ISBN 978-0-670-03855-8.
- 13 Benedictow, Ole J. 2004. La peste noire 1346-1353 : l'histoire complète. Woodbridge : Boydell Press.
- 14 centres pour le contrôle et la prévention des maladies. « Peste : histoire. » http://www.cdc.gov/plague/history/. Consulté le 15 septembre 2016.
- 15 J.S. Bakken et coll. « Diagnostic et prise en charge des rickettsies transmises par les tiques : fièvre ponctuée des Rocheuses, ehrlichioses et anaplasmose — États-Unis. Un guide pratique pour les médecins et les autres professionnels de la santé et de la santé publique. » Recommandations et rapports MMWR 55 no. RR04 (2006) :1-27.
- 16 Laboratoire clé du MOH de biologie des systèmes des agents pathogènes, « Facteurs de virulence des bactéries pathogènes, anaplasma » 2016. http://www.mgc.ac.cn/cgi-bin/VFs/jsif/main.cgi. Consulté le 26 juillet 2016.
- 17 centres pour le contrôle et la prévention des maladies. « Ehrlichiose, symptômes, diagnostic et traitement ». 2016. https://www.cdc.gov/ehrlichiosis/symptoms/index.html. Consulté le 29 juillet 2016.
- 18 Drali, R., Brouqui, P. et Raoult, D. « Le typhus pendant la Première Guerre mondiale » La microbiologie aujourd'hui 41 (2014) 2:58 —61.
- 19 centres pour le contrôle et la prévention des maladies. Informations sur la santé des CDC pour les voyages internationaux 2014 : Le livre jaune. Oxford University Press, 2013. http://wwwnc.cdc.gov/travel/yellowbook/2016/infectious-diseases-related-to-travel/rickettsial-spotted-typhus-fevers-related-infections-anaplasmosis-ehrlichiosis. Consulté le 26 juillet 2016.
- 20 Organisation mondiale de la santé. « Typhus ». 1997. www.who.int/mediacentre/factsheets/fs162/en/. Consulté le 26 juillet 2016.
- 21 centres pour le contrôle et la prévention des maladies. « Fièvre maculée des Rocheuses (RMSF) : statistiques et épidémiologie. » http://www.cdc.gov/rmsf/stats/index.html. Consulté le 16 septembre 2016.
- 22 centres pour le contrôle et la prévention des maladies. « La maladie de Lyme. Données et statistiques. » 2015. http://www.cdc.gov/lyme/stats/index.html. Consulté le 26 juillet 2016.
- 23 centres pour le contrôle et la prévention des maladies. « Signes et symptômes de la maladie de Lyme non traitée ». 2015. http://www.cdc.gov/lyme/signs_symptoms/index.html. Consulté le 27 juillet 2016.
- 24 centres pour le contrôle et la prévention des maladies. « Des tiques. Symptômes de la maladie transmise par les tiques. » 2015. http://www.cdc.gov/ticks/symptoms.html. Consulté le 27 juillet 2016.


