19.2 : Maladies auto-immunes
- Page ID
- 187670
Objectifs d'apprentissage
- Expliquer pourquoi les maladies auto-immunes se développent
- Donnez quelques exemples de maladies auto-immunes systémiques et spécifiques à un organe
En 1970, l'artiste Walt Kelly a développé une affiche faisant la promotion du Jour de la Terre, mettant en scène un personnage de Pogo, sa bande dessinée quotidienne. Sur l'affiche, Pogo regarde de l'autre côté d'une forêt jonchée de détritus et dit ironiquement : « Nous avons rencontré l'ennemi et il est nous ». Pogo ne parlait pas du système immunitaire humain, mais il aurait très bien pu l'être. Bien que le système immunitaire protège l'organisme en attaquant les « ennemis » envahisseurs (agents pathogènes), dans certains cas, le système immunitaire peut identifier par erreur les propres cellules de l'organisme comme étant l'ennemi, ce qui entraîne des maladies auto-immunes.
Les maladies auto-immunes sont celles dans lesquelles le corps est attaqué par sa propre réponse immunitaire adaptative spécifique. Dans un état normal et sain, le système immunitaire induit la tolérance, c'est-à-dire l'absence de réponse auto-immune. Cependant, l'auto-immunité entraîne une perte de tolérance immunitaire et les mécanismes responsables des maladies auto-immunes incluent les réactions d'hypersensibilité de type II, III et IV. Les maladies auto-immunes peuvent présenter divers symptômes mixtes qui apparaissent et disparaissent, ce qui rend le diagnostic difficile.
Les causes des maladies auto-immunes sont une combinaison de la constitution génétique de l'individu et de l'effet d'influences environnementales, telles que la lumière du soleil, les infections, les médicaments et les produits chimiques environnementaux. Cependant, l'imprécision de cette liste reflète notre mauvaise compréhension de l'étiologie de ces maladies. À l'exception de quelques maladies spécifiques, le ou les événements initiateurs de la plupart des états auto-immuns n'ont pas été complètement caractérisés.
Il existe plusieurs causes possibles à l'origine des maladies auto-immunes et l'auto-immunité est probablement due à plusieurs facteurs. Les preuves suggèrent maintenant que les lymphocytes T et B régulateurs jouent un rôle essentiel dans le maintien de la tolérance et la prévention des réponses auto-immunes. Les lymphocytes T régulateurs sont particulièrement importants pour inhiber les lymphocytes T autoréactifs qui ne sont pas éliminés lors de la sélection thymique et qui s'échappent du thymus (voir Lymphocytes T et immunité cellulaire). De plus, le mimétisme antigénique entre les antigènes pathogènes et nos propres antigènes peut entraîner une réactivité croisée et une auto-immunité. Les auto-antigènes cachés peuvent être exposés à la suite d'un traumatisme, d'interactions médicamenteuses ou d'états pathologiques, et déclencher une réponse auto-immune. Tous ces facteurs peuvent contribuer à l'auto-immunité. En fin de compte, les dommages aux tissus et aux organes à l'état de maladie auto-immune sont le résultat de réponses inflammatoires inappropriées ; par conséquent, le traitement comprend souvent des médicaments immunosuppresseurs et des corticostéroïdes.
Maladies auto-immunes spécifiques à un organe
Certaines maladies auto-immunes sont considérées comme spécifiques à un organe, ce qui signifie que le système immunitaire cible des organes ou des tissus spécifiques. Parmi les maladies auto-immunes spécifiques à certains organes, citons la maladie cœliaque, la maladie de Graves, la thyroïdite de Hashimoto, le diabète de type I et la maladie d'Addison.
Maladie cœliaque
La maladie cœliaque est en grande partie une maladie de l'intestin grêle, bien que d'autres organes puissent être affectés. Les personnes âgées de 30 à 40 ans et les enfants sont le plus souvent touchés, mais la maladie cœliaque peut apparaître à tout âge. Il résulte d'une réaction à des protéines, communément appelées gluten, présentes principalement dans le blé, l'orge, le seigle et certaines autres céréales. La maladie a plusieurs causes génétiques (prédispositions) et des influences environnementales mal connues. Lors de l'exposition au gluten, l'organisme produit divers auto-anticorps et une réponse inflammatoire. La réponse inflammatoire dans l'intestin grêle entraîne une réduction de la profondeur des microvillosités de la muqueuse, ce qui entrave l'absorption et peut entraîner une perte de poids et une anémie. La maladie se caractérise également par des diarrhées et des douleurs abdominales, symptômes souvent diagnostiqués à tort comme étant le syndrome du côlon irritable.
Le diagnostic de la maladie cœliaque repose sur des tests sérologiques visant principalement à détecter la présence d'anticorps IgA dirigés contre les composants du gluten, l'enzyme transglutinaminase, et d'auto-anticorps dirigés contre l'endomysium, un tissu conjonctif entourant les fibres musculaires. Les tests sérologiques sont généralement suivis d'une endoscopie et d'une biopsie de la muqueuse duodénale. Des enquêtes de dépistage sérologiques ont révélé qu'environ 1 % des personnes au Royaume-Uni sont positives même si elles ne présentent pas toutes de symptômes. 1 Cette détection précoce permet une surveillance et une prévention plus minutieuses des maladies graves.
La maladie cœliaque est traitée par l'élimination complète des aliments contenant du gluten de l'alimentation, ce qui entraîne une amélioration des symptômes et une réduction du risque de complications. D'autres approches théoriques incluent la sélection de céréales ne contenant pas les composants immunologiquement réactifs ou la mise au point de compléments alimentaires contenant des enzymes qui décomposent les composants protéiques responsables de la réponse immunitaire. 2
Troubles de la thyroïde
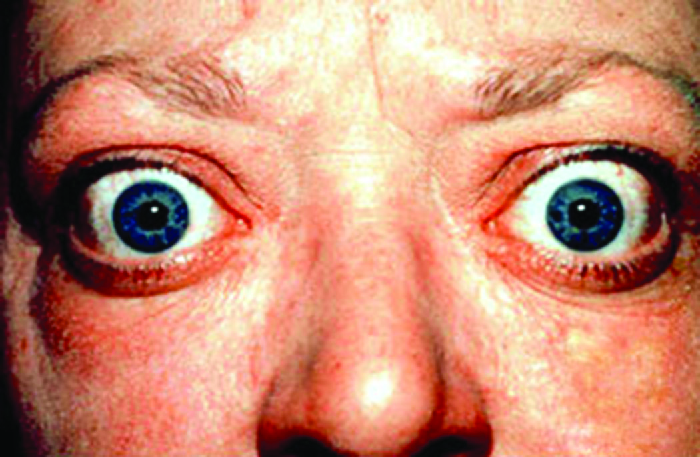
La maladie de Graves est la cause la plus fréquente d'hyperthyroïdie aux États-Unis. Les symptômes de la maladie de Graves résultent de la production d'immunoglobulines stimulant la thyroïde (TSI), également appelées anticorps récepteurs de la TSH. La TSI cible et se lie au récepteur de la thyréostimuline (TSH), qui est naturellement produite par l'hypophyse. Les TSI peuvent provoquer des symptômes contradictoires, car ils peuvent inciter la thyroïde à produire trop d'hormones thyroïdiennes ou bloquer complètement la production d'hormones thyroïdiennes, rendant ainsi le diagnostic plus difficile. Les signes et symptômes de la maladie de Graves incluent l'intolérance à la chaleur, des battements cardiaques rapides et irréguliers, une perte de poids, un goitre (gonflement de la glande thyroïde qui dépasse sous la peau de la gorge [Figure\(\PageIndex{1}\)]) et une exophtalmie (gonflement des yeux), souvent appelée ophtalmopathie de Graves (Figure\(\PageIndex{2}\)).
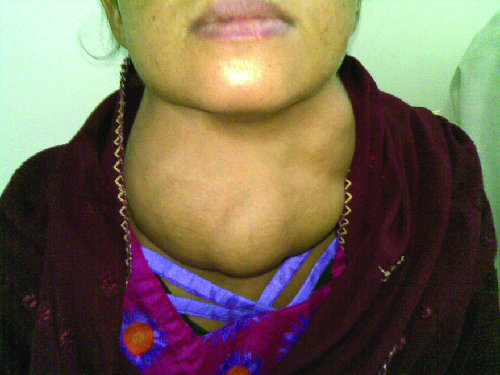
La cause la plus fréquente d'hypothyroïdie aux États-Unis est la thyroïdite de Hashimoto, également appelée thyroïdite lymphoïde chronique. Les patients atteints de thyroïdite de Hashimoto développent souvent un éventail de maladies différentes, car ils sont plus susceptibles de développer d'autres maladies auto-immunes telles que la maladie d'Addison (abordée plus loin dans cette section), le diabète de type 1, la polyarthrite rhumatoïde et la maladie cœliaque. La thyroïdite de Hashimoto est une maladie à médiation cellulaire T H 1 qui survient lorsque la glande thyroïde est attaquée par des lymphocytes cytotoxiques, des macrophages et des auto-anticorps. Cette réponse auto-immune entraîne de nombreux symptômes, notamment le goitre (Figure\(\PageIndex{1}\)), l'intolérance au froid, la faiblesse musculaire, la douleur et la raideur des articulations, la dépression et la perte de mémoire.
Diabète type 1
Le diabète juvénile, ou diabète sucré de type 1, est généralement diagnostiqué chez les enfants et les jeunes adultes. Il s'agit d'une maladie auto-immune dépendante des lymphocytes T caractérisée par la destruction sélective des cellules β des îlots de Langerhans dans le pancréas par les lymphocytes T CD8 médiés par le CD4 T H 1, les anticorps anti-cellules β et l'activité des macrophages. Il est également prouvé que les infections virales peuvent jouer un rôle potentialisateur ou inhibiteur dans le développement du diabète de type 1 (DT1). La destruction des cellules β entraîne une diminution de la production d'insuline par le pancréas. Dans le cas du DT1, la destruction des cellules β peut se produire sur plusieurs années, mais les symptômes d'hyperglycémie, d'augmentation extrême de la soif et de la miction, de perte de poids et de fatigue extrême apparaissent généralement soudainement, et le diagnostic n'est généralement posé que lorsque la plupart des cellules β ont déjà été détruites.
Maladie auto-immune d'Addison
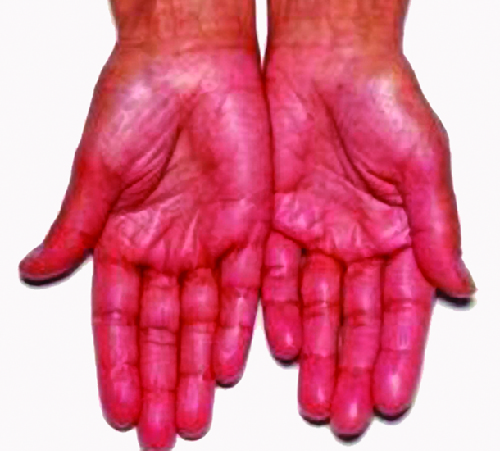
La destruction des glandes surrénales (les glandes situées au-dessus des reins qui produisent des glucocorticoïdes, des minéralocorticoïdes et des stéroïdes sexuels) est à l'origine de la maladie d'Addison, également appelée insuffisance surrénalienne primaire (IAP). Aujourd'hui, jusqu'à 80 % des cas de maladie d'Addison sont diagnostiqués comme étant une maladie d'Addison auto-immune (AAD), qui est causée par une réponse auto-immune à des tissus surrénaliens perturbant la fonction surrénalienne. La perturbation de la fonction surrénalienne entraîne une altération des processus métaboliques nécessitant des taux normaux d'hormones stéroïdes, provoquant des signes et des symptômes dans tout le corps. Il existe des preuves que les mécanismes immunitaires induits par les lymphocytes T CD8 induits par les lymphocytes T CD8 humoraux et pilotés par les lymphocytes T CD4 H 1 sont dirigés vers le cortex surrénalien dans l'AAD. Il existe également des preuves que la réponse auto-immune est également associée à la destruction auto-immune d'autres glandes endocrines, telles que le pancréas et la thyroïde, des affections collectivement appelées syndromes polyendocriniens auto-immuns (APS). Chez jusqu'à 80 % des patients atteints d'AAD, des anticorps sont produits contre trois enzymes impliquées dans la synthèse des stéroïdes : la 21-hydroxylase (21-OH), la 17α-hydroxylase et l'enzyme de clivage de la chaîne latérale du cholestérol. 3 L'auto-anticorps le plus couramment trouvé dans l'AAD est le 21-OH, et les anticorps dirigés contre l'une des enzymes clés de la production de stéroïdes permettent de diagnostiquer l'AAD. Les cellules du cortex surrénalien sont ciblées, détruites et remplacées par du tissu fibreux par une inflammation à médiation immunitaire. Chez certains patients, au moins 90 % du cortex surrénalien est détruit avant que les symptômes ne soient diagnostiqués.
Les symptômes de l'AAD incluent une faiblesse, des nausées, une diminution de l'appétit, une perte de poids, une hyperpigmentation (Figure\(\PageIndex{3}\)), une hyperkaliémie (élévation du taux de potassium dans le sang), une hyponatrémie (diminution du taux de sodium dans le sang), une hypoglycémie (diminution de la glycémie), une hypotension (diminution de la pression artérielle), une anémie, lymphocytose (diminution du taux de globules blancs) et fatigue. En cas de stress extrême, tel qu'une intervention chirurgicale, un traumatisme accidentel ou une infection, les patients atteints d'AAD peuvent présenter une crise surrénalienne provoquant des vomissements, des douleurs abdominales, des crampes au dos ou aux jambes et même une hypotension sévère entraînant un choc.
Exercice\(\PageIndex{1}\)
- Quels sont les noms des maladies auto-immunes qui interfèrent avec le fonctionnement des glandes hormonales ?
- Décrivez en quoi les mécanismes de la maladie de Graves et de la thyroïdite de Hashimoto diffèrent.
- Nommez les cellules détruites dans le diabète de type 1 et décrivez le résultat.
Maladies auto-immunes systémiques
Alors que les maladies auto-immunes spécifiques à des organes ciblent des organes ou des tissus spécifiques, les maladies auto-immunes systémiques sont plus généralisées et ciblent de multiples organes ou tissus dans tout le corps. Parmi les maladies auto-immunes systémiques, citons la sclérose en plaques, la myasthénie grave, le psoriasis, la polyarthrite rhumatoïde et le lupus érythémateux disséminé.
Sclérose multiple
La sclérose en plaques (SEP) est une maladie auto-immune du système nerveux central qui touche le cerveau et la moelle épinière. Les lésions à de multiples endroits du système nerveux central sont caractéristiques de la sclérose en plaques et sont causées par l'infiltration des cellules immunitaires à travers la barrière hémato-encéphalique. Les cellules immunitaires comprennent des lymphocytes T qui favorisent l'inflammation, la démyélinisation et la dégénérescence neuronale, qui perturbent tous la signalisation neuronale. Les symptômes de la SEP incluent des troubles visuels, une faiblesse musculaire, des difficultés de coordination et d'équilibre, des sensations telles que des engourdissements, des picotements ou des « fourmillements », ainsi que des problèmes cognitifs et de mémoire.
Myasthénie grave
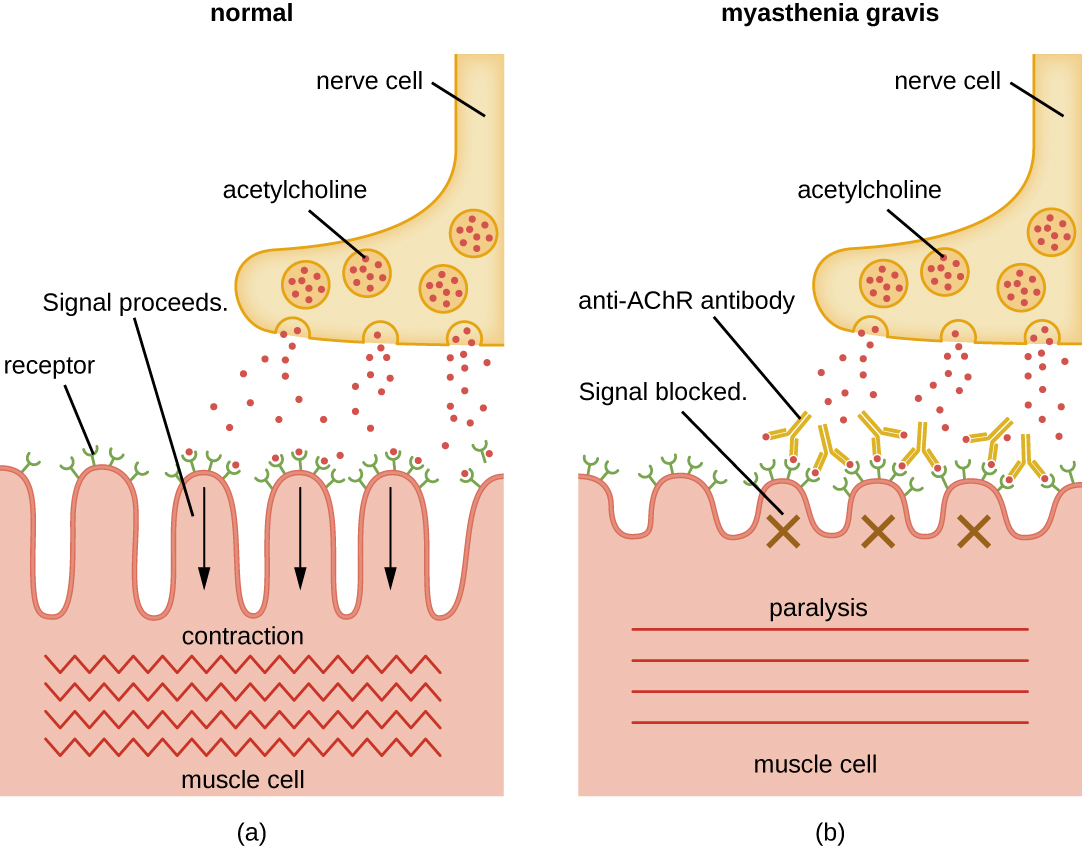
Les auto-anticorps dirigés contre les récepteurs de l'acétylcholine (AChR) dans la fente synaptique des jonctions neuromusculaires entraînent une myasthénie grave (Figure\(\PageIndex{4}\)). Les anticorps anti-ACHR sont des IgG de haute affinité et leur synthèse nécessite des lymphocytes T CD4 activés pour interagir avec les lymphocytes B et les stimuler. Une fois produits, les anticorps anti-ACHR affectent la transmission neuromusculaire par au moins trois mécanismes :
- Liaison et activation du complément au niveau de la jonction neuromusculaire
- Endocytose AChR accélérée de molécules réticulées par des anticorps
- Blocage fonctionnel de l'AChR, qui empêche la fixation normale de l'acétylcholine à l'AcHR et son activation
Quel que soit le mécanisme utilisé, les anti-ACHR ont pour effet une faiblesse musculaire extrême et, dans les cas graves, la mort par arrêt respiratoire.
psoriasis
Le psoriasis est une maladie de la peau qui provoque des démangeaisons ou des douleurs sur une peau rouge épaisse avec des écailles argentées sur les coudes, les genoux, le cuir chevelu, le dos, le visage, les paumes, les pieds et parfois d'autres zones. Certaines personnes atteintes de psoriasis contractent également une forme d'arthrite appelée rhumatisme psoriasique, dans laquelle les articulations peuvent s'enflammer. Le psoriasis résulte de l'interaction complexe entre les kératinocytes, les cellules dendritiques et les lymphocytes T, et les cytokines produites par ces différentes cellules. Dans le cadre d'un processus appelé renouvellement cellulaire, les cellules de la peau qui se développent profondément dans la peau remontent à la surface. Normalement, ce processus prend un mois. Dans le psoriasis, à la suite de l'activation des cytokines, le renouvellement cellulaire se produit en quelques jours seulement. Les plaques épaisses et enflammées caractéristiques du psoriasis se développent parce que les cellules de la peau se soulèvent trop rapidement.
Polyarthrite rhumatoïde
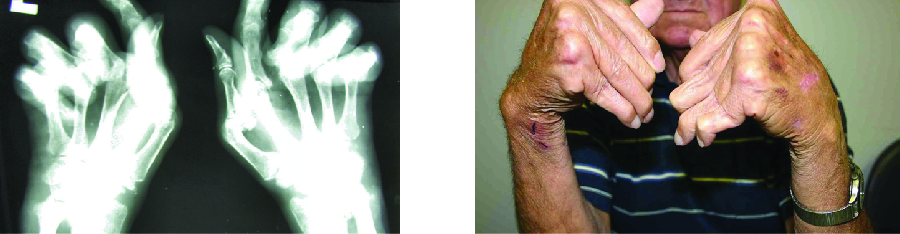
La maladie articulaire inflammatoire chronique la plus courante est la polyarthrite rhumatoïde (PR\(\PageIndex{5}\)) (Figure) et elle constitue toujours un défi médical majeur en raison de questions non résolues liées aux causes environnementales et génétiques de la maladie. La polyarthrite rhumatoïde implique des réactions d'hypersensibilité de type III et l'activation des lymphocytes T CD4, entraînant la libération chronique des cytokines inflammatoires IL-1, IL-6 et du facteur de nécrose tumorale α (TNF-α). Les lymphocytes T CD4 activés stimulent également la production d'anticorps contre le facteur rhumatoïde (RF) et d'anticorps peptidiques citrullinés anticycliques (anti-CCP) qui forment des complexes immuns. Des niveaux accrus de protéines de phase aiguë, telles que la protéine C-réactive (CRP), sont également produits dans le cadre du processus inflammatoire et participent à la fixation du complément avec les anticorps sur les complexes immunitaires. La formation de complexes immunitaires et la réaction aux facteurs immunitaires provoquent un processus inflammatoire dans les articulations, en particulier dans les mains, les pieds et les jambes. Le diagnostic de la polyarthrite rhumatoïde repose sur des taux élevés de RF, d'anti-CCP, de CRP quantitative et sur le taux de sédimentation des érythrocytes (ESR) (Westergren modifié). De plus, les radiographies, les ultrasons ou l'imagerie par résonance magnétique peuvent identifier les lésions articulaires, telles que les érosions, la perte d'os à l'intérieur de l'articulation et le rétrécissement de l'espace articulaire.
Lupus érythémateux disséminé
Les dommages et la pathologie du lupus érythémateux disséminé (LED) sont causés par des réactions d'hypersensibilité de type III. Les autoanticorps produits dans le SLE sont dirigés contre les protéines nucléaires et cytoplasmiques. Des anticorps antinucléaires (ANA) sont présents chez plus de 95 % des patients atteints de LED, 4 avec des auto-anticorps supplémentaires, notamment des anticorps anti-ADN double brin (DS-ADN) et des anticorps anti-SM (anticorps dirigés contre la petite ribonucléoprotéine nucléaire). Les anticorps anti-DS-ADN et anti-SM sont uniques aux patients atteints de LED ; leur présence est donc incluse dans les critères de classification du LED. L'interaction cellulaire avec les auto-anticorps entraîne une destruction nucléaire et cellulaire, des composants étant libérés après la mort cellulaire entraînant la formation de complexes immuns.
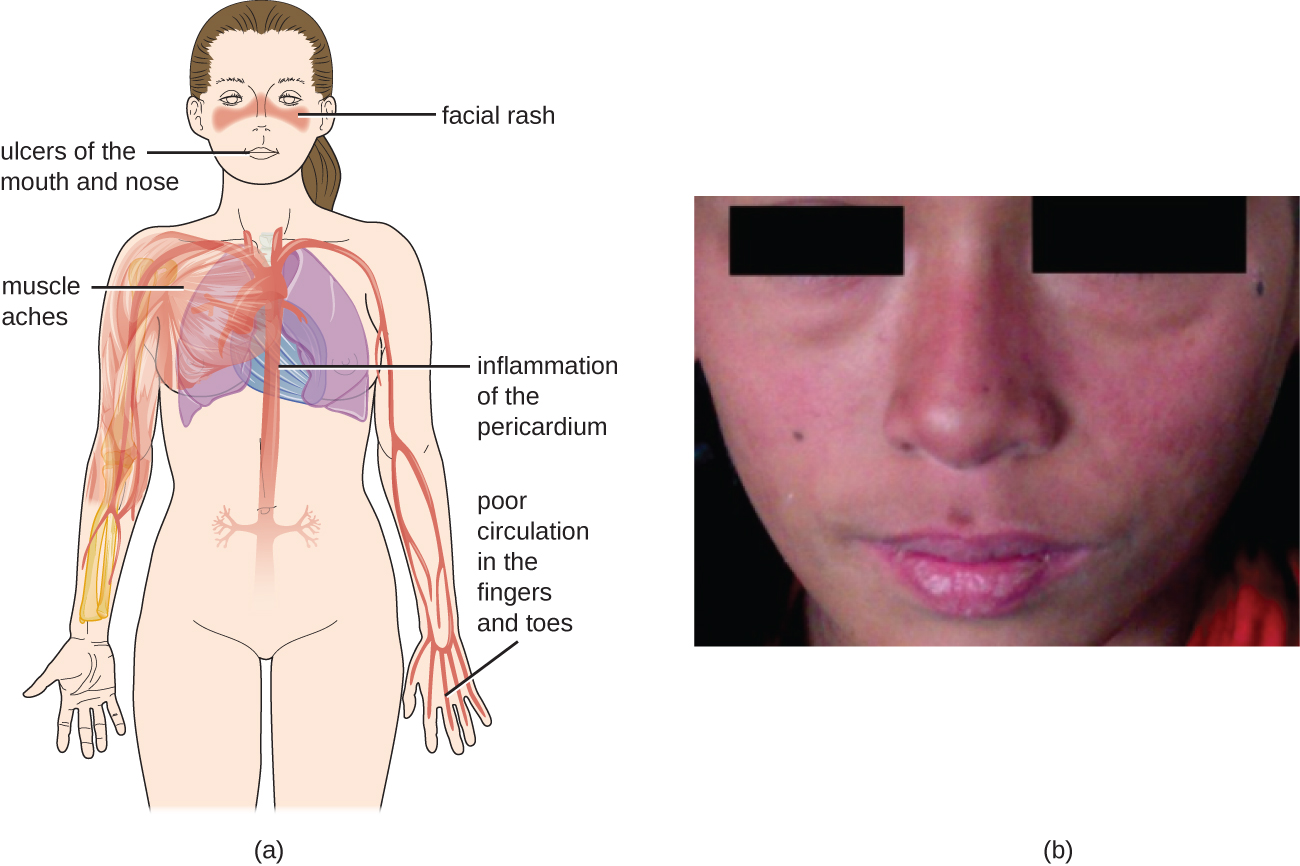
Comme les auto-anticorps du LED peuvent cibler une grande variété de cellules, les symptômes du LED peuvent apparaître dans de nombreuses régions du corps. Cependant, les symptômes les plus courants sont la fatigue, la fièvre sans autre cause, la perte de cheveux et une éruption cutanée « papillon » ou masque de loup (lupus) sensible à la lumière du soleil qui touche environ 50 % des personnes atteintes de LED (Figure\(\PageIndex{6}\)). L'éruption cutanée se manifeste le plus souvent sur les joues et l'arête du nez, mais elle peut être généralisée. D'autres symptômes peuvent apparaître en fonction des zones touchées. Les articulations peuvent être touchées, entraînant une arthrite des doigts, des mains, des poignets et des genoux. Les effets sur le cerveau et le système nerveux peuvent entraîner des maux de tête, des engourdissements, des picotements, des convulsions, des problèmes de vision et des changements de personnalité. Il peut également y avoir des douleurs abdominales, des nausées, des vomissements, des arythmies, un essoufflement et du sang dans les expectorations. Les effets sur la peau peuvent entraîner l'apparition de zones supplémentaires de lésions cutanées, et la vasoconstriction peut provoquer des changements de couleur des doigts lorsqu'ils sont froids (phénomène de Raynaud). Les effets sur les reins peuvent entraîner un œdème des jambes et une prise de poids. Le diagnostic du LED dépend de l'identification de quatre des 11 symptômes les plus courants et de la production confirmée d'une gamme d'auto-anticorps spécifiques au LED. Un test positif pour les ANA seuls ne constitue pas un diagnostic.
Exercice\(\PageIndex{2}\)
- Énumérez les façons dont les anticorps contribuent à la pathogenèse de la myasthénie grave.
- Expliquez pourquoi la polyarthrite rhumatoïde est considérée comme une hypersensibilité de type III.
- Décrivez les symptômes du lupus érythémateux disséminé et expliquez pourquoi ils touchent de nombreuses parties du corps.
- Qu'est-ce qui est reconnu comme antigène dans la myasthénie grave ?
| Maladie | Cause | Signes et symptômes |
|---|---|---|
| Maladie d'Addison | Destruction des cellules des glandes surrénales par des lymphocytes T cytotoxiques | Faiblesse, nausée, hypotension, fatigue ; crise surrénalienne accompagnée de douleurs intenses à l'abdomen, au bas du dos et aux jambes ; collapsus du système circulatoire, insuffisance rénale |
| Maladie cœliaque | Les anticorps dirigés contre le gluten deviennent des auto-anticorps qui ciblent les cellules de l'intestin grêle | Diarrhée sévère, douleurs abdominales, anémie, malnutrition |
| Diabète sucré (type I) | Destruction cytotoxique par les lymphocytes T des cellules β productrices d'insuline du pancréas | Hyperglycémie, augmentation extrême de la soif et de la miction, perte de poids, fatigue extrême |
| maladie de Graves | Les auto-anticorps ciblent les récepteurs de l'hormone stimulant la thyroïde, ce qui entraîne une surstimulation de la thyroïde | Hyperthyroïdie avec battements cardiaques rapides et irréguliers, intolérance à la chaleur, perte de poids, goitre, exophtalmie |
| Thyroïdite de Hashimoto | La glande thyroïde est attaquée par les lymphocytes T cytotoxiques, les lymphocytes, les macrophages et les auto-anticorps | Thyroïdite avec goitre, intolérance au froid, faiblesse musculaire, douleurs et raideurs articulaires, dépression, perte de mémoire |
| Sclérose en plaques (SEP) | Destruction cytotoxique par les lymphocytes T de la gaine de myéline entourant les axones nerveux du système nerveux central | Troubles visuels, faiblesse musculaire, troubles de la coordination et de l'équilibre, engourdissement, sensations de picotement ou de picotement, troubles des fonctions cognitives et de la mémoire |
| Myasthénie grave | Autoanticorps dirigés contre les récepteurs de l'acétylcholine au sein de la jonction neuromusculaire | Faiblesse musculaire extrême entraînant éventuellement un arrêt respiratoire mortel |
| psoriasis | L'activation des kératinocytes par les cytokines provoque un renouvellement rapide et excessif des cellules épidermiques | Démangeaisons ou plaques douloureuses de peau rouge épaisse avec des écailles argentées ; touche fréquemment les coudes, les genoux, le cuir chevelu, le dos, le visage, les paumes et les pieds |
| Polyarthrite rhumatoïde | Les auto-anticorps, les complexes immunitaires, l'activation du complément, les phagocytes et les lymphocytes T endommagent les membranes et les os des articulations | Inflammation, douleur et défiguration des articulations, inflammation systémique chronique |
| Lupus érythémateux disséminé (LED) | Les auto-anticorps dirigés contre les molécules nucléaires et cytoplasmiques forment des complexes immunitaires qui se déposent dans les tissus. Les cellules phagocytaires et l'activation du complément provoquent des lésions tissulaires et une inflammation | Fatigue, fièvre, douleurs et enflures articulaires, perte de cheveux, anémie, coagulation, éruption cutanée « papillon » sensible à la lumière du soleil, lésions cutanées, photosensibilité, diminution de la fonction rénale, perte de mémoire, confusion, dépression |
Concepts clés et résumé
- Les maladies auto-immunes résultent d'une rupture de la tolérance immunologique. Le ou les événements d'induction réels des états auto-immuns sont largement inconnus.
- Certaines maladies auto-immunes s'attaquent à des organes spécifiques, tandis que d'autres sont plus systémiques.
- Les maladies auto-immunes spécifiques à certains organes comprennent la maladie cœliaque, la maladie de Graves, la thyroïdite de Hashimoto, le diabète de type I et la maladie d'Addison.
- Les maladies auto-immunes systémiques incluent la sclérose en plaques, la myasthénie grave, le psoriasis, la polyarthrite rhumatoïde et le lupus érythémateux disséminé.
- Les traitements des maladies auto-immunes font généralement appel à des médicaments anti-inflammatoires et immunosuppresseurs.
Notes
- 1 D.A. Van Heel, J. West. « Progrès récents en matière de maladie cœliaque. » Gut 55 no 7 (2006) :1037—1046.
- 2 ibid.
- 3 P. Martorell et coll. « L'auto-immunité dans la maladie d'Addison. » Journal néerlandais de médecine 60 n° 7 (2002) :269—275.
- 4 C. C. C. Mok, C. S. Lau. « Pathogenèse du lupus érythémateux disséminé. » Journal of Clinical Pathology 56 n° 7 (2003) :481-490.


