19.1 : Hypersensibilités
- Page ID
- 187662
Objectifs d'apprentissage
- Identifier et comparer les caractéristiques distinctives, les mécanismes et les principaux exemples d'hypersensibilités de type I, II, III et IV
Orientation clinique : 1ère partie
Kerry, une pilote de ligne âgée de 40 ans, a pris rendez-vous avec son médecin traitant pour discuter d'une éruption cutanée qui apparaît chaque fois qu'elle passe du temps au soleil. Comme elle l'explique à son médecin, cela ne ressemble pas à un coup de soleil. Elle fait attention à ne pas passer trop de temps au soleil et utilise de la crème solaire. Malgré ces précautions, l'éruption cutanée persiste, se manifestant par des plaques rouges en relief qui deviennent légèrement squameuses. L'éruption cutanée persiste de 7 à 10 jours à chaque fois et semble disparaître d'elle-même. Ces derniers temps, des éruptions cutanées ont également commencé à apparaître sur ses joues et au-dessus de ses yeux, de chaque côté de son front.
Exercice\(\PageIndex{1}\)
- Kerry a-t-elle raison de s'inquiéter, ou devrait-elle simplement faire plus attention à l'exposition au soleil ?
- Y a-t-il des affections pouvant être provoquées par l'exposition au soleil que le médecin de Kerry devrait envisager ?
Dans Défenses adaptatives spécifiques à l'hôte, nous avons discuté des mécanismes par lesquels les défenses immunitaires adaptatives, à la fois humorales et cellulaires, nous protègent des maladies infectieuses. Cependant, ces mêmes défenses immunitaires protectrices peuvent également être responsables de réactions indésirables appelées réactions d'hypersensibilité. Les réactions d'hypersensibilité sont classées selon leur mécanisme immunitaire.
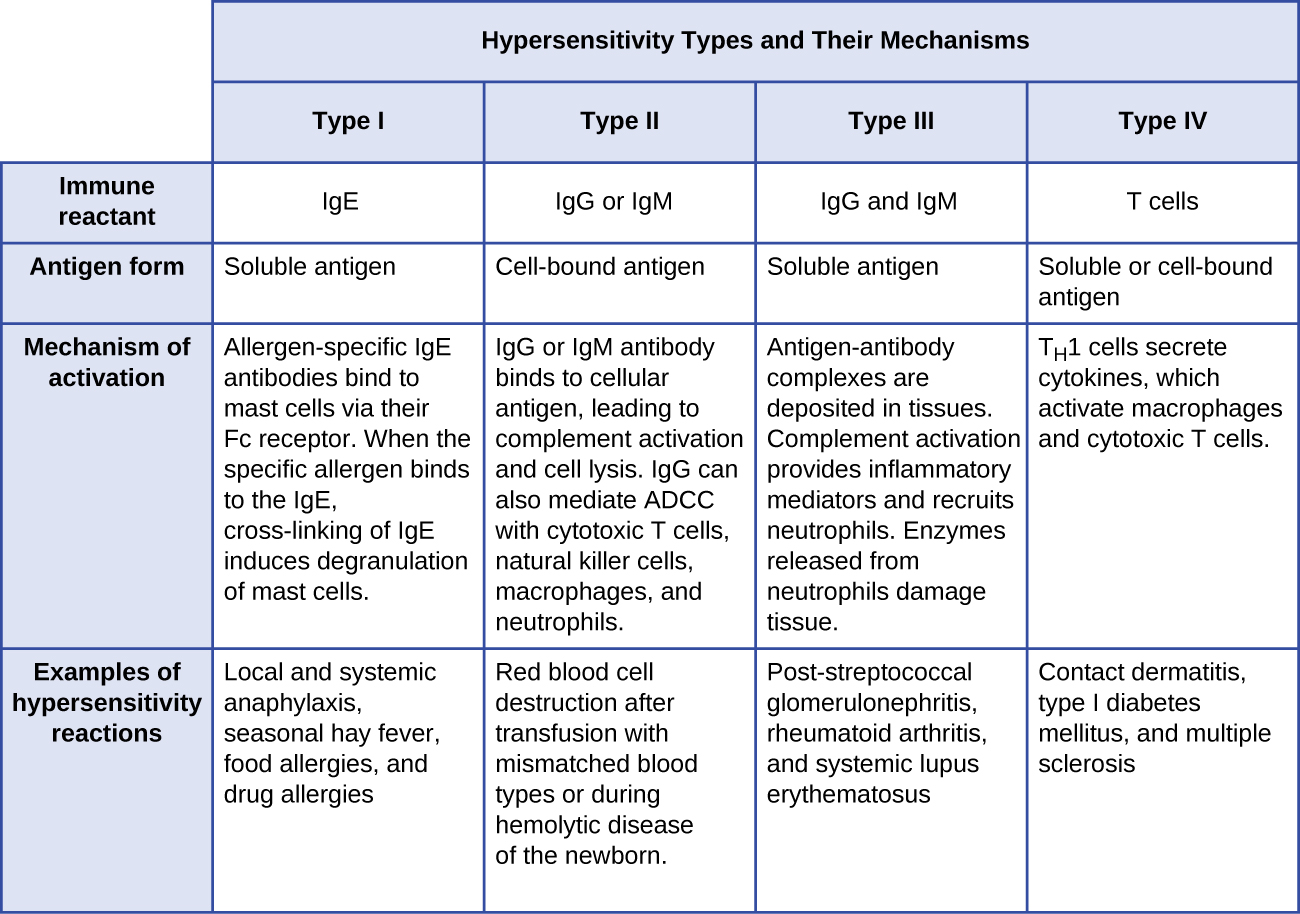
- Les réactions d'hypersensibilité de type I impliquent des anticorps à base d'immunoglobulines E (IgE) dirigés contre l'antigène soluble, déclenchant la dégranulation des mastocytes.
- Les réactions d'hypersensibilité de type II impliquent des anticorps IgG et IgM dirigés contre des antigènes cellulaires, entraînant des lésions cellulaires médiées par d'autres effecteurs du système immunitaire.
- Les réactions d'hypersensibilité de type III impliquent des interactions entre les anticorps IgG, IgM et, occasionnellement, IgA 1 et l'antigène pour former des complexes immunitaires. L'accumulation de complexes immunitaires dans les tissus entraîne des lésions tissulaires médiées par d'autres effecteurs du système immunitaire.
- Les réactions d'hypersensibilité de type IV sont des réactions médiées par les lymphocytes T qui peuvent impliquer des lésions tissulaires induites par des macrophages activés et des lymphocytes T cytotoxiques.
Hypersensibilités de type I
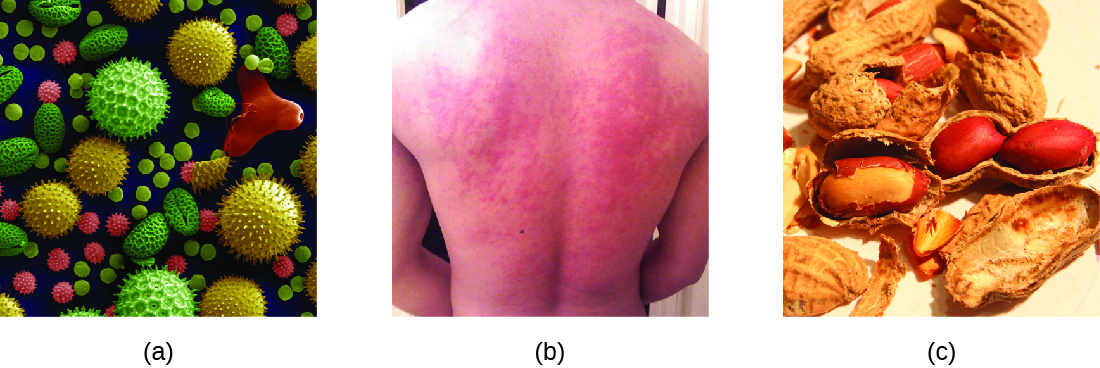
Lorsqu'une personne présensibilisée est exposée à un allergène, cela peut entraîner une réponse immunitaire rapide qui se produit presque immédiatement. Une telle réponse est appelée allergie et est classée comme une hypersensibilité de type I. Les allergènes peuvent être des substances apparemment inoffensives telles que les squames animales, les moisissures ou le pollen. Les allergènes peuvent également être des substances considérées comme naturellement plus dangereuses, comme le venin d'insecte ou les médicaments thérapeutiques. Les intolérances alimentaires peuvent également provoquer des réactions allergiques lorsque les individus deviennent sensibilisés à des aliments tels que les arachides ou les crustacés (Figure\(\PageIndex{1}\)). Quel que soit l'allergène, la première exposition active une réponse primaire en anticorps IgE qui sensibilise une personne à une réaction d'hypersensibilité de type I lors d'une exposition ultérieure.
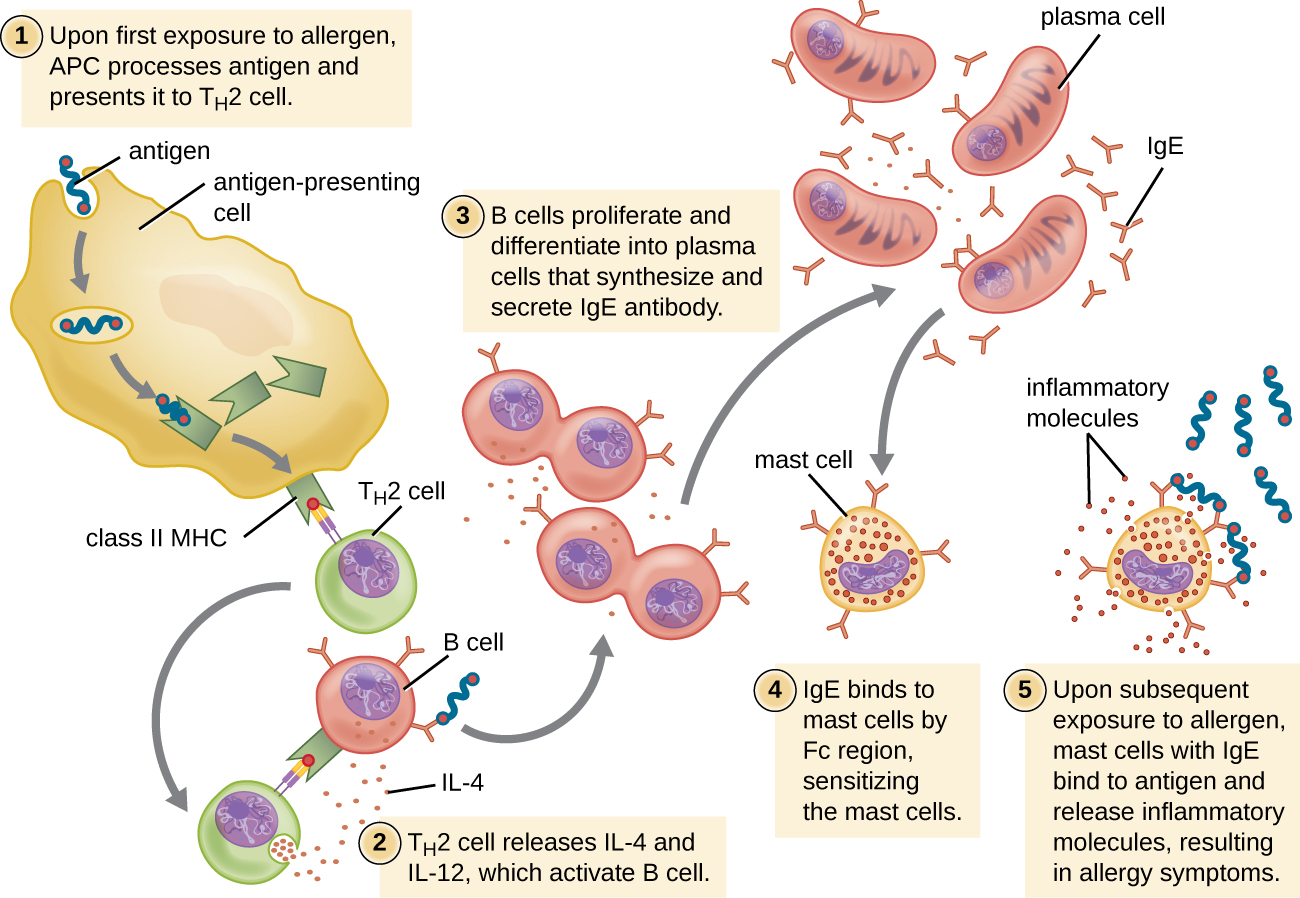
Pour les personnes sensibles, une première exposition à un allergène active une forte réponse des lymphocytes T H 2 (Figure\(\PageIndex{2}\)). Les cytokines interleukine (IL) -4 et IL-13 des lymphocytes T H 2 activent les lymphocytes B spécifiques au même allergène, ce qui entraîne une prolifération clonale, une différenciation en plasmocytes et un passage de la classe d'anticorps de la production d'IgM à la production d'IgE. Les régions cristallisables par fragments (Fc) des anticorps IgE se lient à des récepteurs spécifiques situés à la surface des mastocytes dans tout le corps. On estime que chaque mastocyte peut lier jusqu'à 500 000 molécules d'IgE, chaque molécule d'IgE possédant deux sites de liaison à l'antigène fragmenté (Fab) spécifiques à l'allergène disponibles pour se lier à l'allergène lors d'expositions ultérieures. Au moment où cela se produit, l'allergène n'est souvent plus présent et il n'y a pas de réaction allergique, mais les mastocytes sont préparés pour une exposition ultérieure et la personne est sensibilisée à l'allergène.
Lors d'une exposition ultérieure, les allergènes se lient à plusieurs molécules d'IgE présentes sur les mastocytes, réticulant ainsi les molécules d'IgE. En quelques minutes, cette réticulation des IgE active les mastocytes et déclenche la dégranulation, une réaction au cours de laquelle le contenu des granules du mastocyte est libéré dans l'environnement extracellulaire. Les composants préformés qui sont libérés par les granules comprennent l'histamine, la sérotonine et la bradykinine (Tableau\(\PageIndex{1}\)). Les mastocytes activés libèrent également des médiateurs lipidiques nouvellement formés (leucotriènes et prostaglandines issus du métabolisme de l'acide arachadonique membranaire) et des cytokines telles que le facteur de nécrose tumorale (Tableau\(\PageIndex{2}\)).
| Composant granulaire | Activité |
|---|---|
| Héparine | Stimule la production de bradykinine, ce qui entraîne une augmentation de la perméabilité vasculaire, une vasodilatation, une constriction des bronchioles et une augmentation de la sécrétion de mucus |
| Histamine | Provoque une contraction des muscles lisses, augmente la perméabilité vasculaire, augmente la formation de mucus et de larmes |
| Sérotonine | Augmente la perméabilité vasculaire, provoque une vasodilatation et une contraction des muscles lisses |
Les médiateurs chimiques libérés par les mastocytes provoquent collectivement l'inflammation et les signes et symptômes associés aux réactions d'hypersensibilité de type I. L'histamine stimule la sécrétion de mucus dans les voies nasales et la formation de larmes par les glandes lacrymales, favorisant ainsi l'écoulement nasal et le larmoiement des yeux en cas d'allergies. L'interaction de l'histamine avec les terminaisons nerveuses provoque des démangeaisons et des éternuements. La vasodilatation provoquée par plusieurs médiateurs peut provoquer de l'urticaire, des maux de tête, un angioedème (gonflement qui touche souvent les lèvres, la gorge et la langue) et une hypotension (pression artérielle basse). La constriction bronchiolique causée par certains médiateurs chimiques entraîne une respiration sifflante, une dyspnée (difficulté à respirer), une toux et, dans les cas plus graves, une cyanose (couleur bleutée de la peau ou des muqueuses). Les vomissements peuvent résulter de la stimulation du centre du vomissement dans le cervelet par l'histamine et la sérotonine. L'histamine peut également provoquer une relaxation des muscles lisses de l'intestin et de la diarrhée.
| Médiateur chimique | Activité |
|---|---|
| Leucote riène | Provoque une contraction des muscles lisses et une sécrétion de mucus, augmente la perméabilité vasculaire |
| Prostaglandine | Provoque une contraction des muscles lisses et une vasodilatation |
| TNF-α (cytokine) | Provoque une inflammation et stimule la production de cytokines par d'autres types de cellules |
Les réactions d'hypersensibilité de type I peuvent être localisées ou systémiques. Les réactions d'hypersensibilité localisées de type I incluent le rhume des foins, la rhinite, l'urticaire et l'asthme (Tableau\(\PageIndex{3}\)). Les réactions d'hypersensibilité systémique de type I sont appelées anaphylaxie ou choc anaphylactique. Bien que l'anaphylaxie présente de nombreux symptômes communs aux réactions d'hypersensibilité localisées de type I, le gonflement de la langue et de la trachée, l'obstruction des voies respiratoires, une chute dangereuse de la pression artérielle et l'apparition d'un état de choc peuvent rendre l'anaphylaxie particulièrement grave et mettre la vie en danger. En fait, le décès peut survenir dans les minutes qui suivent l'apparition des signes et des symptômes.
Les réactions de phase tardive des hypersensibilités de type I peuvent apparaître 4 à 12 heures après la phase initiale et sont médiées par les éosinophiles, les neutrophiles et les lymphocytes recrutés par des facteurs chimiotactiques libérés par les mastocytes. L'activation de ces cellules recrutées entraîne la libération d'un plus grand nombre de médiateurs chimiques qui provoquent des lésions tissulaires et des symptômes tardifs tels que gonflement et rougeur de la peau, toux, respiration sifflante et écoulement nasal.
Les personnes qui possèdent des gènes responsables de caractères inadaptés, tels que des réactions d'hypersensibilité de type I intenses à des composants de l'environnement qui seraient autrement inoffensifs, devraient connaître un succès reproducteur réduit. Avec ce type de pression sélective évolutive, on ne s'attend pas à ce que de tels traits persistent au sein d'une population. Cela suggère que les hypersensibilités de type I peuvent avoir une fonction adaptative. Il est prouvé que les IgE produites lors de réactions d'hypersensibilité de type I sont en fait destinées à lutter contre les helminthiases 2. Les helminthes sont l'un des rares organismes à posséder des protéines ciblées par les IgE. De plus, il est prouvé que les helminthes à un jeune âge réduisent le risque d'hypersensibilité de type I à des substances inoffensives plus tard dans la vie. Il se peut donc que les allergies soient la conséquence malheureuse d'une forte sélection dans la lignée des mammifères ou plus tôt pour se défendre contre les vers parasites.
| Nom commun | Cause | Signes et symptômes |
|---|---|---|
| Asthme provoqué par une allergie | Inhalation d'allergènes | Constriction des bronches, respiration difficile, toux, frissons, courbatures |
| Anaphylaxie | Réaction systémique aux allergènes | Urticaire, démangeaisons, gonflement de la langue et de la gorge, nausées, vomissements, baisse de la pression artérielle, état de choc |
| rhume des foins | L'inhalation de moisissures ou de pollen | Nez qui coule, yeux larmoyants, éternuements |
| Urticaire | Allergènes alimentaires ou médicamenteux, piqûres d'insectes | Éruption cutanée bosselée accompagnée de démangeaisons ; les bosses peuvent converger vers de grandes zones surélevées |
Exercice\(\PageIndex{2}\)
- Quelles sont les cellules à l'origine d'une réaction d'hypersensibilité de type I ?
- Décrivez les différences entre les réactions d'hypersensibilité de type I de phase immédiate et tardive.
- Dressez la liste des signes et symptômes de l'anaphylaxie.
L'hypothèse de l'hygiène
Dans la plupart des sociétés modernes, une bonne hygiène est associée à un bain régulier et une bonne santé à la propreté. Mais certaines études récentes suggèrent que l'association entre la santé et un mode de vie sain est peut-être erronée. Certains vont même jusqu'à suggérer que les enfants devraient être encouragés à jouer dans la saleté, voire à manger de la terre 3, pour le bien de leur santé. Cette recommandation est basée sur l'hypothèse dite de l'hygiène, selon laquelle l'exposition des enfants à des antigènes provenant de divers types de microbes conduit à un meilleur fonctionnement du système immunitaire plus tard dans la vie.
L'hypothèse de l'hygiène a été suggérée pour la première fois en 1989 par David Strachan 4, qui a observé une relation inverse entre le nombre d'enfants plus âgés dans une famille et l'incidence du rhume des foins. Bien que le rhume des foins ait considérablement augmenté chez les enfants au milieu du 20e siècle, son incidence était nettement plus faible dans les familles comptant un plus grand nombre d'enfants. Strachan a suggéré que la faible incidence d'allergies dans les familles nombreuses pourrait être liée à des infections contractées chez des frères et sœurs plus âgés, suggérant que ces infections rendaient les enfants moins vulnérables aux allergies. Strachan a également fait valoir que la tendance à réduire les familles et à mettre davantage l'accent sur la propreté au XXe siècle avait réduit l'exposition aux agents pathogènes et entraîné ainsi une hausse des taux globaux d'allergies, d'asthme et d'autres troubles immunitaires.
D'autres chercheurs ont observé une relation inverse entre l'incidence des troubles immunitaires et des maladies infectieuses qui sont aujourd'hui rares dans les pays industrialisés mais encore courantes dans les pays moins industrialisés. 5 Dans les pays développés, les enfants de moins de 5 ans ne sont pas exposés à de nombreux microbes, molécules et antigènes qu'ils auraient certainement rencontrés il y a un siècle. L'absence de défis précoces du système immunitaire par les organismes avec lesquels les humains et leurs ancêtres ont évolué peut entraîner des dysfonctionnements du système immunitaire plus tard dans la vie.
Hypersensibilités de type II (cytotoxiques)
Les réactions immunitaires classées comme des hypersensibilités de type II ou des hypersensibilités cytotoxiques sont médiées par des anticorps IgG et IgM se liant à des antigènes de surface cellulaire ou à des antigènes associés à des matrices sur les membranes basales. Ces anticorps peuvent soit activer le complément, entraînant une réponse inflammatoire et la lyse des cellules ciblées, soit être impliqués dans la cytotoxicité à médiation cellulaire dépendante des anticorps (ADCC) avec les lymphocytes T cytotoxiques.
Dans certains cas, l'antigène peut être un auto-antigène, auquel cas la réaction serait également décrite comme une maladie auto-immune. (Les maladies auto-immunes sont décrites dans la section Troubles auto-immuns). Dans d'autres cas, les anticorps peuvent se lier à des molécules naturelles mais exogènes présentes à la surface des cellules, telles que les antigènes associés au typage sanguin des globules rouges (RBC). Cela conduit à l'enrobage des globules rouges par des anticorps, à l'activation de la cascade du complément et à la lyse des globules rouges médiée par le complément, ainsi qu'à l'opsonisation des globules rouges pour la phagocytose. Deux exemples de réactions d'hypersensibilité de type II impliquant des globules rouges sont la réaction transfusionnelle hémolytique (HTR) et la maladie hémolytique du nouveau-né (HDN). Ces réactions d'hypersensibilité de type II, qui seront examinées plus en détail, sont résumées dans le tableau\(\PageIndex{4}\).
L'immuno-hématologie est l'étude du sang et des tissus hématopoïétiques en relation avec la réponse immunitaire. Les réactions provoquées par les anticorps contre les cellules sanguines sont des hypersensibilités de type II, relevant donc du domaine de l'immuno-hématologie. Pour les étudiants qui découvrent l'immuno-hématologie pour la première fois, la compréhension des mécanismes immunologiques impliqués est rendue encore plus difficile par le système complexe de nomenclature utilisé pour identifier les différents antigènes des groupes sanguins, souvent appelés groupes sanguins. Les premiers antigènes des groupes sanguins utilisaient des noms alphabétiques ou étaient nommés en l'honneur de la première personne connue pour produire des anticorps contre l'antigène des globules rouges (par exemple, Kell, Duffy ou Diego). Cependant, en 1980, le groupe de travail sur la terminologie de la Société internationale de transfusion sanguine (ISBT) a créé une norme pour la terminologie des groupes sanguins afin d'identifier de manière plus cohérente les antigènes des groupes sanguins récemment découverts. Les nouveaux antigènes sont désormais numérotés et affectés à un système de groupes sanguins, à une collection ou à une série. Cependant, malgré cet effort, la nomenclature des groupes sanguins reste incohérente.
| Nom commun | Cause | Signes et symptômes |
|---|---|---|
| Maladie hémolytique du nouveau-né (HDN) | Les IgG de la mère traversent le placenta, ciblant les globules rouges du fœtus à des fins de destruction | Anémie, œdème, hypertrophie du foie ou de la rate, hydrops (liquide dans la cavité corporelle), entraînant la mort du nouveau-né dans les cas graves |
| Réactions transfusionnelles hémolytiques (HTR) | Les IgG et les IgM se lient aux antigènes des globules rouges transfusés, ciblant ainsi les globules rouges des donneurs en vue de leur destruction | Fièvre, ictère, hypotension, coagulation intravasculaire disséminée pouvant entraîner une insuffisance rénale et la mort |
Incompatibilité des groupes sanguins ABO
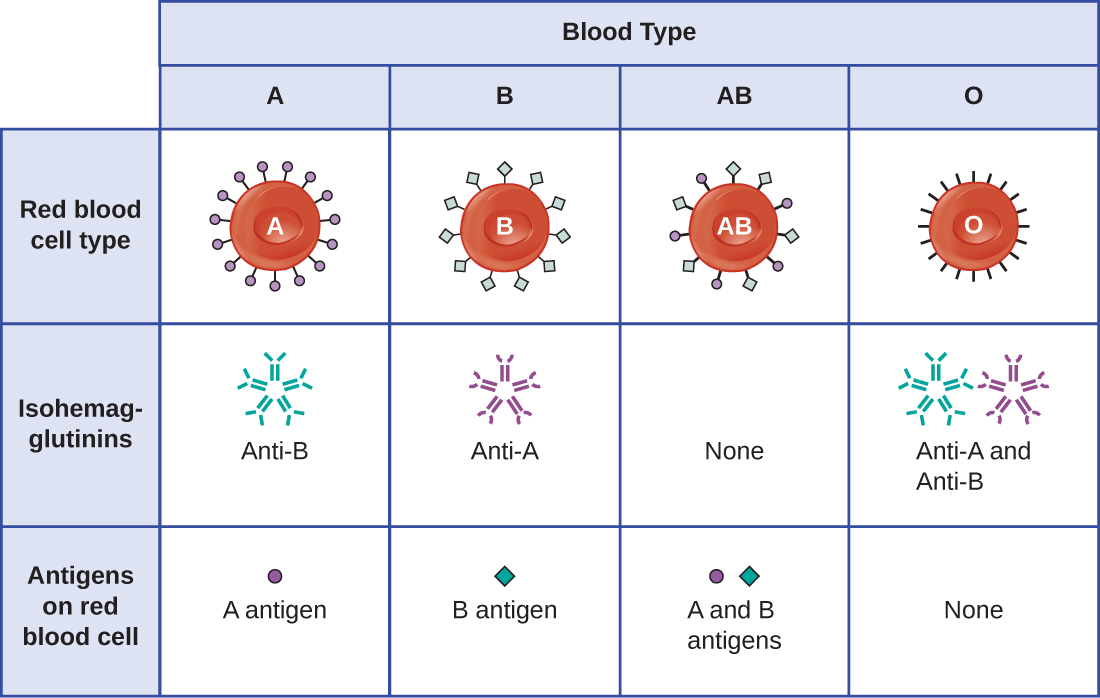
La reconnaissance du fait que les individus ont des groupes sanguins différents a été décrite pour la première fois par Karl Landsteiner (1868-1943) au début des années 1900, en se basant sur son observation selon laquelle le sérum d'une personne pouvait provoquer l'agrégation des globules rouges d'une autre personne. Ces études ont conduit Landsteiner à identifier quatre groupes sanguins distincts. Des recherches ultérieures menées par d'autres scientifiques ont déterminé que les quatre groupes sanguins étaient basés sur la présence ou l'absence de glycoprotéines de surface « A » et « B », ce qui a jeté les bases du système de groupes sanguins ABO qui est toujours utilisé aujourd'hui (Figure\(\PageIndex{3}\)). Les fonctions de ces antigènes sont inconnues, mais certains ont été associés à des fonctions biochimiques normales de la cellule. De plus, les groupes sanguins ABO sont hérités sous forme d'allèles (un pour chaque parent) et présentent des modèles d'hérédité dominante et codominante. Les allèles des groupes sanguins A et B sont codominants l'un par rapport à l'autre, et les deux prédominent sur le groupe sanguin O. Par conséquent, les individus porteurs des génotypes AA ou AO ont du sang de type A et expriment l'antigène de la glycoprotéine A à la surface de leurs globules rouges. Les personnes porteuses du génotype BB ou BO ont du sang de type B et expriment l'antigène de la glycoprotéine B à la surface de leurs globules rouges. Les personnes porteuses d'un génotype AB ont du sang de type AB et expriment les antigènes des glycoprotéines A et B à la surface de leurs globules rouges. Enfin, les individus porteurs d'un génotype d'OO ont du sang de type O et sont dépourvus de glycoprotéines A et B à la surface de leurs globules rouges.
Il est important de noter que les globules rouges des quatre groupes sanguins ABO partagent une molécule réceptrice protéique commune et que c'est l'ajout de glucides spécifiques aux récepteurs protéiques qui détermine les groupes sanguins A, B et AB. Les gènes hérités des groupes sanguins A, B et AB codent des enzymes qui ajoutent le composant glucidique au récepteur protéique. Les personnes du groupe sanguin O possèdent toujours le récepteur protéique mais ne possèdent pas les enzymes qui ajouteraient des glucides qui produiraient leurs globules rouges de type A, B ou AB.
Les anticorps IgM présents dans le plasma qui réagissent de manière croisée avec des antigènes de groupes sanguins non présents dans les globules rouges d'un individu sont appelés isohémagglutinines (Figure\(\PageIndex{3}\)). Les isohémagglutinines sont produites dans les premières semaines suivant la naissance et persistent tout au long de la vie. Ces anticorps sont produits en réponse à une exposition à des antigènes environnementaux provenant d'aliments et de microorganismes. Une personne ayant du sang de type A possède des antigènes A à la surface de ses globules rouges et produira des anticorps anti-B dirigés contre des antigènes environnementaux qui ressemblent à la composante glucidique des antigènes B. Une personne ayant du sang de type B possède des antigènes B à la surface de ses globules rouges et produira des anticorps anti-A dirigés contre des antigènes environnementaux similaires à la composante glucidique des antigènes A. Les personnes du groupe sanguin O n'ont pas d'antigènes A et B sur leurs globules rouges et produisent donc des anticorps anti-A et anti-B. À l'inverse, les personnes du groupe sanguin AB ont des antigènes A et B sur leurs globules rouges et, par conséquent, ne possèdent pas d'anticorps anti-A et anti-B.
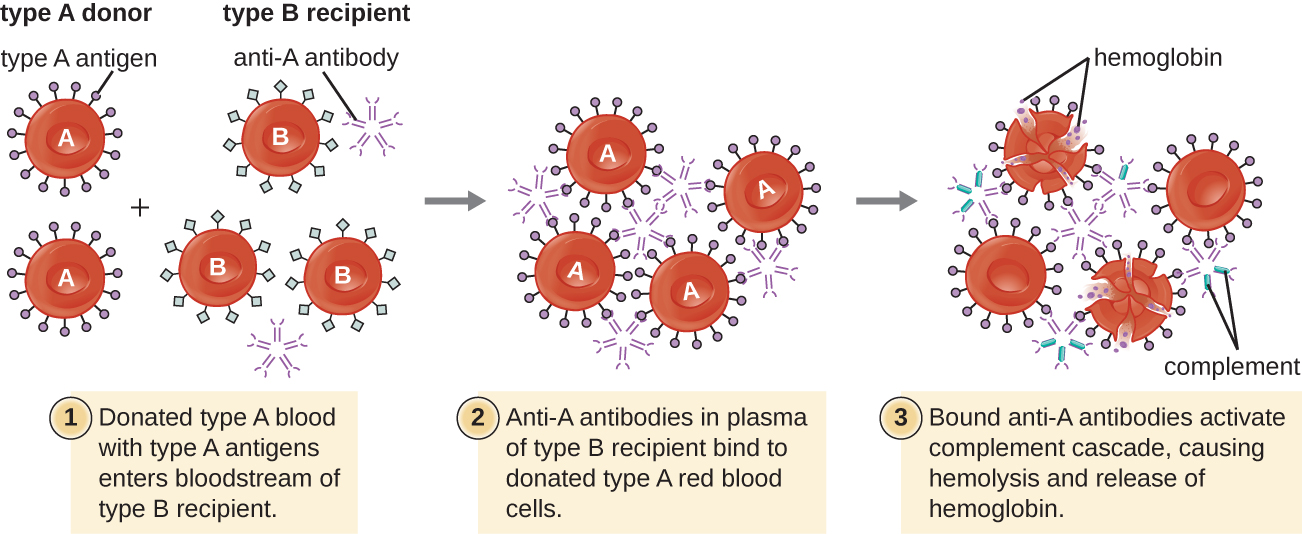
Un patient peut avoir besoin d'une transfusion sanguine parce qu'il n'a pas suffisamment de globules rouges (anémie) ou parce qu'il a subi une perte importante de volume sanguin à la suite d'un traumatisme ou d'une maladie. Bien que la transfusion sanguine soit administrée pour aider le patient, il est essentiel que celui-ci reçoive une transfusion avec le groupe sanguin ABO correspondant. Une transfusion avec un groupe sanguin ABO incompatible peut entraîner une réponse cytotoxique d'hypersensibilité de type II forte et potentiellement létale appelée réaction transfusionnelle hémolytique (HTR) (Figure\(\PageIndex{4}\)).
Par exemple, si une personne ayant du sang de type B reçoit une transfusion de sang de type A, ses anticorps anti-A se lieront aux globules rouges transfusés et agglutineront les globules rouges transfusés. De plus, l'activation de la cascade classique du complément entraînera une forte réponse inflammatoire, et le complexe d'attaque membranaire du complément (MAC) médiera une hémolyse massive des globules rouges transfusés. Les débris provenant des globules rouges endommagés et détruits peuvent obstruer les vaisseaux sanguins des alvéoles des poumons et des glomérules des reins. Dans les 1 à 24 heures suivant une transfusion incompatible, le patient présente de la fièvre, des frissons, un prurit (démangeaisons), de l'urticaire (urticaire), une dyspnée, une hémoglobinurie (hémoglobine dans les urines) et une hypotension (pression artérielle basse). Dans les réactions les plus graves, une pression artérielle dangereusement basse peut entraîner un choc, une défaillance multiviscérale et la mort du patient.
Les hôpitaux, les centres médicaux et les laboratoires cliniques associés utilisent généralement des systèmes d'hémovigilance pour minimiser le risque de HTR dû à une erreur d'écriture. Les systèmes d'hémovigilance sont des procédures qui permettent de suivre les informations transfusionnelles provenant de la source du donneur et des produits sanguins obtenus jusqu'au suivi des patients receveurs. Les systèmes d'hémovigilance utilisés dans de nombreux pays identifient les HTR et leurs résultats par le biais de rapports obligatoires (par exemple, à la Food and Drug Administration des États-Unis), et ces informations sont précieuses pour aider à prévenir de tels événements à l'avenir. Par exemple, s'il est établi qu'un HTR est le résultat d'une erreur de laboratoire ou d'écriture, d'autres produits sanguins prélevés auprès du donneur à ce moment-là peuvent être localisés et étiquetés correctement afin d'éviter d'autres HTR. À la suite de ces mesures, les décès associés à l'HTR aux États-Unis surviennent dans environ une unité transfusée sur 2 millions. 6
Facteurs Rh
De nombreux types d'antigènes érythrocytaires ont été découverts depuis la description des antigènes érythrocytaires ABO. Les deuxièmes antigènes RBC les plus fréquemment décrits sont les facteurs Rh, nommés d'après les facteurs du macaque rhésus (Macaca mulatta) identifiés par Karl Landsteiner et Alexander Weiner en 1940. Le système Rh des antigènes des globules rouges est le système de groupes sanguins le plus complexe et le plus immunogène, avec plus de 50 spécificités identifiées à ce jour. De tous les antigènes Rh, celui désigné Rho (Weiner) ou D (Fisher-Race) est le plus immunogène. Les cellules sont classées comme Rh positives (Rh+) si l'antigène Rho/D est présent ou comme Rh négatives (Rh−) si l'antigène Rho/D est absent. Contrairement aux molécules de glucides qui distinguent les groupes sanguins ABO et qui sont les cibles des isohémagglutinines IgM présentes dans les HTR, les antigènes du facteur Rh sont des protéines. Comme indiqué dans Lymphocytes B et immunité humorale, les antigènes protéiques activent la production de lymphocytes B et d'anticorps par un mécanisme dépendant des lymphocytes T, et les lymphocytes T H 2 stimulent le passage de classe des IgM à d'autres classes d'anticorps. Dans le cas des antigènes du facteur Rh, les cellules T H 2 stimulent le passage de classe à l'IgG, ce qui a des implications importantes pour le mécanisme du HDN.
Tout comme les incompatibilités ABO, les transfusions sanguines d'un donneur avec les mauvais antigènes du facteur Rh peuvent provoquer une HTR d'hypersensibilité de type II. Cependant, contrairement aux isohémagglutinines IgM produites tôt dans la vie par exposition à des antigènes environnementaux, la production d'anticorps anti-facteur RH nécessite l'exposition d'une personne ayant du sang Rh− à des globules rouges Rh+ positifs et l'activation d'une réponse immunitaire primaire. Bien que cette réponse immunitaire primaire puisse provoquer un HTR chez le patient transfusé, la réaction hémolytique serait retardée jusqu'à 2 semaines pendant la période de latence prolongée d'une réponse anticorps primaire (lymphocytes B et immunité humorale). Toutefois, si le patient reçoit une transfusion ultérieure de globules rouges Rh+, un HTR plus rapide se produira avec des anticorps anti-facteur RH déjà présents dans le sang. De plus, la réponse immunitaire secondaire rapide fournirait encore plus d'anticorps anti-facteur RH pour le HTR.
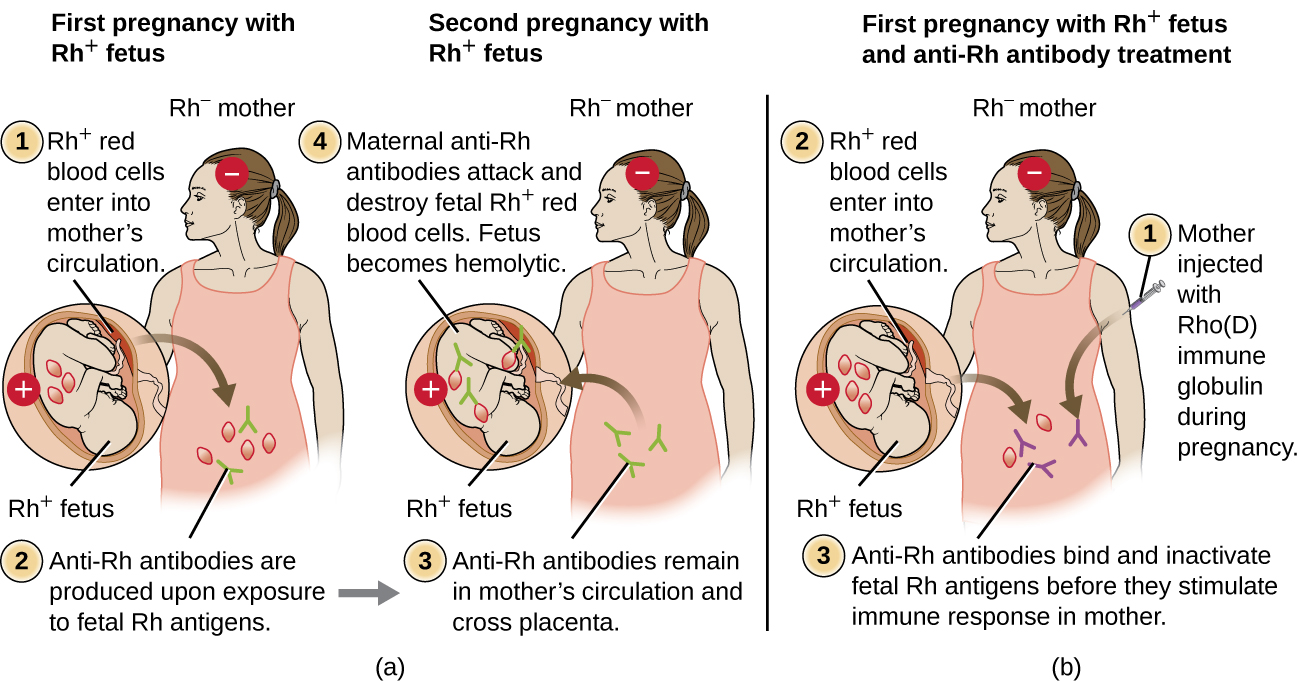
L'incompatibilité du facteur Rh entre la mère et le fœtus peut également provoquer une réaction hémolytique d'hypersensibilité de type II, appelée maladie hémolytique du nouveau-né (HDN) (Figure\(\PageIndex{5}\)). Si une femme Rh− porte un bébé Rh+ jusqu'à terme, le système immunitaire de la mère peut être exposé aux globules rouges foetaux Rh+. Cette exposition se produit généralement au cours du dernier trimestre de la grossesse et pendant le processus d'accouchement. Si cette exposition se produit, les globules rouges Rh+ foetaux activeront une réponse immunitaire adaptative primaire chez la mère, et des anticorps IgG anti-facteur RH seront produits. Les anticorps IgG constituent la seule classe d'anticorps capable de traverser le placenta de la mère au foetus ; toutefois, dans la plupart des cas, le premier bébé Rh+ n'est pas affecté par ces anticorps, car la première exposition se produit généralement suffisamment tard pendant la grossesse pour que la mère n'ait pas le temps de procéder à une primovaccination suffisante réponse immunitaire avant la naissance du bébé.
Toutefois, en cas de grossesse ultérieure avec un foetus Rh+, la deuxième exposition de la mère aux antigènes du facteur Rh provoque une forte réponse anticorps secondaire qui produit de plus grandes quantités d'IgG anti-facteur RH. Ces anticorps peuvent traverser le placenta de la mère au fœtus et provoquer le HDN, une maladie potentiellement mortelle pour le bébé (Figure\(\PageIndex{5}\)).
Avant la mise au point de techniques de diagnostic et de prévention, l'incompatibilité du facteur Rh était la cause la plus fréquente du HDN, entraînant des milliers de décès infantiles chaque année dans le monde. 7 Pour cette raison, les facteurs Rh des futurs parents sont régulièrement testés et des traitements ont été développés pour prévenir le HDN causé par une incompatibilité avec le Rh. Pour prévenir la HDN médiée par le facteur Rh, l'immunoglobuline humaine Rho (D) (par exemple RhoGam) est injectée par voie intraveineuse ou intramusculaire à la mère au cours de la 28e semaine de grossesse et dans les 72 heures suivant l'accouchement. Des doses supplémentaires peuvent être administrées après des événements pouvant entraîner une hémorragie transplacentaire (par exemple, prélèvement de sang ombilical, prélèvement de villosités choriales, traumatisme abdominal, amniocentèse). Ce traitement est initié lors de la première grossesse chez un foetus Rh+. Les anticorps anti-RH contenus dans l'immunoglobuline Rho (D) se lient au facteur Rh de tous les globules rouges foetaux qui accèdent à la circulation sanguine de la mère, empêchant ainsi ces cellules Rh+ d'activer la réponse immunitaire primaire de la mère. En l'absence d'une réponse anticorps anti-facteur RH primaire, le risque de HDN sera minime lors de la prochaine grossesse avec un Rh+. Cependant, la mère devra être retraitée avec des immunoglobulines Rho (D) au cours de cette grossesse afin de prévenir une réponse primaire en anticorps anti-RH qui pourrait menacer les grossesses ultérieures.
Utilisez ce jeu de typage sanguin interactif pour renforcer vos connaissances en matière de typage sanguin.
Exercice\(\PageIndex{3}\)
- Qu'arrive-t-il aux cellules qui possèdent des antigènes incompatibles lors d'une réaction d'hypersensibilité de type II ?
- Décrivez la maladie hémolytique du nouveau-né et expliquez comment elle peut être évitée.
Orientation clinique : partie 2
Le médecin traitant de Kerry ne sait pas pourquoi Kerry semble développer des éruptions cutanées après avoir passé du temps au soleil. Elle demande donc une analyse d'urine et des analyses sanguines de base. Les résultats révèlent que Kerry présente une protéinurie (taux anormaux de protéines dans les urines), une hémoglobinurie (excès d'hémoglobine dans les urines) et un faible hématocrite (taux de globules rouges). Ces tests suggèrent que Kerry souffre d'une légère crise d'anémie hémolytique. Le médecin soupçonne que le problème pourrait être auto-immun. Elle oriente donc Kerry vers un rhumatologue pour des tests et un diagnostic supplémentaires.
Exercice\(\PageIndex{4}\)
Les rhumatologues se spécialisent dans les maladies musculosquelettiques telles que l'arthrite, l'ostéoporose et les douleurs articulaires. Pourquoi le médecin de Kerry pourrait-il l'orienter vers ce type de spécialiste en particulier alors qu'elle ne présente aucun de ces symptômes ?
Hypersensibilités de type III
Les hypersensibilités de type III sont des réactions immunitaires complexes qui ont été caractérisées pour la première fois par Nicolas Maurice Arthus (1862-1945) en 1903. Pour produire des anticorps destinés à des procédures expérimentales, Arthus a immunisé des lapins en leur injectant du sérum provenant de chevaux. Cependant, alors qu'il immunisait des lapins à plusieurs reprises avec du sérum de cheval, Arthus a remarqué une hémorragie sous-cutanée localisée inattendue et inédite accompagnée d'un œdème au site d'injection. Cette réaction s'est développée dans les 3 à 10 heures suivant l'injection. Cette réaction localisée à des protéines sériques autres que l'auto-sérum a été appelée réaction d'Arthus. Une réaction d'Arthus se produit lorsque des antigènes solubles se lient aux IgG dans un rapport qui entraîne l'accumulation d'agrégats antigène-anticorps appelés complexes immuns.
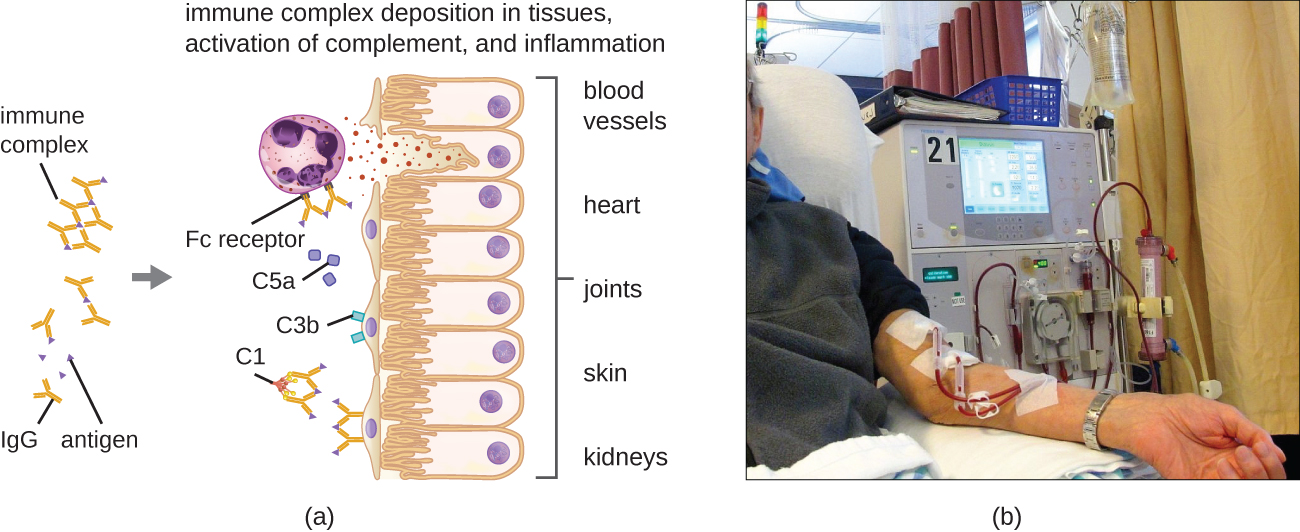
Une caractéristique unique de l'hypersensibilité de type III est l'excès d'anticorps (principalement des IgG), associé à une concentration relativement faible d'antigène, qui entraîne la formation de petits complexes immunitaires qui se déposent à la surface des cellules épithéliales qui tapissent la lumière interne des petits vaisseaux sanguins ou sur les surfaces des tissus (Figure\(\PageIndex{6}\)). Cette accumulation de complexe immunitaire entraîne une cascade d'événements inflammatoires, dont les suivants :
- Liaison des IgG aux récepteurs d'anticorps des mastocytes localisés, entraînant une dégranulation des mastocytes
- Activation du complément avec production de C3a et de C5a pro-inflammatoires (voir Défenses chimiques)
- Perméabilité des vaisseaux sanguins accrue avec recrutement chimiotactique de neutrophiles et de macrophages
Comme ces complexes immunitaires n'ont pas une taille optimale et se déposent à la surface des cellules, ils ne peuvent pas être phagocytés de la manière habituelle par les neutrophiles et les macrophages, qui, à leur tour, sont souvent décrits comme « frustrés ». Bien que la phagocytose ne se produise pas, la dégranulation des neutrophiles entraîne la libération d'enzymes lysosomales qui provoquent la destruction extracellulaire du complexe immunitaire, endommageant ainsi des cellules localisées. L'activation des voies de coagulation se produit également, entraînant la formation de thrombus (caillots sanguins) qui obstruent les vaisseaux sanguins et provoquent une ischémie pouvant entraîner une nécrose vasculaire et une hémorragie localisée.
L'hypersensibilité systémique de type III (maladie sérique) survient lorsque des complexes immuns se déposent sur diverses parties du corps, provoquant une réponse inflammatoire systémique plus généralisée. Ces complexes immunitaires impliquent des protéines autres que les auto-protéines, telles que les anticorps produits chez les animaux pour l'immunité passive artificielle (voir Vaccins), certains médicaments ou des antigènes microbiens qui sont libérés de façon continue au fil du temps lors d'infections chroniques (par exemple, endocardite bactérienne subaiguë, virus chronique hépatite). Les mécanismes de la maladie sérique sont similaires à ceux décrits dans l'hypersensibilité localisée de type III mais impliquent une activation généralisée des mastocytes, du complément, des neutrophiles et des macrophages, qui provoque la destruction des tissus dans des zones telles que les reins, les articulations et les vaisseaux sanguins. À la suite de la destruction des tissus, les symptômes de la maladie sérique incluent des frissons, de la fièvre, des éruptions cutanées, des vascularites et de l'arthrite. Le développement d'une glomérulonéphrite ou d'une hépatite est également possible.
Les maladies auto-immunes telles que le lupus érythémateux disséminé (LED) et la polyarthrite rhumatoïde peuvent également entraîner des réactions d'hypersensibilité de type III dommageables lorsque les auto-anticorps forment des complexes immuns avec des auto-antigènes. Ces affections sont abordées dans la section sur les maladies auto-immunes.
Exercice\(\PageIndex{5}\)
- Pourquoi l'excès d'anticorps est-il important en cas d'hypersensibilité de type III ?
- Décrivez les différences entre la réaction d'Arthus et la maladie sérique.
Antitoxine diphtérique
Les sérums antibactériens sont beaucoup moins utilisés aujourd'hui que par le passé, ayant été remplacés par des vaccins à base d'anatoxine. Cependant, l'antitoxine diphtérique produite chez les chevaux est un exemple de traitement de ce type qui est encore utilisé dans certaines régions du monde. Bien que son utilisation ne soit pas homologuée par la FDA aux États-Unis, l'antitoxine diphtérique peut être utilisée pour traiter les cas de diphtérie, causés par la bactérie Corynebacterium diphtheriae. 8 Le traitement n'est toutefois pas sans risques. Une maladie sérique peut survenir lorsque le patient développe une réponse immunitaire à des protéines provenant de chevaux autres que lui-même. Des complexes immunitaires se forment entre les protéines du cheval et les anticorps circulants lorsque les deux existent dans certaines proportions. Ces complexes immunitaires peuvent se déposer dans les organes et provoquer des dommages tels que l'arthrite, la néphrite, les éruptions cutanées et la fièvre. La maladie sérique est généralement transitoire et ne présente aucun dommage permanent, sauf si le patient est exposé de façon chronique à l'antigène, ce qui peut entraîner des dommages irréversibles à des sites corporels tels que les articulations et les reins. Au fil du temps, les cellules phagocytaires telles que les macrophages sont capables d'éliminer les antigènes sériques du cheval, ce qui entraîne une amélioration de l'état du patient et une diminution des symptômes à mesure que la réponse immunitaire se dissipe.
Orientation clinique : 3e partie
Kerry n'arrive pas chez le rhumatologue. Elle fait une crise d'épilepsie alors qu'elle quitte le cabinet de son médecin traitant. Elle est rapidement transportée au service des urgences, où son médecin traitant relate ses antécédents médicaux et les résultats des tests récents. Le médecin du service des urgences fait appel au rhumatologue du personnel de l'hôpital pour consultation. Sur la base des symptômes et des résultats des tests, le rhumatologue soupçonne Kerry d'être atteint de lupus et demande deux analyses sanguines : un test d'anticorps antinucléaires (ANA) pour rechercher des anticorps qui se lient à l'ADN et un autre test pour rechercher des anticorps qui se lient à un auto-antigène appelé antigène Smith (Sm).
Exercice\(\PageIndex{6}\)
Sur la base des analyses sanguines demandées, quel type de réaction le rhumatologue soupçonne-t-il d'être à l'origine de la crise de Kerry ?
Hypersensibilités de type IV
Les hypersensibilités de type IV ne sont pas véhiculées par des anticorps comme les trois autres types d'hypersensibilité. Les hypersensibilités de type IV sont plutôt régulées par les lymphocytes T et impliquent l'action des cellules effectrices. Ces types d'hypersensibilité peuvent être organisés en trois sous-catégories en fonction du sous-type de lymphocytes T, du type d'antigène et du mécanisme effecteur qui en résulte (Tableau\(\PageIndex{5}\)).
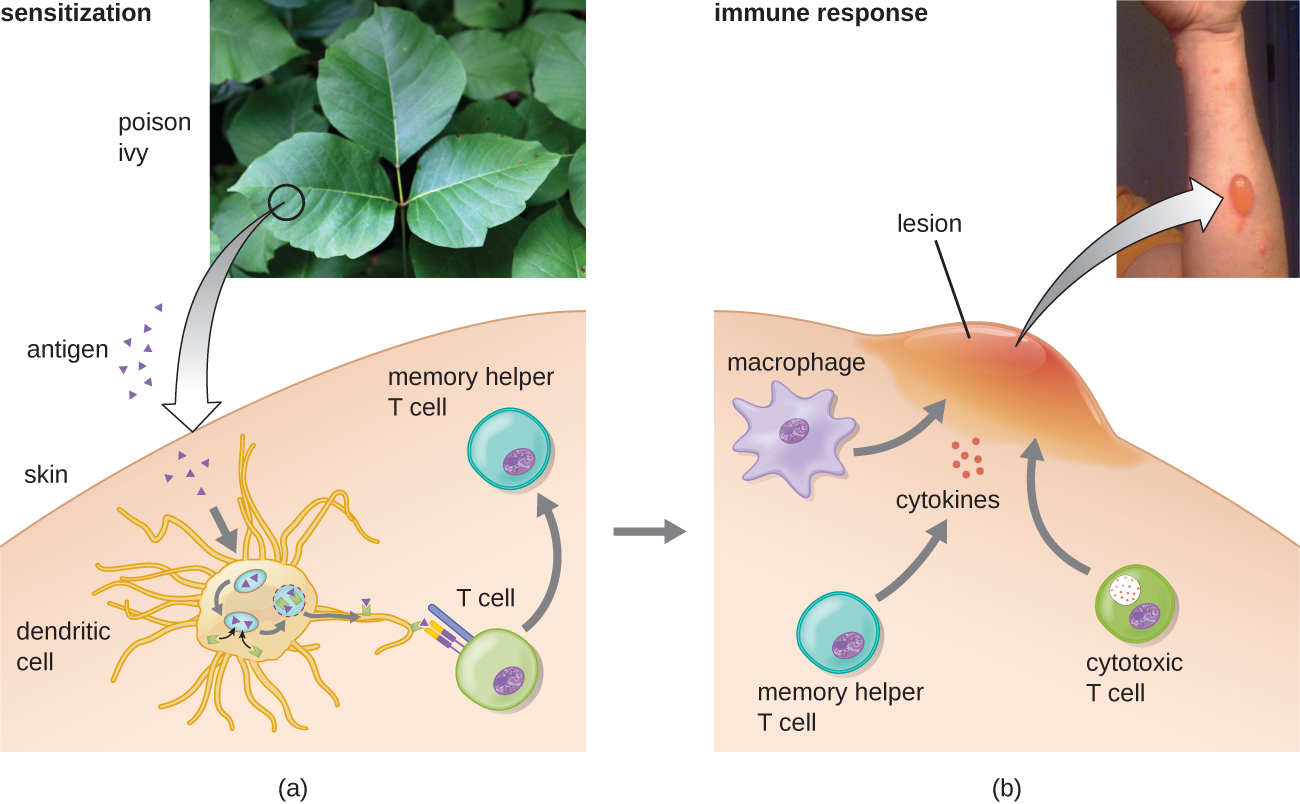
Dans la première sous-catégorie de type IV, les réactions médiées par le CD4 T H 1 sont décrites comme des hypersensibilités de type retardé (DTH). L'étape de sensibilisation implique l'introduction d'antigène dans la peau et la phagocytose par des cellules présentatrices d'antigènes (CPA) locales. Les APC activent les lymphocytes T auxiliaires, stimulant la prolifération clonale et la différenciation en cellules T H 1 mémoire. Lors d'une exposition ultérieure à l'antigène, ces cellules mémoire T H 1 sensibilisées libèrent des cytokines qui activent les macrophages, et les macrophages activés sont responsables d'une grande partie des lésions tissulaires. Des exemples de cette hypersensibilité médiée par le T H 1 sont observés dans la tuberculine, le test cutané de Mantoux et la dermatite de contact, comme cela se produit lors de réactions allergiques au latex.
Dans la deuxième sous-catégorie de type IV, les réactions médiées par le CD4 T H 2 entraînent un asthme chronique ou une rhinite allergique chronique. Dans ces cas, l'antigène soluble est d'abord inhalé, ce qui entraîne le recrutement et l'activation des éosinophiles avec libération de cytokines et de médiateurs inflammatoires.
Dans la troisième sous-catégorie de type IV, les réactions médiées par les lymphocytes T cytotoxiques (CTL) CD8 sont associées au rejet d'une greffe de tissu et à une dermatite de contact (Figure\(\PageIndex{7}\)). Pour cette forme d'hypersensibilité à médiation cellulaire, les CPA traitent et présentent l'antigène avec le MHC I à des lymphocytes T CD8 naïfs. Lorsque ces lymphocytes T CD8 naïfs sont activés, ils prolifèrent et se différencient en CTL. Les cellules T H 1 activées peuvent également améliorer l'activation des CTL. Les CTL activés ciblent et induisent ensuite l'apoptose médiée par les granzymes dans les cellules présentant le même antigène que le MHC I. Ces cellules cibles peuvent être des cellules « autonomes » qui ont absorbé l'antigène étranger (comme dans le cas d'une dermatite de contact due à l'herbe à puce), ou il peut s'agir de cellules tissulaires transplantées présentant des éléments étrangers antigène du donneur.
| Sous-catégorie | Antigène | Mécanisme effecteur | Exemples |
|---|---|---|---|
| 1 | Antigène soluble | Les macrophages activés endommagent les tissus et favorisent la réponse inflammatoire | Dermatite de contact (p. ex. exposition au latex) et hypersensibilité de type retardé (p. ex. réaction tuberculinique) |
| 2 | Antigène soluble | Le recrutement et l'activation des éosinophiles libèrent des cytokines et des produits chimiques pro-inflammatoires | Asthme chronique et rhinite allergique chronique |
| 3 | Antigène associé aux cellules | Cytotoxicité médiée par le CTL | Dermatite de contact (par ex. contact avec de l'herbe à puce) et rejet d'une greffe de tissu |
Exercice\(\PageIndex{7}\)
- Décrivez les trois sous-types d'hypersensibilité de type IV.
- Expliquer comment les lymphocytes T contribuent aux lésions tissulaires en cas d'hypersensibilité de type IV.
Utilisation de l'hypersensibilité retardée pour tester la tuberculose
Le pédiatre autrichien Clemans von Pirquet (1874-1929) a décrit pour la première fois les mécanismes allergiques, y compris la maladie sérique de type III. 9 Son intérêt a mené à la mise au point d'un test de dépistage de la tuberculose (TB) utilisant l'antigène tuberculinique, sur la base de travaux antérieurs d'identification de l'agent pathogène de la tuberculose réalisés par Robert Koch. La méthode de Pirquet impliquait la scarification, qui se traduit par de multiples perforations simultanées, à l'aide d'un appareil muni d'un ensemble d'aiguilles pour casser la peau à de nombreuses reprises sur une petite zone. L'appareil utilisé par Pirquet était similaire au dispositif de test des dents à quatre aiguilles vu sur la figure\(\PageIndex{8}\).
Le bout de toutes les aiguilles de la matrice est recouvert de tuberculine, un extrait protéique de la bactérie de la tuberculose, qui introduit efficacement la tuberculine dans la peau. Un à trois jours plus tard, la région peut être examinée pour détecter une réaction d'hypersensibilité retardée, dont les signes incluent un gonflement et une rougeur.
Comme vous pouvez l'imaginer, la scarification n'a pas été une expérience plaisante10 et les nombreuses perforations cutanées exposaient le patient à un risque de développer une infection bactérienne de la peau. Mantoux a modifié le test de Pirquet pour utiliser une seule injection sous-cutanée de tuberculine purifiée. Un test positif, qui est indiqué par un gonflement localisé retardé au site d'injection, ne signifie pas nécessairement que le patient est actuellement infecté par une tuberculose active. Étant donné que l'hypersensibilité de type IV (type retardé) est induite par la réactivation des lymphocytes T mémoire, ces cellules peuvent avoir été créées récemment (en raison d'une infection active) ou des années auparavant (si un patient était atteint de tuberculose et l'avait éliminée spontanément, ou si elle était restée en latence). Cependant, le test peut être utilisé pour confirmer l'infection dans les cas où des symptômes chez le patient ou des résultats sur une radiographie suggèrent sa présence.

Pneumonite d'hypersensibilité
Certaines maladies causées par des hypersensibilités ne sont pas causées exclusivement par un seul type. Par exemple, la pneumonie d'hypersensibilité (HP), qui est souvent une maladie professionnelle ou environnementale, survient lorsque les poumons s'enflamment en raison d'une réaction allergique à l'inhalation de poussière, d'endospores, de plumes d'oiseaux, de déjections d'oiseaux, de moisissures ou de produits chimiques. HP porte de nombreux noms différents associés à diverses formes d'exposition (Figure\(\PageIndex{9}\)). Les HP associés aux déjections d'oiseaux sont parfois appelés poumon de pigeon ou poumon de travailleur avicole, deux éléments courants chez les éleveurs et les maîtres-oiseaux. La maladie du manipulateur de fromage, le poumon du fermier, la maladie des utilisateurs de sauna et les poumons des spas sont d'autres noms des HP associés à l'exposition à des moisissures dans divers environnements.
La pathologie associée à la HP peut être due à des hypersensibilités de type III (médiées par des complexes immuns) et de type IV (médiées par les cellules T H 1 et les macrophages). L'exposition répétée à des allergènes peut provoquer une alvéolite en raison de la formation de complexes immunitaires dans la paroi alvéolaire du poumon, accompagnée d'une accumulation de liquide, et de la formation de granulomes et d'autres lésions pulmonaires à la suite de l'activation des macrophages médiée par le T H 1. Une alvéolite accompagnée de formation de liquide et de granulome entraîne une mauvaise perfusion d'oxygène dans les alvéoles, ce qui peut provoquer des symptômes tels que toux, dyspnée, frissons, fièvre, transpiration, myalgies, maux de tête et nausées. Les symptômes peuvent apparaître aussi rapidement que 2 heures après l'exposition et peuvent persister pendant des semaines s'ils ne sont pas traités.

Exercice\(\PageIndex{8}\)
Expliquez pourquoi la pneumonie d'hypersensibilité est considérée comme une maladie professionnelle.
La figure\(\PageIndex{10}\) résume les mécanismes et les effets de chaque type d'hypersensibilité abordé dans cette section.
Diagnostic des hypersensibilités
Le diagnostic des hypersensibilités de type I est un processus complexe qui nécessite plusieurs tests diagnostiques en plus de l'historique bien documenté du patient. Les taux sériques d'IgE peuvent être mesurés, mais un taux élevé d'IgE ne suffit pas à confirmer l'apparition Dans le cadre du processus d'identification des antigènes responsables d'une réaction allergique de type I, un test cutané par piqûre (PPST) ou un test intradermique peut être réalisé. La PPST est réalisée avec l'introduction d'allergènes lors d'une série de piqûres cutanées superficielles sur le dos ou les bras du patient (Figure\(\PageIndex{11}\)). Les PPST sont considérés comme le moyen le plus pratique et le moins coûteux de diagnostiquer les allergies, selon le Joint Council of Allergy des États-Unis et l'Académie européenne d'allergie et d'immunologie. Le deuxième type de test, le test intradermique, nécessite une injection dans le derme à l'aide d'une petite aiguille. Cette aiguille, également appelée aiguille à tuberculine, est fixée à une seringue contenant une petite quantité d'allergène. Le test PPST et le test intradermique sont observés pendant 15 à 20 minutes pour détecter une réaction de poussée de papule aux allergènes. La mesure de toute papule (bosse qui démange) et de toute poussée (rougeur) en quelques minutes indique une hypersensibilité de type I, et plus la réaction de poussée de papule est importante, plus le patient est sensible à l'allergène.
Les hypersensibilités de type III peuvent souvent être mal diagnostiquées en raison de leur nature inflammatoire non spécifique. Les symptômes sont facilement visibles, mais ils peuvent être associés à n'importe laquelle d'autres maladies. Des antécédents solides et complets du patient sont essentiels à un diagnostic correct et précis. Les tests utilisés pour établir le diagnostic d'une pneumonie d'hypersensibilité (résultant d'une hypersensibilité de type III) comprennent le lavage bronchoalvéolaire (BAL), les tests de la fonction pulmonaire et la tomodensitométrie haute résolution (HRCT).
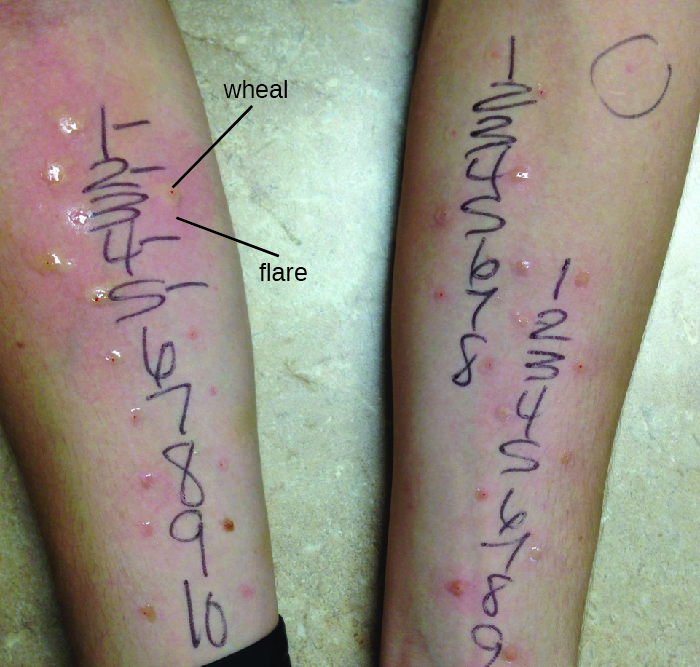
Exercice\(\PageIndex{9}\)
- Décrivez le test cutané par ponction.
- Expliquer pourquoi les hypersensibilités de type III peuvent être difficiles à diagnostiquer
Traitements des hypersensibilités
Les réactions allergiques peuvent être traitées de différentes manières. La prévention des réactions allergiques peut être obtenue par un traitement de désensibilisation (hyposensibilisation), qui peut être utilisé pour réduire la réaction d'hypersensibilité par des injections répétées d'allergènes. Des concentrations extrêmement diluées d'allergènes connus (déterminées à partir des tests allergéniques) sont injectées au patient à des intervalles prescrits (par exemple, une fois par semaine). La quantité d'allergène délivrée par les injections augmente lentement au cours d'une période d'accumulation jusqu'à ce qu'une dose efficace soit déterminée et que cette dose soit maintenue pendant toute la durée du traitement, qui peut durer des années. Les patients sont généralement invités à rester chez le médecin pendant 30 minutes après avoir reçu l'injection au cas où les allergènes administrés provoqueraient une réaction systémique sévère. Les cabinets médicaux qui administrent des traitements de désensibilisation doivent être prêts à fournir une réanimation et un traitement médicamenteux en cas de tel événement.
La thérapie de désensibilisation est utilisée pour les allergies aux piqûres d'insectes et les allergies environnementales. Les vaccins contre les allergies provoquent la production de différentes réponses en interleukines et en anticorps IgG au lieu d'IgE. Lorsqu'un excès d'anticorps IgG spécifiques à un allergène est produit et se lie à l'allergène, ils peuvent agir comme des anticorps bloquants pour neutraliser l'allergène avant qu'il ne puisse se lier aux IgE sur les mastocytes. Certaines études préliminaires utilisant la thérapie orale pour la désensibilisation aux allergies alimentaires sont prometteuses. 11 12 Ces études consistent à donner à des enfants allergiques de petites quantités d'allergène (par exemple, de la farine d'arachide) ou de protéines connexes au fil du temps. De nombreux sujets présentent une diminution de la sévérité de la réaction à l'allergène alimentaire après le traitement.
Il existe également des thérapies conçues pour traiter les réactions allergiques graves. L'anaphylaxie systémique d'urgence est traitée dans un premier temps par une injection d'épinéphrine, qui peut neutraliser la chute de la pression artérielle. Les personnes atteintes d'allergies graves connues portent souvent sur elles un auto-injecteur qui peut être utilisé en cas d'exposition à l'allergène (par exemple, piqûre d'insecte ou ingestion accidentelle d'un aliment provoquant une réaction grave). En s'auto-administrant une injection d'épinéphrine (ou parfois deux), le patient peut endiguer la réaction suffisamment longtemps pour consulter un médecin. Le traitement de suivi consiste généralement à administrer au patient des antihistaminiques et des corticostéroïdes à action lente pendant plusieurs jours après la réaction afin de prévenir d'éventuelles réactions de phase tardive. Cependant, les effets des traitements antihistaminiques et corticostéroïdes ne sont pas bien étudiés et sont utilisés sur la base de considérations théoriques.
Le traitement des réactions allergiques légères fait généralement appel à des antihistaminiques et à d'autres médicaments anti-inflammatoires. Une variété de médicaments antihistaminiques sont disponibles, sur ordonnance et en vente libre. Il existe également des antileucotriènes et des antiprostaglandines qui peuvent être utilisés en association avec des antihistaminiques dans le cadre d'un régime thérapeutique combiné (et plus efficace).
Les traitements des hypersensibilités de type III incluent la prévention d'une exposition ultérieure à l'antigène et l'utilisation d'anti-inflammatoires. Certaines conditions peuvent être résolues lorsque l'exposition à l'antigène est empêchée. Des inhalateurs de corticostéroïdes anti-inflammatoires peuvent également être utilisés pour diminuer l'inflammation et permettre aux lésions pulmonaires de guérir. Le traitement systémique aux corticostéroïdes, par voie orale ou intraveineuse, est également courant pour les hypersensibilités de type III affectant les systèmes corporels. Le traitement de la pneumonie d'hypersensibilité consiste à éviter l'allergène et à ajouter éventuellement des stéroïdes sur ordonnance tels que la prednisone pour réduire l'inflammation.
Le traitement des hypersensibilités de type IV comprend des antihistaminiques, des anti-inflammatoires, des analgésiques et, si possible, l'élimination de toute exposition ultérieure à l'antigène.
Exercice\(\PageIndex{10}\)
- Décrire le traitement de désensibilisation.
- Expliquer le rôle de l'épinéphrine dans le traitement des réactions d'hypersensibilité.
Concepts clés et résumé
- Une allergie est une réponse immunitaire adaptative, parfois mortelle, à un allergène.
- L'hypersensibilité de type I nécessite une sensibilisation des mastocytes aux IgE, impliquant une réponse initiale en anticorps IgE et une fixation des IgE aux mastocytes. Lors d'une deuxième exposition à un allergène, la réticulation des molécules d'IgE sur les mastocytes déclenche la dégranulation et la libération de médiateurs chimiques préformés et nouvellement formés de l'inflammation. L'hypersensibilité de type I peut être localisée et relativement mineure (urticaire et rhume des foins) ou systémique et dangereuse (anaphylaxie systémique).
- Les hypersensibilités de type II résultent de la liaison d'anticorps aux antigènes présents sur les cellules et du déclenchement de réponses cytotoxiques. Les exemples incluent la réaction transfusionnelle hémolytique et la maladie hémolytique du nouveau-né.
- Les hypersensibilités de type III résultent de la formation et de l'accumulation de complexes immunitaires dans les tissus, stimulant des réponses inflammatoires dommageables.
- Les hypersensibilités de type IV ne sont pas médiées par des anticorps, mais par l'activation des macrophages, des éosinophiles et des lymphocytes T cytotoxiques par les lymphocytes T auxiliaires.
Notes
- 1 D.S. Strayer et coll. (éd.). Rubin's Pathology : Clinicopathological Foundations of Medicine. 7e éd. 2 Philadelphie, PA : Lippincott, Williams et Wilkins, 2014.
- 2 C.M. Fitzsimmons et coll. « Les allergènes helminthiques, les IgE spécifiques aux parasites et leur rôle protecteur dans l'immunité humaine. » Frontier en immunologie 5 (2015) :47.
- 3 S. T. Weiss. « Mangez de la saleté : hypothèse de l'hygiène et maladies allergiques. » Journal de médecine de la Nouvelle-Angleterre 347 n° 12 (2002) :930—931.
- 4 D.P. Strachan « Rhume des foins, hygiène et taille des ménages ». Journal médical britannique 299 n° 6710 (1989) :1259.
- 5 H. Okada et coll. « L'hypothèse de l'hygiène pour les maladies auto-immunes et allergiques : une mise à jour. » Immunologie clinique et expérimentale 160 no. 1 (2010) :1—9.
- 6 E. C. Vamvakas, M. A. Blanchman. « Mortalité liée aux transfusions : les risques permanents de la transfusion sanguine allogénique et les stratégies disponibles pour les prévenir ». Blood 113 n° 15 (2009) :3406—3417.
- 7 G. Reali. « Quarante ans d'immunoprophylaxie anti-D ». Transfusion sanguine 5 no 1 (2007) :3—6.
- 8 centres pour le contrôle et la prévention des maladies. « Antitoxine diphtérique ». http://www.cdc.gov/diphtheria/dat.html. Consulté le 25 mars 2016.
- 9 B. Huber « 100 ans d'allergie : Clemens von Pirquet—Sein Allergiebegriff und das ihm zugrunde liegende Krankheitsverständnis ». Wiener Klinische Wochenschrift 118 n° 19-20 (2006) :573-579.
- 10 C.A. Stewart. « Le test de Pirquet : comparaison des méthodes d'application de la scarification et de la ponction. » Archives de pédiatrie et de médecine des adolescents 35 n° 3 (1928) :388—391.
- 11 C.L. Schneider et coll. « Une étude pilote sur l'omalizumab pour faciliter la désensibilisation orale rapide chez les patients allergiques aux arachides à haut risque. » Journal des allergies et de l'immunologie clinique 132 n° 6 (2013) :1368—1374.
- 12 P. Varshney et coll. « Une étude contrôlée randomisée sur l'immunothérapie orale aux arachides : désensibilisation clinique et modulation de la réponse allergique. » Journal des allergies et de l'immunologie clinique 127 n° 3 (2011) :654—660.


