12.4 : Génie génétique : risques, avantages et perceptions
- Page ID
- 187905
Objectifs d'apprentissage
- Résumez les mécanismes, les risques et les avantages potentiels de la thérapie génique
- Identifier les problèmes éthiques liés à la thérapie génique et aux agences de réglementation qui assurent la supervision des essais cliniques
- Comparez la thérapie génique des cellules somatiques et de la lignée germinale
De nombreux types de génie génétique ont apporté des avantages évidents avec peu de risques apparents. Peu de gens remettraient en question, par exemple, la valeur de notre approvisionnement désormais abondant en insuline humaine produite par des bactéries génétiquement modifiées. Cependant, de nombreuses applications émergentes du génie génétique sont beaucoup plus controversées, souvent parce que leurs avantages potentiels sont liés à des risques importants, réels ou perçus. C'est certainement le cas de la thérapie génique, une application clinique du génie génétique qui pourrait un jour permettre de guérir de nombreuses maladies, mais qui reste encore largement une approche expérimentale du traitement.
Mécanismes et risques de la thérapie génique
Les maladies humaines résultant de mutations génétiques sont souvent difficiles à traiter à l'aide de médicaments ou d'autres formes de thérapie traditionnelles, car les signes et symptômes de la maladie résultent d'anomalies du génome du patient. Par exemple, un patient peut présenter une mutation génétique qui empêche l'expression d'une protéine spécifique nécessaire au fonctionnement normal d'un type de cellule particulier. C'est le cas chez les patients atteints d'immunodéficience combinée sévère (SCID), une maladie génétique qui altère le fonctionnement de certains globules blancs essentiels au système immunitaire.
La thérapie génique vise à corriger les anomalies génétiques en introduisant un gène fonctionnel non muté dans le génome du patient. Le gène non muté code pour une protéine fonctionnelle que le patient ne serait pas en mesure de produire autrement. Des vecteurs viraux tels que l'adénovirus sont parfois utilisés pour introduire le gène fonctionnel ; une partie du génome viral est retirée et remplacée par le gène souhaité (Figure\(\PageIndex{1}\)). Des formes plus avancées de thérapie génique tentent de corriger la mutation au site d'origine du génome, comme c'est le cas pour le traitement du SCID.
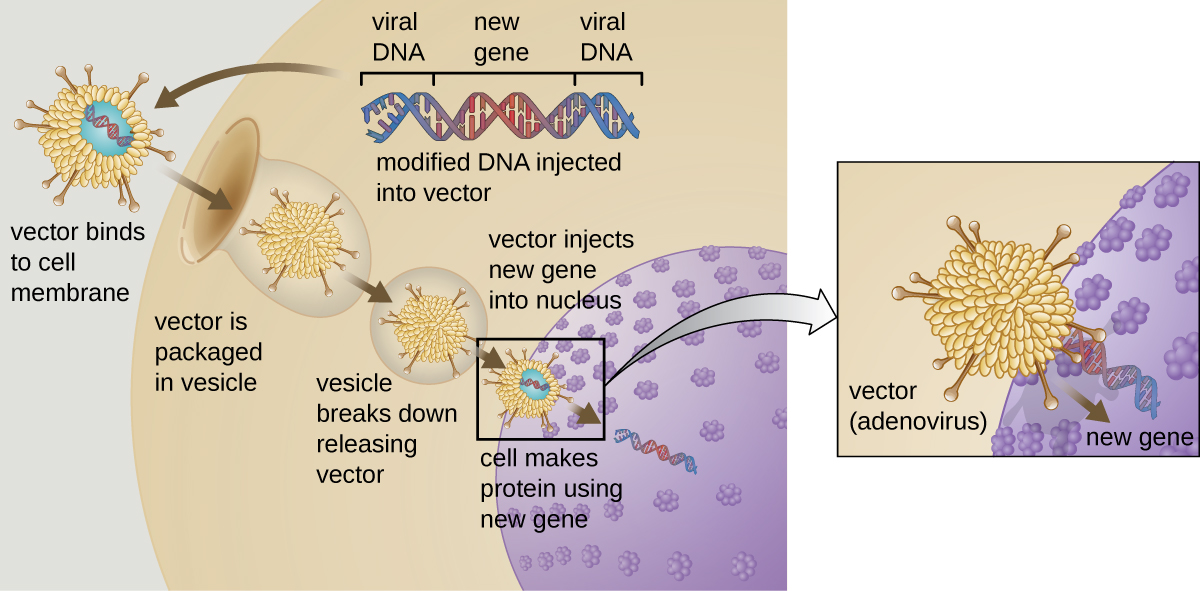
Jusqu'à présent, les thérapies géniques se sont révélées relativement inefficaces, à l'exception peut-être des traitements de la mucoviscidose et du déficit en adénosine désaminase, un type de SCID. D'autres essais ont montré les dangers évidents d'une tentative de manipulation génétique sur des organismes multicellulaires complexes tels que les humains. Chez certains patients, l'utilisation d'un vecteur adénoviral peut déclencher une réponse inflammatoire imprévue du système immunitaire, pouvant entraîner une défaillance organique. De plus, étant donné que les virus peuvent souvent cibler plusieurs types de cellules, le vecteur viral peut infecter des cellules non ciblées par le traitement, endommager ces autres cellules et éventuellement provoquer des maladies telles que le cancer. Un autre risque potentiel est que le virus modifié redevienne infectieux et cause une maladie chez le patient. Enfin, le gène inséré risque d'inactiver involontairement un autre gène important du génome du patient, perturbant ainsi le cycle cellulaire normal et pouvant entraîner la formation de tumeurs et le cancer. Étant donné que la thérapie génique comporte de nombreux risques, les candidats à la thérapie génique doivent être pleinement informés de ces risques avant de donner leur consentement éclairé à suivre le traitement.
La thérapie génique a mal tourné
Les risques de la thérapie génique ont été pris en compte en 1999 dans le cas de Jesse Gelsinger, un patient de 18 ans qui a reçu une thérapie génique dans le cadre d'un essai clinique à l'université de Pennsylvanie. Jesse a reçu une thérapie génique pour une maladie appelée déficit en ornithine transcarbamylase (OTC), qui entraîne une accumulation d'ammoniac dans le sang en raison d'un traitement déficient de l'ammoniac. Quatre jours après le traitement, Jesse est décédé des suites d'une réponse immunitaire massive au vecteur adénovirus. 1
Jusqu'alors, les chercheurs n'avaient pas vraiment considéré qu'une réponse immunitaire au vecteur constituait un risque légitime, mais après enquête, il semble que les chercheurs disposaient de certaines preuves suggérant qu'il s'agissait d'une issue possible. Avant le traitement de Jesse, plusieurs autres patients humains avaient souffert des effets secondaires du traitement, et trois singes utilisés dans un essai étaient décédés des suites d'une inflammation et de troubles de la coagulation. Malgré cette information, il semble que ni Jesse ni sa famille n'aient été informés de ces résultats lorsqu'ils ont consenti à la thérapie. Le décès de Jesse a été le premier patient à la suite d'un traitement de thérapie génique et a entraîné l'arrêt immédiat de l'essai clinique auquel il participait, l'arrêt ultérieur de tous les autres essais de thérapie génique à l'Université de Pennsylvanie et l'enquête sur tous les autres essais de thérapie génique dans le États-Unis. En conséquence, la réglementation et la supervision de la thérapie génique dans son ensemble ont été réexaminées, ce qui a donné lieu à de nouveaux protocoles réglementaires qui sont toujours en place aujourd'hui.
Exercice\(\PageIndex{1}\)
- Expliquez comment fonctionne la thérapie génique en théorie.
- Identifiez certains risques liés à la thérapie génique.
Supervision de la thérapie génique
À l'heure actuelle, les essais cliniques de thérapie génique font l'objet d'une surveillance importante. Au niveau fédéral, trois agences réglementent la thérapie génique en parallèle : la Food and Drug Administration (FDA), l'Office of Human Research Protection (OHRP) et le Comité consultatif sur l'ADN recombinant (RAC) des National Institutes of Health (NIH). Avec plusieurs agences locales, ces agences fédérales interagissent avec le comité d'examen institutionnel pour s'assurer que des protocoles sont en place pour protéger la sécurité des patients pendant les essais cliniques. Le respect de ces protocoles est assuré principalement au niveau local en coopération avec les agences fédérales. Les thérapies géniques font actuellement l'objet de l'examen fédéral et local le plus approfondi par rapport aux autres types de thérapies, qui font généralement l'objet d'un examen uniquement par la FDA. Certains chercheurs pensent que ces réglementations étendues entravent en fait les progrès de la recherche en thérapie génique. En 2013, l'Institute of Medicine (aujourd'hui la National Academy of Medicine) a demandé au NIH d'assouplir son examen des essais de thérapie génique dans la plupart des cas. 2 Cependant, garantir la sécurité des patients reste une préoccupation majeure.
Préoccupations éthiques
Au-delà des risques pour la santé liés à la thérapie génique, la capacité de modifier génétiquement les humains pose un certain nombre de problèmes éthiques liés aux limites de cette « thérapie ». Alors que les recherches actuelles se concentrent sur la thérapie génique pour les maladies génétiques, les scientifiques pourraient un jour appliquer ces méthodes pour manipuler d'autres traits génétiques considérés comme indésirables. Cela soulève des questions telles que :
Exercice\(\PageIndex{2}\)
- Quels traits génétiques méritent d'être « corrigés » ?
- La thérapie génique doit-elle être utilisée pour des raisons esthétiques ou pour améliorer les capacités humaines ?
- La manipulation génétique devrait-elle être utilisée pour transmettre des traits souhaitables à l'enfant à naître ?
- Tout le monde a-t-il droit à la thérapie génique ou le coût de la thérapie génique pourrait-il créer de nouvelles formes d'inégalité sociale ?
- Qui devrait être chargé de réglementer et de contrôler l'utilisation inappropriée des thérapies géniques ?
La capacité de modifier les cellules reproductrices à l'aide de la thérapie génique pourrait également générer de nouveaux dilemmes éthiques. À ce jour, les différents types de thérapies géniques ont été ciblés sur les cellules somatiques, c'est-à-dire les cellules non reproductrices du corps. Comme les caractères des cellules somatiques ne sont pas hérités, aucun changement génétique résultant de la thérapie génique à base de cellules somatiques ne serait transmis à la progéniture. Toutefois, si les scientifiques réussissent à introduire de nouveaux gènes dans les cellules germinales (ovules ou spermatozoïdes), les caractéristiques qui en résultent pourraient être transmises à la progéniture. Cette approche, appelée thérapie génique germinale, pourrait potentiellement être utilisée pour lutter contre les maladies héréditaires, mais elle pourrait également avoir des conséquences imprévues pour les générations futures. De plus, il y a la question du consentement éclairé, car les personnes touchées par la thérapie génique germinale ne sont pas encore nées et ne peuvent donc pas choisir de recevoir ou non le traitement. Pour ces raisons, le gouvernement américain ne finance pas actuellement de projets de recherche portant sur les thérapies géniques germinales chez l'homme.
Thérapies géniques
Bien qu'il n'existe actuellement aucune thérapie génique sur le marché aux États-Unis, de nombreuses thérapies sont en préparation et il est probable que certaines seront finalement approuvées. Compte tenu des récents progrès des thérapies géniques ciblant le gène p53, dont les mutations des cellules somatiques sont impliquées dans plus de 50 % des cancers humains, 3 traitements du cancer par thérapies géniques pourraient devenir beaucoup plus répandus une fois qu'ils seront commercialisés.
La mise sur le marché de tout nouveau traitement soulève des questions éthiques qui mettent en balance les bénéfices attendus et les risques. À quelle vitesse les nouvelles thérapies doivent-elles être mises sur le marché ? Comment pouvons-nous nous assurer que les nouvelles thérapies ont été suffisamment testées en termes de sécurité et d'efficacité avant d'être commercialisées auprès du public ? Le processus par lequel de nouvelles thérapies sont développées et approuvées complique ces questions, car les personnes impliquées dans le processus d'approbation sont souvent soumises à de fortes pressions pour obtenir l'approbation d'un nouveau traitement, même en présence de risques importants.
Pour obtenir l'approbation de la FDA pour un nouveau traitement, les chercheurs doivent recueillir des données de laboratoire importantes issues d'essais sur des animaux et soumettre une demande de nouveau médicament expérimental (IND) au Center for Drug Evaluation and Research (CDER) de la FDA. Après une période d'attente de 30 jours pendant laquelle la FDA examine l'IND, des essais cliniques impliquant des sujets humains peuvent commencer. Si la FDA perçoit un problème avant ou pendant l'essai clinique, elle peut ordonner une « suspension clinique » jusqu'à ce que tout problème soit résolu. Au cours des essais cliniques, les chercheurs collectent et analysent des données sur l'efficacité et la sécurité du traitement, y compris les effets secondaires observés. Une fois que le traitement répond aux normes de la FDA en matière d'efficacité et de sécurité, les développeurs peuvent soumettre une demande de nouveau médicament (NDA) détaillant la manière dont le traitement sera fabriqué, emballé, surveillé et administré.
Les nouvelles thérapies géniques étant souvent le résultat de nombreuses années (voire des décennies) de recherche en laboratoire et clinique, elles nécessitent un investissement financier important. Lorsque le traitement atteint le stade des essais cliniques, les enjeux financiers sont élevés pour les sociétés pharmaceutiques et leurs actionnaires. Cela crée des conflits d'intérêts potentiels qui peuvent parfois affecter le jugement objectif des chercheurs, de leurs bailleurs de fonds et même des participants aux essais. L'affaire Jesse Gelsinger (voir Case in Point : Gene Therapy Gone Wrong) en est un exemple classique. Confronté à une maladie potentiellement mortelle et à l'absence de traitement raisonnable, il est facile de comprendre pourquoi un patient peut être impatient de participer à un essai clinique, quels que soient les risques. Il est également facile de comprendre comment un chercheur pourrait considérer les risques à court terme pour un petit groupe de participants à l'étude comme un petit prix à payer pour les avantages potentiels d'un nouveau traitement révolutionnaire.
Le décès de Gelsinger a entraîné une surveillance accrue de la thérapie génique, et les résultats négatifs ultérieurs de la thérapie génique ont entraîné l'arrêt temporaire des essais cliniques dans l'attente d'une enquête plus approfondie. Par exemple, lorsque des enfants français traités par thérapie génique pour le SCID ont commencé à développer une leucémie plusieurs années après le traitement, la FDA a temporairement arrêté les essais cliniques de types similaires de thérapie génique menés aux États-Unis. 4 De tels cas mettent en évidence la nécessité pour les chercheurs et les professionnels de santé non seulement de valoriser le bien-être humain et les droits des patients par rapport à la rentabilité, mais également de maintenir l'objectivité scientifique lors de l'évaluation des risques et des avantages des nouvelles thérapies.
Exercice\(\PageIndex{3}\)
- Pourquoi la recherche en thérapie génique est-elle si étroitement réglementée ?
- Quelle est la principale préoccupation éthique associée à la thérapie génique germinale ?
Concepts clés et résumé
- Bien que la thérapie génique soit très prometteuse pour le traitement des maladies génétiques, elle comporte également des risques importants.
- Il existe une réglementation fédérale et locale considérable concernant le développement de thérapies géniques par les sociétés pharmaceutiques destinées à être utilisées chez l'homme.
- Avant que l'utilisation de la thérapie génique ne puisse augmenter de façon spectaculaire, de nombreuses questions éthiques doivent être abordées par les communautés médicales et de recherche, les politiciens et la société dans son ensemble.
Notes
- 1 Barbara Sibbald. « La mort, mais une conséquence imprévue d'un essai de thérapie génique. » Journal 164 de l'Association médicale canadienne n° 11 (2001) : 1612—1612.
- 2 Kerry Greens. « Rapport : Ease Gene Therapy Reviews. » The Scientist, 9 décembre 2013. http://www.the-scientist.com/?articl...erapy-Reviews/. Consulté le 27 mai 2016.
- 3 Zhen Wang et Yi Sun. « Cibler la p53 pour une nouvelle thérapie anticancéreuse. » Oncologie translationnelle 3, no 1 (2010) : 1—12.
- 4 Erika Check. « La thérapie génique : un revers tragique. » Nature 420 n° 6912 (2002) : 116—118.


