12.3 : Méthodes du génome entier et applications industrielles
- Page ID
- 187900
Objectifs d'apprentissage
- Expliquer les utilisations des analyses comparatives à l'échelle du génome
- Résumez les avantages des produits pharmaceutiques génétiquement modifiés
Les progrès de la biologie moléculaire ont conduit à la création de domaines scientifiques entièrement nouveaux. Parmi ceux-ci figurent des domaines qui étudient les aspects du génome entier, collectivement appelés méthodes du génome entier. Dans cette section, nous allons donner un bref aperçu des domaines du génome entier que sont la génomique, la transcriptomique et la protéomique.
Génomique, transcriptomique et protéomique
L'étude et la comparaison de génomes entiers, y compris de l'ensemble complet des gènes, de leur séquence nucléotidique et de leur organisation, s'appellent la génomique. Ce domaine présente un grand potentiel pour les avancées médicales futures grâce à l'étude du génome humain ainsi que des génomes des organismes infectieux. L'analyse des génomes microbiens a contribué au développement de nouveaux antibiotiques, outils de diagnostic, vaccins, traitements médicaux et techniques de nettoyage de l'environnement.
Le domaine de la transcriptomique est la science de l'ensemble des molécules d'ARNm produites par les cellules. Les scientifiques comparent les modèles d'expression génique entre des cellules hôtes infectées et non infectées, obtenant ainsi des informations importantes sur les réponses cellulaires aux maladies infectieuses. De plus, la transcriptomique peut être utilisée pour surveiller l'expression génique des facteurs de virulence dans les microorganismes, aidant ainsi les scientifiques à mieux comprendre les processus pathogènes de ce point de vue.
Lorsque la génomique et la transcriptomique sont appliquées à des communautés microbiennes entières, nous utilisons les termes métagénomique et métatranscriptomique, respectivement. La métagénomique et la métatranscriptomique permettent aux chercheurs d'étudier les gènes et l'expression génique d'un ensemble d'espèces multiples, dont beaucoup ne peuvent pas être facilement cultivées ou cultivées du tout en laboratoire. Un microréseau à ADN (discuté dans la section précédente) peut être utilisé dans les études métagénomiques.
Une autre application clinique prometteuse de la génomique et de la transcriptomique est la pharmacogénomique, également appelée toxicogénomique, qui consiste à évaluer l'efficacité et la sécurité des médicaments sur la base d'informations provenant de la séquence génomique d'un individu. Les réponses génomiques aux médicaments peuvent être étudiées à l'aide d'animaux de laboratoire (tels que des rats ou des souris de laboratoire) ou de cellules vivantes en laboratoire avant d'entreprendre des études sur des humains. Les modifications de l'expression génique en présence d'un médicament peuvent parfois être un indicateur précoce du potentiel d'effets toxiques. Les informations sur les séquences génomiques personnelles pourraient un jour être utilisées pour prescrire les médicaments les plus efficaces et les moins toxiques en fonction du génotype de chaque patient.
L'étude de la protéomique est une extension de la génomique qui permet aux scientifiques d'étudier l'ensemble des protéines d'un organisme, appelé protéome. Même si toutes les cellules d'un organisme multicellulaire possèdent le même ensemble de gènes, les cellules de divers tissus produisent différents ensembles de protéines. Ainsi, le génome est constant, mais le protéome varie et est dynamique au sein d'un organisme. La protéomique peut être utilisée pour étudier quelles protéines sont exprimées dans diverses conditions au sein d'un même type de cellule ou pour comparer les modèles d'expression des protéines entre différents organismes.
La maladie la plus importante étudiée à l'aide d'approches protéomiques est le cancer, mais ce domaine d'étude s'applique également aux maladies infectieuses. Des recherches sont actuellement en cours pour examiner la faisabilité de l'utilisation d'approches protéomiques pour diagnostiquer divers types d'hépatite, de tuberculose et d'infection par le VIH, qui sont assez difficiles à diagnostiquer à l'aide des techniques actuellement disponibles. 1
Une analyse protéomique récente et en développement repose sur l'identification de protéines appelées biomarqueurs, dont l'expression est affectée par le processus pathologique. Des biomarqueurs sont actuellement utilisés pour détecter diverses formes de cancer ainsi que des infections causées par des agents pathogènes tels que Yersinia pestis et le virus Vaccinia. 2
Les autres sciences « omiques » liées à la génomique et à la protéomique incluent la métabolomique, la glycomique et la lipidomique, qui se concentrent sur l'ensemble complet des métabolites à petites molécules, des sucres et des lipides, respectivement, présents dans une cellule. Grâce à ces différentes approches mondiales, les scientifiques continuent de collecter, de compiler et d'analyser de grandes quantités d'informations génétiques. Ce domaine émergent de la bioinformatique peut être utilisé, parmi de nombreuses autres applications, pour trouver des indices pour traiter des maladies et comprendre le fonctionnement des cellules.
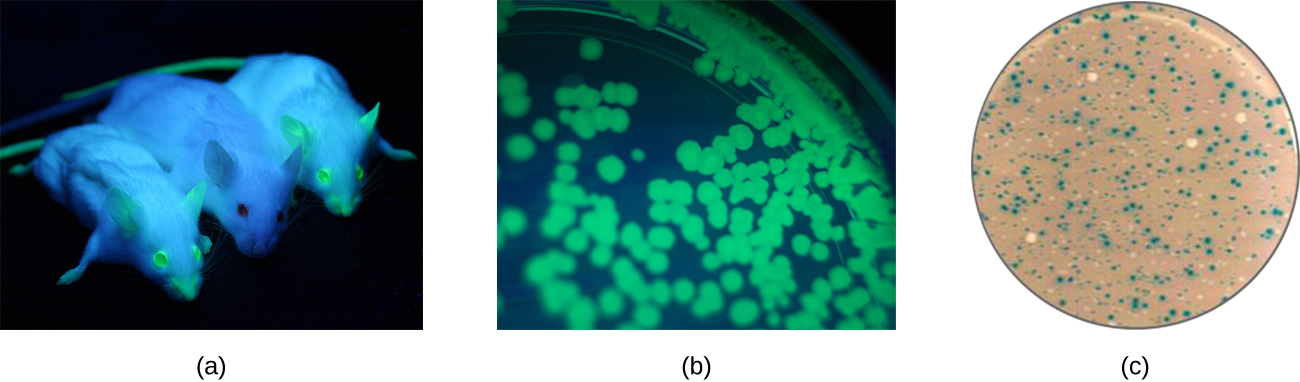
De plus, les chercheurs peuvent utiliser la génétique inverse, une technique liée à l'analyse mutationnelle classique, pour déterminer la fonction de gènes spécifiques. Les méthodes classiques d'étude de la fonction des gènes impliquaient de rechercher les gènes responsables d'un phénotype donné. La génétique inverse utilise l'approche inverse, en commençant par une séquence d'ADN spécifique et en tentant de déterminer le phénotype qu'elle produit. Les scientifiques peuvent également associer des gènes connus (appelés gènes rapporteurs) qui codent des caractéristiques facilement observables à des gènes d'intérêt, et la localisation de l'expression de tels gènes d'intérêt peut être facilement surveillée. Cela fournit au chercheur des informations importantes sur ce que pourrait faire le produit génique ou sur sa localisation dans l'organisme. Les gènes rapporteurs courants incluent la bactérie LacZ, qui code pour la bêta-galactosidase et dont l'activité peut être surveillée par des changements de couleur des colonies en présence de X-gal, comme décrit précédemment, et le gène codant pour la protéine fluorescente verte (GFP) de méduse dont l'activité peut être visualisée dans des colonies exposées à la lumière ultraviolette (Figure\(\PageIndex{1}\)).
Exercice\(\PageIndex{1}\)
- En quoi la génomique diffère-t-elle de la génétique traditionnelle ?
- Si vous vouliez étudier la façon dont deux cellules différentes du corps réagissent à une infection, quel domaine de l'omique utiliseriez-vous ?
- À quoi servent les biomarqueurs découverts en protéomique ?
Orientation clinique : résolution
Les symptômes de Kayla étant suffisamment persistants et graves pour nuire à ses activités quotidiennes, le médecin de Kayla a décidé de prescrire des tests de laboratoire. Le médecin a prélevé des échantillons de sang, de liquide céphalorachidien (LCR) et de liquide synovial (provenant de l'un de ses genoux enflés) de Kayla et a demandé une analyse par PCR sur les trois échantillons. Les tests de PCR effectués sur le LCR et le liquide synovial se sont révélés positifs pour détecter la présence de Borrelia burgdorferi, la bactérie responsable de la maladie de Lyme.
Le médecin de Kayla a immédiatement prescrit un traitement complet de l'antibiotique doxycycline. Heureusement, Kayla s'est complètement rétablie en quelques semaines et n'a pas souffert des symptômes à long terme du syndrome de la maladie de Lyme (PTLDS) après le traitement, qui touche 10 à 20 % des patients atteints de la maladie de Lyme. Pour prévenir de futures infections, le médecin de Kayla lui a conseillé d'utiliser un insectifuge et de porter des vêtements de protection lors de ses aventures en plein air. Ces mesures peuvent limiter l'exposition aux tiques porteuses de Lyme, qui sont courantes dans de nombreuses régions des États-Unis pendant les mois les plus chauds de l'année. On a également conseillé à Kayla de prendre l'habitude de s'examiner elle-même pour détecter la présence de tiques à son retour d'activités de plein air, car le retrait rapide d'une tique réduit considérablement les risques d'infection.
La maladie de Lyme est souvent difficile à diagnostiquer. B. burgdorferi n'est pas facile à cultiver en laboratoire et les premiers symptômes peuvent être très légers et ressembler à ceux de nombreuses autres maladies. Mais s'ils ne sont pas traités, les symptômes peuvent devenir très graves et débilitants. Outre deux tests d'anticorps, qui n'ont pas été concluants dans le cas de Kayla, et le test PCR, un Southern blot a pu être utilisé avec des sondes d'ADN spécifiques à B. burgdorferi pour identifier l'ADN du pathogène. Le séquençage des gènes des protéines de surface des espèces de Borrelia est également utilisé pour identifier les souches au sein de l'espèce qui peuvent être transmises plus facilement à l'homme ou provoquer des maladies plus graves.
Technologie de l'ADN recombinant et production pharmaceutique
Le génie génétique a permis de créer de nouveaux produits pharmaceutiques appelés produits pharmaceutiques à ADN recombinant. Ces produits comprennent des antibiotiques, des vaccins et des hormones utilisés pour traiter diverses maladies. Le\(\PageIndex{1}\) tableau présente des exemples de produits d'ADN recombinant et leurs utilisations.
Par exemple, les voies naturelles de synthèse des antibiotiques de diverses espèces de Streptomyces, connues depuis longtemps pour leurs capacités de production d'antibiotiques, peuvent être modifiées afin d'améliorer les rendements ou de créer de nouveaux antibiotiques grâce à l'introduction de gènes codant pour des enzymes supplémentaires. Plus de 200 nouveaux antibiotiques ont été produits grâce à l'inactivation ciblée de gènes et à la nouvelle combinaison de gènes de synthèse d'antibiotiques chez des hôtes de Streptomyces producteurs d'antibiotiques. 3
Le génie génétique est également utilisé pour fabriquer des vaccins sous-unitaires, qui sont plus sûrs que les autres vaccins car ils ne contiennent qu'une seule molécule antigénique et ne contiennent aucune partie du génome du pathogène (voir Vaccins). Par exemple, un vaccin contre l'hépatite B est créé en insérant un gène codant pour une protéine de surface de l'hépatite B dans une levure ; la levure produit ensuite cette protéine, que le système immunitaire humain reconnaît comme un antigène. L'antigène de l'hépatite B est purifié à partir de cultures de levures et administré aux patients sous forme de vaccin. Même si le vaccin ne contient pas le virus de l'hépatite B, la présence de la protéine antigénique stimule le système immunitaire à produire des anticorps qui protégeront le patient contre le virus en cas d'exposition. 4 5
Le génie génétique a également joué un rôle important dans la production d'autres protéines thérapeutiques, telles que l'insuline, les interférons et l'hormone de croissance humaine, pour traiter diverses maladies humaines. Par exemple, à une époque, il était possible de traiter le diabète uniquement en administrant de l'insuline porcine aux patients, ce qui provoquait des réactions allergiques dues à de petites différences entre les protéines exprimées dans l'insuline humaine et porcine. Cependant, depuis 1978, la technologie de l'ADN recombinant est utilisée pour produire de grandes quantités d'insuline humaine à l'aide d'E. coli selon un procédé relativement peu coûteux qui permet d'obtenir un produit pharmaceutique plus efficace de manière constante. Les scientifiques ont également modifié génétiquement des E. coli capables de produire de l'hormone de croissance humaine (HGH), utilisée pour traiter les troubles de la croissance chez les enfants et certains autres troubles chez les adultes. Le gène HGH a été cloné à partir d'une banque d'ADNc et inséré dans des cellules d'E. coli par clonage dans un vecteur bactérien. À terme, le génie génétique sera utilisé pour produire des vaccins à ADN et diverses thérapies géniques, ainsi que des médicaments personnalisés pour lutter contre le cancer et d'autres maladies.
| Produit d'ADN recombinant | Demande |
|---|---|
| Peptide natriurétique auriculaire | Traitement des maladies du cœur (p. ex. insuffisance cardiaque congestive), des maladies rénales, de l'hypertension |
| ADNase | Traitement des sécrétions pulmonaires visqueuses dans la mucoviscidose |
| Érythropoïétine | Traitement de l'anémie sévère avec atteinte rénale |
| Facteur VIII | Traitement de l'hémophilie |
| vaccin contre l'hépatite B | Prévention de l'infection par l'hépatite B |
| Hormone de croissance humaine | Traitement du déficit en hormone de croissance, du syndrome de Turner, des brûlures |
| Insuline humaine | Traitement du diabète |
| Interférons | Traitement de la sclérose en plaques, de divers cancers (par exemple, le mélanome), des infections virales (par exemple, les hépatites B et C) |
| Tétracénomycines | Utilisés comme antibiotiques |
| Activateur tissulaire du plasminogène | Traitement de l'embolie pulmonaire lors d'un accident vasculaire cérébral ischémique, d'un infarctus du myocarde |
Exercice\(\PageIndex{2}\)
- Quelle bactérie a été génétiquement modifiée pour produire de l'insuline humaine pour le traitement du diabète ?
- Expliquer comment les microorganismes peuvent être modifiés pour produire des vaccins.
Technologie d'interférence ARN
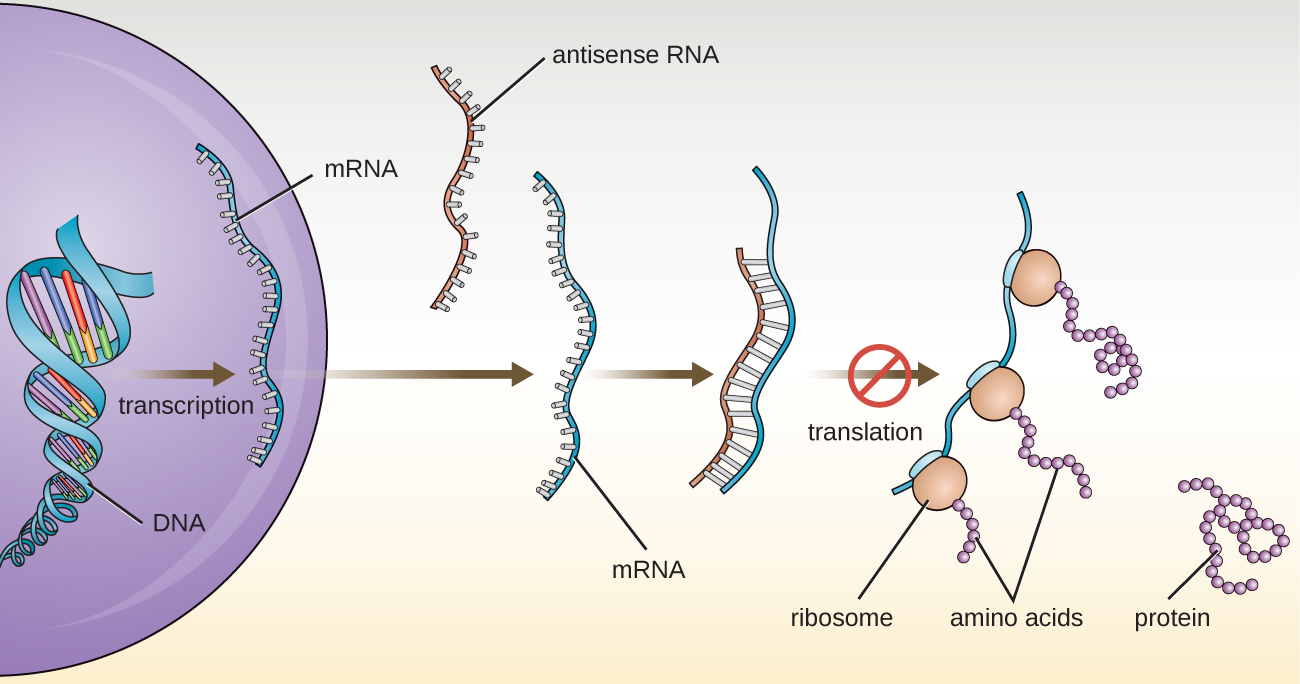
Dans Structure et fonction de l'ARN, nous avons décrit la fonction de l'ARNm, de l'ARNr et de l'ARNt. Outre ces types d'ARN, les cellules produisent également plusieurs types de petites molécules d'ARN non codantes qui sont impliquées dans la régulation de l'expression des gènes. Il s'agit notamment des molécules d'ARN antisens, qui sont complémentaires des régions de molécules d'ARNm spécifiques présentes à la fois dans les procaryotes et les cellules eucaryotes. Les molécules d'ARN non codantes jouent un rôle majeur dans l'interférence ARN (ARNi), un mécanisme de régulation naturel qui empêche les molécules d'ARNm de guider la synthèse des protéines. L'interférence de gènes spécifiques par l'ARN résulte de l'appariement de bases de molécules d'ARN antisens courtes et monocaténaires à des régions au sein de molécules d'ARNm complémentaires, empêchant ainsi la synthèse des protéines. Les cellules utilisent l'interférence de l'ARN pour se protéger de l'invasion virale, qui peut introduire des molécules d'ARN double brin dans le cadre du processus de réplication virale (Figure\(\PageIndex{2}\)).
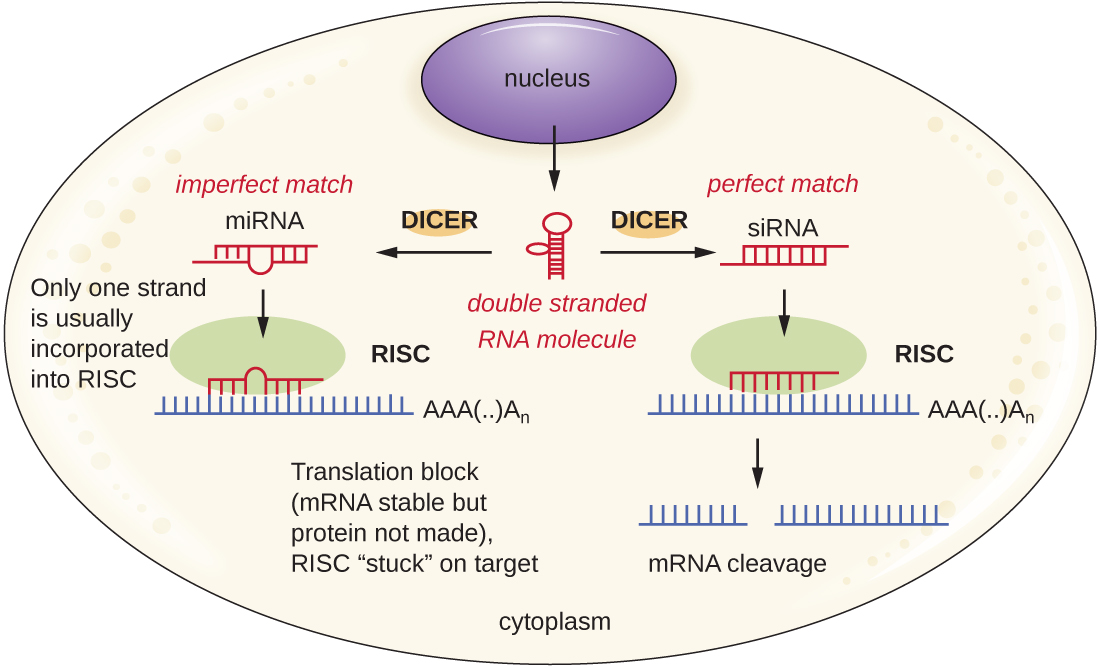
Les chercheurs développent actuellement des techniques pour imiter le processus naturel d'interférence de l'ARN afin de traiter les infections virales dans les cellules eucaryotes. La technologie d'interférence ARN implique l'utilisation de petits ARN interférents (siRNA) ou microARN (miARN) (Figure\(\PageIndex{3}\)). Les siRNA sont complètement complémentaires du transcrit d'ARNm d'un gène d'intérêt spécifique, tandis que les miARN sont pour la plupart complémentaires. Ces ARN bicaténaires sont liés à DICER, une endonucléase qui divise l'ARN en molécules courtes (environ 20 nucléotides de long). Les ARN sont ensuite liés au complexe de silençage induit par l'ARN (RISC), une ribonucléoprotéine. Le complexe siRNA-RISC se lie à l'ARNm et le clive. Pour le miRNA, un seul des deux brins se lie au RISC. Le complexe miRNA-RISC se lie ensuite à l'ARNm, inhibant ainsi la traduction. Si le miARN est complètement complémentaire du gène cible, l'ARNm peut être clivé. Pris ensemble, ces mécanismes sont connus sous le nom de silençage génique.
Concepts clés et résumé
- La science de la génomique permet aux chercheurs d'étudier les organismes à un niveau holistique et possède de nombreuses applications d'intérêt médical.
- La transcriptomique et la protéomique permettent aux chercheurs de comparer les modèles d'expression génique entre différentes cellules et s'avèrent très prometteuses pour mieux comprendre les réponses globales à diverses conditions.
- Les différentes technologies —omics se complètent et fournissent ensemble une image plus complète de l'état d'un organisme ou d'une communauté microbienne (métagénomique).
- L'analyse requise pour les grands ensembles de données produits par la génomique, la transcriptomique et la protéomique a conduit à l'émergence de la bioinformatique.
- Les gènes rapporteurs codant des caractéristiques facilement observables sont couramment utilisés pour suivre les modèles d'expression génique de gènes dont la fonction est inconnue.
- L'utilisation de la technologie de l'ADN recombinant a révolutionné l'industrie pharmaceutique, permettant la production rapide de produits pharmaceutiques à base d'ADN recombinant de haute qualité utilisés pour traiter une grande variété de maladies humaines.
- La technologie d'interférence ARN est très prometteuse en tant que méthode de traitement des infections virales en réduisant au silence l'expression de gènes spécifiques.
Notes
- 1 E.O. List, D.E. Berryman, B. Bower, L. Sackmann-Sala, E. Gosney, J. Ding, S. Okada et J.J. Kopchick. « L'utilisation de la protéomique pour étudier les maladies infectieuses. » Troubles infectieux-cibles médicamenteux (anciennement cibles médicamenteuses actuelles - troubles infectieux) 8 no 1 (2008) : 31—45.
- 2 Mohan Natesan et Robert G. Ulrich. « Microréseaux de protéines et biomarqueurs des maladies infectieuses ». Journal international des sciences moléculaires 11 n° 12 (2010) : 5165—5183.
- 3 José-Luis Adrio et Arnold L. Demain. « Organismes recombinants pour la production de produits industriels. » Bioengineering Bugs 1 no 2 (2010) : 116—131.
- 4 Département de la santé et des services sociaux des États-Unis. « Types de vaccins ». 2013. www.vaccines.gov/more_info/types/ #subunit. Consulté le 27 mai 2016.
- 5 La liste des médicaments sur Internet. Recombivax. 2015. http://www.rxlist.com/recombivax-drug.htm. Consulté le 27 mai 2016.


