11.7 : Régulation des gènes - Théorie des opérons
- Page ID
- 187667
Objectifs d'apprentissage
- Comparez les opérons inductibles et les opérons répressibles
- Décrire pourquoi la régulation des opérons est importante
Chaque cellule nucléée d'un organisme multicellulaire contient des copies du même ADN. De même, toutes les cellules de deux cultures bactériennes pures inoculées à partir de la même colonie de départ contiennent le même ADN, à l'exception des modifications résultant de mutations spontanées. Si chaque cellule d'un organisme multicellulaire possède le même ADN, comment se fait-il que les cellules des différentes parties du corps de l'organisme présentent des caractéristiques différentes ? De même, comment se fait-il que les mêmes cellules bactériennes présentes dans deux cultures pures exposées à des conditions environnementales différentes puissent présenter des phénotypes différents ? Dans les deux cas, chaque cellule génétiquement identique n'active pas ou n'exprime pas le même ensemble de gènes. Seul un sous-ensemble de protéines présentes dans une cellule à un moment donné est exprimé.
L'ADN génomique contient à la fois des gènes structuraux, qui codent des produits qui servent de structures cellulaires ou d'enzymes, et des gènes régulateurs, qui codent des produits qui régulent l'expression des gènes. L'expression d'un gène est un processus hautement régulé. Alors que la régulation de l'expression génique dans les organismes multicellulaires permet la différenciation cellulaire, dans les organismes unicellulaires tels que les procaryotes, elle garantit principalement que les ressources d'une cellule ne sont pas gaspillées pour produire des protéines dont la cellule n'a pas besoin à ce moment-là.
Il est important d'élucider les mécanismes qui contrôlent l'expression des gènes pour comprendre la santé humaine. Les dysfonctionnements de ce processus chez l'homme entraînent le développement de cancers et d'autres maladies. Il est important de comprendre l'interaction entre l'expression génique d'un agent pathogène et celle de son hôte humain pour comprendre une maladie infectieuse particulière. La régulation génique implique un réseau complexe d'interactions au sein d'une cellule donnée entre les signaux provenant de l'environnement de la cellule, les molécules de signalisation présentes dans la cellule et l'ADN de la cellule. Ces interactions mènent à l'expression de certains gènes et à la suppression d'autres, selon les circonstances.
Les procaryotes et les eucaryotes partagent certaines similitudes dans leurs mécanismes de régulation de l'expression génique ; toutefois, l'expression génique chez les eucaryotes est plus compliquée en raison de la séparation temporelle et spatiale entre les processus de transcription et de traduction. Ainsi, bien que la majeure partie de la régulation de l'expression génique se fasse par le contrôle transcriptionnel chez les procaryotes, la régulation de l'expression génique chez les eucaryotes se fait au niveau transcriptionnel et post-transcriptionnel (après la réalisation du transcrit primaire).
Régulation des gènes procaryotes
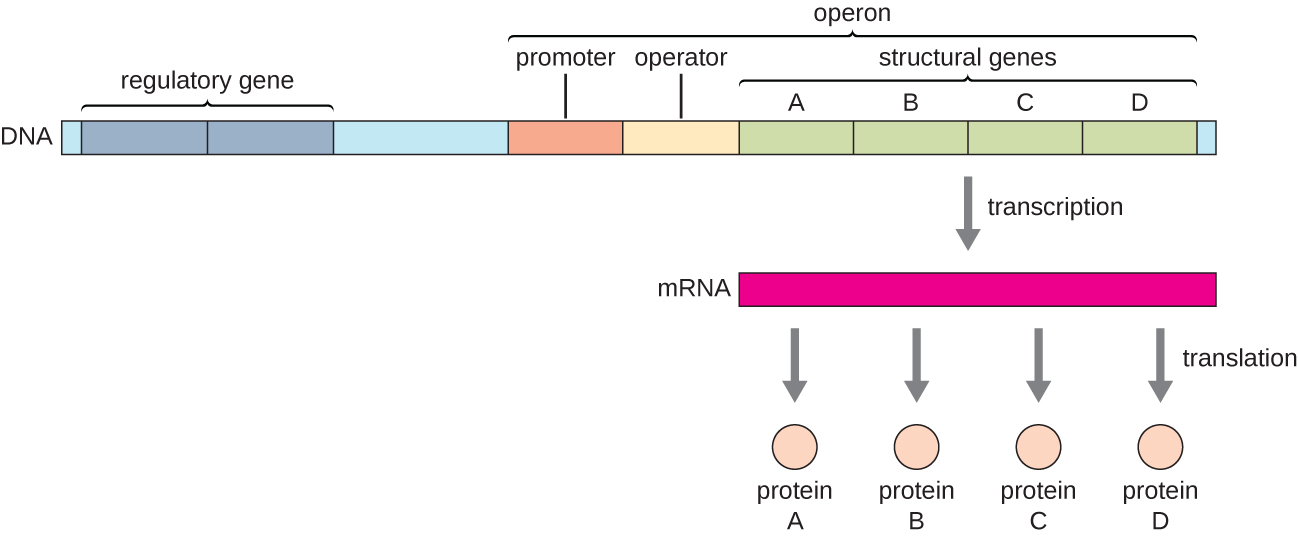
Chez les bactéries et les archées, les protéines structurales ayant des fonctions connexes sont généralement codées ensemble au sein du génome dans un bloc appelé opéron et sont transcrites ensemble sous le contrôle d'un seul promoteur, ce qui entraîne la formation d'un transcrit polycistronique (Figure\(\PageIndex{1}\)). Ainsi, la régulation de la transcription de tous les gènes structuraux codant les enzymes qui catalysent les nombreuses étapes d'une même voie biochimique peut être contrôlée simultanément, car soit ils seront tous nécessaires en même temps, soit aucun ne sera nécessaire. Par exemple, chez E. coli, tous les gènes structuraux qui codent les enzymes nécessaires à l'utilisation du lactose comme source d'énergie se trouvent côte à côte dans l'opéron du lactose (ou lac) sous le contrôle d'un seul promoteur, le promoteur lac. Les scientifiques français François Jacob (1920-2013) et Jacques Monod de l'Institut Pasteur ont été les premiers à montrer l'organisation des gènes bactériens en opérons, à travers leurs études sur l'opéron lac d'E. coli. Pour ce travail, ils ont remporté le prix Nobel de physiologie ou de médecine en 1965. Bien que les gènes eucaryotes ne soient pas organisés en opérons, les opérons procaryotes constituent d'excellents modèles pour en savoir plus sur la régulation génique en général. Certains groupes de gènes chez les eucaryotes fonctionnent de la même manière que les opérons. De nombreux principes peuvent être appliqués aux systèmes eucaryotes et contribuent à notre compréhension des modifications de l'expression génique chez les eucaryotes qui peuvent entraîner des changements pathologiques tels que le cancer.
Chaque opéron comprend des séquences d'ADN qui influencent sa propre transcription ; celles-ci sont situées dans une région appelée région régulatrice. La région régulatrice comprend le promoteur et la région entourant le promoteur, auxquels peuvent se lier des facteurs de transcription, des protéines codées par des gènes régulateurs. Les facteurs de transcription influencent la liaison de l'ARN polymérase au promoteur et permettent sa progression vers la transcription des gènes structuraux. Un répresseur est un facteur de transcription qui supprime la transcription d'un gène en réponse à un stimulus externe en se liant à une séquence d'ADN située dans la région régulatrice appelée opérateur, située entre le site de liaison de l'ARN polymérase du promoteur et le site de départ transcriptionnel du premier gène structural. La liaison au répresseur empêche physiquement l'ARN polymérase de transcrire les gènes structuraux. Inversement, un activateur est un facteur de transcription qui augmente la transcription d'un gène en réponse à un stimulus externe en facilitant la liaison de l'ARN polymérase au promoteur. Un inducteur, troisième type de molécule régulatrice, est une petite molécule qui active ou réprime la transcription en interagissant avec un répresseur ou un activateur.
Chez les procaryotes, il existe des exemples d'opérons dont les produits géniques sont requis de manière assez constante et dont l'expression n'est donc pas régulée. Ces opérons sont exprimés de manière constitutive, c'est-à-dire qu'ils sont transcrits et traduits en continu pour fournir à la cellule des niveaux intermédiaires constants de produits protéiques. Ces gènes codent des enzymes impliquées dans les fonctions ménagères nécessaires au maintien des cellules, y compris la réplication, la réparation et l'expression de l'ADN, ainsi que des enzymes impliquées dans le métabolisme central. En revanche, il existe d'autres opérons procaryotes qui ne sont exprimés que lorsque cela est nécessaire et qui sont régulés par des répresseurs, des activateurs et des inducteurs.
Exercice\(\PageIndex{1}\)
- Quelles sont les parties de la séquence d'ADN d'un opéron ?
- Quels sont les types de molécules régulatrices ?
Régulation par la répression
Les opérons procaryotes sont généralement contrôlés par la liaison de répresseurs à des régions opératrices, empêchant ainsi la transcription des gènes structuraux. Ces opérons sont classés en opérons répressibles ou en opérons inductibles. Les opérons répressibles, tels que l'opéron du tryptophane (trp), contiennent généralement des gènes codant des enzymes nécessaires à une voie de biosynthèse. Tant que le produit de la voie, comme le tryptophane, continue d'être requis par la cellule, un opéron répressible continuera à être exprimé. Cependant, lorsque le produit de la voie de biosynthèse commence à s'accumuler dans la cellule, éliminant ainsi la nécessité pour la cellule de continuer à en fabriquer davantage, l'expression de l'opéron est réprimée. À l'inverse, les opérons inductibles, comme l'opéron lac d'E. coli, contiennent souvent des gènes codant des enzymes dans une voie impliquée dans le métabolisme d'un substrat spécifique tel que le lactose. Ces enzymes ne sont nécessaires que lorsque ce substrat est disponible, de sorte que l'expression des opérons n'est généralement induite qu'en présence du substrat.
L'opération piège : une opération répressible
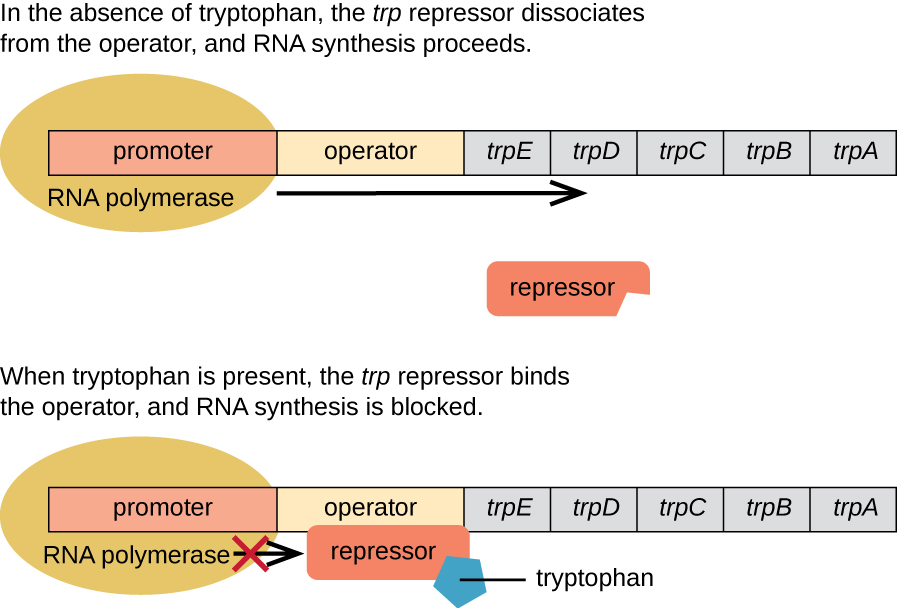
E. coli peut synthétiser le tryptophane à l'aide d'enzymes codées par cinq gènes structuraux situés côte à côte dans l'opéron trp (Figure\(\PageIndex{2}\)). Lorsque le taux de tryptophane dans l'environnement est bas, l'opéron est activé. Cela signifie que la transcription est initiée, que les gènes sont exprimés et que le tryptophane est synthétisé. Toutefois, si du tryptophane est présent dans l'environnement, l'opéron trp est désactivé. La transcription n'a pas lieu et le tryptophane n'est pas synthétisé.
Lorsque le tryptophane n'est pas présent dans la cellule, le répresseur lui-même ne se lie pas à l'opérateur ; par conséquent, l'opéron est actif et le tryptophane est synthétisé. Cependant, lorsque le tryptophane s'accumule dans la cellule, deux molécules de tryptophane se lient à la molécule répressive du trp, qui change de forme, lui permettant de se lier à l'opérateur trp. Cette liaison de la forme active du répresseur trp à l'opérateur empêche l'ARN polymérase de transcrire les gènes structuraux, arrêtant ainsi l'expression de l'opéron. Ainsi, le produit réel de la voie de biosynthèse contrôlée par l'opéron régule l'expression de l'opéron.
Regardez cette vidéo pour en savoir plus sur l'opéron trp.
L'opéron de lac : un opéron inductible
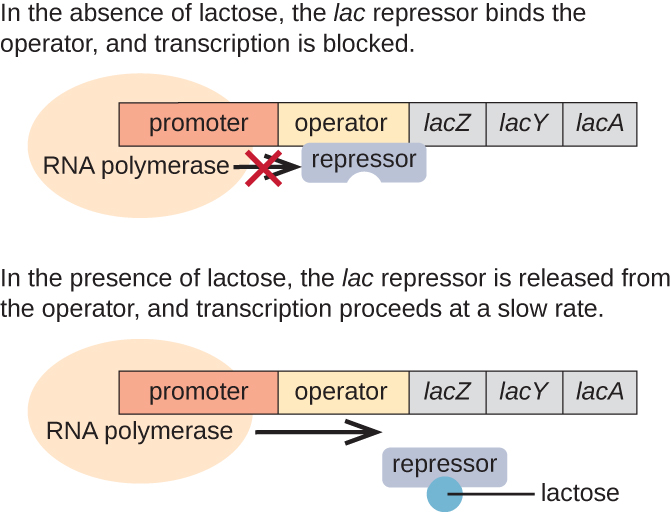
L'opéron lac est un exemple d'opéron inductible qui est également sujet à activation en l'absence de glucose (Figure\(\PageIndex{3}\)). L'opéron lac code trois gènes structuraux nécessaires à l'acquisition et à la transformation du lactose disaccharide présent dans l'environnement et à sa décomposition en sucres simples, le glucose et le galactose. Pour que l'opéron lac soit exprimé, le lactose doit être présent. Cela est logique pour la cellule, car créer les enzymes nécessaires à la transformation du lactose serait un gaspillage d'énergie si le lactose n'était pas disponible.
En l'absence de lactose, le répresseur lac est lié à la région opératrice de l'opéron lac, empêchant physiquement l'ARN polymérase de transcrire les gènes structuraux. Cependant, lorsque du lactose est présent, le lactose à l'intérieur de la cellule est converti en allolactose. L'allolactose sert de molécule inductrice, se liant au répresseur et modifiant sa forme de telle sorte qu'il ne soit plus capable de se lier à l'ADN de l'opérateur. L'élimination du répresseur en présence de lactose permet à l'ARN polymérase de se déplacer dans la région opératrice et de commencer la transcription des gènes structuraux lacustres.
L'opéron lac : activation par la protéine activatrice des catabolites
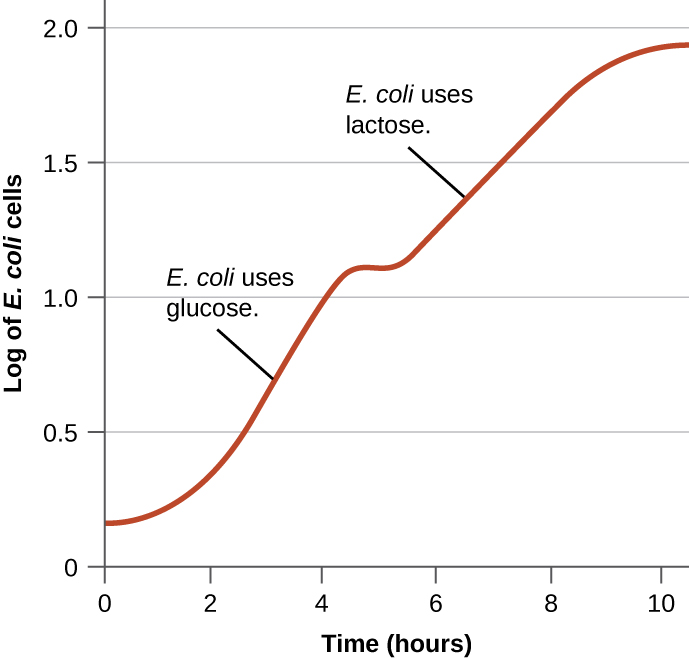
Les bactéries ont généralement la capacité d'utiliser divers substrats comme sources de carbone. Cependant, comme le glucose est généralement préférable à d'autres substrats, les bactéries disposent de mécanismes garantissant que des substrats alternatifs ne sont utilisés que lorsque le glucose est épuisé. De plus, les bactéries disposent de mécanismes garantissant que les gènes codant des enzymes pour l'utilisation de substrats alternatifs ne sont exprimés que lorsque le substrat alternatif est disponible. Dans les années 1940, Jacques Monod a été le premier à démontrer sa préférence pour certains substrats par rapport à d'autres grâce à ses études sur la croissance d'E. coli lorsqu'il est cultivé en présence de deux substrats différents simultanément. De telles études ont généré des courbes de croissance diauxiques, comme celle illustrée à la figure\(\PageIndex{4}\). Bien que le glucose soit utilisé en premier lieu, E. coli se développe rapidement et les enzymes nécessaires au métabolisme du lactose sont absentes. Cependant, une fois le taux de glucose épuisé, les taux de croissance ralentissent, induisant l'expression des enzymes nécessaires au métabolisme du deuxième substrat, le lactose. Remarquez que le taux de croissance du lactose est plus lent, comme l'indique la pente plus faible de la courbe de croissance.
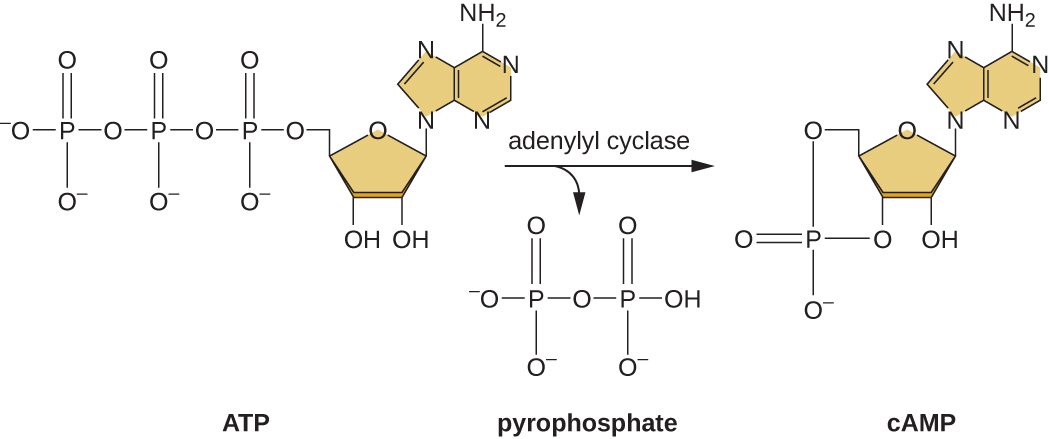
La capacité de passer de l'utilisation du glucose à un autre substrat tel que le lactose est une conséquence de l'activité d'une enzyme appelée enzyme IIA (EIIA). Lorsque le taux de glucose baisse, les cellules produisent moins d'ATP par catabolisme (voir Catabolisme des glucides) et l'EIIA se phosphoryle. L'EIIA phosphorylé active l'adénylyl cyclase, une enzyme qui convertit une partie de l'ATP restant en AMP cyclique (AMP), un dérivé cyclique de l'AMP et une molécule de signalisation importante impliquée dans le métabolisme du glucose et de l'énergie chez E. coli. En conséquence, les niveaux de cAMP commencent à augmenter dans la cellule (Figure\(\PageIndex{5}\)).
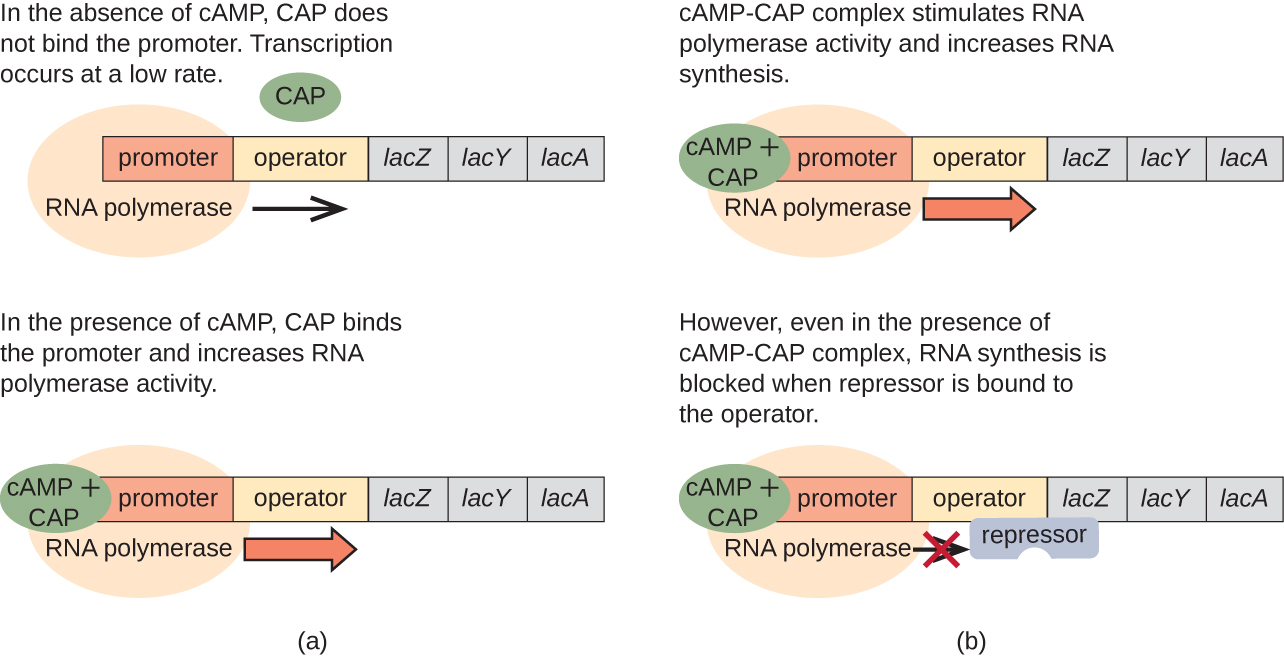
L'opéron lac joue également un rôle dans ce passage de l'utilisation du glucose à celle du lactose. Lorsque le glucose est rare, l'AMPc qui s'accumule en raison de l'activité accrue de l'adénylyl cyclase se lie à la protéine activatrice des catabolites (CAP), également connue sous le nom de protéine réceptrice de l'AMPc (CRP). Le complexe se lie à la région promotrice de l'opéron lac (Figure\(\PageIndex{6}\)). Dans les régions régulatrices de ces opérons, un site de fixation du CAP est situé en amont du site de liaison de l'ARN polymérase dans le promoteur. La liaison du complexe Cap-AMPc à ce site augmente la capacité de liaison de l'ARN polymérase à la région promotrice pour initier la transcription des gènes structuraux. Ainsi, dans le cas de l'opéron lac, pour que la transcription se produise, il faut que du lactose soit présent (élimination de la protéine répressive lac) et que le taux de glucose soit réduit (permettant la liaison d'une protéine activatrice). Lorsque le taux de glucose est élevé, il y a répression catabolite des opérons codant des enzymes pour le métabolisme de substrats alternatifs. En raison des faibles niveaux d'AMPc dans ces conditions, la quantité du complexe CAP-AMPc est insuffisante pour activer la transcription de ces opérons. Voir le tableau\(\PageIndex{1}\) pour un résumé de la régulation de l'opéron lac.
| Du glucose | liaisons CAP | Lactose | Le répresseur se lie | Transcription |
|---|---|---|---|---|
| + | — | — | + | Non |
| + | — | + | — | Certains |
| — | + | — | + | Non |
| — | + | + | — | Oui |
Regardez un didacticiel animé sur le fonctionnement du lac Opéron ici.
Exercice\(\PageIndex{2}\)
- Qu'est-ce qui affecte la liaison du répresseur de l'opéron trp à l'opérateur ?
- Comment et quand le comportement de la protéine répressive lac est-il modifié ?
- En plus d'être répressible, comment l'opéron lacustre est-il régulé autrement ?
Réponses globales des procaryotes
Chez les procaryotes, il existe également plusieurs niveaux plus élevés de régulation génique qui ont la capacité de contrôler la transcription de nombreux opérons apparentés simultanément en réponse à un signal environnemental. Un groupe d'opérons tous contrôlés simultanément est appelé régulon.
Alarmones
Lorsqu'ils détectent un stress imminent, les procaryotes modifient l'expression d'une grande variété d'opérons pour répondre de manière coordonnée. Pour ce faire, ils produisent des alarmones, de petits dérivés de nucléotides intracellulaires. Les alarmones modifient les gènes exprimés et stimulent l'expression de gènes spécifiques de réponse au stress. L'utilisation d'alarmones pour modifier l'expression des gènes en réponse au stress semble être importante chez les bactéries pathogènes. Lorsqu'ils sont confrontés à des mécanismes de défense de l'hôte et à d'autres conditions difficiles au cours de l'infection, de nombreux opérons codant des gènes de virulence sont régulés à la hausse en réponse à la signalisation d'alarme. La connaissance de ces réponses est essentielle pour bien comprendre le processus d'infection de nombreux agents pathogènes et pour développer des thérapies pour contrer ce processus.
Facteurs σ alternatifs
Puisque la sous-unité σ de l'ARN polymérase bactérienne confère une spécificité quant aux promoteurs à transcrire, la modification du facteur σ utilisé est un autre moyen pour les bactéries de modifier rapidement et globalement les régulons transcrits à un moment donné. Le facteur σ reconnaît les séquences d'un promoteur bactérien, de sorte que les différents facteurs σ reconnaîtront chacun des séquences promotrices légèrement différentes. Ainsi, lorsque la cellule détecte des conditions environnementales spécifiques, elle peut réagir en modifiant le facteur σ qu'elle exprime, en dégradant l'ancien et en produisant un nouveau facteur pour transcrire les opérons codant pour les gènes dont les produits seront utiles dans les nouvelles conditions environnementales. Par exemple, chez les bactéries sporulantes des genres Bacillus et Clostridium (qui comprennent de nombreux agents pathogènes), un groupe de facteurs σ contrôle l'expression des nombreux gènes nécessaires à la sporulation en réponse à des signaux stimulant la sporulation.
Exercice\(\PageIndex{3}\)
- Quel est le nom donné à un ensemble d'opérons qui peuvent être régulés en tant que groupe ?
- Quel type de stimulus déclencherait la transcription d'un facteur σ différent ?
Méthodes supplémentaires de régulation chez les bactéries : atténuation et riboswitch
Bien que la majeure partie de l'expression génique soit régulée au niveau de l'initiation de la transcription chez les procaryotes, il existe également des mécanismes permettant de contrôler simultanément l'achèvement de la transcription et la traduction. Depuis leur découverte, il a été démontré que ces mécanismes contrôlent l'achèvement de la transcription et de la traduction de nombreux opérons procaryotes. Comme ces mécanismes relient directement la régulation de la transcription et de la traduction, ils sont spécifiques aux procaryotes, car ces processus sont physiquement séparés chez les eucaryotes.
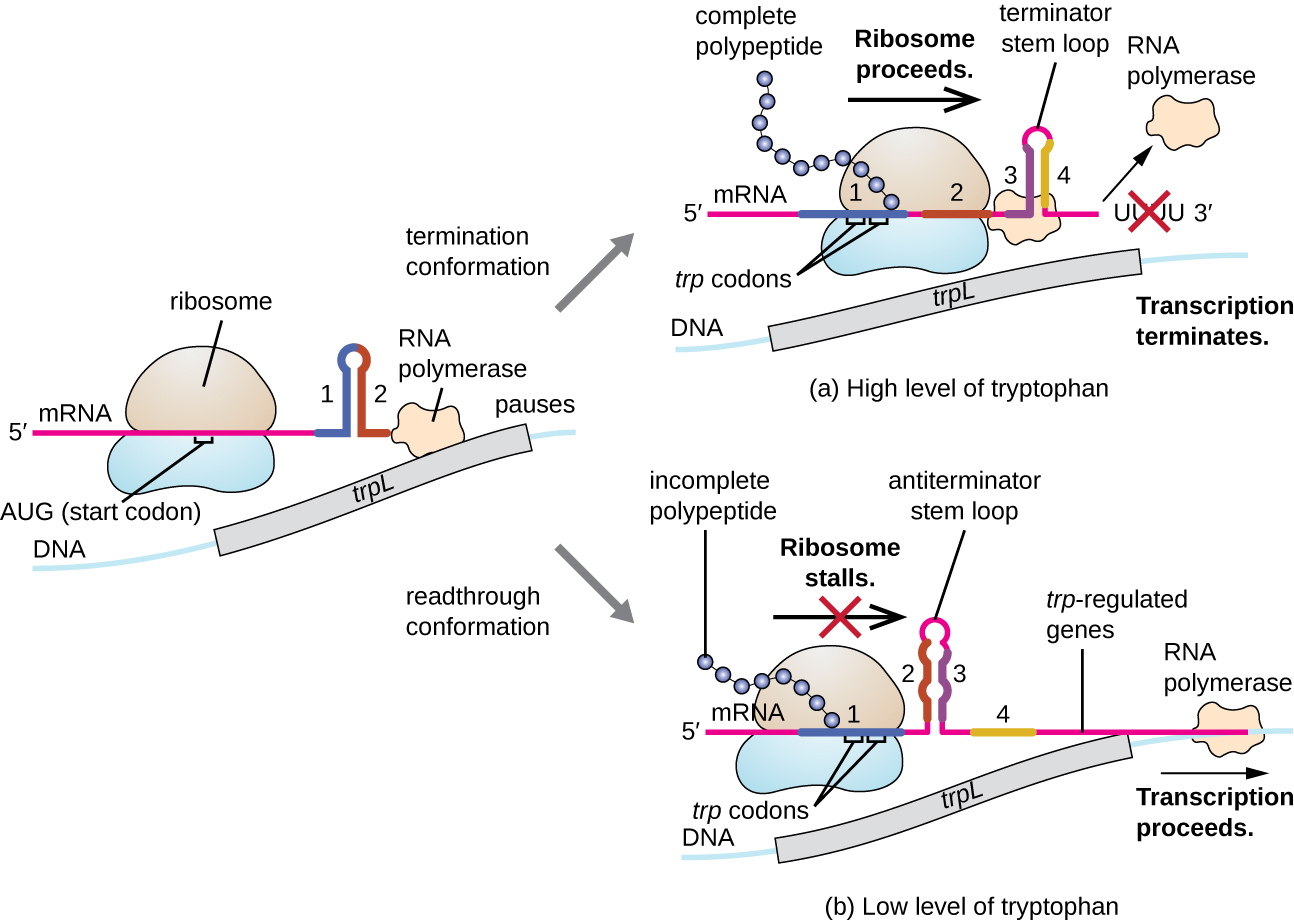
L'un de ces systèmes de régulation est l'atténuation, par laquelle des structures tige-boucle secondaires formées à l'extrémité 5' d'un ARNm en cours de transcription déterminent si la transcription nécessaire à la synthèse de cet ARNm aura lieu et si cet ARNm sera utilisé pour la traduction. Au-delà du mécanisme de répression transcriptionnelle déjà discuté, l'atténuation contrôle également l'expression de l'opéron trp chez E. coli (Figure\(\PageIndex{7}\)). La région régulatrice de l'opéron trp contient une séquence principale appelée trPL entre l'opérateur et le premier gène structural, qui possède quatre segments d'ARN qui peuvent s'apparier entre eux selon différentes combinaisons de bases. Lorsqu'une boucle tige terminatrice se forme, la transcription se termine, libérant l'ARN polymérase de l'ARNm. Cependant, lorsqu'une boucle tige antiterminatrice se forme, cela empêche la formation de la boucle tige terminatrice, de sorte que l'ARN polymérase peut transcrire les gènes structuraux.
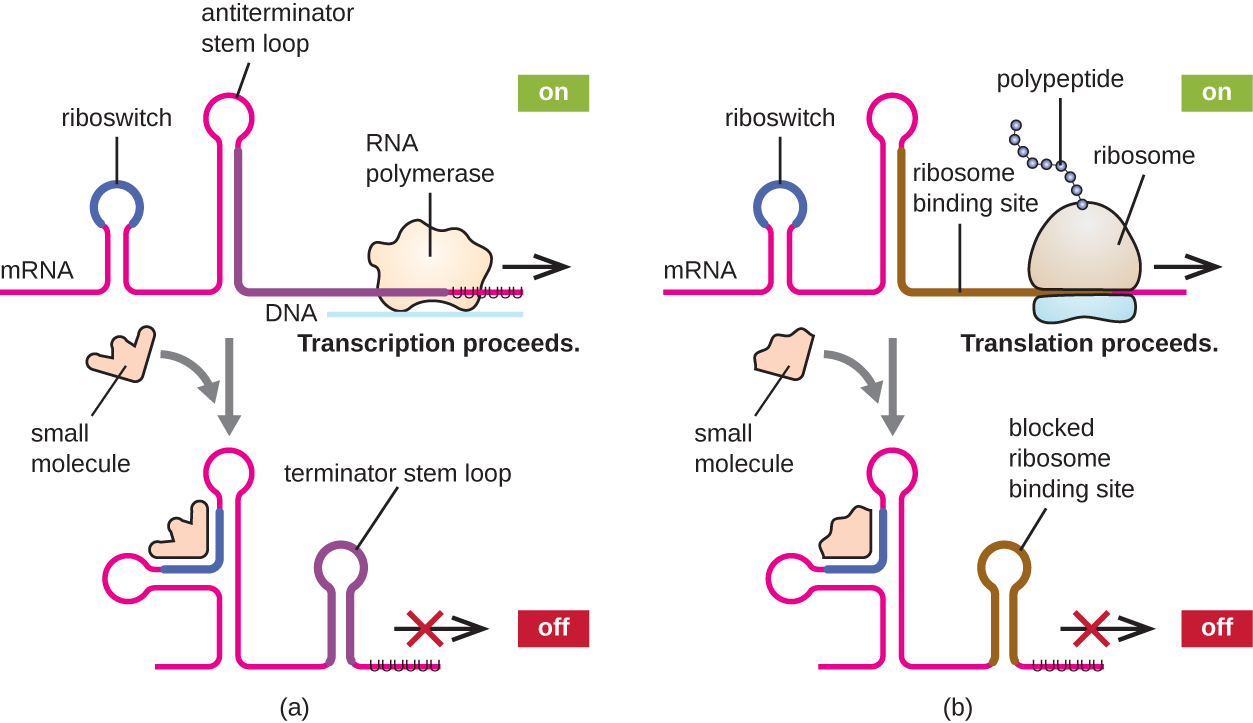
Un mécanisme connexe de régulation simultanée de la transcription et de la traduction chez les procaryotes est l'utilisation d'un riboswitch, une petite région d'ARN non codant située à l'extrémité 5' de certaines molécules d'ARNm procaryotes (Figure\(\PageIndex{8}\)). Un riboswitch peut se lier à une petite molécule intracellulaire pour stabiliser certaines structures secondaires de la molécule d'ARNm. La liaison de la petite molécule détermine la structure tige-boucle qui se forme, influençant ainsi l'achèvement de la synthèse de l'ARNm et de la synthèse des protéines.
Autres facteurs influant sur l'expression des gènes chez les procaryotes et les eucaryotes
Bien que l'accent mis sur notre discussion sur le contrôle transcriptionnel ait utilisé des opérons procaryotes comme exemples, le contrôle transcriptionnel eucaryote est similaire à bien des égards. Comme chez les procaryotes, la transcription eucaryote peut être contrôlée par la liaison de facteurs de transcription, notamment des répresseurs et des activateurs. Il est intéressant de noter que la transcription eucaryote peut être influencée par la liaison des protéines à des régions de l'ADN, appelées activateurs, assez éloignées du gène, par le biais d'une boucle d'ADN facilitée entre l'activateur et le promoteur (Figure\(\PageIndex{9}\)). Dans l'ensemble, la régulation de la transcription est un moyen très efficace de contrôler l'expression des gènes chez les procaryotes et les eucaryotes. Cependant, le contrôle de l'expression génique chez les eucaryotes en réponse à des stress environnementaux et cellulaires peut être réalisé par d'autres moyens sans lier les facteurs de transcription aux régions régulatrices.
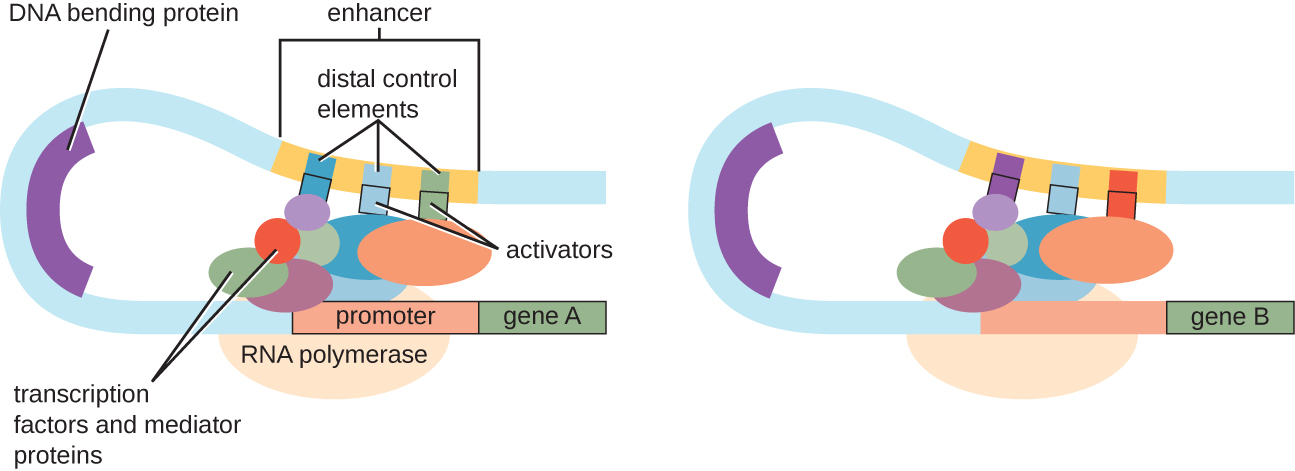
Contrôle au niveau de l'ADN
Chez les eucaryotes, les molécules d'ADN ou les histones associées peuvent être modifiées chimiquement de manière à influencer la transcription ; c'est ce que l'on appelle la régulation épigénétique. Il a été démontré que la méthylation de certains nucléotides de cytosine dans l'ADN en réponse à des facteurs environnementaux influence l'utilisation de cet ADN pour la transcription, la méthylation de l'ADN étant généralement corrélée à une diminution des niveaux d'expression génique. De plus, en réponse à des facteurs environnementaux, les protéines histones destinées au conditionnement de l'ADN peuvent également être modifiées chimiquement de multiples manières, notamment par acétylation et désacétylation, influençant ainsi l'état de conditionnement de l'ADN et affectant ainsi la disponibilité de l'ADN faiblement enroulé pour la transcription. Ces modifications chimiques peuvent parfois être maintenues par de multiples cycles de division cellulaire, ce qui rend au moins certaines de ces modifications épigénétiques héréditaires.
Cette vidéo décrit comment la régulation épigénétique contrôle l'expression des gènes.
Exercice\(\PageIndex{}\)
- Qu'est-ce qui arrête ou permet à la transcription de se poursuivre lorsque l'atténuation fonctionne ?
- Qu'est-ce qui détermine l'état d'un riboswitch ?
- Décrivez la fonction d'un amplificateur.
- Décrire deux mécanismes de régulation épigénétique chez les eucaryotes.
Orientation clinique : résolution
Bien que Mark ait survécu à sa crise de fasciite nécrosante, il devait maintenant subir une greffe de peau, suivie d'une physiothérapie à long terme. Compte tenu de la quantité de masse musculaire qu'il a perdue, il est peu probable que sa jambe reprenne toute sa force, mais son physiothérapeute est optimiste quant à la possibilité qu'il reprenne l'usage de sa jambe.
Des tests de laboratoire ont révélé que l'agent causal de l'infection de Mark était une souche de streptocoque du groupe A (streptocoque du groupe A). Comme l'exige la loi, le cas de Mark a été signalé au département de la santé de l'État et finalement aux Centers for Disease Control and Prevention (CDC). Au CDC, la souche de streptocoque du groupe A isolée de Mark a été analysée de manière plus approfondie pour déterminer sa résistance à la méthicilline.
La résistance à la méticilline est codée génétiquement et est de plus en plus courante chez les streptocoques du groupe A par transfert horizontal de gènes. Dans les cas de fasciite nécrosante, le flux sanguin vers la zone infectée est généralement limité en raison de l'action de diverses toxines bactériennes codées génétiquement. C'est pourquoi il y a généralement peu ou pas de saignement à la suite du test d'incision. Malheureusement, ces toxines bactériennes limitent l'efficacité des antibiotiques administrés par voie intraveineuse pour éliminer l'infection de la peau et des tissus sous-jacents, ce qui signifie que la résistance aux antibiotiques à elle seule n'explique pas l'inefficacité du traitement de Mark. Néanmoins, l'antibiothérapie par voie intraveineuse était justifiée pour aider à minimiser les conséquences possibles d'une septicémie, qui est une conséquence courante de la fasciite nécrosante. L'analyse génomique de la souche isolée de Mark effectuée par les CDC a permis de démontrer que plusieurs des gènes de virulence importants étaient codés sur des prophages, ce qui indique que la transduction joue un rôle important dans le transfert horizontal de ces gènes d'une cellule bactérienne à une autre.
Concepts clés et résumé
- L'expression des gènes est un processus étroitement régulé.
- L'expression des gènes chez les procaryotes est largement régulée au moment de la transcription. L'expression des gènes chez les eucaryotes est également régulée de manière post-transcriptionnelle.
- Les gènes structuraux procaryotes ayant des fonctions connexes sont souvent organisés en opérons, tous contrôlés par la transcription à partir d'un seul promoteur. La région régulatrice d'un opéron comprend le promoteur lui-même et la région entourant le promoteur à laquelle les facteurs de transcription peuvent se lier pour influencer la transcription.
- Bien que certains opérons soient exprimés de manière constitutive, la plupart sont soumis à une régulation par l'utilisation de facteurs de transcription (répresseurs et activateurs). Un répresseur se lie à un opérateur, une séquence d'ADN située dans la région régulatrice située entre le site de liaison de l'ARN polymérase dans le promoteur et le premier gène structural, bloquant ainsi physiquement la transcription de ces opérons. Un activateur se lie dans la région régulatrice d'un opéron, aidant l'ARN polymérase à se lier au promoteur, améliorant ainsi la transcription de cet opéron. Un inducteur influence la transcription en interagissant avec un répresseur ou un activateur.
- L'opéron trp est un exemple classique d'opéron répressible. Lorsque le tryptophane s'accumule, le tryptophane se lie à un répresseur, qui se lie ensuite à l'opérateur, empêchant ainsi toute transcription ultérieure.
- L'opéron lac est un exemple classique d'opéron inductible. Lorsque le lactose est présent dans la cellule, il est converti en allolactose. L'allolactose agit comme un inducteur, se liant au répresseur et empêchant le répresseur de se lier à l'opérateur. Cela permet la transcription des gènes structuraux.
- L'opéron lac est également sujet à activation. Lorsque le taux de glucose est épuisé, une partie de l'ATP cellulaire est convertie en AMPc, qui se lie à la protéine activatrice des catabolites (CAP). Le complexe Camp-Cap active la transcription de l'opéron lac. Lorsque le taux de glucose est élevé, sa présence empêche la transcription de l'opéron lac et d'autres opérons par répression des catabolites.
- De petites molécules intracellulaires appelées alarmones sont fabriquées en réponse à divers stress environnementaux, permettant aux bactéries de contrôler la transcription d'un groupe d'opérons, appelé régulon.
- Les bactéries ont la capacité de modifier le facteur σ de l'ARN polymérase qu'elles utilisent en réponse aux conditions environnementales afin de modifier rapidement et globalement les régulons transcrits.
- Les procaryotes possèdent des mécanismes de régulation, notamment l'atténuation et l'utilisation de ribocommutateurs, pour contrôler simultanément l'achèvement de la transcription et de la traduction à partir de ce transcrit. Ces mécanismes agissent par la formation de boucles souches à l'extrémité 5' d'une molécule d'ARNm actuellement synthétisée.
- Il existe d'autres points de régulation de l'expression génique chez les procaryotes et les eucaryotes. Chez les eucaryotes, la régulation épigénétique par modification chimique de l'ADN ou des histones et la régulation du traitement de l'ARN sont deux méthodes.


