7.4 : Protéines
- Page ID
- 187795
Objectifs d'apprentissage
- Décrire la structure fondamentale d'un acide aminé
- Décrire les structures chimiques des protéines
- Résumez les caractéristiques uniques des protéines
Au début de ce chapitre, une expérience célèbre a été décrite dans laquelle des scientifiques ont synthétisé des acides aminés dans des conditions simulant celles présentes sur Terre bien avant l'évolution de la vie telle que nous la connaissons. Ces composés sont capables de se lier entre eux en un nombre pratiquement illimité, produisant des molécules de toutes tailles qui possèdent un large éventail de propriétés physiques et chimiques et remplissent de nombreuses fonctions vitales pour tous les organismes. Les molécules dérivées des acides aminés peuvent fonctionner en tant que composants structuraux des cellules et des entités subcellulaires, en tant que sources de nutriments, en tant que réservoirs de stockage d'atomes et d'énergie et en tant qu'espèces fonctionnelles telles que les hormones, les enzymes, les récepteurs et les molécules de transport.
Acides aminés et liaisons peptidiques
Un acide aminé est une molécule organique dans laquelle un atome d'hydrogène, un groupe carboxyle (-COOH) et un groupe amino (-NH 2) sont tous liés au même atome de carbone, appelé carbone α. Le quatrième groupe lié au carbone α varie entre les différents acides aminés et est appelé résidu ou chaîne latérale, représenté dans les formules structurales par la lettre R. Un résidu est un monomère qui se forme lorsque deux ou plusieurs acides aminés se combinent et éliminent les molécules d'eau. La structure primaire d'une protéine, une chaîne peptidique, est constituée de résidus d'acides aminés. Les caractéristiques uniques des groupes fonctionnels et des groupes R permettent à ces composants des acides aminés de former des liaisons hydrogène, ioniques et disulfure, ainsi que des interactions polaires/non polaires nécessaires à la formation de structures protéiques secondaires, tertiaires et quaternaires. Ces groupes sont composés principalement de carbone, d'hydrogène, d'oxygène, d'azote et de soufre, sous forme d'hydrocarbures, d'acides, d'amides, d'alcools et d'amines. Quelques exemples illustrant ces possibilités sont fournis dans la figure\(\PageIndex{1}\).
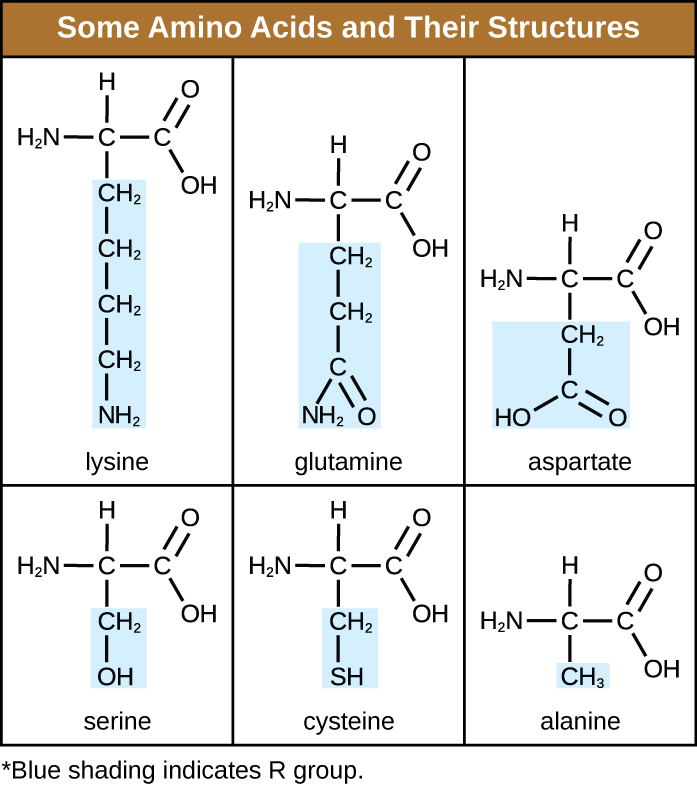
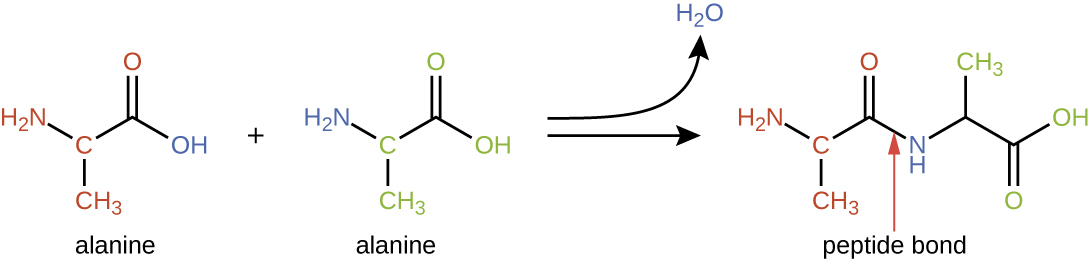
Les acides aminés peuvent se lier chimiquement entre eux par réaction du groupe acide carboxylique d'une molécule avec le groupe amine d'une autre molécule. Cette réaction forme une liaison peptidique et une molécule d'eau et constitue un autre exemple de synthèse par déshydratation (Figure\(\PageIndex{2}\)). Les molécules formées en liant chimiquement un nombre relativement modeste d'acides aminés (environ 50 ou moins) sont appelées peptides, et des préfixes sont souvent utilisés pour spécifier ces nombres : dipeptides (deux acides aminés), tripeptides (trois acides aminés), etc. Plus généralement, le nombre approximatif d'acides aminés est désigné : les oligopeptides sont formés en joignant jusqu'à environ 20 acides aminés, tandis que les polypeptides sont synthétisés à partir d'environ 50 acides aminés. Lorsque le nombre d'acides aminés liés entre eux devient très important, ou lorsque plusieurs polypeptides sont utilisés comme sous-unités de construction, les macromolécules qui en résultent sont appelées protéines. La longueur continuellement variable (le nombre de monomères) de ces biopolymères, ainsi que la variété de groupes R possibles sur chaque acide aminé, permettent une diversité presque illimitée dans les types de protéines qui peuvent se former.
Exercice\(\PageIndex{1}\)
Combien d'acides aminés contiennent les polypeptides ?
Structure des protéines
La taille (longueur) et la séquence spécifique d'acides aminés d'une protéine sont des déterminants majeurs de sa forme, et la forme d'une protéine est essentielle à son fonctionnement. Par exemple, lors du processus de fixation biologique de l'azote (voir Cycles biogéochimiques), les microorganismes du sol appelés rhizobiums interagissent en symbiose avec les racines de légumineuses telles que le soja, les arachides ou les haricots pour former une nouvelle structure appelée nodule sur les racines des plantes. La plante produit ensuite une protéine porteuse appelée leghémoglobine, une protéine qui transporte de l'azote ou de l'oxygène. La leghémoglobine se lie avec une très grande affinité à l'oxygène de son substrat dans une région spécifique de la protéine où la forme et la séquence d'acides aminés sont appropriées (le site actif). Si la forme ou l'environnement chimique du site actif est modifié, même légèrement, il se peut que le substrat ne soit pas capable de se lier aussi fortement, ou qu'il ne se lie pas du tout. Ainsi, pour que la protéine soit pleinement active, elle doit avoir la forme appropriée à sa fonction.
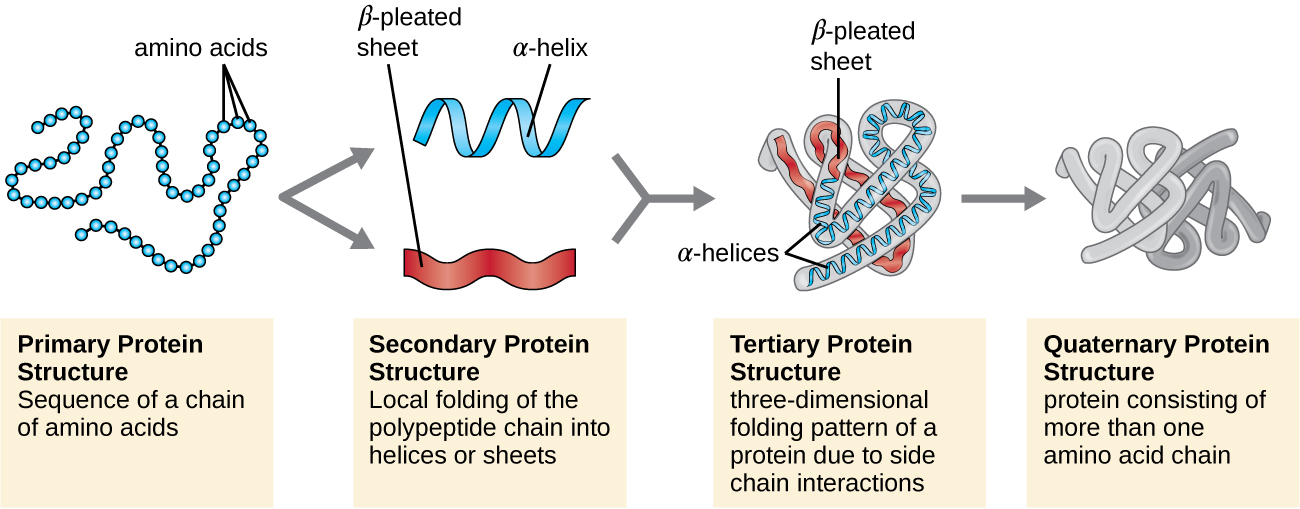
La structure des protéines est classée en fonction de quatre niveaux : primaire, secondaire, tertiaire et quaternaire. La structure principale est simplement la séquence d'acides aminés qui constituent la chaîne polypeptidique. La figure\(\PageIndex{3}\) montre la structure primaire d'une protéine.
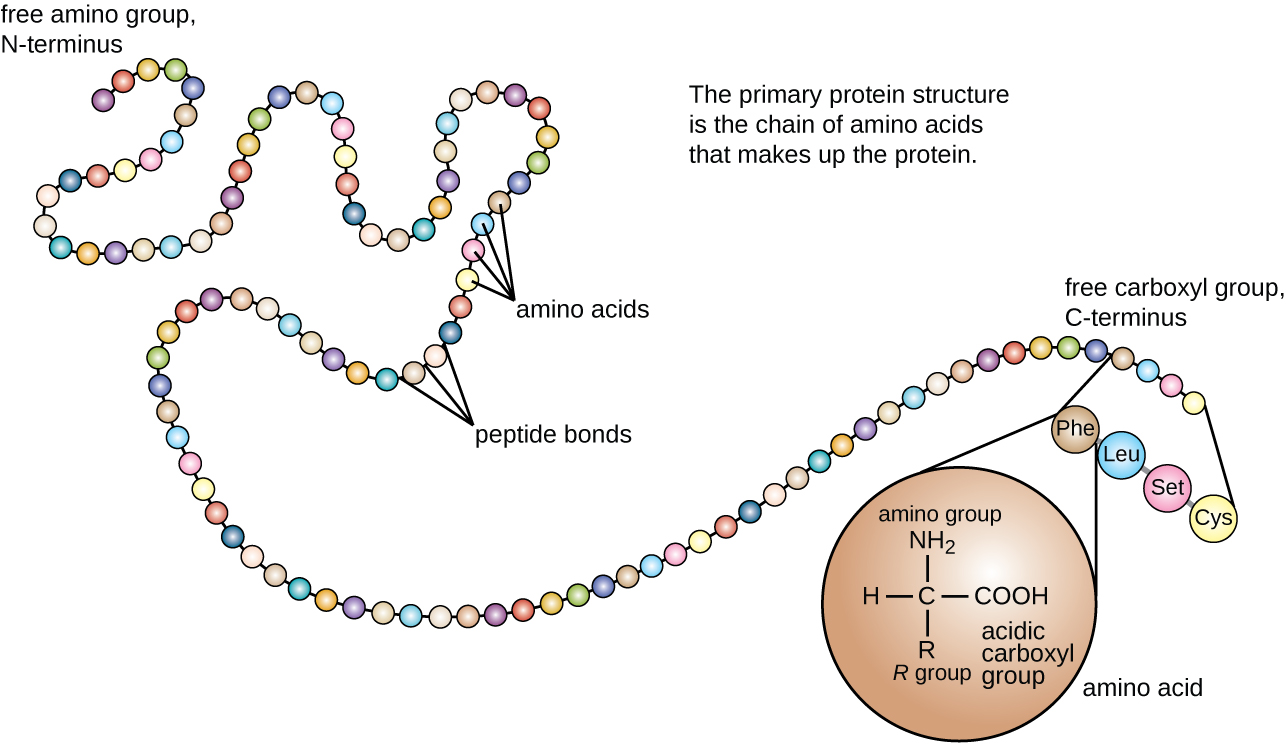
La chaîne d'acides aminés qui définit la structure primaire d'une protéine n'est pas rigide, mais flexible en raison de la nature des liaisons qui maintiennent les acides aminés ensemble. Lorsque la chaîne est suffisamment longue, une liaison hydrogène peut se produire entre les groupes fonctionnels amine et carbonyle au sein du squelette peptidique (à l'exception du groupe côté R), entraînant un repliement localisé de la chaîne polypeptidique en hélices et en nappes. Ces formes constituent la structure secondaire d'une protéine. Les structures secondaires les plus courantes sont l'hélice α et la feuille plissée β. Dans la structure de l'hélice α, l'hélice est maintenue par des liaisons hydrogène entre l'atome d'oxygène d'un groupe carbonyle d'un acide aminé et l'atome d'hydrogène du groupe aminé situé à seulement quatre unités d'acides aminés plus loin le long de la chaîne. Dans la feuille plissée β, les plis sont formés par des liaisons hydrogène similaires entre des séquences continues de groupes carbonyle et amino qui sont ensuite séparés sur le squelette de la chaîne polypeptidique (Figure\(\PageIndex{4}\)).
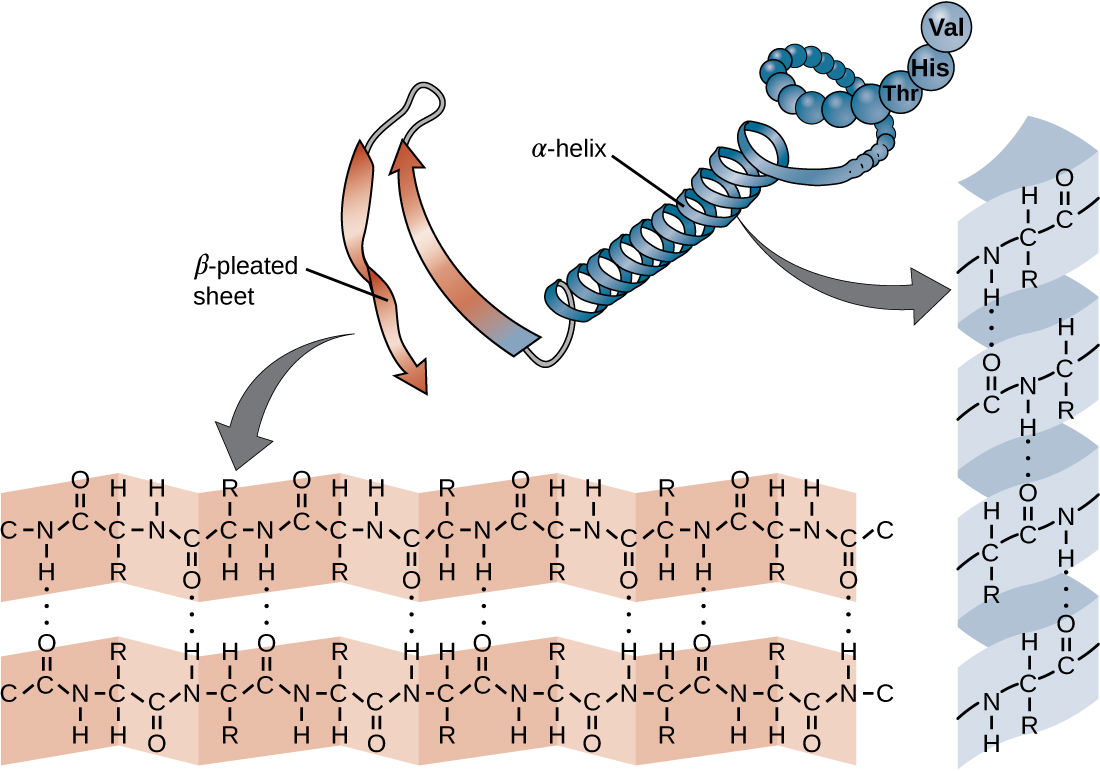
Le niveau suivant de l'organisation des protéines est la structure tertiaire, qui est la forme tridimensionnelle à grande échelle d'une chaîne polypeptidique unique. La structure tertiaire est déterminée par les interactions entre les résidus d'acides aminés qui sont très éloignés les uns des autres dans la chaîne. Diverses interactions donnent naissance à la structure tertiaire des protéines, telles que les ponts disulfure, qui sont des liaisons entre les groupes fonctionnels sulfhydryl (-SH) des groupes latéraux d'acides aminés, des liaisons hydrogène, des liaisons ioniques et des interactions hydrophobes entre des chaînes latérales non polaires. Toutes ces interactions, faibles et fortes, se combinent pour déterminer la forme tridimensionnelle finale de la protéine et sa fonction (Figure\(\PageIndex{5}\)).
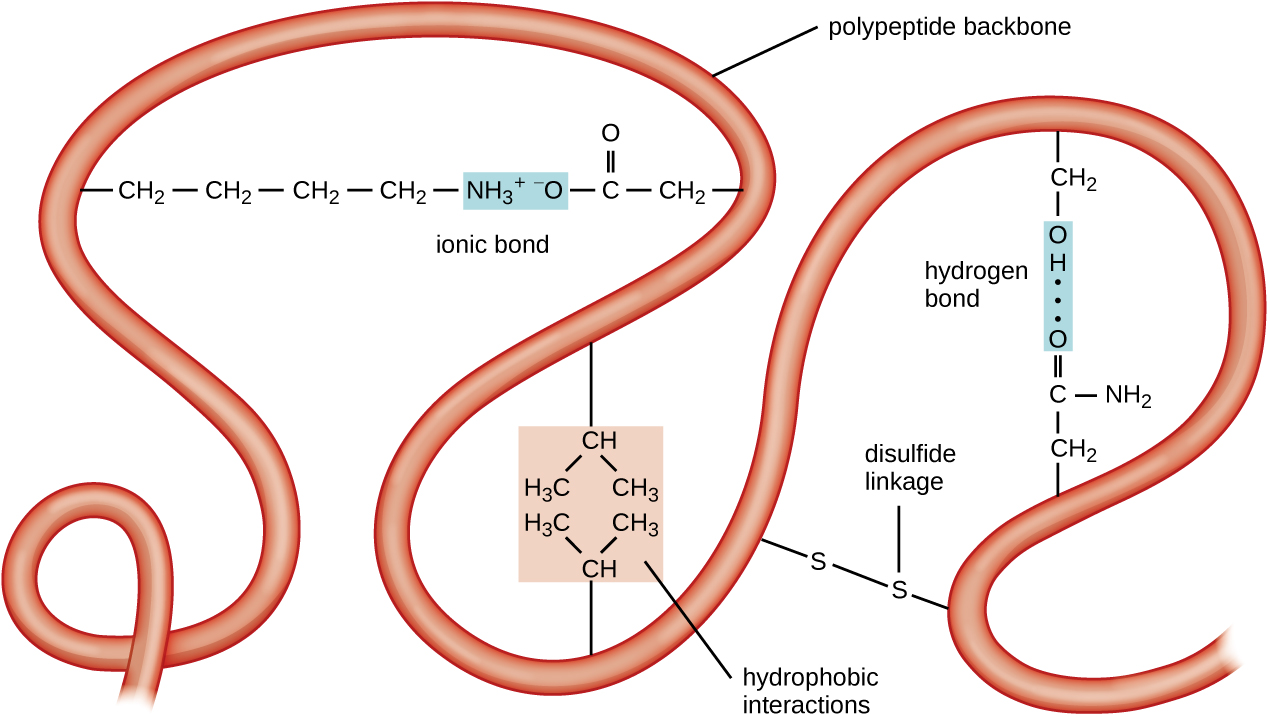
Le processus par lequel une chaîne polypeptidique prend une forme tridimensionnelle à grande échelle est appelé repliement des protéines. Les protéines repliées qui sont pleinement fonctionnelles dans leur rôle biologique normal sont réputées posséder une structure native. Lorsqu'une protéine perd sa forme tridimensionnelle, il se peut qu'elle ne soit plus fonctionnelle. Ces protéines dépliées sont dénaturées. La dénaturation implique la perte de la structure secondaire et de la structure tertiaire (et, le cas échéant, de la structure quaternaire) sans perte de la structure primaire.
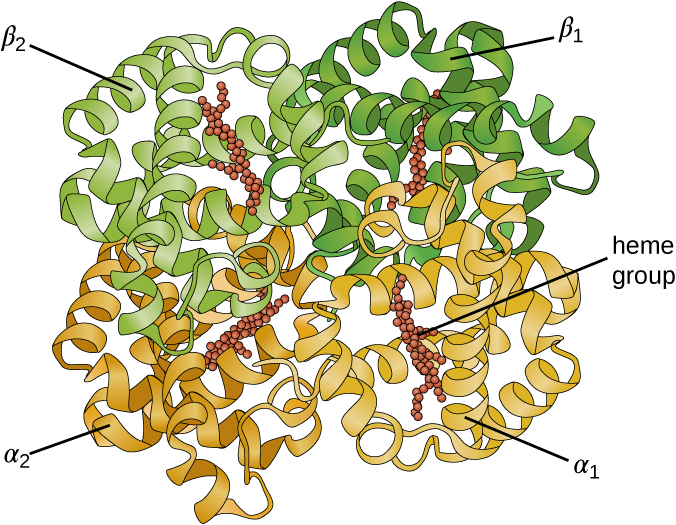
Certaines protéines sont des assemblages de plusieurs polypeptides distincts, également appelés sous-unités protéiques. Ces protéines ne fonctionnent correctement que lorsque toutes les sous-unités sont présentes et configurées de manière appropriée. Les interactions qui maintiennent ces sous-unités ensemble constituent la structure quaternaire de la protéine. La structure quaternaire globale est stabilisée par des interactions relativement faibles. L'hémoglobine, par exemple, a une structure quaternaire de quatre sous-unités protéiques globulaires : deux polypeptides α et deux polypeptides β, chacun contenant un hème à base de fer (Figure\(\PageIndex{6}\)).
Une autre classe importante de protéines est celle des protéines conjuguées qui contiennent une partie non protéique. Si un glucide est attaché à la protéine conjuguée, on parle de glycoprotéine. Si un lipide y est attaché, on parle de lipoprotéine. Ces protéines sont des composants importants des membranes. La figure\(\PageIndex{7}\) résume les quatre niveaux de structure des protéines.
Exercice\(\PageIndex{2}\)
Que peut-il se passer si la structure primaire, secondaire, tertiaire ou quaternaire d'une protéine est modifiée ?
Structure primaire, protéines dysfonctionnelles et fibrose kystique
Les protéines associées aux membranes biologiques sont classées comme extrinsèques ou intrinsèques. Les protéines extrinsèques, également appelées protéines périphériques, sont faiblement associées à un côté de la membrane. Les protéines intrinsèques, ou protéines intégrales, sont intégrées dans la membrane et font souvent partie des systèmes de transport en tant que protéines transmembranaires. La fibrose kystique (CF) est une maladie génétique humaine causée par une modification de la protéine transmembranaire. Elle affecte principalement les poumons, mais peut également affecter le pancréas, le foie, les reins et les intestins. La mucoviscidose est causée par la perte de l'acide aminé phénylalanine dans une protéine transmembranaire de la mucoviscidose (CFTR). La perte d'un acide aminé modifie la structure primaire d'une protéine qui contribue normalement au transport du sel et de l'eau à l'intérieur et à l'extérieur des cellules (Figure\(\PageIndex{8}\)).
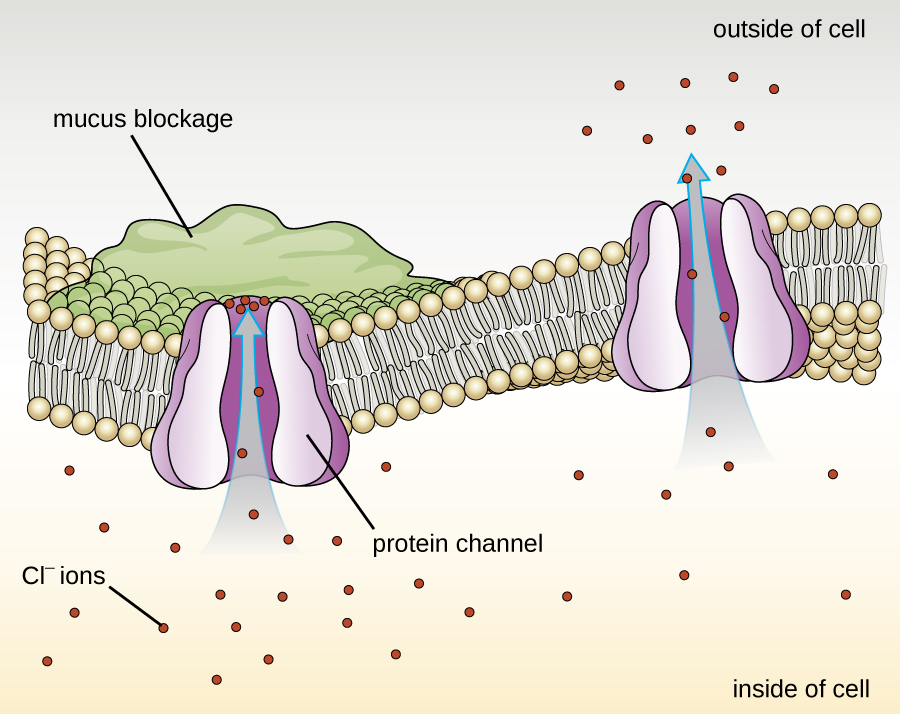
La modification de la structure primaire empêche la protéine de fonctionner correctement, ce qui amène le corps à produire un mucus exceptionnellement épais qui obstrue les poumons et entraîne l'accumulation de mucus collant. Le mucus obstrue le pancréas et empêche les enzymes naturelles d'aider le corps à décomposer les aliments et à absorber les nutriments essentiels.
Dans les poumons des personnes atteintes de mucoviscidose, le mucus altéré crée un environnement propice à la prolifération des bactéries. Cette colonisation entraîne la formation de biofilms dans les petites voies respiratoires des poumons. Les agents pathogènes les plus courants détectés dans les poumons des patients atteints de mucoviscidose sont Pseudomonas aeruginosa (Figure\(\PageIndex{9}\)) et Burkholderia cepacia. Les pseudomonas se différencient au sein du biofilm des poumons et forment de grandes colonies, appelées Pseudomonas « mucoïdes ». Les colonies ont une pigmentation unique qui apparaît lors des tests de laboratoire (Figure\(\PageIndex{9}\)) et fournit aux médecins le premier indice que le patient est atteint de mucoviscidose (de telles colonies sont rares chez les personnes en bonne santé).
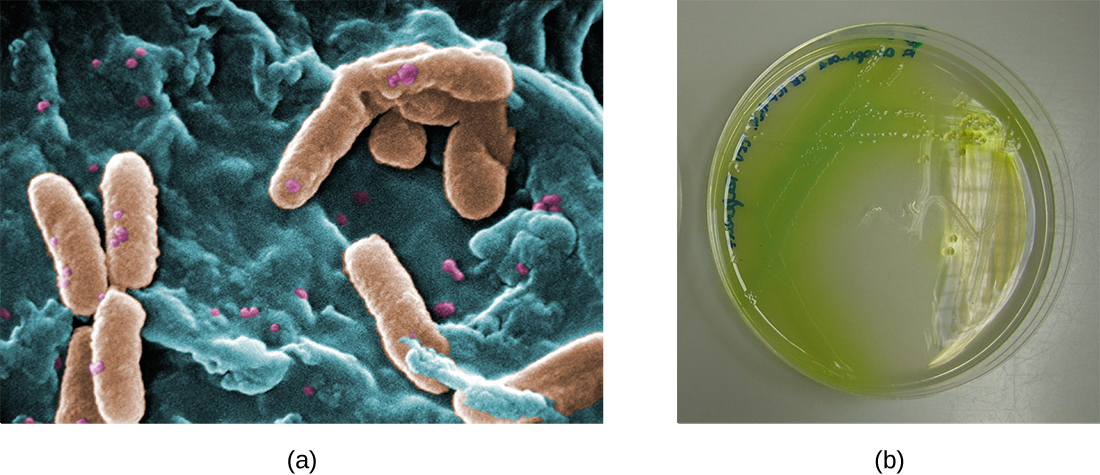
Pour plus d'informations sur la fibrose kystique, visitez le site Web de la Fondation pour la fibrose kystique.
Concepts clés et résumé
- Les acides aminés sont de petites molécules essentielles à toute forme de vie. Chacun possède un carbone α auquel sont liés un atome d'hydrogène, un groupe carboxyle et un groupe amine. Le quatrième groupe lié, représenté par R, varie en composition chimique, en taille, en polarité et en charge entre les différents acides aminés, ce qui permet de varier les propriétés.
- Les peptides sont des polymères formés par la liaison d'acides aminés par synthèse par déshydratation. Les liaisons entre les acides aminés liés sont appelées liaisons peptidiques. Le nombre d'acides aminés liés entre eux peut varier de quelques à plusieurs.
- Les protéines sont des polymères formés par la liaison d'un très grand nombre d'acides aminés. Ils remplissent de nombreuses fonctions importantes dans une cellule, en tant que nutriments et enzymes, en tant que molécules de stockage du carbone, de l'azote et de l'énergie, et en tant que composants structuraux.
- La structure d'une protéine est un déterminant essentiel de sa fonction et est décrite par une classification graduée : primaire, secondaire, tertiaire et quaternaire. La structure native d'une protéine peut être perturbée par la dénaturation, entraînant la perte de sa structure d'ordre supérieur et de sa fonction biologique.
- Certaines protéines sont formées de plusieurs sous-unités protéiques distinctes, l'interaction de ces sous-unités constituant la structure quaternaire du complexe protéique.
- Les protéines conjuguées ont une partie non polypeptidique qui peut être un hydrate de carbone (formant une glycoprotéine) ou une fraction lipidique (formant une lipoprotéine). Ces protéines sont des composants importants des membranes.


