2.4 : Coloration d'échantillons microscopiques
- Page ID
- 187815
Objectifs d'apprentissage
- Faites la différence entre les taches simples et différentielles
- Décrire les caractéristiques uniques des teintures couramment utilisées
- Expliquer les procédures et nommer les applications cliniques de la coloration Gram, des endospores, de la coloration acido-résistante, des capsules négatives et des flagelles
À l'état naturel, la plupart des cellules et des microorganismes que nous observons au microscope manquent de couleur et de contraste. Il est donc difficile, voire impossible, de détecter les structures cellulaires importantes et leurs caractéristiques distinctives sans traiter artificiellement les échantillons. Nous avons déjà fait allusion à certaines techniques impliquant des colorants et des colorants fluorescents, et dans cette section, nous aborderons plus en détail des techniques spécifiques pour la préparation des échantillons. En effet, de nombreuses méthodes ont été développées pour identifier au microscope des microbes, des structures cellulaires, des séquences d'ADN ou des indicateurs d'infection spécifiques dans des échantillons de tissus. Ici, nous allons nous concentrer sur les techniques les plus pertinentes sur le plan clinique.
Préparation des échantillons pour la microscopie optique
En milieu clinique, les microscopes optiques sont les microscopes les plus couramment utilisés. Deux types de préparation de base sont utilisés pour visualiser les échantillons au microscope optique : les supports humides et les échantillons fixes.
Le type de préparation le plus simple est le support humide, dans lequel l'échantillon est placé sur la lame dans une goutte de liquide. Certains échantillons, comme une goutte d'urine, sont déjà sous forme liquide et peuvent être déposés sur la lame à l'aide d'un compte-gouttes. Des échantillons solides, tels qu'un raclage de la peau, peuvent être placés sur la lame avant d'ajouter une goutte de liquide pour préparer le support humide. Parfois, le liquide utilisé est simplement de l'eau, mais des taches sont souvent ajoutées pour améliorer le contraste. Une fois que le liquide a été ajouté à la lame, une lamelle est placée sur le dessus et l'échantillon est prêt à être examiné au microscope.
La deuxième méthode de préparation des échantillons pour la microscopie optique est la fixation. La « fixation » d'un échantillon fait référence au processus de fixation des cellules sur une lame. La fixation est souvent réalisée soit par chauffage (fixation thermique), soit par traitement chimique de l'échantillon. En plus de fixer l'échantillon à la lame, la fixation tue également les microorganismes présents dans l'échantillon, arrêtant ainsi leur mouvement et leur métabolisme tout en préservant l'intégrité de leurs composants cellulaires pour l'observation.
Pour fixer un échantillon à chaud, une fine couche de l'échantillon est étalée sur la lame (appelée frottis), puis la lame est brièvement chauffée au-dessus d'une source de chaleur (Figure\(\PageIndex{1}\)). Les fixateurs chimiques sont souvent préférables à la chaleur pour les échantillons de tissus. Des agents chimiques tels que l'acide acétique, l'éthanol, le méthanol, le formaldéhyde (formol) et le glutaraldéhyde peuvent dénaturer les protéines, arrêter les réactions biochimiques et stabiliser les structures cellulaires dans les échantillons de tissus (Figure\(\PageIndex{1}\)).

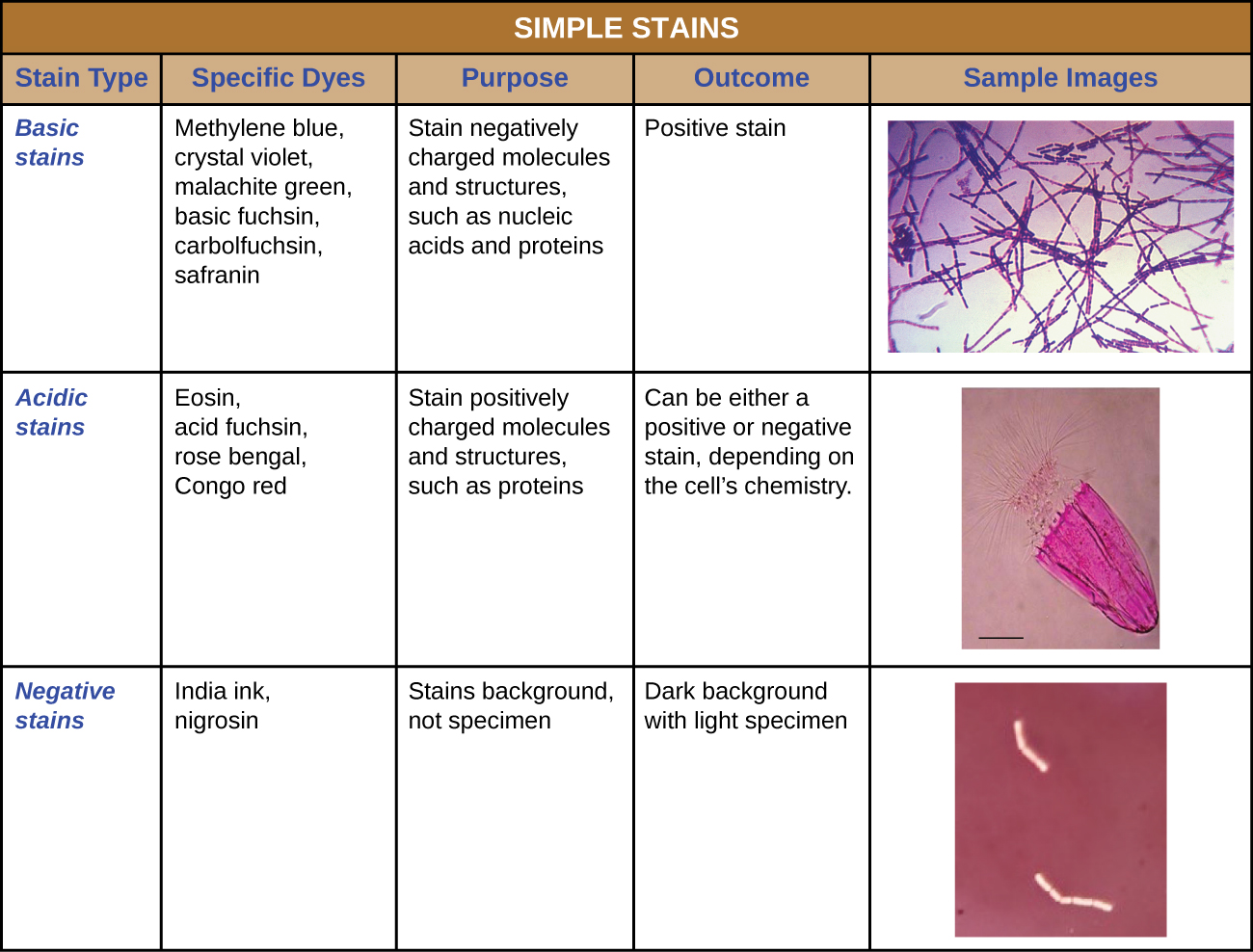
En plus de la fixation, la coloration est presque toujours appliquée pour colorer certaines caractéristiques d'un échantillon avant de l'examiner au microscope optique. Les teintures, ou colorants, contiennent des sels composés d'un ion positif et d'un ion négatif. Selon le type de colorant, l'ion positif ou négatif peut être le chromophore (l'ion coloré) ; l'autre ion non coloré est appelé contre-ion. Si le chromophore est l'ion chargé positivement, le colorant est classé comme colorant basique ; si l'ion négatif est le chromophore, le colorant est considéré comme un colorant acide.
Les colorants sont sélectionnés pour la coloration en fonction des propriétés chimiques du colorant et de l'échantillon observé, qui déterminent la façon dont le colorant interagira avec l'échantillon. Dans la plupart des cas, il est préférable d'utiliser un colorant positif, un colorant qui sera absorbé par les cellules ou les organismes observés, en ajoutant de la couleur aux objets d'intérêt pour les faire ressortir sur le fond. Cependant, il existe des scénarios dans lesquels il est avantageux d'utiliser une coloration négative, qui est absorbée par l'arrière-plan mais pas par les cellules ou les organismes présents dans l'échantillon. La coloration négative produit un contour ou une silhouette des organismes sur un fond coloré (Figure\(\PageIndex{2}\)).

Comme les cellules ont généralement des parois cellulaires chargées négativement, les chromophores positifs contenus dans les colorants basiques ont tendance à adhérer aux parois cellulaires, ce qui en fait des taches positives. Ainsi, les colorants basiques couramment utilisés tels que la fuchsine basique, le violet cristallin, le vert malachite, le bleu de méthylène et la safranine servent généralement de colorants positifs. D'autre part, les chromophores chargés négativement des colorants acides sont repoussés par les parois cellulaires chargées négativement, ce qui en fait des taches négatives. Les colorants acides couramment utilisés incluent la fuchsine acide, l'éosine et le rose bengal. La figure\(\PageIndex{10}\) fournit plus de détails.
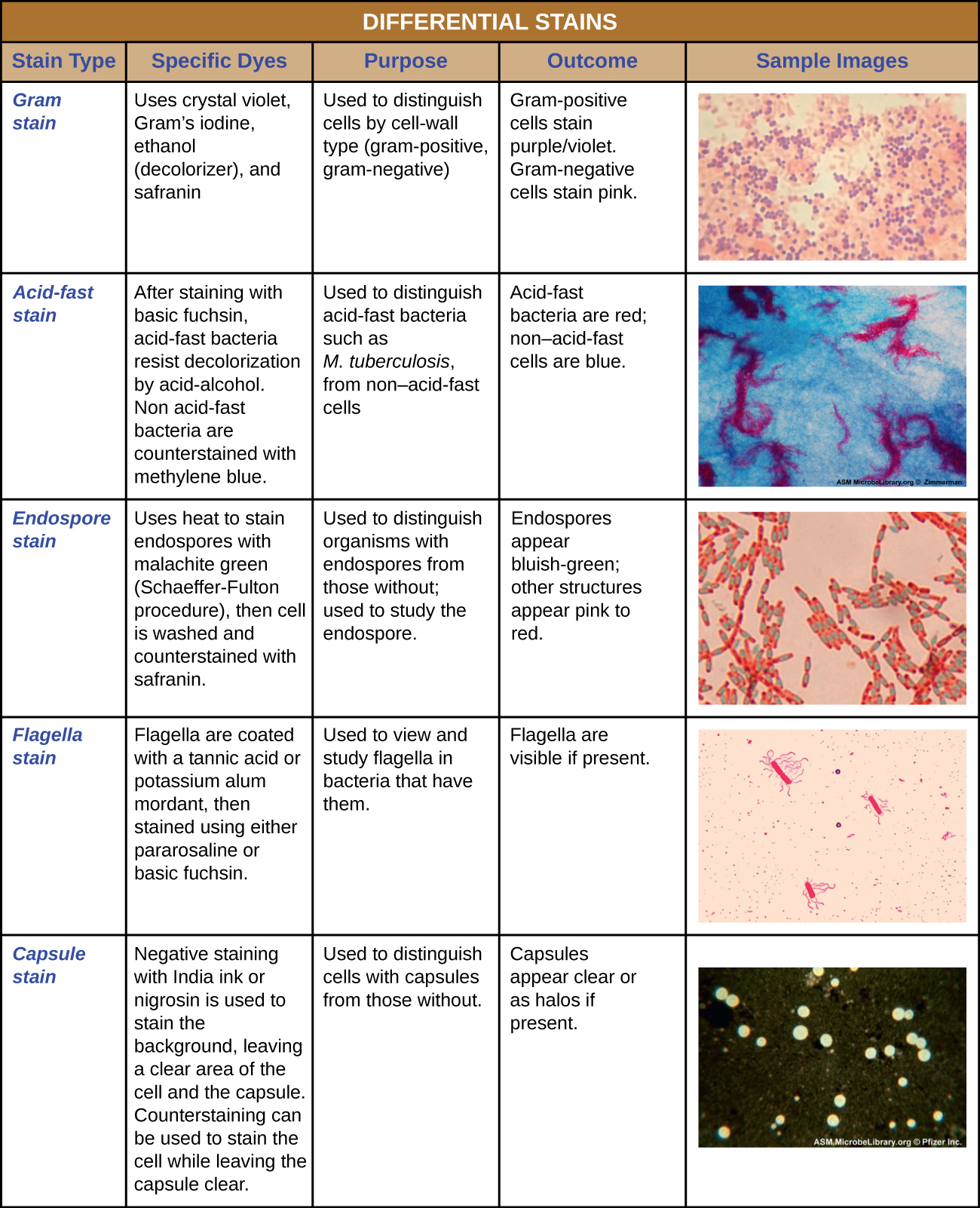
Certaines techniques de coloration impliquent l'application d'un seul colorant sur l'échantillon ; d'autres nécessitent plus d'un colorant. Dans le cas d'une coloration simple, un seul colorant est utilisé pour mettre en valeur des structures particulières de l'échantillon. Une simple coloration donne généralement l'impression que tous les organismes d'un échantillon sont de la même couleur, même si l'échantillon contient plus d'un type d'organisme. En revanche, la coloration différentielle permet de distinguer les organismes en fonction de leurs interactions avec de multiples colorants. En d'autres termes, deux organismes d'un échantillon coloré différemment peuvent sembler de couleurs différentes. Les techniques de coloration différentielle couramment utilisées en milieu clinique incluent la coloration Gram, la coloration acido-résistante, la coloration des endospores, la coloration des flagelles et la coloration des capsules. La figure\(\PageIndex{11}\) fournit plus de détails sur ces techniques de coloration différentielle.
Exercice\(\PageIndex{1}\)
- Expliquez pourquoi il est important de fixer un échantillon avant de le regarder au microscope optique.
- Quels types d'échantillons devraient être fixés chimiquement plutôt que fixés à chaud ?
- Pourquoi un colorant acide peut-il réagir différemment avec un échantillon donné par rapport à un colorant basique ?
- Expliquez la différence entre une coloration positive et une coloration négative.
- Expliquez la différence entre la coloration simple et la coloration différentielle.
Coloration aux grammes
La procédure de coloration Gram est une procédure de coloration différentielle qui comporte plusieurs étapes. Elle a été développée par le microbiologiste danois Hans Christian Gram en 1884 en tant que méthode efficace pour distinguer les bactéries présentant différents types de parois cellulaires. Aujourd'hui encore, elle reste l'une des techniques de coloration les plus fréquemment utilisées. Les étapes de la procédure de coloration de Gram sont répertoriées ci-dessous et illustrées dans la figure\(\PageIndex{3}\).
- Tout d'abord, le violet cristallin, une coloration primaire, est appliqué sur un frottis thermofixé, donnant à toutes les cellules une couleur violette.
- Ensuite, de l'iode de Gram, un mordant, est ajouté. Un mordant est une substance utilisée pour fixer ou stabiliser des taches ou des colorants ; dans ce cas, l'iode de Gram agit comme un agent piégeant qui se complexe avec le cristal violet, faisant en sorte que le complexe cristallin-violet et iode s'agglutine et reste contenu dans d'épaisses couches de peptidoglycane présentes dans les parois cellulaires.
- Ensuite, un agent décolorant est ajouté, généralement de l'éthanol ou une solution acétone/éthanol. Les cellules qui ont d'épaisses couches de peptidoglycane dans leurs parois cellulaires sont beaucoup moins affectées par l'agent décolorant ; elles retiennent généralement le colorant violet cristallin et restent violettes. Cependant, l'agent décolorant élimine plus facilement le colorant des cellules contenant des couches plus fines de peptidoglycane, les rendant à nouveau incolores.
- Enfin, une contre-coloration secondaire, généralement de la safranine, est ajoutée. Cela colore les cellules décolorées en rose et est moins visible dans les cellules qui contiennent encore le colorant violet cristallin.
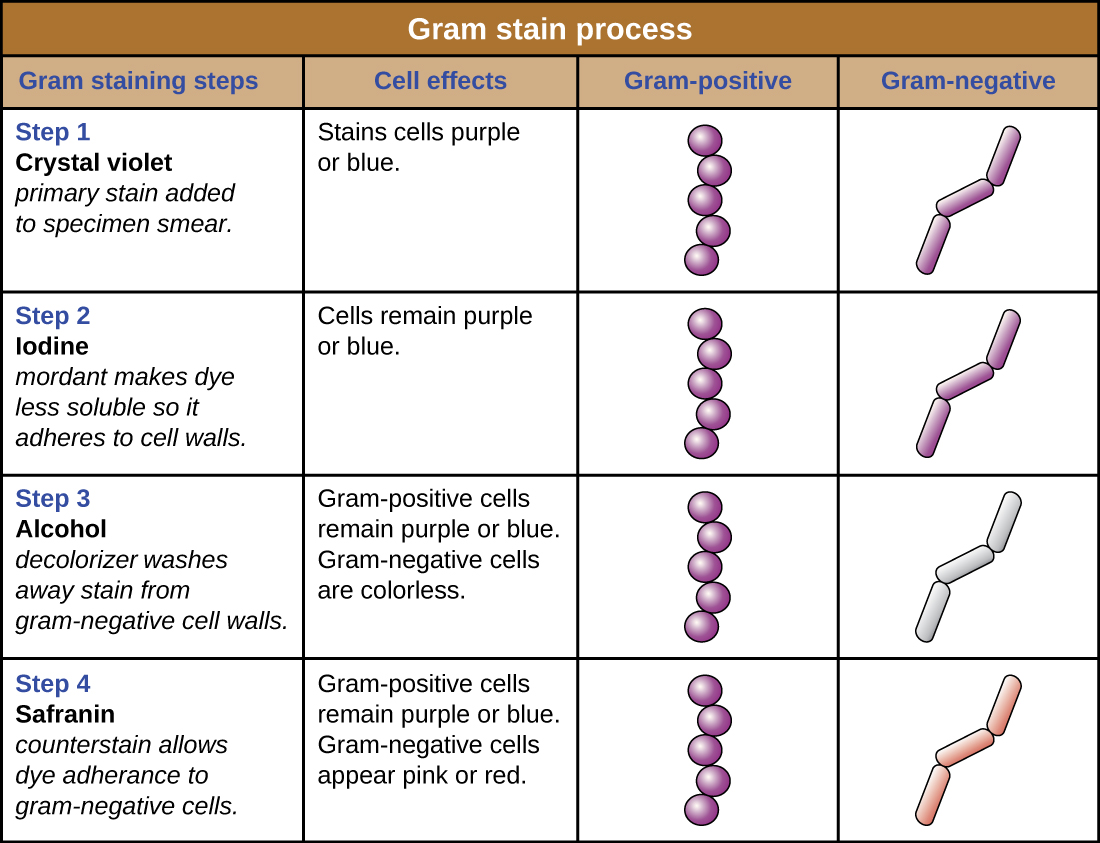
Les cellules colorées en violet cristallin sont appelées cellules gram-positives, tandis que les cellules rouges teintées à la safranine sont gram-négatives (Figure\(\PageIndex{4}\)). Cependant, plusieurs facteurs importants entrent en ligne de compte lorsqu'il s'agit d'interpréter les résultats d'une coloration de Gram. Tout d'abord, les parois cellulaires des cellules bactériennes plus anciennes peuvent être endommagées, ce qui leur donne une apparence gram-négative, même si l'espèce est gram-positive. Il est donc préférable d'utiliser des cultures bactériennes fraîches pour la coloration de Gram. Ensuite, des erreurs telles que le fait de laisser le décolorant trop longtemps sur le décolorant peuvent affecter les résultats. Dans certains cas, la plupart des cellules apparaîtront gram-positives tandis que quelques-unes apparaîtront gram-négatives (comme dans la figure\(\PageIndex{4}\)). Cela suggère que les cellules ont été endommagées ou que le décolorant a été laissé en place trop longtemps ; les cellules doivent tout de même être classées comme gram-positives si elles appartiennent toutes à la même espèce plutôt qu'à une culture mixte.
Outre leurs interactions différentes avec les colorants et les agents décolorants, les différences chimiques entre les cellules à Gram positif et à Gram négatif ont d'autres implications d'importance clinique. Par exemple, la coloration Gram peut aider les cliniciens à classer les bactéries pathogènes présentes dans un échantillon en catégories associées à des propriétés spécifiques. Les bactéries gram-négatives ont tendance à être plus résistantes à certains antibiotiques que les bactéries gram-positives. Nous aborderons cette question et d'autres applications de la coloration Gram plus en détail dans les chapitres suivants.
Exercice\(\PageIndex{2}\)
- Expliquer le rôle de l'iode de Gram dans la procédure de coloration de Gram.
- Expliquez le rôle de l'alcool dans la procédure de coloration de Gram.
- De quelle couleur sont les cellules Gram positif et Gram négatif, respectivement, après la procédure de coloration à Gram ?
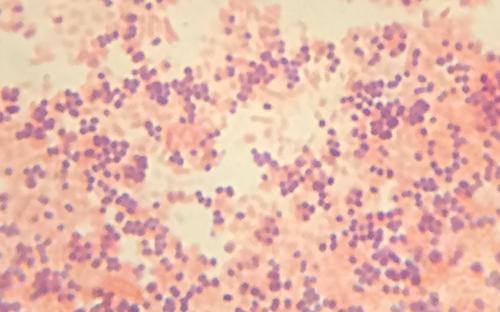
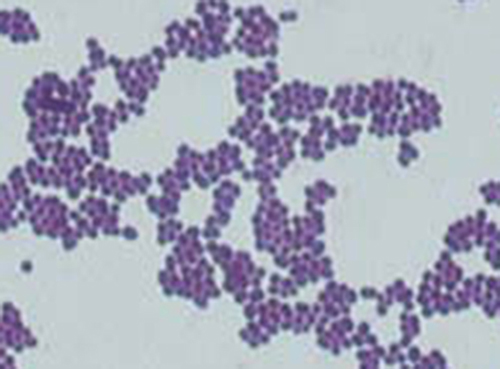
Orientation clinique : 3e partie
L'examen de l'échantillon de Cindy au microscope à fond noir a fourni à la technicienne des indices importants sur l'identité du microbe à l'origine de son infection. Cependant, de plus amples informations sont nécessaires pour établir un diagnostic concluant. Le technicien décide de faire une coloration de Gram sur l'échantillon. Cette technique est couramment utilisée comme étape précoce de l'identification des bactéries pathogènes. Une fois la procédure de coloration de Gram terminée, le technicien regarde la lame au microscope à fond clair et observe des amas de cellules sphériques violettes ressemblant à du raisin (Figure\(\PageIndex{5}\)).
Exercice\(\PageIndex{3}\)
- Ces bactéries sont-elles gram-positives ou gram-négatives ?
- Qu'est-ce que cela révèle sur leurs parois cellulaires ?
Taches résistantes aux acides
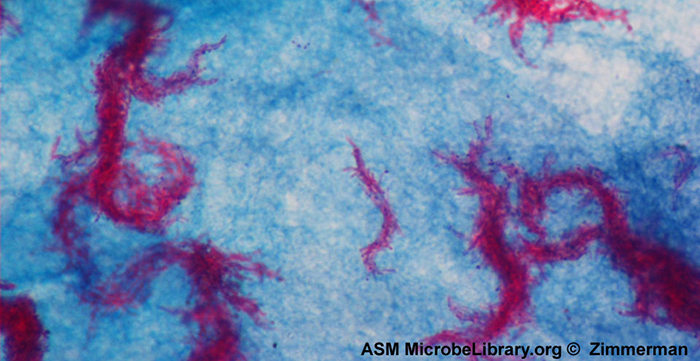
La coloration résistante aux acides est une autre technique de coloration différentielle couramment utilisée qui peut constituer un outil de diagnostic important. Une coloration résistante aux acides permet de différencier deux types de cellules à Gram positif : celles qui ont des acides mycoliques cireux dans leurs parois cellulaires et celles qui n'en ont pas. Deux méthodes différentes de coloration résistante aux acides sont la technique Ziehl-Neelsen et la technique Kinyoun. Les deux utilisent la carbolfuchsine comme colorant principal. Les cellules cireuses résistantes aux acides retiennent la carbolfuchsine même après l'application d'un agent décolorant (solution acide-alcool). Une contre-coloration secondaire, le bleu de méthylène, est ensuite appliquée, ce qui rend les cellules non résistantes aux acides bleues.
La différence fondamentale entre les deux méthodes à base de carbolfuchsine réside dans l'utilisation de chaleur lors du processus de coloration primaire. La méthode Ziehl-Neelsen utilise la chaleur pour infuser la carbolfuchsine dans les cellules acido-résistantes, alors que la méthode Kinyoun n'utilise pas de chaleur. Les deux techniques sont des outils diagnostiques importants car un certain nombre de maladies spécifiques sont causées par des bactéries acido-résistantes (AFB). Si des AFB sont présentes dans un échantillon de tissu, leur couleur rouge ou rose est clairement visible sur le fond bleu des cellules tissulaires environnantes (Figure\(\PageIndex{6}\)).
Exercice\(\PageIndex{4}\)
Pourquoi les teintures résistantes aux acides sont-elles utiles ?
La bactérie responsable de la tuberculose, Mycobacterium tuberculosis, peut être détectée dans des échantillons sur la base de la présence de bacilles acido-résistants. Souvent, un frottis est préparé à partir d'un échantillon des expectorations du patient, puis coloré à l'aide de la technique Ziehl-Neelsen (Figure\(\PageIndex{6}\)). Si la présence de bactéries acido-résistantes est confirmée, elles sont généralement mises en culture pour permettre une identification positive. Des variantes de cette approche peuvent être utilisées comme première étape pour déterminer si M. tuberculosis ou d'autres bactéries acido-résistantes sont présentes, bien que des échantillons provenant d'autres parties du corps (comme l'urine) puissent contenir d'autres espèces de Mycobacterium.
L'immunofluorescence est une autre approche pour déterminer la présence de M. tuberculosis. Dans cette technique, les anticorps marqués au fluorochrome se lient à M. tuberculosis, s'ils sont présents. Des colorants fluorescents spécifiques aux anticorps peuvent être utilisés pour observer les mycobactéries au microscope à fluorescence.
Coloration des capsules
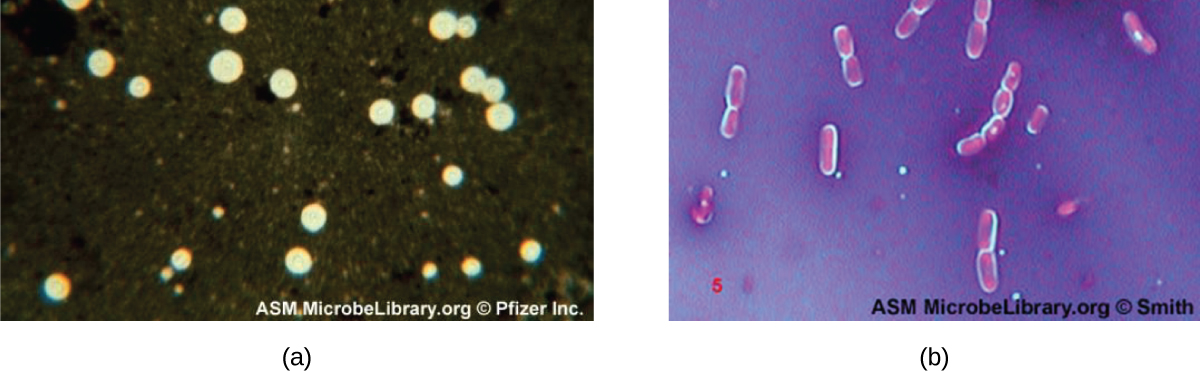
Certaines bactéries et levures possèdent une structure externe protectrice appelée capsule. Comme la présence d'une capsule est directement liée à la virulence d'un microbe (sa capacité à provoquer une maladie), la capacité de déterminer si les cellules d'un échantillon contiennent des capsules est un outil diagnostique important. Les gélules n'absorbent pas la plupart des colorants basiques ; par conséquent, une technique de coloration négative (coloration autour des cellules) est généralement utilisée pour la coloration des gélules. Le colorant colore le fond mais ne pénètre pas dans les capsules, qui apparaissent comme des halos sur les bords de la cellule. L'échantillon n'a pas besoin d'être thermofixé avant la coloration négative.
Une technique de coloration négative courante pour identifier les levures et les bactéries encapsulées consiste à ajouter quelques gouttes d'encre de Chine ou de nigrosine à un échantillon. D'autres colorants capsulaires peuvent également être utilisés pour colorer négativement les cellules encapsulées (Figure\(\PageIndex{7}\)). Des techniques de coloration positive et négative peuvent également être combinées pour visualiser les capsules : la coloration positive colore le corps de la cellule, et la coloration négative colore l'arrière-plan mais pas la capsule, laissant un halo autour de chaque cellule.
Exercice\(\PageIndex{5}\)
Comment la coloration négative nous aide-t-elle à visualiser les gélules ?
Coloration des endospores
Les endospores sont des structures produites dans certaines cellules bactériennes qui leur permettent de survivre dans des conditions difficiles. La coloration Gram seule ne peut pas être utilisée pour visualiser les endospores, qui apparaissent clairement lorsque des cellules colorées au Gram sont observées. La coloration des endospores utilise deux colorants pour différencier les endospores du reste de la cellule. La méthode de Schaeffer-Fulton (la technique de coloration des endospores la plus couramment utilisée) utilise la chaleur pour pousser le colorant primaire (vert malachite) dans l'endospore. Le lavage à l'eau décolore la cellule, mais l'endospore conserve la tache verte. La cellule est ensuite contre-colorée en rose avec de la safranine. L'image obtenue révèle la forme et l'emplacement des endospores, si elles sont présentes. Les endospores vertes apparaîtront soit à l'intérieur des cellules végétatives roses, soit séparément des cellules roses. Si aucune endospore n'est présente, seules les cellules végétatives roses seront visibles (Figure\(\PageIndex{8}\)).
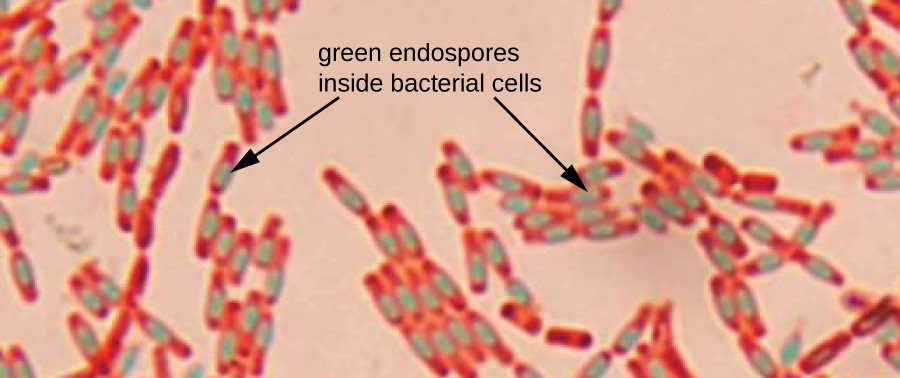
Les techniques de coloration des endospores sont importantes pour identifier Bacillus et Clostridium, deux genres de bactéries productrices d'endospores qui contiennent des espèces cliniquement significatives. Parmi d'autres, B. anthracis (responsable de la fièvre charbonneuse) a suscité un intérêt particulier en raison de la crainte que ses spores ne soient utilisées comme agent bioterroriste. C. difficile est une espèce particulièrement importante responsable de l'infection typiquement nosocomiale connue sous le nom de « C. diff ».
Exercice\(\PageIndex{6}\)
La coloration des endospores est-elle un exemple de coloration positive, négative ou différentielle ?
Coloration des flagelles
Les flagelles (au singulier : flagelle) sont des structures cellulaires semblables à des queues utilisées pour la locomotion par certaines bactéries, archées et eucaryotes. Comme ils sont si fins, les flagelles ne peuvent généralement pas être observés au microscope optique sans une technique spécialisée de coloration des flagelles. La coloration des flagelles permet d'épaissir les flagelles en appliquant d'abord un mordant (généralement de l'acide tanique, mais parfois de l'alun de potassium), qui recouvre les flagelles ; ensuite, l'échantillon est coloré avec de la pararosaniline (le plus souvent) ou de la fuchsine basique (Figure\(\PageIndex{9}\)).
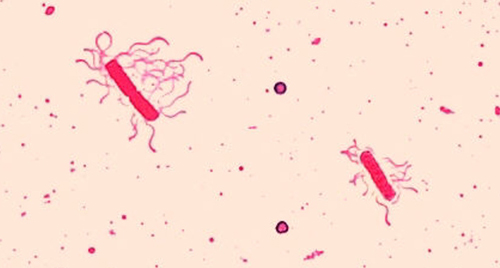
Bien que la coloration des flagelles soit rare en milieu clinique, cette technique est couramment utilisée par les microbiologistes, car la localisation et le nombre de flagelles peuvent être utiles pour classer et identifier les bactéries dans un échantillon. Lors de l'utilisation de cette technique, il est important de manipuler l'échantillon avec le plus grand soin ; les flagelles sont des structures délicates qui peuvent facilement être endommagées ou arrachées, compromettant ainsi les tentatives de localiser et de compter avec précision le nombre de flagelles.
Préparation des échantillons pour la microscopie électronique
Les échantillons à analyser à l'aide d'un TEM doivent avoir des sections très fines. Mais les cellules sont trop molles pour être coupées finement, même avec des couteaux diamantés. Pour couper les cellules sans les endommager, les cellules doivent être incorporées dans de la résine plastique puis déshydratées par une série de trempages dans des solutions d'éthanol (50 %, 60 %, 70 %, etc.). L'éthanol remplace l'eau dans les cellules, et la résine se dissout dans l'éthanol et pénètre dans la cellule, où elle se solidifie. Ensuite, les fines sections sont découpées à l'aide d'un appareil spécialisé appelé ultramicrotome (Figure\(\PageIndex{12}\)). Enfin, les échantillons sont fixés sur de fins fils de cuivre ou des grilles en fibres de carbone et teints, non pas avec des colorants colorés, mais avec des substances telles que l'acétate d'uranyle ou le tétroxyde d'osmium, qui contiennent des atomes de métaux lourds denses aux électrons.

Lorsque les échantillons sont préparés pour la visualisation à l'aide d'un SEM, ils doivent également être déshydratés à l'aide d'une série d'éthanol. Cependant, ils doivent être encore plus secs que ce qui est nécessaire pour un TEM. Un séchage au point critique avec du dioxyde de carbone liquide inerte sous pression est utilisé pour déplacer l'eau de l'échantillon. Après séchage, les échantillons sont recouverts de métal par pulvérisation cathodique en projetant des atomes d'une cible de palladium contenant des particules énergétiques. Le revêtement par pulvérisation empêche les échantillons d'être chargés par le faisceau d'électrons du SEM.
Exercice\(\PageIndex{7}\)
- Pourquoi est-il important de déshydrater les cellules avant de les examiner au microscope électronique ?
- Nommez le dispositif utilisé pour créer de fines sections d'échantillons pour la microscopie électronique.
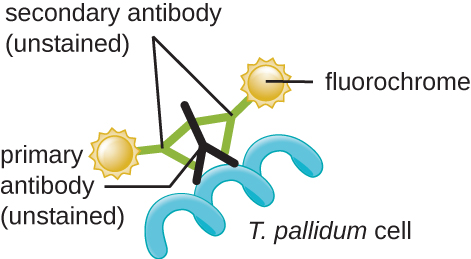
L'agent responsable de la syphilis est Treponema pallidum, une cellule spiralée flexible (spirochète) qui peut être très fine (<0,15 μm) et correspondre à l'indice de réfraction du milieu, ce qui la rend difficile à visualiser par microscopie à fond clair. De plus, cette espèce n'a pas été cultivée avec succès en laboratoire sur un milieu artificiel ; par conséquent, le diagnostic dépend de l'identification réussie à l'aide de techniques microscopiques et de sérologie (analyse des fluides corporels, souvent à la recherche d'anticorps contre un agent pathogène). Comme la fixation et la coloration tueraient les cellules, la microscopie sur fond noir est généralement utilisée pour observer des spécimens vivants et observer leurs mouvements. Cependant, d'autres approches peuvent également être utilisées. Par exemple, les cellules peuvent être épaissies avec des particules d'argent (dans des coupes de tissu) et observées au microscope optique. Il est également possible d'utiliser la fluorescence ou la microscopie électronique pour visualiser le tréponème (Figure\(\PageIndex{13}\)).

En milieu clinique, l'immunofluorescence indirecte est souvent utilisée pour identifier le tréponème. Un anticorps primaire non coloré se fixe directement à la surface de l'agent pathogène, et des anticorps secondaires « marqués » par une coloration fluorescente se fixent à l'anticorps primaire. De multiples anticorps secondaires peuvent se fixer à chaque anticorps primaire, amplifiant ainsi la quantité de colorant attachée à chaque cellule du tréponème et les rendant plus faciles à détecter (Figure\(\PageIndex{14}\)).
Préparation et coloration pour d'autres microscopes
Les échantillons pour la microscopie à fluorescence et la microscopie confocale sont préparés de la même manière que les échantillons pour la microscopie optique, sauf que les colorants sont des fluorochromes. Les taches sont souvent diluées dans un liquide avant d'être appliquées sur la lame. Certains colorants se fixent à un anticorps pour colorer des protéines spécifiques sur des types de cellules spécifiques (immunofluorescence) ; d'autres peuvent se fixer à des molécules d'ADN par un processus appelé hybridation in situ par fluorescence (FISH), provoquant la coloration des cellules selon qu'elles possèdent ou non une séquence d'ADN spécifique.
La préparation des échantillons pour la microscopie à deux photons est similaire à la microscopie à fluorescence, à l'exception de l'utilisation de colorants infrarouges. Les échantillons destinés à la STM doivent être posés sur une surface très propre et atomiquement lisse. Il s'agit souvent de mica recouvert d'Au (111). La vapeur de toluène est un fixateur courant.
Exercice\(\PageIndex{8}\)
Quelle est la principale différence entre la préparation d'un échantillon pour la microscopie à fluorescence et la microscopie optique ?
Lien vers l'apprentissage
Les études de cas en microscopie de l'université Cornell proposent une série de problèmes cliniques basés sur des événements réels. Chaque étude de cas vous guide à travers un problème clinique en utilisant des techniques de microscopie appropriées à chaque étape.
Orientation clinique : résolution
Grâce aux résultats de la coloration de Gram, le technicien sait maintenant que l'infection de Cindy est causée par des bactéries sphériques à Gram positif qui forment des grappes ressemblant à du raisin, ce qui est typique des bactéries staphylococciques. Après quelques tests supplémentaires, le technicien détermine que ces bactéries sont l'espèce médicalement importante connue sous le nom de Staphylococcus aureus, responsable le plus fréquent des infections des plaies. Certaines souches de S. aureus étant résistantes à de nombreux antibiotiques, les infections cutanées peuvent se propager à d'autres parties du corps et devenir graves, parfois même entraîner des amputations ou la mort si les antibiotiques appropriés ne sont pas utilisés.
Après avoir testé plusieurs antibiotiques, le laboratoire est en mesure d'en identifier un qui est efficace contre cette souche particulière de S. aureus. Le médecin de Cindy prescrit rapidement le médicament et souligne l'importance de prendre la totalité du traitement antibiotique, même si l'infection semble disparaître avant la dernière dose prévue. Cela réduit le risque que des bactéries particulièrement résistantes puissent survivre, provoquer une deuxième infection ou se propager à une autre personne.
À mesure que l'utilisation d'antibiotiques a proliféré en médecine et en agriculture, les microbes ont évolué pour devenir plus résistants. Les souches de bactéries telles que le S. aureus résistant à la méthicilline (SARM), qui a développé un haut niveau de résistance à de nombreux antibiotiques, constituent un problème de plus en plus inquiétant, à tel point que des recherches sont en cours pour mettre au point de nouveaux antibiotiques plus diversifiés.
La microscopie à fluorescence peut être utile pour tester l'efficacité de nouveaux antibiotiques contre des souches résistantes telles que le SARM. Lors de l'essai d'un nouvel antibiotique dérivé d'une bactérie marine, le MC21-A (bromophène), les chercheurs ont utilisé le colorant fluorescent SYTOX Green pour colorer des échantillons de SARM. Le SYTOX Green est souvent utilisé pour distinguer les cellules mortes des cellules vivantes, par microscopie à fluorescence. Les cellules vivantes n'absorberont pas le colorant, mais les cellules tuées par un antibiotique absorberont le colorant, car l'antibiotique a endommagé la membrane cellulaire bactérienne. Dans ce cas précis, les bactéries du SARM qui avaient été exposées au MC21-A sont effectivement apparues vertes au microscope à fluorescence, ce qui a amené les chercheurs à conclure qu'il s'agissait d'un antibiotique efficace contre le SARM.
Bien entendu, certains affirment que la mise au point de nouveaux antibiotiques ne fera que créer encore plus de microbes résistants aux antibiotiques, appelés superbactéries, qui pourraient engendrer des épidémies avant que de nouveaux traitements ne soient mis au point. C'est pourquoi de nombreux professionnels de santé commencent à faire preuve de plus de discrétion dans la prescription d'antibiotiques. Alors que les antibiotiques étaient autrefois prescrits régulièrement pour des maladies courantes sans diagnostic précis, les médecins et les hôpitaux sont beaucoup plus enclins à effectuer des tests supplémentaires pour déterminer si un antibiotique est nécessaire et approprié avant de le prescrire.
Un patient malade peut raisonnablement s'opposer à cette approche avare de prescription d'antibiotiques. Pour le patient qui souhaite simplement se sentir mieux le plus rapidement possible, les avantages potentiels de la prise d'un antibiotique peuvent sembler l'emporter sur les risques immédiats pour la santé qui pourraient survenir si l'antibiotique est inefficace. Mais à quel moment les risques d'une utilisation généralisée d'antibiotiques l'emportent-ils sur le désir de les utiliser dans des cas individuels ?
Concepts clés et résumé
- Les échantillons doivent être correctement préparés pour la microscopie. Cela peut impliquer la coloration, la fixation et/ou la découpe de sections minces.
- Diverses techniques de coloration peuvent être utilisées en microscopie optique, notamment la coloration Gram, la coloration acido-résistante, la coloration des capsules, la coloration des endospores et la coloration des flagelles.
- Les échantillons destinés à la TEM nécessitent des sections très fines, tandis que les échantillons destinés au SEM nécessitent un revêtement par pulvérisation.
- La préparation pour la microscopie à fluorescence est similaire à celle pour la microscopie optique, sauf que des fluorochromes sont utilisés.


