2.3 : Instruments de microscopie
- Page ID
- 187809
Objectifs d'apprentissage
- Identifier et décrire les pièces d'un microscope à fond clair
- Calculer le grossissement total pour un microscope composé
- Décrire les caractéristiques distinctives et les utilisations typiques de divers types de microscopes optiques, de microscopes électroniques et de microscopes à sonde à balayage
Les premiers pionniers de la microscopie ont ouvert une fenêtre sur le monde invisible des microorganismes. Mais la microscopie a continué de progresser au cours des siècles qui ont suivi. En 1830, Joseph Jackson Lister a créé un microscope optique essentiellement moderne. Le 20e siècle a vu le développement de microscopes qui exploitent la lumière non visible, tels que la microscopie à fluorescence, qui utilise une source de lumière ultraviolette, et la microscopie électronique, qui utilise des faisceaux d'électrons de courte longueur d'onde. Ces avancées ont entraîné des améliorations majeures en termes de grossissement, de résolution et de contraste. En comparaison, les microscopes relativement rudimentaires de van Leeuwenhoek et de ses contemporains étaient bien moins puissants que les microscopes les plus basiques utilisés aujourd'hui. Dans cette section, nous examinerons le large éventail de technologies microscopiques modernes et les applications courantes pour chaque type de microscope.
Microscopie optique
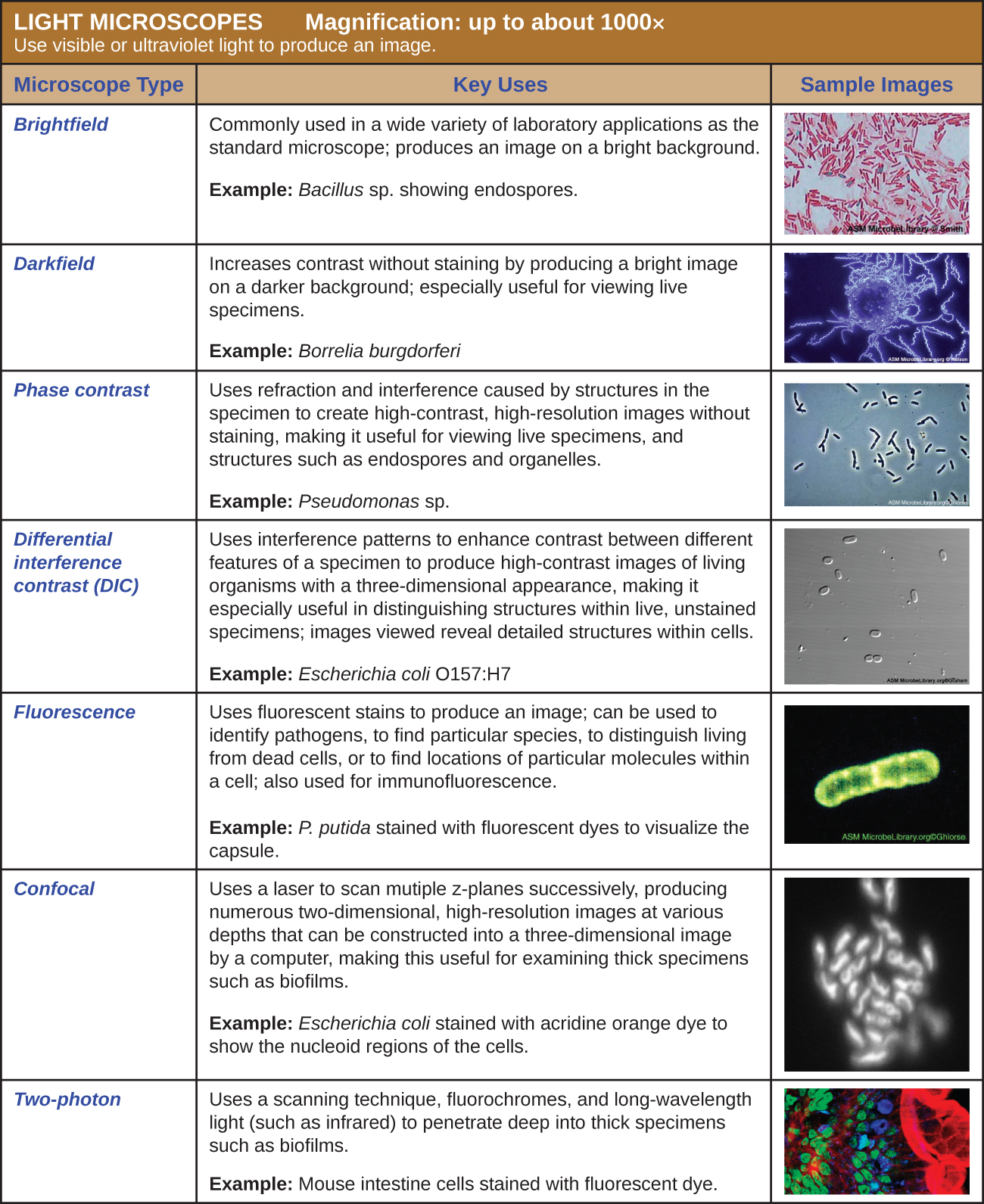
De nombreux types de microscopes entrent dans la catégorie des microscopes optiques, qui utilisent la lumière pour visualiser des images. Des exemples de microscopes optiques incluent les microscopes à fond clair, les microscopes à fond noir, les microscopes à contraste de phase, les microscopes à contraste d'interférence différentielle, les microscopes à fluorescence, les microscopes laser à balayage confocal et les microscopes à deux photons. Ces différents types de microscopes optiques peuvent être utilisés de manière complémentaire dans les domaines du diagnostic et de la recherche.
Microscopes à fond clair
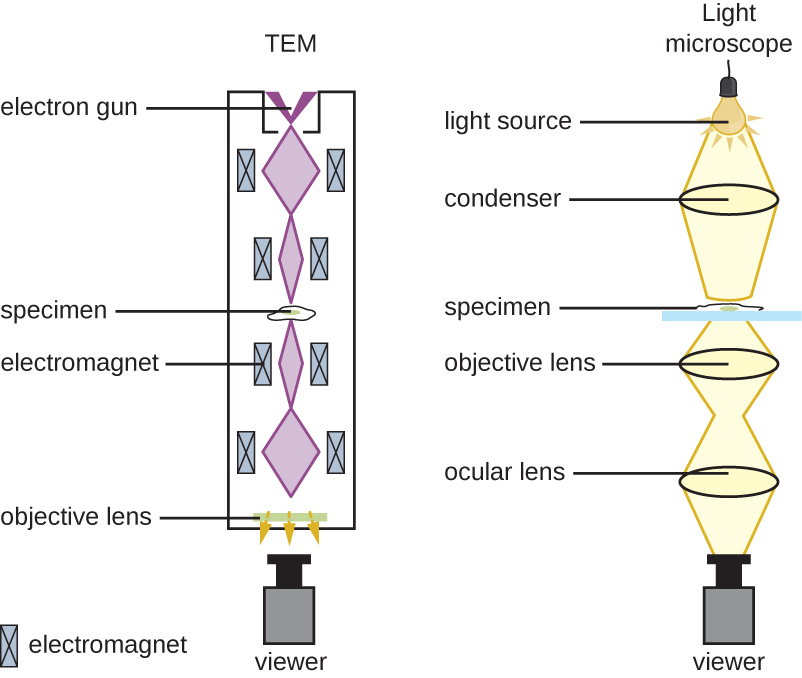
Le microscope à fond clair, peut-être le type de microscope le plus couramment utilisé, est un microscope composé de deux lentilles ou plus qui produit une image sombre sur un fond clair. Certains microscopes à fond clair sont monoculaires (dotés d'un seul oculaire), bien que la plupart des nouveaux microscopes à fond clair soient binoculaires (dotés de deux oculaires), comme celui illustré sur la figure\(\PageIndex{1}\) ; dans les deux cas, chaque oculaire contient une lentille appelée lentille oculaire. Les lentilles oculaires grossissent généralement les images 10 fois (10). À l'autre extrémité du tube corporel se trouvent un ensemble de lentilles d'objectif fixées sur un embout nasal rotatif. Le grossissement de ces objectifs est généralement compris entre 4 et 100, le grossissement de chaque objectif étant indiqué sur le boîtier métallique de l'objectif. Les lentilles oculaires et objectives fonctionnent ensemble pour créer une image agrandie. Le grossissement total est le produit du grossissement oculaire par le grossissement objectif :
\[\text{ocular magnification} \times \text{objective magnification} \nonumber\]
Par exemple, si une lentille d'\(40 \times\)objectif est sélectionnée alors que la lentille oculaire l'est\(10\times\), le grossissement total serait
\[(40×)(10×)=400× \nonumber\]
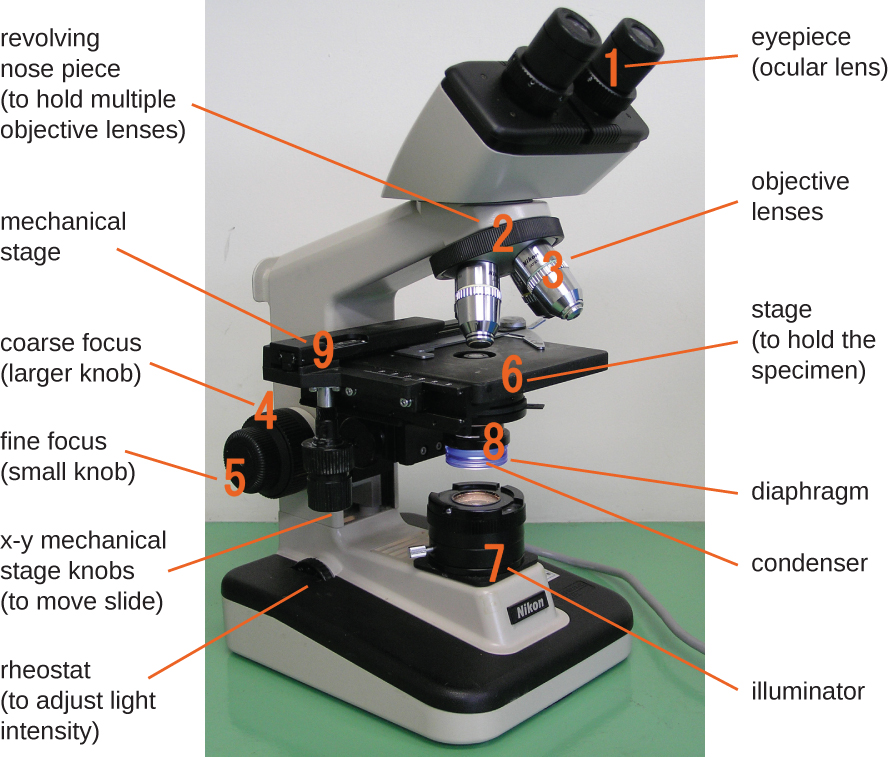
Composants d'un microscope à fond clair classique.
L'objet visualisé s'appelle un spécimen. L'échantillon est placé sur une lame de verre, qui est ensuite clipsée sur la platine (plate-forme) du microscope. Une fois la lame fixée, l'échantillon sur la lame est positionné au-dessus de la lumière à l'aide des boutons de scène mécaniques x-y. Ces boutons déplacent la glissière sur la surface de la scène, mais ne la soulèvent ni ne l'abaissent. Une fois que l'échantillon est centré au-dessus de la lumière, la position de la scène peut être élevée ou abaissée pour focaliser l'image. Le bouton de mise au point grossière est utilisé pour les mouvements à grande échelle avec des objectifs 4 et 10 ; le bouton de mise au point fine est utilisé pour les mouvements à petite échelle, en particulier avec des objectifs de 40 ou 100.
Lorsque les images sont agrandies, elles s'assombrissent car il y a moins de lumière par unité de surface d'image. Les images fortement agrandies produites par des microscopes nécessitent donc un éclairage intense. Dans un microscope à fond clair, cette lumière est fournie par un illuminateur, qui est généralement une ampoule à haute intensité située sous la scène. La lumière provenant de l'illuminateur passe par une lentille condenseuse (située sous la scène), qui concentre tous les rayons lumineux sur l'échantillon afin de maximiser l'éclairage. La position du condenseur peut être optimisée à l'aide du bouton de mise au point du condenseur intégré ; une fois la distance optimale établie, le condenseur ne doit pas être déplacé pour régler la luminosité. Si des niveaux de lumière inférieurs au maximum sont nécessaires, la quantité de lumière frappant l'échantillon peut être facilement ajustée en ouvrant ou en fermant un diaphragme entre le condenseur et l'échantillon. Dans certains cas, la luminosité peut également être réglée à l'aide du rhéostat, un variateur qui contrôle l'intensité de l'illuminateur.
Un microscope à fond clair crée une image en dirigeant la lumière de l'illuminateur vers l'échantillon ; cette lumière est transmise, absorbée, réfléchie ou réfractée de manière différentielle par différentes structures. Les différentes couleurs peuvent se comporter différemment lorsqu'elles interagissent avec les chromophores (pigments qui absorbent et réfléchissent certaines longueurs d'onde de lumière) présents dans certaines parties de l'échantillon. Souvent, des chromophores sont ajoutés artificiellement à l'échantillon à l'aide de colorants, qui servent à augmenter le contraste et la résolution. En général, les structures de l'échantillon apparaissent plus foncées, à des degrés divers, que l'arrière-plan clair, ce qui crée des images d'une netteté maximale à des grossissements allant jusqu'à environ 1 000. Un agrandissement supplémentaire créerait une image plus grande, mais sans augmentation de la résolution. Cela nous permet de voir des objets aussi petits que des bactéries, visibles à environ 400 degrés, mais pas des objets plus petits tels que des virus.
À des grossissements très élevés, la résolution peut être compromise lorsque la lumière traverse la petite quantité d'air entre l'échantillon et la lentille. Cela est dû à la grande différence entre les indices de réfraction de l'air et du verre ; l'air diffuse les rayons lumineux avant qu'ils ne puissent être focalisés par la lentille. Pour résoudre ce problème, une goutte d'huile peut être utilisée pour remplir l'espace entre l'échantillon et une lentille à immersion dans l'huile, une lentille spéciale conçue pour être utilisée avec des huiles d'immersion. Comme l'huile a un indice de réfraction très similaire à celui du verre, elle augmente l'angle maximum auquel la lumière sortant de l'échantillon peut frapper la lentille. Cela augmente la lumière collectée et, par conséquent, la résolution de l'image (Figure\(\PageIndex{2}\)). Diverses huiles peuvent être utilisées pour différents types de lumière.
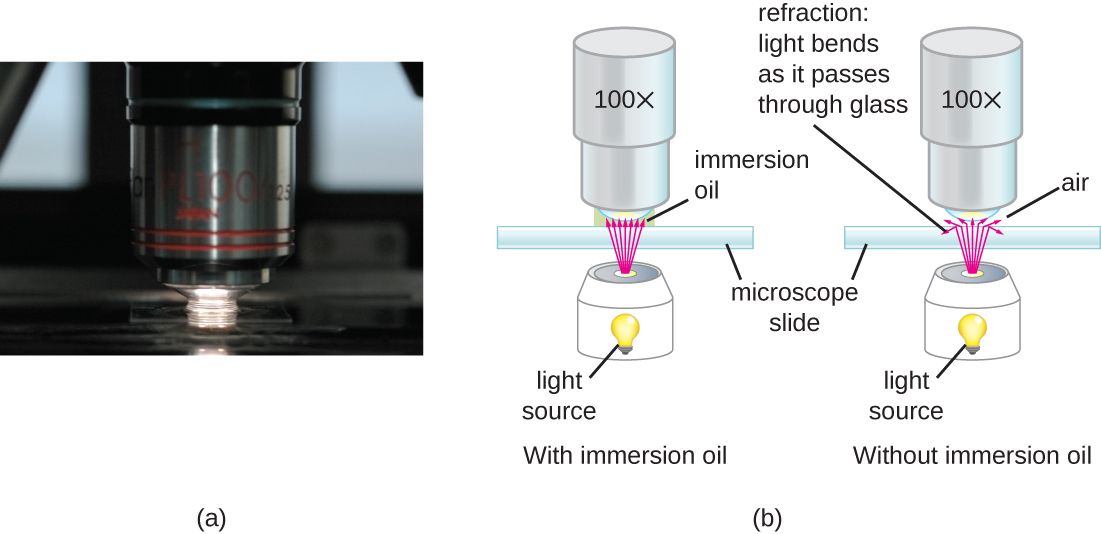
Même un microscope très puissant ne peut pas fournir d'images à haute résolution s'il n'est pas correctement nettoyé et entretenu. Comme les lentilles sont soigneusement conçues et fabriquées pour réfracter la lumière avec une grande précision, même une lentille légèrement sale ou rayée réfractera la lumière de manière involontaire, dégradant ainsi l'image de l'échantillon. De plus, les microscopes sont des instruments assez délicats et il faut faire très attention à ne pas endommager les pièces et les surfaces. Entre autres choses, l'entretien approprié d'un microscope comprend les éléments suivants :
- nettoyage des lentilles avec du papier pour lentilles
- empêcher les lentilles d'entrer en contact avec la lame (par exemple, en modifiant rapidement la mise au point)
- protéger l'ampoule (s'il y en a une) contre les bris
- ne pas pousser un objectif dans une diapositive
- ne pas utiliser le bouton de mise au point grossière lorsque vous utilisez des objectifs à 40° ou plus
- en utilisant uniquement de l'huile d'immersion avec un objectif d'huile spécialisé, généralement l'objectif de 100 %
- huile de nettoyage des lentilles à immersion après utilisation du microscope
- nettoyer toute huile transférée accidentellement par d'autres lentilles
- recouvrir le microscope ou le placer dans une armoire lorsqu'il n'est pas utilisé
Microscopie à fond noir
Un microscope à fond noir est un microscope à fond clair qui présente une modification mineure mais significative du condenseur. Un petit disque opaque (environ 1 cm de diamètre) est placé entre l'illuminateur et la lentille du condenseur. Ce stop de lumière opaque, comme on appelle le disque, bloque la majeure partie de la lumière provenant de l'illuminateur lorsqu'elle traverse le condenseur pour se rendre à l'objectif, produisant ainsi un cône de lumière creux qui est focalisé sur l'échantillon. La seule lumière qui atteint l'objectif est celle qui a été réfractée ou réfléchie par les structures de l'échantillon. L'image obtenue montre généralement des objets clairs sur un fond sombre (Figure\(\PageIndex{3}\))
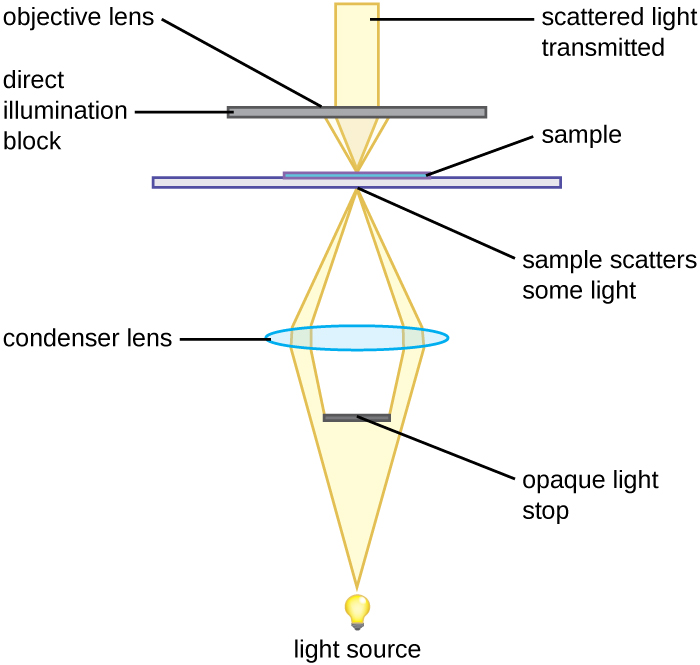
Un diaphragme optique opaque inséré dans un microscope à fond clair est utilisé pour produire une image sur fond noir. Le diaphragme empêche la lumière de se déplacer directement de l'illuminateur vers l'objectif, permettant ainsi à seule la lumière réfléchie ou réfractée par l'échantillon d'atteindre l'œil.
La microscopie sur fond noir permet souvent de créer des images à haute résolution et à contraste élevé d'échantillons sans utiliser de colorants, ce qui est particulièrement utile pour observer des spécimens vivants qui pourraient être tués ou autrement endommagés par les taches. Par exemple, il est préférable de visualiser des spirochètes fins tels que Treponema pallidum, l'agent responsable de la syphilis, à l'aide d'un microscope à fond noir (Figure\(\PageIndex{4}\)).
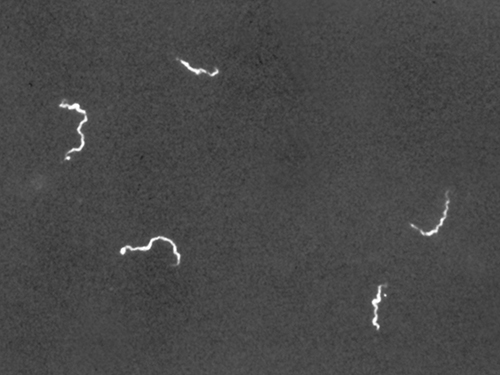
L'utilisation d'un microscope à fond noir nous permet de visualiser des échantillons vivants non colorés du spirochète Treponema pallidum. Semblables à un négatif photographique, les spirochètes apparaissent brillants sur un fond sombre. (crédit : Centres pour le contrôle et la prévention des maladies/C.W. Hubbard)
Exercice\(\PageIndex{1}\)
Identifier les principales différences entre la microscopie à fond clair et la microscopie à fond noir.
Orientation clinique : partie 2
Les infections des plaies comme celle de Cindy peuvent être causées par de nombreux types de bactéries, dont certaines peuvent se propager rapidement et entraîner de graves complications. Il est très important d'identifier la cause précise pour choisir un médicament capable de tuer ou d'arrêter la croissance de la bactérie.
Après avoir appelé un médecin local à propos du cas de Cindy, l'infirmière du camp envoie l'échantillon prélevé sur la plaie au laboratoire médical le plus proche. Malheureusement, comme le camp se trouve dans une région isolée, le laboratoire le plus proche est petit et mal équipé. Un laboratoire plus moderne utiliserait probablement d'autres méthodes pour cultiver, cultiver et identifier la bactérie, mais dans ce cas, le technicien décide de fabriquer une monture humide à partir de l'échantillon et de l'examiner au microscope à fond clair. Dans un support humide, une petite goutte d'eau est ajoutée à la lame, et un couvercle est placé sur l'échantillon pour le maintenir en place avant qu'il ne soit placé sous l'objectif.
Au microscope à fond clair, le technicien peut à peine voir les cellules bactériennes car elles sont presque transparentes sur le fond clair. Pour augmenter le contraste, le technicien insère un diaphragme opaque au-dessus de l'illuminateur. L'image sur fond noir qui en résulte montre clairement que les cellules bactériennes sont sphériques et regroupées en grappes, comme les raisins.
- Pourquoi est-il important d'identifier la forme et les modèles de croissance des cellules d'un échantillon ?
- Quels autres types de microscopie pourraient être utilisés efficacement pour visualiser cet échantillon ?
Microscopes à contraste de phase
Les microscopes à contraste de phase utilisent la réfraction et les interférences causées par les structures d'un échantillon pour créer des images à contraste élevé et à haute résolution sans coloration. Il s'agit du type de microscope le plus ancien et le plus simple qui crée une image en modifiant la longueur d'onde des rayons lumineux traversant l'échantillon. Pour créer des trajets de longueur d'onde modifiés, une butée annulaire est utilisée dans le condenseur. La butée annulaire produit un cône de lumière creux qui est focalisé sur l'échantillon avant d'atteindre l'objectif. L'objectif contient une plaque de phase contenant un anneau de phase. Par conséquent, la lumière provenant directement de l'illuminateur passe à travers l'anneau de phase tandis que la lumière réfractée ou réfléchie par l'échantillon traverse la plaque. Cela fait que les ondes traversant l'anneau sont déphasées d'environ la moitié de la longueur d'onde par rapport à celles qui traversent la plaque. Comme les vagues ont des pics et des creux, elles peuvent s'additionner (si elles sont en phase ensemble) ou s'annuler mutuellement (si elles sont déphasées). Lorsque les longueurs d'onde sont déphasées, les creux d'ondes annulent les pics d'ondes, ce que l'on appelle interférence destructrice. Les structures qui réfractent la lumière apparaissent alors sombres sur un fond clair composé uniquement de lumière non réfractée. Plus généralement, les structures dont les caractéristiques, telles que l'indice de réfraction, diffèrent en termes de niveaux d'obscurité (Figure\(\PageIndex{5}\)).
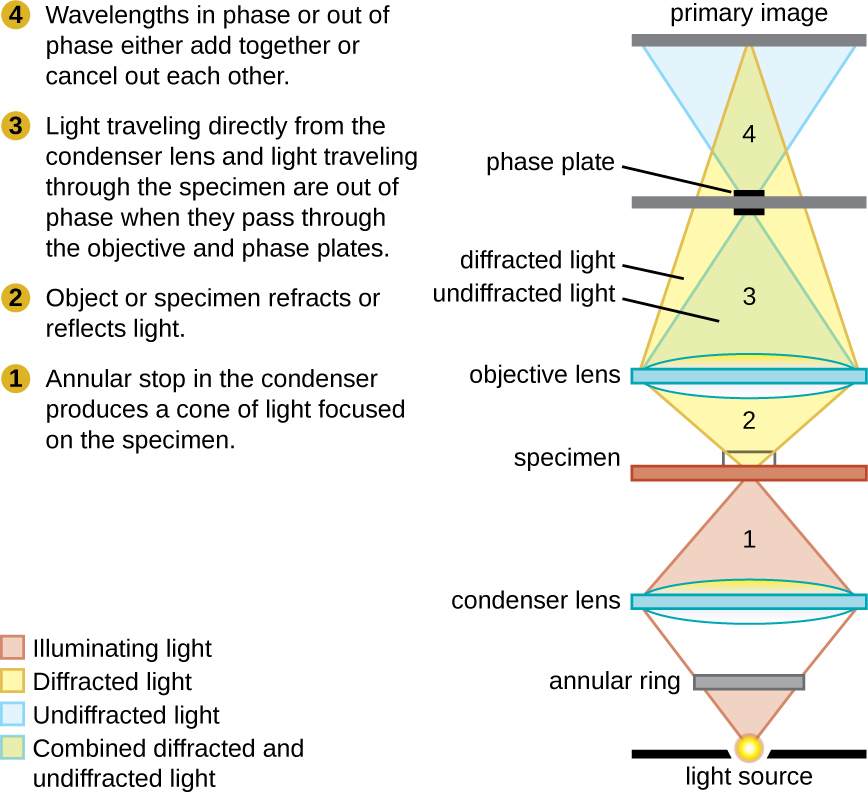
Ce schéma d'un microscope à contraste de phase illustre les différences de phase entre la lumière traversant l'objet et l'arrière-plan. Ces différences sont produites en faisant passer les rayons à travers différentes parties d'une plaque de phase. Les rayons lumineux se superposent dans le plan de l'image, produisant un contraste dû à leur interférence.
Comme elle augmente le contraste sans nécessiter de coloration, la microscopie à contraste de phase est souvent utilisée pour observer des spécimens vivants. Certaines structures, telles que les organites des cellules eucaryotes et les endospores des cellules procaryotes, sont particulièrement bien visualisées par microscopie à contraste de phase (Figure\(\PageIndex{6}\)).
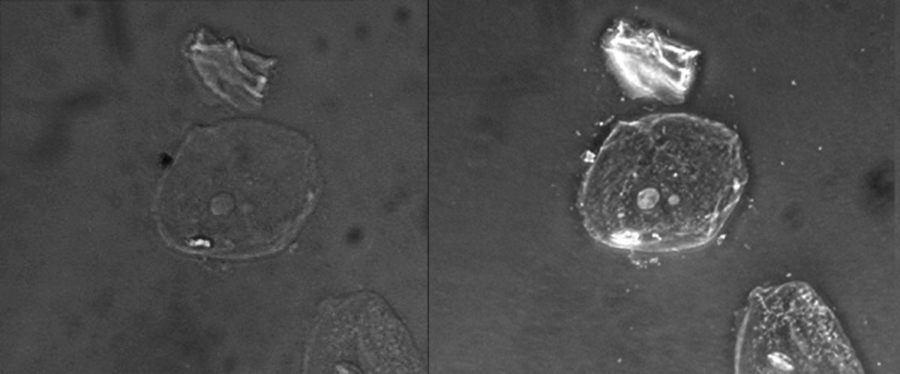
Cette figure compare une image en fond clair (à gauche) à une image en contraste de phase (à droite) des mêmes cellules épithéliales squameuses simples non colorées. Les cellules se trouvent au centre et en bas à droite de chaque photographie (l'élément irrégulier au-dessus des cellules est un débris acellulaire). Remarquez que les cellules non colorées de l'image en fond clair sont presque invisibles par rapport à l'arrière-plan, tandis que les cellules de l'image à contraste de phase semblent briller sur l'arrière-plan, révélant ainsi beaucoup plus de détails. (crédit : « Clearly kéfir » /Wikimedia Commons)
Microscopes à contraste interférentiel
Les microscopes à contraste interférentiel différentiel (DIC) (également appelés optiques Nomarski) sont similaires aux microscopes à contraste de phase en ce sens qu'ils utilisent des motifs d'interférence pour améliorer le contraste entre les différentes caractéristiques d'un échantillon. Dans un microscope DIC, deux faisceaux de lumière sont créés dans lesquels la direction du mouvement des ondes (polarisation) diffère. Une fois que les faisceaux traversent l'échantillon ou l'espace libre de l'échantillon, ils sont recombinés et les effets des échantillons entraînent des différences dans les modèles d'interférence générés par la combinaison des faisceaux. Il en résulte des images très contrastées d'organismes vivants ayant une apparence tridimensionnelle. Ces microscopes sont particulièrement utiles pour distinguer les structures d'échantillons vivants non colorés. (Figurine\(\PageIndex{7}\)).

Une image DIC de Fonsecaea pedrosoi cultivée sur de la gélose Leonian modifiée. Ce champignon provoque la chromoblastomycose, une infection cutanée chronique courante dans les climats tropicaux et subtropicaux.
Exercice\(\PageIndex{2}\)
Quels sont les avantages de la microscopie à contraste de phase et de la microscopie DIC ?
Microscopes à fluorescence
Un microscope à fluorescence utilise des chromophores fluorescents appelés fluorochromes, qui sont capables d'absorber l'énergie d'une source de lumière et d'émettre ensuite cette énergie sous forme de lumière visible. Les fluorochromes comprennent des substances naturellement fluorescentes (telles que les chlorophylles) ainsi que des colorants fluorescents qui sont ajoutés à l'échantillon pour créer un contraste. Les colorants tels que le rouge Texas et le FITC sont des exemples de fluorochromes. D'autres exemples incluent les colorants d'acides nucléiques 4',6'-diamidino-2-phénylindole (DAPI) et l'acridine orange.
Le microscope transmet une lumière d'excitation, généralement une forme d'EMR de courte longueur d'onde, telle que la lumière ultraviolette ou bleue, vers l'échantillon ; les chromophores absorbent la lumière d'excitation et émettent de la lumière visible de plus grandes longueurs d'onde. La lumière d'excitation est ensuite filtrée (en partie parce que la lumière ultraviolette est nocive pour les yeux) afin que seule la lumière visible passe à travers la lentille oculaire. Cela produit une image du spécimen dans des couleurs vives sur un fond sombre.
Les microscopes à fluorescence sont particulièrement utiles en microbiologie clinique. Ils peuvent être utilisés pour identifier des agents pathogènes, pour trouver des espèces particulières dans un environnement ou pour localiser des molécules et des structures particulières au sein d'une cellule. Des approches ont également été développées pour distinguer les cellules vivantes des cellules mortes à l'aide de la microscopie à fluorescence selon qu'elles absorbent ou non des fluorochromes particuliers. Parfois, plusieurs fluorochromes sont utilisés sur le même échantillon pour montrer des structures ou des caractéristiques différentes.
L'une des applications les plus importantes de la microscopie à fluorescence est une technique appelée immunofluorescence, qui permet d'identifier certains microbes pathogènes en observant si les anticorps s'y lient. (Les anticorps sont des molécules de protéines produites par le système immunitaire qui se fixent à des agents pathogènes spécifiques pour les tuer ou les inhiber.) Il existe deux approches de cette technique : le test d'immunofluorescence directe (DFA) et le test d'immunofluorescence indirecte (IFA). Dans le DFA, des anticorps spécifiques (par exemple, ceux qui ciblent le virus de la rage) sont colorés au fluorochrome. Si l'échantillon contient le pathogène ciblé, on peut observer les anticorps se liant à l'agent pathogène au microscope à fluorescence. C'est ce que l'on appelle une coloration primaire des anticorps, car les anticorps colorés se fixent directement sur l'agent pathogène.
Dans l'IFA, les anticorps secondaires sont colorés avec un fluorochrome plutôt qu'avec des anticorps primaires. Les anticorps secondaires ne se fixent pas directement à l'agent pathogène, mais ils se lient aux anticorps primaires. Lorsque les anticorps primaires non colorés se lient au pathogène, les anticorps secondaires fluorescents peuvent être observés se liant aux anticorps primaires. Ainsi, les anticorps secondaires sont attachés indirectement au pathogène. Comme plusieurs anticorps secondaires peuvent souvent se fixer à un anticorps primaire, l'IFA augmente le nombre d'anticorps fluorescents attachés à l'échantillon, ce qui permet de visualiser plus facilement les caractéristiques de l'échantillon (Figure\(\PageIndex{8}\)).
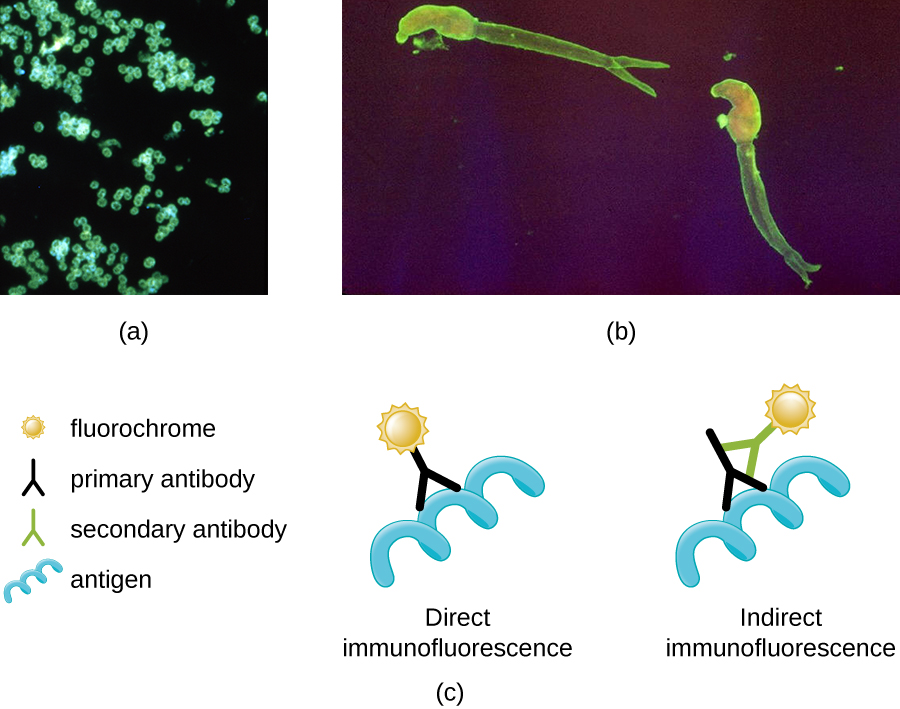
Exercice\(\PageIndex{3}\)
Pourquoi faut-il utiliser des fluorochromes pour examiner un échantillon au microscope à fluorescence ?
Microscopes confocaux
Alors que d'autres formes de microscopie optique créent une image focalisée au maximum à une seule distance de l'observateur (profondeur ou plan z), un microscope confocal utilise un laser pour balayer plusieurs plans Z successivement. Cela produit de nombreuses images bidimensionnelles à haute résolution à différentes profondeurs, qui peuvent être transformées en une image tridimensionnelle par un ordinateur. Comme pour les microscopes à fluorescence, les colorants fluorescents sont généralement utilisés pour augmenter le contraste et la résolution. La clarté de l'image est encore améliorée par une ouverture étroite qui élimine toute lumière ne provenant pas du plan Z. Les microscopes confocaux sont donc très utiles pour examiner des échantillons épais tels que des biofilms, qui peuvent être examinés vivants et non fixés (Figure\(\PageIndex{9}\)).
Microscopes à deux photons
Bien que les microscopes fluorescents et confocaux originaux permettaient de mieux visualiser les caractéristiques uniques des échantillons, certains problèmes empêchaient toujours une visualisation optimale. La sensibilité effective de la microscopie à fluorescence lors de l'observation d'échantillons épais était généralement limitée par des reflets flous, ce qui entraînait une mauvaise résolution. Cette limitation a été considérablement réduite dans le microscope confocal grâce à l'utilisation d'un sténopé confocal pour rejeter la fluorescence de fond floue avec de fines sections optiques non floues (<1 μm). Cependant, même les microscopes confocaux n'avaient pas la résolution nécessaire pour visualiser des échantillons de tissus épais. Ces problèmes ont été résolus grâce à la mise au point du microscope à deux photons, qui utilise une technique de balayage, des fluorochromes et de la lumière à grande longueur d'onde (comme l'infrarouge) pour visualiser les échantillons. La faible énergie associée à la lumière de grande longueur d'onde signifie que deux photons doivent frapper un endroit en même temps pour exciter le fluorochrome. La faible énergie de la lumière d'excitation endommage moins les cellules, et la grande longueur d'onde de la lumière d'excitation pénètre plus facilement en profondeur dans les échantillons épais. Cela rend le microscope à deux photons utile pour examiner les cellules vivantes présentes dans des tissus intacts : des tranches de cerveau, des embryons, des organes entiers et même des animaux entiers.
Actuellement, l'utilisation de microscopes à deux photons est limitée aux laboratoires cliniques et de recherche avancés en raison du coût élevé des instruments. Un microscope à deux photons coûte généralement entre 300 000 et 500 000 dollars, et les lasers utilisés pour exciter les colorants utilisés sur les échantillons sont également très chers. Cependant, à mesure que la technologie s'améliore, les microscopes à deux photons pourraient devenir plus facilement disponibles en milieu clinique.
Exercice\(\PageIndex{4}\)
Quels types d'échantillons sont mieux examinés par microscopie confocale ou par microscopie à deux photons ?
Microscopie électronique
La résolution théorique maximale des images créées par les microscopes optiques est finalement limitée par les longueurs d'onde de la lumière visible. La plupart des microscopes optiques ne peuvent grossir que 1 000 et quelques-uns peuvent agrandir jusqu'à 1 500, mais cela ne correspond pas à la puissance d'agrandissement d'un microscope électronique (EM), qui utilise des faisceaux d'électrons de courte longueur d'onde plutôt que de la lumière pour augmenter le grossissement et la résolution.
Les électrons, comme le rayonnement électromagnétique, peuvent se comporter comme des ondes, mais avec des longueurs d'onde de 0,005 nm, ils peuvent produire une bien meilleure résolution que la lumière visible. Un EM peut produire une image nette qui est agrandie jusqu'à 100 000. Ainsi, les EM peuvent résoudre les structures subcellulaires ainsi que certaines structures moléculaires (par exemple, des brins uniques d'ADN) ; toutefois, la microscopie électronique ne peut pas être utilisée sur du matériel vivant en raison des méthodes nécessaires pour préparer les échantillons.
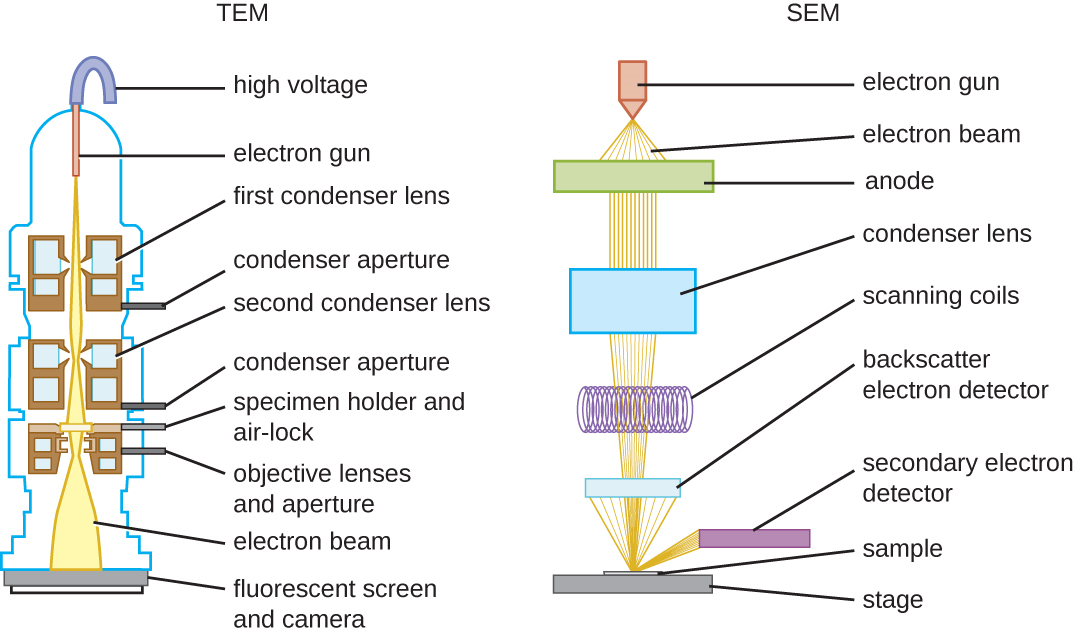
Il existe deux principaux types d'EM : le microscope électronique à transmission (MET) et le microscope électronique à balayage (MEB) (Figure\(\PageIndex{10}\)). Le TEM est quelque peu analogue au microscope optique à fond clair en ce qui concerne son fonctionnement. Cependant, il utilise un faisceau d'électrons provenant du dessus de l'échantillon qui est focalisé à l'aide d'une lentille magnétique (plutôt que d'une lentille en verre) et projeté à travers l'échantillon sur un détecteur. Les électrons traversent l'échantillon, puis le détecteur capture l'image (Figure\(\PageIndex{11}\)).
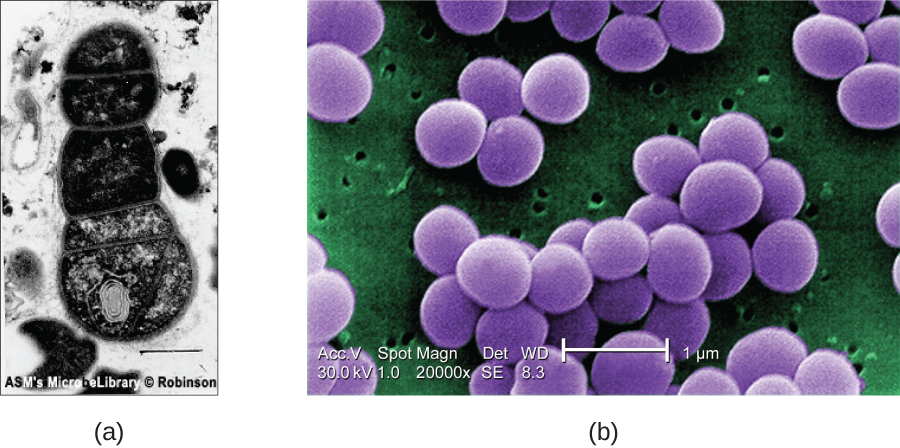
Pour que les électrons puissent traverser l'échantillon lors d'un TEM, celui-ci doit être extrêmement fin (20 à 100 nm d'épaisseur). L'image est produite en raison de l'opacité variable des différentes parties de l'échantillon. Cette opacité peut être améliorée en colorant l'échantillon avec des matériaux tels que des métaux lourds, qui sont denses aux électrons. La TEM exige que le faisceau et l'échantillon soient placés sous vide et que l'échantillon soit très fin et déshydraté. Les étapes spécifiques nécessaires à la préparation d'un spécimen en vue de son observation sous EM sont décrites en détail dans la section suivante.
Les SEM forment des images de la surface des échantillons, généralement à partir d'électrons qui sont projetés sur les échantillons par un faisceau d'électrons. Cela permet de créer des images très détaillées avec une apparence tridimensionnelle qui s'affichent sur un écran (Figure\(\PageIndex{12}\)). Généralement, les échantillons sont séchés et préparés avec des fixateurs qui réduisent les artéfacts, tels que le ratatinage, qui peuvent être produits par séchage, avant d'être recouverts par pulvérisation d'une fine couche de métal tel que l'or. Alors que la microscopie électronique à transmission nécessite des sections très fines et permet de voir les structures internes telles que les organites et l'intérieur des membranes, la microscopie électronique à balayage peut être utilisée pour observer les surfaces d'objets plus grands (comme un grain de pollen) ainsi que les surfaces de très petits échantillons ( \(\PageIndex{13}\)Chiffre). Certains EM peuvent agrandir une image jusqu'à 2 000 000. 1
Exercice\(\PageIndex{5}\)
- Quels sont les avantages et les inconvénients de la microscopie électronique, par rapport à la microscopie optique, pour l'examen d'échantillons microbiologiques ?
- Quels sont les types d'échantillons qu'il est préférable d'examiner avec la TEM SEM ?
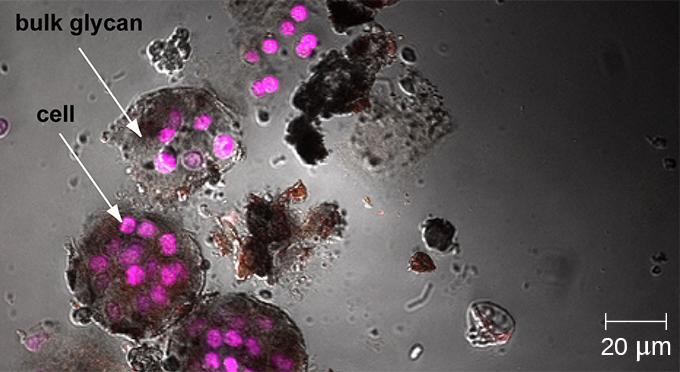
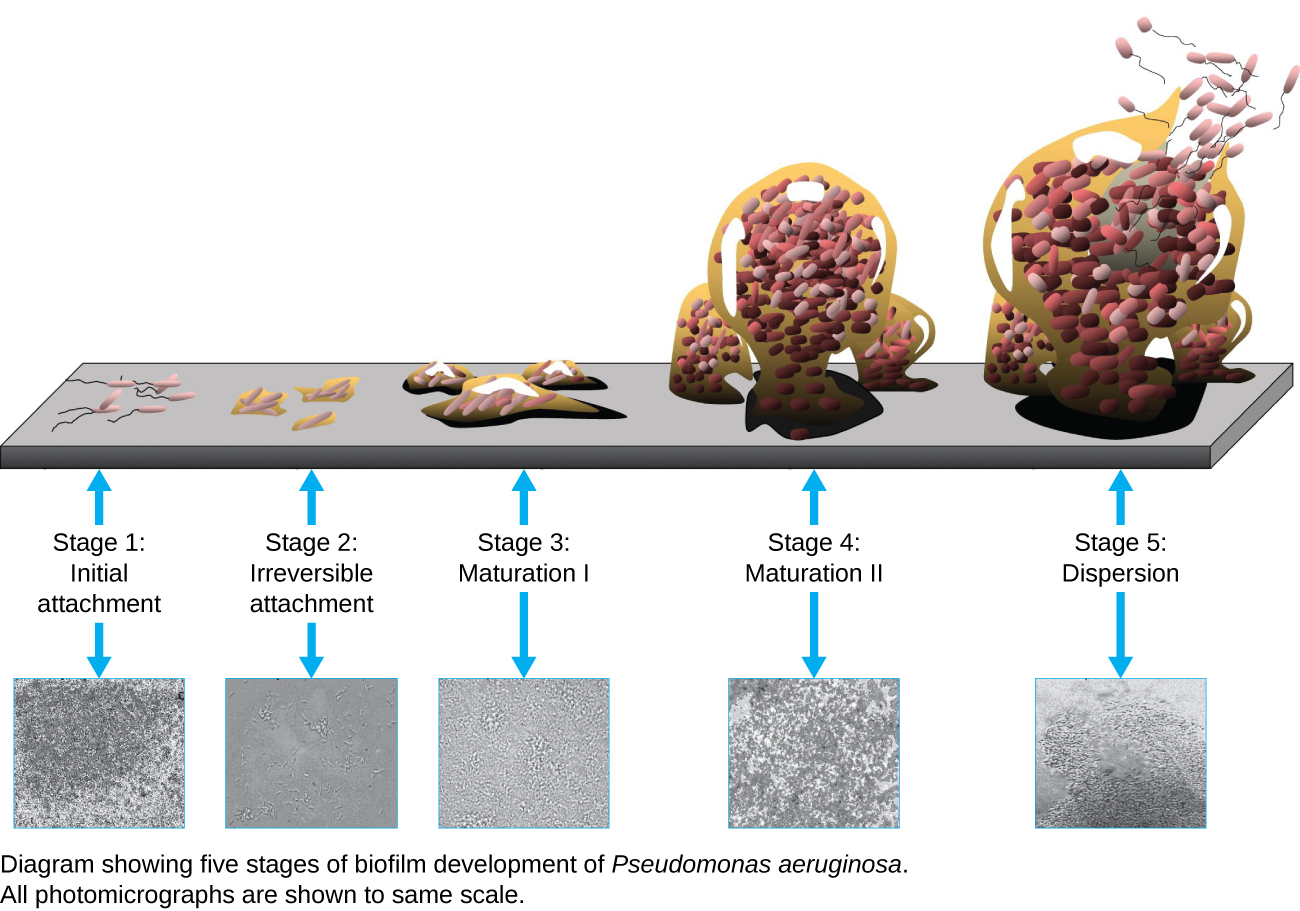
Un biofilm est une communauté complexe d'une ou de plusieurs espèces de microorganismes qui se forme généralement sous la forme d'un revêtement visqueux fixé à une surface en raison de la production d'une substance extrapolymère (EPS) qui se fixe à une surface ou à l'interface entre les surfaces (par exemple, entre l'air et l'eau). Dans la nature, les biofilms sont abondants et occupent fréquemment des niches complexes au sein des écosystèmes (Figure\(\PageIndex{14}\)). En médecine, les biofilms peuvent recouvrir les dispositifs médicaux et exister dans l'organisme. Parce qu'ils possèdent des caractéristiques uniques, telles qu'une résistance accrue au système immunitaire et aux médicaments antimicrobiens, les biofilms intéressent particulièrement les microbiologistes et les cliniciens.
Comme les biofilms sont épais, ils ne peuvent pas être très bien observés à l'aide de la microscopie optique ; trancher un biofilm pour créer un échantillon plus fin peut tuer ou perturber la communauté microbienne. La microscopie confocale fournit des images plus claires des biofilms car elle permet de se concentrer sur un plan Z à la fois et de produire une image tridimensionnelle d'un échantillon épais. Les colorants fluorescents peuvent être utiles pour identifier les cellules de la matrice. De plus, des techniques telles que l'immunofluorescence et l'hybridation in situ par fluorescence (FISH), dans lesquelles des sondes fluorescentes sont utilisées pour se lier à l'ADN, peuvent être utilisées.
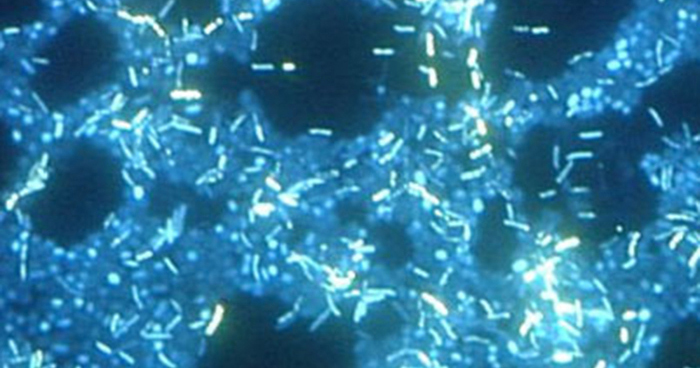
La microscopie électronique peut être utilisée pour observer les biofilms, mais uniquement après déshydratation de l'échantillon, ce qui produit des artéfacts indésirables et le déforme. Outre ces approches, il est possible de suivre les courants d'eau à travers les formes (telles que les cônes et les champignons) des biofilms, en utilisant une vidéo du mouvement de billes recouvertes de fluorescence (Figure\(\PageIndex{15}\)).
Microscopie à sonde à balayage
Un microscope à sonde à balayage n'utilise ni lumière ni électrons, mais plutôt des sondes très pointues qui passent sur la surface de l'échantillon et interagissent directement avec celui-ci. Cela produit des informations qui peuvent être assemblées en images avec des grossissements allant jusqu'à 100 000 000. De tels grossissements peuvent être utilisés pour observer des atomes individuels sur des surfaces. À ce jour, ces techniques ont été utilisées principalement pour la recherche plutôt que pour le diagnostic.
Il existe deux types de microscopes à sonde à balayage : le microscope à effet tunnel à balayage (STM) et le microscope à force atomique (AFM). Un STM utilise une sonde qui passe juste au-dessus de l'échantillon car une polarisation de tension constante crée le potentiel d'un courant électrique entre la sonde et l'échantillon. Ce courant se produit par tunnel quantique d'électrons entre la sonde et l'échantillon, et l'intensité du courant dépend de la distance entre la sonde et l'échantillon. La sonde est déplacée horizontalement au-dessus de la surface et l'intensité du courant est mesurée. La microscopie à effet tunnel à balayage permet de cartographier efficacement la structure des surfaces à une résolution à laquelle des atomes individuels peuvent être détectés.
Semblables à un STM, les AFM sont dotés d'une fine sonde qui passe juste au-dessus de l'échantillon. Toutefois, plutôt que de mesurer les variations du courant à une hauteur constante au-dessus de l'échantillon, un AFM établit un courant constant et mesure les variations de la hauteur de la pointe de la sonde lorsqu'elle passe au-dessus de l'échantillon. Lorsque la pointe de la sonde passe au-dessus de l'échantillon, les forces entre les atomes (forces de Van der Waals, forces capillaires, liaisons chimiques, forces électrostatiques, etc.) font monter et descendre ce dernier. La déflexion de la pointe de la sonde est déterminée et mesurée à l'aide de la loi d'élasticité de Hooke, et ces informations sont utilisées pour construire des images de la surface de l'échantillon avec une résolution au niveau atomique (Figure\(\PageIndex{16}\)).

Exercice\(\PageIndex{6}\)
- Lequel a un grossissement plus élevé, un microscope optique ou un microscope à sonde à balayage ?
- Citez un avantage et une limite de la microscopie à sonde à balayage.


Concepts clés et résumé
- De nombreux types de microscopes utilisent différentes technologies pour générer des micrographies. La plupart sont utiles pour un type d'échantillon ou d'application particulier.
- La microscopie optique utilise des lentilles pour focaliser la lumière sur un échantillon afin de produire une image. Les microscopes optiques couramment utilisés incluent les microscopes à fond clair, à fond noir, à contraste de phase, à contraste d'interférence différentiel, à fluorescence, confocaux et à deux photons.
- La microscopie électronique concentre les électrons sur l'échantillon à l'aide d'aimants, produisant ainsi un grossissement beaucoup plus important que la microscopie optique. Le microscope électronique à transmission (TEM) et le microscope électronique à balayage (SEM) sont deux formes courantes.
- La microscopie à sonde à balayage produit des images d'un grossissement encore plus élevé en mesurant la rétroaction des sondes tranchantes qui interagissent avec l'échantillon. Les microscopes à sonde incluent le microscope à effet tunnel à balayage (STM) et le microscope à force atomique (AFM).
Notes
- 1 « Microscope électronique à transmission JEM-ARM200F », JEOL USA Inc, www.JEOLUSA.com/products/TRAN... specifications. Consulté le 28/08/2015.
Lexique
- microscope à force atomique
- un microscope à sonde à balayage qui utilise une fine sonde passée juste au-dessus de l'échantillon pour mesurer les forces entre les atomes et la sonde
- binoculaire
- ayant deux oculaires
- microscope à fond clair
- un microscope à lumière composée à deux lentilles ; il produit une image sombre sur un fond clair
- bouton de focalisation brut
- un bouton sur un microscope qui produit des mouvements relativement importants pour régler la mise au point
- chromophores
- des pigments qui absorbent et réfléchissent des longueurs d'onde particulières de la lumière (leur donnant une couleur)
- lentille à condensateur
- une lentille d'un microscope qui focalise la lumière provenant de la source de lumière sur l'échantillon
- microscope confocal
- un microscope laser à balayage qui utilise des colorants fluorescents et des lasers à excitation pour créer des images tridimensionnelles
- microscope à fond noir
- un microscope à lumière composée qui produit une image claire sur un fond sombre ; généralement un microscope à fond clair modifié
- diaphragme
- un composant d'un microscope ; se compose généralement d'un disque placé sous la platine avec des trous de différentes tailles ; peut être ajusté pour permettre à une plus ou moins grande quantité de lumière provenant de la source de lumière d'atteindre l'échantillon
- microscope à contraste interférentiel différentiel
- un microscope qui utilise la lumière polarisée pour augmenter le contraste
- microscope électronique
- type de microscope qui utilise des faisceaux d'électrons de courte longueur d'onde plutôt que de la lumière pour augmenter le grossissement et la résolution
- bouton de focalisation fine
- un bouton sur un microscope qui produit des mouvements relativement faibles pour régler la mise au point
- microscope à fluorescence
- un microscope qui utilise des fluorochromes naturels ou des colorants fluorescents pour augmenter le contraste
- fluorochromes
- des chromophores qui sont fluorescents (absorbent puis émettent de la lumière)
- illuminateur
- la source de lumière sur un microscope
- immunofluorescence
- une technique qui utilise un microscope à fluorescence et des fluorochromes spécifiques aux anticorps pour déterminer la présence d'agents pathogènes spécifiques dans un échantillon
- monoculaire
- ayant un seul oculaire
- lentilles d'objectif
- sur un microscope optique, les lentilles les plus proches de l'échantillon, généralement situées aux extrémités des tourelles
- lentille oculaire
- au microscope, la lentille la plus proche de l'œil (aussi appelée oculaire)
- lentille à immersion dans l'
- un objectif spécial sur un microscope conçu pour être utilisé avec de l'huile d'immersion afin d'améliorer la résolution
- microscope à contraste de phase
- un microscope optique qui utilise une butée annulaire et une plaque annulaire pour augmenter le contraste
- rhéostat
- un variateur d'intensité qui contrôle l'intensité de l'illuminateur sur un microscope optique
- microscope électronique à balayage (SEM)
- type de microscope électronique qui fait rebondir des électrons sur l'échantillon pour former une image de la surface
- microscope à sonde à balayage
- un microscope qui utilise une sonde qui parcourt la surface d'un échantillon à une distance constante pendant que le courant, qui est sensible à la taille de l'espace, est mesuré
- microscope à effet tunnel à balayage
- un microscope qui utilise une sonde qui passe juste au-dessus de l'échantillon sous forme de polarisation à tension constante crée le potentiel d'un courant électrique entre la sonde et l'échantillon
- scène
- la plate-forme d'un microscope sur laquelle sont placées les lames
- grossissement total
- dans un microscope optique est une valeur calculée en multipliant le grossissement de l'oculaire par le grossissement des lentilles d'objectif
- microscope électronique à transmission (TEM)
- type de microscope électronique qui utilise un faisceau d'électrons focalisé à l'aide d'aimants qui traverse un échantillon mince
- microscope à deux photons
- un microscope qui utilise de la lumière infrarouge ou de grandes longueurs d'onde pour émettre des fluorochromes dans l'échantillon
- boutons de scène mécaniques X-Y
- boutons d'un microscope utilisés pour ajuster la position de l'échantillon sur la surface de la scène, généralement pour le centrer directement au-dessus de la lumière


