41.1 : Osmorégulation et équilibre osmotique
- Page ID
- 189443
Compétences à développer
- Définir l'osmose et expliquer son rôle au sein des molécules
- Expliquer pourquoi l'osmorégulation et l'équilibre osmotique sont des fonctions corporelles importantes
- Décrire les mécanismes de transport actifs
- Expliquer l'osmolarité et la façon dont elle est mesurée
- Décrire les osmorégulateurs ou les osmoconformeurs et comment ces outils permettent aux animaux de s'adapter à différents environnements
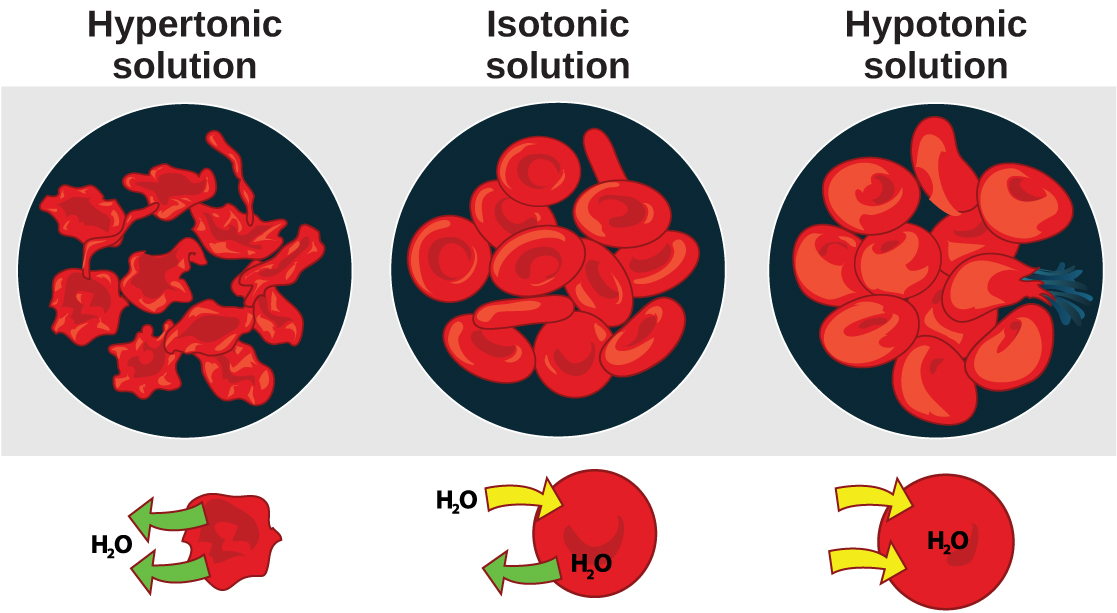
L'osmose est la diffusion de l'eau à travers une membrane en réponse à la pression osmotique provoquée par un déséquilibre des molécules de chaque côté de la membrane. L'osmorégulation est le processus de maintien de l'équilibre salin et hydrique (équilibre osmotique) à travers les membranes des fluides corporels, qui sont composés d'eau, d'électrolytes et de non-électrolytes. Un électrolyte est un soluté qui se dissocie en ions lorsqu'il est dissous dans l'eau. Un non-électrolyte, en revanche, ne se dissocie pas en ions lors de la dissolution de l'eau. Les électrolytes et les non-électrolytes contribuent à l'équilibre osmotique. Les fluides corporels comprennent le plasma sanguin, le cytosol contenu dans les cellules et le liquide interstitiel, le liquide qui existe dans les espaces entre les cellules et les tissus du corps. Les membranes du corps (telles que les membranes pleurale, séreuse et cellulaire) sont des membranes semi-perméables. Les membranes semi-perméables sont perméables (ou permissives) à certains types de solutés et d'eau. Les solutions situées sur les deux côtés d'une membrane semi-perméable ont tendance à s'égaliser en termes de concentration de solutés par le mouvement des solutés et/ou de l'eau à travers la membrane. Comme le montre la figure\(\PageIndex{1}\), une cellule placée dans l'eau a tendance à gonfler en raison de la prise d'eau provenant d'un environnement hypotonique ou « pauvre en sel ». En revanche, une cellule placée dans une solution à forte concentration en sel a tendance à faire rétrécir la membrane en raison de la perte d'eau dans un environnement hypertonique ou « riche en sel ». Les cellules isotoniques ont une concentration égale de solutés à l'intérieur et à l'extérieur de la cellule ; cela égalise la pression osmotique de chaque côté de la membrane cellulaire qui est une membrane semi-perméable.
Le corps n'existe pas isolément. Il y a un apport constant d'eau et d'électrolytes dans le système. Alors que l'osmorégulation est réalisée à travers les membranes du corps, l'excès d'électrolytes et de déchets est transporté vers les reins et excrété, contribuant ainsi au maintien de l'équilibre osmotique.
Besoin d'osmorégulation
Les systèmes biologiques interagissent et échangent constamment de l'eau et des nutriments avec l'environnement par la consommation d'aliments et d'eau et par l'excrétion sous forme de sueur, d'urine et de matières fécales. En l'absence d'un mécanisme de régulation de la pression osmotique, ou lorsqu'une maladie endommage ce mécanisme, on a tendance à accumuler des déchets toxiques et de l'eau, ce qui peut avoir des conséquences désastreuses.
Les systèmes des mammifères ont évolué pour réguler non seulement la pression osmotique globale à travers les membranes, mais également les concentrations spécifiques d'électrolytes importants dans les trois principaux compartiments liquides : plasma sanguin, liquide extracellulaire et liquide intracellulaire. Comme la pression osmotique est régulée par le mouvement de l'eau à travers les membranes, le volume des compartiments de fluide peut également changer temporairement. Comme le plasma sanguin est l'un des composants liquides, les pressions osmotiques ont une incidence directe sur la pression artérielle.
Transport des électrolytes à travers les membranes cellulaires
Les électrolytes, tels que le chlorure de sodium, s'ionisent dans l'eau, ce qui signifie qu'ils se dissocient pour former les ions qui les composent. Dans l'eau, le chlorure de sodium (NaCl) se dissocie en ions sodium (Na +) et en ion chlorure (Cl —). Les ions les plus importants, dont les concentrations sont très étroitement régulées dans les fluides corporels, sont les cations sodium (Na +), potassium (K +), calcium (Ca +2), magnésium (Mg +2) et les anions chlorure (Cl -), carbonate (CO 3 -2) ), du bicarbonate (HCO 3 -) et du phosphate (PO 3 -). Les électrolytes sont perdus par le corps lors de la miction et de la transpiration. Pour cette raison, les athlètes sont encouragés à remplacer les électrolytes et les liquides pendant les périodes d'activité accrue et de transpiration.
La pression osmotique est influencée par la concentration de solutés dans une solution. Il est directement proportionnel au nombre d'atomes ou de molécules de soluté et ne dépend pas de la taille des molécules de soluté. Comme les électrolytes se dissocient en ions, ils ajoutent essentiellement plus de particules de soluté dans la solution et ont un effet plus important sur la pression osmotique, par masse, que les composés qui ne se dissocient pas dans l'eau, tels que le glucose.
L'eau peut traverser les membranes par diffusion passive. Si les ions électrolytes pouvaient se diffuser passivement à travers les membranes, il serait impossible de maintenir des concentrations spécifiques d'ions dans chaque compartiment liquide. Ils nécessitent donc des mécanismes spéciaux pour traverser les membranes semi-perméables du corps. Ce mouvement peut être réalisé par une diffusion facilitée et un transport actif. La diffusion facilitée nécessite des canaux à base de protéines pour déplacer le soluté. Le transport actif nécessite de l'énergie sous forme de conversion de l'ATP, de protéines porteuses ou de pompes afin de déplacer les ions à contre-courant du gradient de concentration.
Concept d'osmolalité et de milliéquivalent
Pour calculer la pression osmotique, il est nécessaire de comprendre comment les concentrations de solutés sont mesurées. L'unité de mesure des solutés est la mole. Une mole est définie comme le poids moléculaire en grammes du soluté. Par exemple, le poids moléculaire du chlorure de sodium est de 58,44. Ainsi, une mole de chlorure de sodium pèse 58,44 grammes. La molarité d'une solution est le nombre de moles de soluté par litre de solution. La molalité d'une solution est le nombre de moles de soluté par kilogramme de solvant. Si le solvant est de l'eau, un kilogramme d'eau équivaut à un litre d'eau. Alors que la molarité et la molalité sont utilisées pour exprimer la concentration des solutions, les concentrations d'électrolyte sont généralement exprimées en milliéquivalents par litre (mEq/L) : le mEq/L est égal à la concentration en ions (en millimoles) multipliée par le nombre de charges électriques sur l'ion. L'unité de milliéquivalent prend en compte les ions présents dans la solution (puisque les électrolytes forment des ions dans les solutions aqueuses) et la charge sur les ions.
Ainsi, pour les ions qui ont une charge de un, un milliéquivalent est égal à une millimole. Pour les ions qui ont une charge de deux (comme le calcium), un milliéquivalent équivaut à 0,5 millimoles. Une autre unité d'expression de la concentration en électrolyte est la milliosmole (MosM), qui est le nombre de milliéquivalents de soluté par kilogramme de solvant. Les fluides corporels sont généralement maintenus dans la plage de 280 à 300 mOsm.
Osmorégulateurs et osmoconformeurs
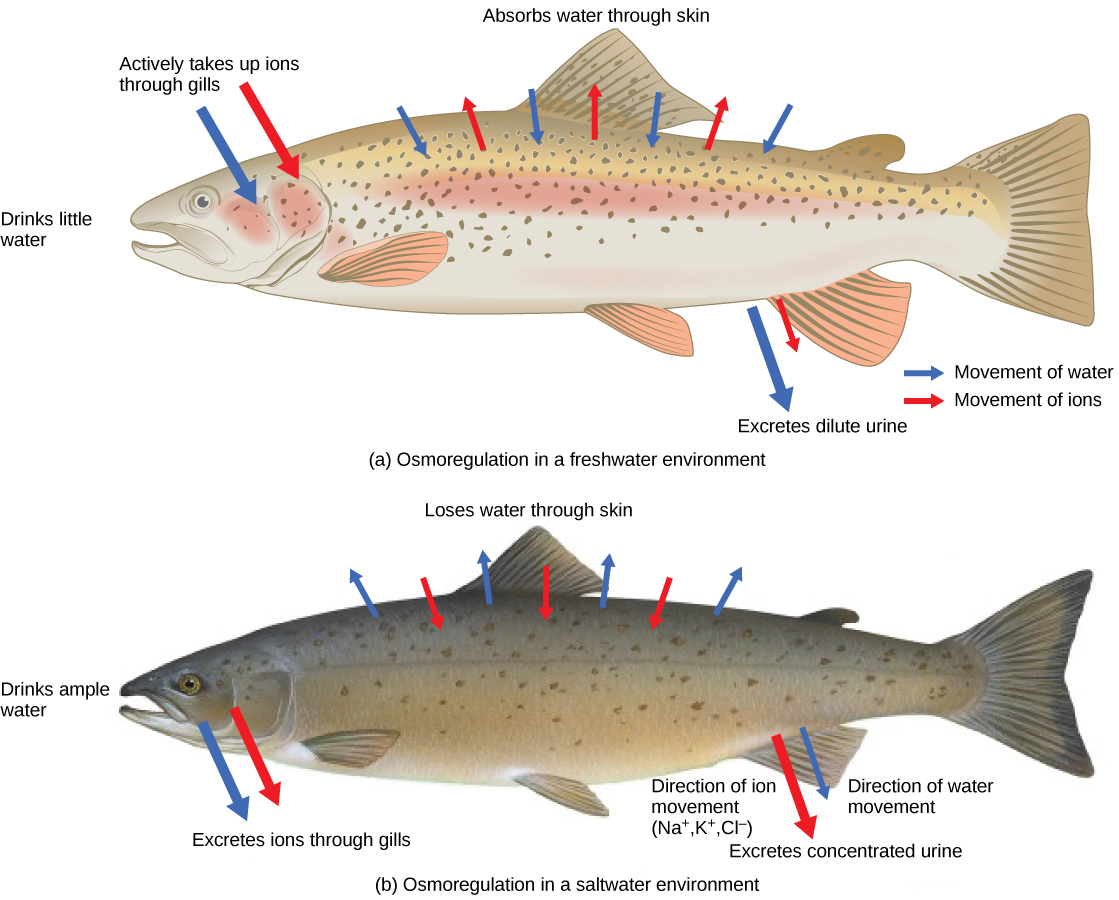
Les personnes perdues en mer sans eau douce à boire risquent de se déshydrater gravement car le corps humain ne peut pas s'adapter à la consommation d'eau de mer, qui est hypertonique par rapport aux fluides corporels. Les organismes tels que les poissons rouges qui ne peuvent tolérer qu'une plage relativement étroite de salinité sont appelés sténohalines. Environ 90 pour cent de tous les poissons osseux sont confinés à l'eau douce ou à l'eau de mer. Ils sont incapables de réguler l'osmose dans l'environnement opposé. Il est toutefois possible que quelques poissons, comme le saumon, passent une partie de leur vie en eau douce et une partie en eau de mer. Des organismes tels que le saumon et le molly qui peuvent tolérer une plage de salinité relativement large sont appelés organismes euryhalins. Cela est possible parce que certains poissons ont développé des mécanismes d'osmorégulation pour survivre dans tous les types de milieux aquatiques. Lorsqu'ils vivent en eau douce, leur corps a tendance à absorber de l'eau parce que l'environnement est relativement hypotonique, comme l'illustre la figure\(\PageIndex{2}\) a. Dans de tels environnements hypotoniques, ces poissons ne boivent pas beaucoup d'eau. Au lieu de cela, ils laissent passer une grande quantité d'urine très diluée et atteignent l'équilibre électrolytique en transportant activement des sels à travers les branchies. Lorsqu'ils se déplacent vers un environnement marin hypertonique, ces poissons commencent à boire de l'eau de mer ; ils excrètent l'excès de sel par leurs branchies et leur urine, comme l'illustre la figure\(\PageIndex{2}\) b. La plupart des invertébrés marins, par contre, peuvent être isotoniques avec l'eau de mer (osmoconformères). Leurs concentrations dans les fluides corporels sont conformes aux variations de la concentration de l'eau de mer. La composition en sel du sang des poissons cartilagineux est similaire à celle des poissons osseux ; toutefois, le sang des requins contient des composés organiques urée et oxyde de triméthylamine (TMAO). Cela ne signifie pas que leur composition électrolytique est similaire à celle de l'eau de mer. Ils atteignent l'isotonicité avec la mer en stockant de grandes concentrations d'urée. Ces animaux qui sécrètent de l'urée sont appelés animaux uréotéliques. La TMAO stabilise les protéines en présence de niveaux élevés d'urée, empêchant ainsi la rupture des liaisons peptidiques qui se produirait chez d'autres animaux exposés à des niveaux similaires d'urée. Les requins sont des poissons cartilagineux dotés d'une glande rectale qui sécrète du sel et contribue à l'osmorégulation.
Lien de carrière : technicien en dialyse
La dialyse est un processus médical qui consiste à éliminer les déchets et l'excès d'eau du sang par diffusion et ultrafiltration. Lorsque la fonction rénale est défaillante, une dialyse doit être effectuée pour débarrasser artificiellement le corps des déchets. Il s'agit d'un processus vital pour maintenir les patients en vie. Dans certains cas, les patients sont soumis à une dialyse artificielle jusqu'à ce qu'ils soient éligibles à une greffe de rein. Chez d'autres personnes qui ne sont pas candidates à une greffe de rein, la dialyse est une nécessité à vie.
Les techniciens en dialyse travaillent généralement dans les hôpitaux et les cliniques. Bien que certains rôles dans ce domaine incluent le développement et la maintenance des équipements, la plupart des techniciens en dialyse travaillent dans le domaine des soins directs aux patients. Leurs tâches au travail, qui se déroulent généralement sous la supervision directe d'une infirmière autorisée, se concentrent sur la prestation de traitements de dialyse. Cela peut inclure l'examen des antécédents et de l'état actuel du patient, l'évaluation et la réponse aux besoins des patients avant et pendant le traitement, et la surveillance du processus de dialyse. Le traitement peut inclure la prise et la déclaration des signes vitaux du patient et la préparation de solutions et d'équipements pour garantir des procédures précises et stériles.
Résumé
Les concentrations de solutés à travers une membrane semi-perméable influencent le mouvement de l'eau et des solutés à travers la membrane. C'est le nombre de molécules de soluté et non la taille moléculaire qui est important dans l'osmose. L'osmorégulation et l'équilibre osmotique sont des fonctions corporelles importantes qui permettent d'équilibrer l'eau et le sel. Tous les solutés ne peuvent pas traverser une membrane semi-perméable. L'osmose est le mouvement de l'eau à travers la membrane. L'osmose se produit pour égaliser le nombre de molécules de soluté à travers une membrane semi-perméable par le mouvement de l'eau vers le côté où la concentration de soluté est plus élevée. La diffusion facilitée utilise des canaux protéiques pour déplacer les molécules de soluté des zones de concentration plus élevée vers les zones de concentration plus faible, tandis que des mécanismes de transport actifs sont nécessaires pour déplacer les solutés contre les gradients de concentration L'osmolarité est mesurée en unités de milliéquivalents ou de milliosmoles, qui tiennent compte dans les deux cas du nombre de particules de soluté et de leur charge. Les poissons qui vivent en eau douce ou en eau salée s'adaptent en devenant des osmorégulateurs ou des osmoconformeurs.
Lexique
- électrolyte
- soluté qui se décompose en ions lorsqu'il est dissous dans l'eau
- molalité
- nombre de moles de soluté par kilogramme de solvant
- molarité
- nombre de moles de soluté par litre de solution
- taupe
- équivalent en grammes du poids moléculaire d'une substance
- non électrolytique
- soluté qui ne se décompose pas en ions lorsqu'il est dissous dans l'eau
- osmoconformeur
- organisme qui modifie sa tonicité en fonction de son environnement
- osmorégulation
- mécanisme par lequel les concentrations d'eau et de soluté sont maintenues aux niveaux souhaités
- osmorégulateur
- organisme qui conserve sa tonicité quel que soit son environnement
- équilibre osmotique
- équilibre de la quantité d'eau et de sel entrant et sortant d'un système biologique sans perturber la pression osmotique et la concentration de soluté souhaitées dans chaque compartiment
- pression osmotique
- pression exercée sur une membrane pour égaliser la concentration de soluté de chaque côté
- membrane semi-perméable
- membrane qui ne laisse passer que certains solutés


