10.3 : Contrôle du cycle cellulaire
- Page ID
- 189608
Compétences à développer
- Comprendre comment le cycle cellulaire est contrôlé par des mécanismes internes et externes à la cellule
- Expliquer comment les trois points de contrôle interne se produisent à la fin de G 1, lors de la transition G 2 /M et pendant la métaphase
- Décrire les molécules qui contrôlent le cycle cellulaire par une régulation positive et négative
La durée du cycle cellulaire est très variable, même au sein des cellules d'un seul organisme. Chez l'homme, la fréquence du renouvellement cellulaire varie de quelques heures au début du développement embryonnaire, à une moyenne de deux à cinq jours pour les cellules épithéliales, et à toute une vie humaine passée en G 0 par des cellules spécialisées, telles que les neurones corticaux ou les cellules du muscle cardiaque. Il existe également une variation du temps qu'une cellule passe à chaque phase du cycle cellulaire. Lorsque des cellules de mammifères à division rapide sont cultivées en culture (à l'extérieur du corps dans des conditions de croissance optimales), la durée du cycle est d'environ 24 heures. Dans les cellules humaines à division rapide avec un cycle cellulaire de 24 heures, la phase G 1 dure environ neuf heures, la phase S dure 10 heures, la phase G 2 dure environ quatre heures et demie et la phase M dure environ une demi-heure. Chez les premiers embryons de mouches des fruits, le cycle cellulaire est terminé en huit minutes environ. La chronologie des événements du cycle cellulaire est contrôlée par des mécanismes internes et externes à la cellule.
Régulation du cycle cellulaire par des événements extérieurs
L'initiation et l'inhibition de la division cellulaire sont déclenchées par des événements extérieurs à la cellule lorsqu'elle est sur le point de commencer le processus de réplication. Un événement peut être aussi simple que la mort d'une cellule voisine ou aussi radical que la libération d'hormones favorisant la croissance, telles que l'hormone de croissance humaine (HGH). Un manque de HGH peut inhiber la division cellulaire, ce qui entraîne un nanisme, alors qu'une trop grande quantité de HGH peut entraîner un gigantisme. L'encombrement des cellules peut également inhiber la division cellulaire. Un autre facteur qui peut initier la division cellulaire est la taille de la cellule ; à mesure qu'une cellule grandit, elle devient inefficace en raison de la diminution de son rapport surface/volume. La solution à ce problème est de diviser.
Quelle que soit la source du message, la cellule reçoit le signal et une série d'événements au sein de la cellule lui permet de passer en interphase. À partir de ce point de départ, tous les paramètres requis pendant chaque phase du cycle cellulaire doivent être respectés, faute de quoi le cycle ne peut pas progresser.
Réglementation aux points de contrôle internes
Il est essentiel que les cellules filles produites soient des répliques exactes de la cellule mère. Des erreurs dans la duplication ou la distribution des chromosomes entraînent des mutations qui peuvent être transmises à chaque nouvelle cellule produite à partir d'une cellule anormale. Pour empêcher une cellule fragilisée de continuer à se diviser, des mécanismes de contrôle internes fonctionnent à trois points de contrôle principaux du cycle cellulaire. Un point de contrôle est l'un des nombreux points du cycle cellulaire eucaryote où la progression d'une cellule vers l'étape suivante du cycle peut être interrompue jusqu'à ce que les conditions soient favorables. Ces points de contrôle apparaissent vers la fin de G 1, lors de la transition G 2 /M et pendant la métaphase (Figure\(\PageIndex{1}\)).
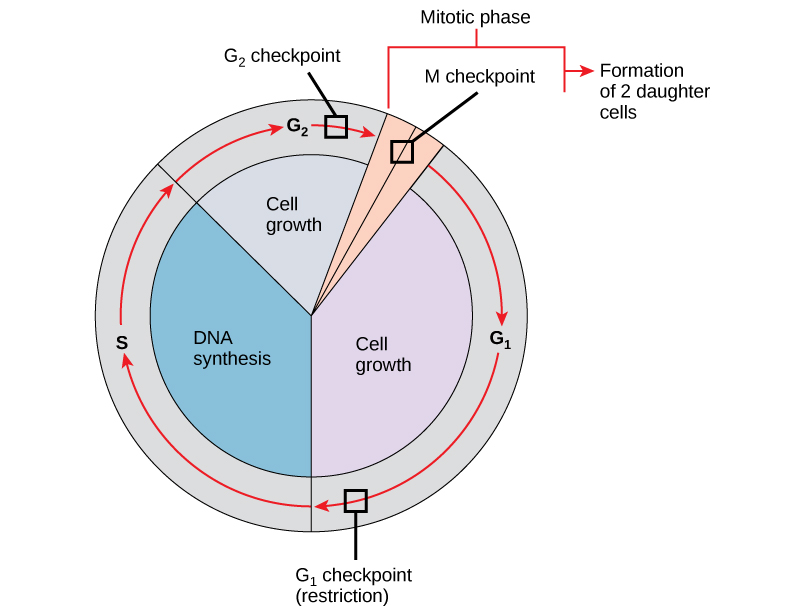
Le point de contrôle G 1
Le point de contrôle G 1 détermine si toutes les conditions sont favorables à la poursuite de la division cellulaire. Le point de contrôle G 1, également appelé point de restriction (chez la levure), est un point auquel la cellule s'engage de manière irréversible dans le processus de division cellulaire. Les influences externes, telles que les facteurs de croissance, jouent un rôle important dans le transport de la cellule au-delà du point de contrôle G 1. En plus des réserves et de la taille des cellules adéquates, un contrôle des dommages à l'ADN génomique est effectué au point de contrôle G 1. Une cellule qui ne répond pas à toutes les exigences ne sera pas autorisée à passer à la phase S. La cellule peut arrêter le cycle et tenter de remédier à l'état problématique, ou elle peut avancer dans G 0 et attendre d'autres signaux lorsque les conditions s'améliorent.
Le point de contrôle du G 2
Le point de contrôle G 2 interdit l'entrée dans la phase mitotique si certaines conditions ne sont pas remplies. Comme au point de contrôle G 1, la taille des cellules et les réserves de protéines sont évaluées. Cependant, le rôle le plus important du point de contrôle G 2 est de s'assurer que tous les chromosomes ont été répliqués et que l'ADN répliqué n'est pas endommagé. Si les mécanismes des points de contrôle détectent des problèmes avec l'ADN, le cycle cellulaire est interrompu et la cellule tente soit de terminer la réplication de l'ADN, soit de réparer l'ADN endommagé.
Le point de contrôle M
Le point de contrôle M se situe vers la fin du stade de métaphase de la caryocinèse. Le point de contrôle M est également connu sous le nom de point de contrôle de la broche, car il détermine si toutes les chromatides sœurs sont correctement fixées aux microtubules du fuseau. Comme la séparation des chromatides sœurs pendant l'anaphase est une étape irréversible, le cycle ne se poursuivra que lorsque les kinétochores de chaque paire de chromatides sœurs seront solidement ancrés à au moins deux fibres fusiformes provenant de pôles opposés de la cellule.
Lien vers l'apprentissage

Observez ce qui se passe aux points de contrôle G 1, G 2 et M en visitant ce site Web pour voir une animation du cycle cellulaire.
Molécules régulatrices du cycle cellulaire
Outre les points de contrôle contrôlés en interne, il existe deux groupes de molécules intracellulaires qui régulent le cycle cellulaire. Ces molécules régulatrices favorisent la progression de la cellule vers la phase suivante (régulation positive) ou arrêtent le cycle (régulation négative). Les molécules régulatrices peuvent agir individuellement ou influencer l'activité ou la production d'autres protéines régulatrices. Par conséquent, la défaillance d'un seul régulateur peut n'avoir pratiquement aucun effet sur le cycle cellulaire, en particulier si plusieurs mécanismes contrôlent le même événement. À l'inverse, l'effet d'un régulateur déficient ou non fonctionnel peut être très vaste et peut être fatal à la cellule si plusieurs processus sont affectés.
Régulation positive du cycle cellulaire
Deux groupes de protéines, appelés cyclines et kinases dépendantes des cyclines (Cdks), sont responsables de la progression de la cellule à travers les différents points de contrôle. Les niveaux des quatre protéines cyclines fluctuent tout au long du cycle cellulaire selon un schéma prévisible (Figure\(\PageIndex{2}\)). Increases in the concentration of cyclin proteins are triggered by both external and internal signals. After the cell moves to the next stage of the cell cycle, the cyclins that were active in the previous stage are degraded.
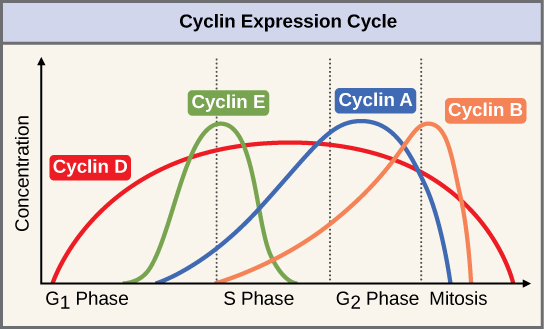
Cyclins regulate the cell cycle only when they are tightly bound to Cdks. To be fully active, the Cdk/cyclin complex must also be phosphorylated in specific locations. Like all kinases, Cdks are enzymes (kinases) that phosphorylate other proteins. Phosphorylation activates the protein by changing its shape. The proteins phosphorylated by Cdks are involved in advancing the cell to the next phase. (Figure \(\PageIndex{3}\)). The levels of Cdk proteins are relatively stable throughout the cell cycle; however, the concentrations of cyclin fluctuate and determine when Cdk/cyclin complexes form. The different cyclins and Cdks bind at specific points in the cell cycle and thus regulate different checkpoints.
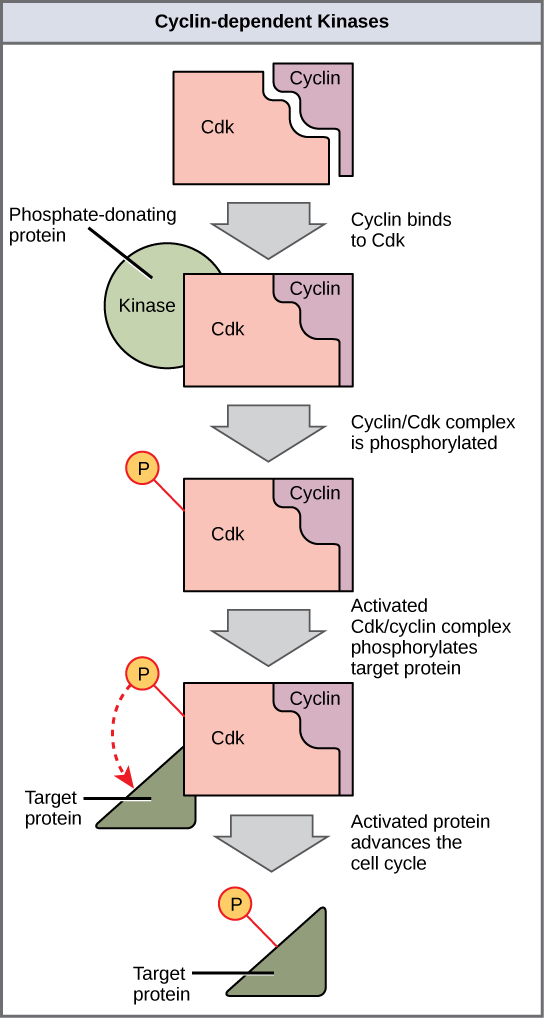
Since the cyclic fluctuations of cyclin levels are based on the timing of the cell cycle and not on specific events, regulation of the cell cycle usually occurs by either the Cdk molecules alone or the Cdk/cyclin complexes. Without a specific concentration of fully activated cyclin/Cdk complexes, the cell cycle cannot proceed through the checkpoints.
Although the cyclins are the main regulatory molecules that determine the forward momentum of the cell cycle, there are several other mechanisms that fine-tune the progress of the cycle with negative, rather than positive, effects. These mechanisms essentially block the progression of the cell cycle until problematic conditions are resolved. Molecules that prevent the full activation of Cdks are called Cdk inhibitors. Many of these inhibitor molecules directly or indirectly monitor a particular cell cycle event. The block placed on Cdks by inhibitor molecules will not be removed until the specific event that the inhibitor monitors is completed.
Negative Regulation of the Cell Cycle
The second group of cell cycle regulatory molecules are negative regulators. Negative regulators halt the cell cycle. Remember that in positive regulation, active molecules cause the cycle to progress.
The best understood negative regulatory molecules are retinoblastoma protein (Rb), p53, and p21. Retinoblastoma proteins are a group of tumor-suppressor proteins common in many cells. The 53 and 21 designations refer to the functional molecular masses of the proteins (p) in kilodaltons. Much of what is known about cell cycle regulation comes from research conducted with cells that have lost regulatory control. All three of these regulatory proteins were discovered to be damaged or non-functional in cells that had begun to replicate uncontrollably (became cancerous). In each case, the main cause of the unchecked progress through the cell cycle was a faulty copy of the regulatory protein.
Rb, p53, and p21 act primarily at the G1 checkpoint. p53 is a multi-functional protein that has a major impact on the commitment of a cell to division because it acts when there is damaged DNA in cells that are undergoing the preparatory processes during G1. If damaged DNA is detected, p53 halts the cell cycle and recruits enzymes to repair the DNA. If the DNA cannot be repaired, p53 can trigger apoptosis, or cell suicide, to prevent the duplication of damaged chromosomes. As p53 levels rise, the production of p21 is triggered. p21 enforces the halt in the cycle dictated by p53 by binding to and inhibiting the activity of the Cdk/cyclin complexes. As a cell is exposed to more stress, higher levels of p53 and p21 accumulate, making it less likely that the cell will move into the S phase.
Rb exerts its regulatory influence on other positive regulator proteins. Chiefly, Rb monitors cell size. In the active, dephosphorylated state, Rb binds to proteins called transcription factors, most commonly, E2F (Figure \(\PageIndex{4}\)). Transcription factors “turn on” specific genes, allowing the production of proteins encoded by that gene. When Rb is bound to E2F, production of proteins necessary for the G1/S transition is blocked. As the cell increases in size, Rb is slowly phosphorylated until it becomes inactivated. Rb releases E2F, which can now turn on the gene that produces the transition protein, and this particular block is removed. For the cell to move past each of the checkpoints, all positive regulators must be “turned on,” and all negative regulators must be “turned off.”
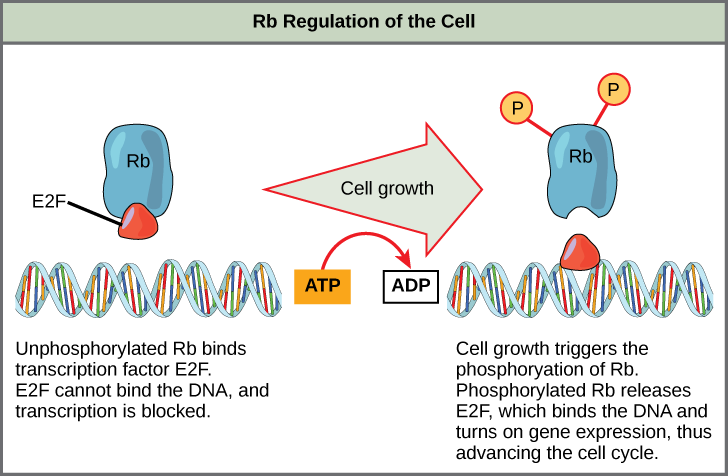
Exercise \(\PageIndex{1}\)
Rb and other proteins that negatively regulate the cell cycle are sometimes called tumor suppressors. Why do you think the name tumor suppressor might be appropriate for these proteins?
- Answer
-
Rb and other negative regulatory proteins control cell division and therefore prevent the formation of tumors. Mutations that prevent these proteins from carrying out their function can result in cancer.
Summary
Each step of the cell cycle is monitored by internal controls called checkpoints. There are three major checkpoints in the cell cycle: one near the end of G1, a second at the G2/M transition, and the third during metaphase. Positive regulator molecules allow the cell cycle to advance to the next stage. Negative regulator molecules monitor cellular conditions and can halt the cycle until specific requirements are met.
Glossary
- cell cycle checkpoint
- mechanism that monitors the preparedness of a eukaryotic cell to advance through the various cell cycle stages
- cyclin
- one of a group of proteins that act in conjunction with cyclin-dependent kinases to help regulate the cell cycle by phosphorylating key proteins; the concentrations of cyclins fluctuate throughout the cell cycle
- cyclin-dependent kinase
- one of a group of protein kinases that helps to regulate the cell cycle when bound to cyclin; it functions to phosphorylate other proteins that are either activated or inactivated by phosphorylation
- p21
- cell cycle regulatory protein that inhibits the cell cycle; its levels are controlled by p53
- p53
- cell cycle regulatory protein that regulates cell growth and monitors DNA damage; it halts the progression of the cell cycle in cases of DNA damage and may induce apoptosis
- retinoblastoma protein (Rb)
- regulatory molecule that exhibits negative effects on the cell cycle by interacting with a transcription factor (E2F)


