5.4 : La structure de l'atome
- Page ID
- 191997
Objectifs d'apprentissage
À la fin de cette section, vous serez en mesure de :
- Décrire la structure des atomes et les composants des noyaux
- Expliquer le comportement des électrons au sein des atomes et comment les électrons interagissent avec la lumière pour se déplacer entre les niveaux d'énergie
L'idée selon laquelle la matière est composée de minuscules particules appelées atomes remonte à au moins 25 siècles. Cependant, il a fallu attendre le XXe siècle pour que les scientifiques inventent des instruments leur permettant de sonder l'intérieur d'un atome et de découvrir que celui-ci n'est pas, comme on le pensait, dur et indivisible. L'atome est plutôt une structure complexe composée de particules encore plus petites.
Sondage de l'atome
La première de ces particules plus petites a été découverte par le physicien britannique James (J.J.) Thomson en 1897. Appelée électron, cette particule est chargée négativement. (C'est le flux de ces particules qui produit des courants électriques, que ce soit dans les éclairs ou dans les fils menant à votre lampe.) Comme un atome dans son état normal est électriquement neutre, chaque électron d'un atome doit être équilibré par la même quantité de charge positive.
L'étape suivante a consisté à déterminer où se situent les charges positives et négatives dans l'atome. En 1911, le physicien britannique Ernest Rutherford a conçu une expérience qui a apporté une partie de la réponse à cette question. Il a bombardé une feuille d'or extrêmement fine, d'environ 400 atomes d'épaisseur seulement, avec un faisceau de particules alpha (Figure\(\PageIndex{1}\)). Les particules alpha (particules α) sont des atomes d'hélium qui ont perdu leurs électrons et sont donc chargés positivement. La plupart de ces particules ont traversé la feuille d'or comme si celle-ci et les atomes qu'elle contenait formaient un espace presque vide. Cependant, environ 1 particule alpha sur 8 000 a complètement inversé la direction et a rebondi vers l'arrière à partir de la feuille. Rutherford a écrit : « C'est l'événement le plus incroyable qui me soit jamais arrivé dans ma vie. C'était presque aussi incroyable que si vous avez tiré un obus de 15 pouces sur un morceau de papier de soie et que celui-ci est revenu et vous a frappé. »
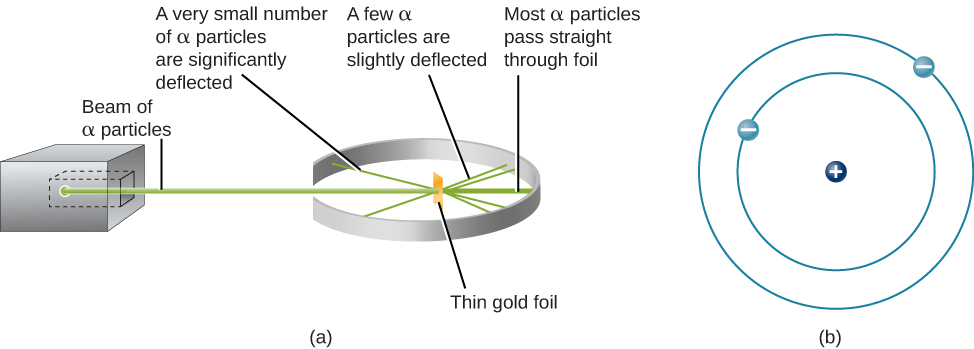
La seule façon de prendre en compte les particules qui se sont inversées lorsqu'elles ont heurté la feuille d'or était de supposer que presque toute la masse, ainsi que toute la charge positive de chaque atome d'or individuel, est concentrée dans un centre ou un noyau minuscule. Lorsqu'une particule alpha chargée positivement frappe un noyau, elle change de direction, tout comme une boule blanche inverse la direction lorsqu'elle heurte une autre boule de billard. Le modèle de Rutherford plaçait l'autre type de charge, les électrons négatifs, en orbite autour de ce noyau.
Le modèle de Rutherford exigeait que les électrons soient en mouvement. Les charges positives et négatives s'attirent mutuellement, de sorte que des électrons stationnaires tomberaient dans le noyau positif. De plus, comme les électrons et le noyau sont extrêmement petits, la majeure partie de l'atome est vide. C'est pourquoi presque toutes les particules de Rutherford ont pu traverser la feuille d'or sans entrer en collision avec quoi que ce soit. Le modèle de Rutherford était une explication très réussie des expériences qu'il a menées, même si les scientifiques ont fini par découvrir que même le noyau lui-même a une structure.
Le noyau atomique
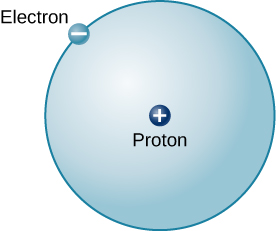
L'atome le plus simple possible (et le plus courant dans le Soleil et les étoiles) est l'hydrogène. Le noyau de l'hydrogène ordinaire contient un seul proton. Un seul électron se déplace autour de ce proton. La masse d'un électron est presque 2000 fois plus petite que la masse d'un proton ; l'électron porte une quantité de charge exactement égale à celle du proton mais de signe opposé (Figure\(\PageIndex{2}\)). Les charges opposées s'attirent mutuellement. Il s'agit donc d'une force électromagnétique qui maintient le proton et l'électron ensemble, tout comme la gravité est la force qui maintient les planètes en orbite autour du Soleil.
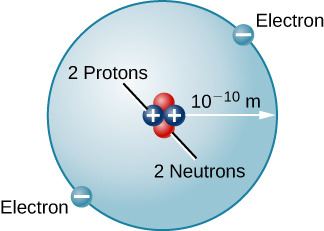
Il existe de nombreux autres types d'atomes dans la nature. L'hélium, par exemple, est le deuxième élément le plus abondant du Soleil. L'hélium possède deux protons dans son noyau au lieu du seul proton qui caractérise l'hydrogène. De plus, le noyau d'hélium contient deux neutrons, des particules d'une masse comparable à celle du proton mais sans charge électrique. Deux électrons se déplacent autour de ce noyau, de sorte que la charge nette totale de l'atome d'hélium est également nulle (Figure\(\PageIndex{3}\)).
À partir de cette description de l'hydrogène et de l'hélium, vous avez peut-être deviné la structure de tous les éléments (différents types d'atomes) que nous trouvons dans l'univers. Le type d'élément est déterminé par le nombre de protons dans le noyau de l'atome. Par exemple, tout atome à six protons est l'élément carbone, avec huit protons est l'oxygène, 26 est le fer et 92 est l'uranium. Sur Terre, un atome typique possède le même nombre d'électrons que les protons, et ces électrons suivent des modèles orbitaux complexes autour du noyau. Au plus profond des étoiles, cependant, il fait si chaud que les électrons se détachent du noyau et (comme nous le verrons) mènent des vies distinctes mais productives.
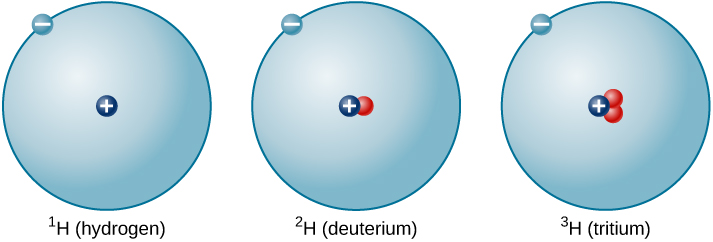
Le rapport entre les neutrons et les protons augmente à mesure que le nombre de protons augmente, mais chaque élément est unique. Le nombre de neutrons n'est pas nécessairement le même pour tous les atomes d'un élément donné. Par exemple, la plupart des atomes d'hydrogène ne contiennent aucun neutron. Il existe cependant des atomes d'hydrogène qui contiennent un proton et un neutron, et d'autres qui contiennent un proton et deux neutrons. Les différents types de noyaux d'hydrogène contenant différents nombres de neutrons sont appelés isotopes de l'hydrogène (Figure\(\PageIndex{4}\)), et tous les autres éléments possèdent également des isotopes. Vous pouvez considérer les isotopes comme des frères et sœurs d'une même « famille » d'éléments, étroitement liés mais avec des caractéristiques et des comportements différents.
Pour explorer la structure des atomes, rendez-vous sur le site Web PhET Build an Atom où vous pouvez ajouter des protons, des neutrons ou des électrons à un modèle et le nom de l'élément que vous avez créé apparaîtra. Vous pouvez également voir la charge nette, le nombre de masse, s'il est stable ou instable, et s'il s'agit d'un ion ou d'un atome neutre.
L'atome de Bohr
Le modèle de Rutherford pour les atomes présente un sérieux problème. Selon la théorie du rayonnement électromagnétique de Maxwell, lorsque les électrons changent de vitesse ou de direction, ils doivent émettre de l'énergie. Les électrons en orbite changent constamment de direction de mouvement, ils doivent donc émettre un flux d'énergie constant. En appliquant la théorie de Maxwell au modèle de Rutherford, tous les électrons devraient entrer en spirale dans le noyau de l'atome à mesure qu'ils perdent de l'énergie, et cet effondrement devrait se produire très rapidement, en 10 à 16 secondes environ.
C'est le physicien danois Niels Bohr (1885-1962) qui a résolu le mystère de la façon dont les électrons restent en orbite. Il essayait de développer un modèle de l'atome qui expliquerait également certaines régularités observées dans le spectre de l'hydrogène. Il a suggéré que le spectre de l'hydrogène peut être compris si nous supposons que des orbites de certaines tailles seulement sont possibles pour l'électron. Bohr a en outre supposé que tant que l'électron se déplace sur une seule de ces orbites autorisées, il ne rayonne aucune énergie : son énergie ne changerait que s'il se déplaçait d'une orbite à l'autre.
Cette suggestion, selon les termes de l'historien des sciences Abraham Pais, était « l'une des hypothèses les plus audacieuses jamais introduites en physique ». Si quelque chose d'équivalent était à l'œuvre dans le monde de tous les jours, vous constaterez peut-être qu'en vous promenant après un cours d'astronomie, la nature vous permettait de faire deux pas par minute, cinq pas par minute et 12 pas par minute, mais aucune vitesse entre les deux. Quelle que soit la manière dont vous essayez de bouger vos jambes, seules certaines vitesses de marche seraient autorisées. Pour rendre les choses encore plus bizarres, il ne faudrait aucun effort pour marcher à l'une des vitesses autorisées, mais il serait difficile de passer d'une vitesse à l'autre. Heureusement, aucune règle de ce type ne s'applique au niveau du comportement humain. Mais au niveau microscopique de l'atome, expérience après expérience, a confirmé la validité de l'étrange idée de Bohr. Les suggestions de Bohr sont devenues l'un des fondements du nouveau modèle (et beaucoup plus sophistiqué) du monde subatomique appelé mécanique quantique.
Dans le modèle de Bohr, si l'électron se déplace d'une orbite à l'autre plus près du noyau atomique, il doit céder de l'énergie sous forme de rayonnement électromagnétique. Cependant, si l'électron passe d'une orbite interne à une orbite plus éloignée du noyau, il a besoin d'énergie supplémentaire. L'un des moyens d'obtenir l'énergie nécessaire consiste à absorber le rayonnement électromagnétique qui peut traverser l'atome à partir d'une source extérieure.
L'une des principales caractéristiques du modèle de Bohr est que chacune des orbites électroniques autorisées autour d'un atome donné possède une certaine valeur énergétique ; nous pouvons donc considérer chaque orbite comme un niveau d'énergie. Pour passer d'une orbite à une autre (qui aura sa propre valeur énergétique spécifique), il faut modifier l'énergie de l'électron, une modification déterminée par la différence entre les deux valeurs d'énergie. Si l'électron passe à un niveau inférieur, la différence d'énergie sera émise ; si l'électron passe à un niveau supérieur, la différence d'énergie doit être obtenue d'un autre endroit. Chaque saut (ou transition) vers un niveau différent est associé à un changement d'énergie fixe et défini.
Une analogie grossière de cette situation pourrait être la vie dans une tour d'appartements de luxe où le loyer est déterminé par la qualité de la vue. Un tel bâtiment comporte certains niveaux ou étages numérotés et définis sur lesquels les appartements sont situés. Personne ne peut vivre à l'étage 5.37 ou 22.5. De plus, le loyer augmente à mesure que vous montez aux étages supérieurs. Si vous souhaitez échanger un appartement au vingtième étage contre un appartement au deuxième étage, vous ne devrez pas autant de loyer. Toutefois, si vous souhaitez passer du troisième étage au vingt-cinquième étage, votre loyer augmentera. Dans un atome également, l'endroit « le moins cher » où un électron peut vivre est le niveau le plus bas possible, et de l'énergie est nécessaire pour atteindre un niveau supérieur.
Nous avons ici l'une des situations où il est plus facile de considérer le rayonnement électromagnétique comme des particules (photons) plutôt que comme des ondes. Lorsque les électrons se déplacent d'un niveau à un autre, ils émettent ou absorbent de petits paquets d'énergie. Lorsqu'un électron passe à un niveau supérieur, il absorbe un photon de la bonne énergie (à condition qu'il en existe une). Lorsqu'il passe à un niveau inférieur, il émet un photon avec la quantité exacte d'énergie dont il n'a plus besoin dans sa « situation de faible coût de vie ».
Les perspectives des photons et des ondes doivent être équivalentes : la lumière est la lumière, peu importe comment on la regarde. Ainsi, chaque photon transporte une certaine quantité d'énergie qui est proportionnelle à la fréquence (\(f\)) de l'onde qu'il représente. La valeur de son énergie (\(E\)) est donnée par la formule
\[E=hf \nonumber\]
où la constante de proportionnalité est appelée constante de Planck.\(h\)
La constante doit son nom à Max Planck, le physicien allemand qui a été l'un des initiateurs de la théorie quantique (Figure\(\PageIndex{5}\)). Si des unités métriques sont utilisées (c'est-à-dire si l'énergie est mesurée en joules et la fréquence en hertz), la constante de Planck a la valeur\(h = 6.626 \times 10^{–34}\) joule-secondes (J-s). Les photons de haute énergie correspondent à des ondes de haute fréquence (qui ont une longueur d'onde plus courte) ; les photons de faible énergie sont des ondes de fréquence plus basse.

Pour prendre un exemple précis, prenons l'exemple d'un atome de calcium dans l'atmosphère du Soleil dans lequel un électron passe d'un niveau inférieur à un niveau supérieur. Pour ce faire, il a besoin d'environ 5 × 10 —19 joules d'énergie, qu'il peut facilement obtenir en absorbant un photon passant de cette énergie provenant des profondeurs du Soleil. Ce photon est équivalent à une onde lumineuse dont la fréquence est d'environ 7,5 × 10 14 hertz et dont la longueur d'onde est d'environ 3,9 × 10 —7 mètres (393 nanomètres), dans la partie violette profonde du spectre de la lumière visible. Bien qu'il puisse sembler étrange au premier abord de passer de l'image de la lumière sous la forme d'un photon (ou d'un paquet d'énergie) à celle d'une onde, une telle transition est devenue une seconde nature pour les astronomes et peut s'avérer un outil pratique pour effectuer des calculs sur les spectres.
Exemple\(\PageIndex{1}\) : L'énergie d'un photon
Maintenant que nous savons comment calculer la longueur d'onde et la fréquence d'un photon, nous pouvons utiliser ces informations, ainsi que la constante de Planck, pour déterminer la quantité d'énergie transportée par chaque photon. Quelle est l'énergie d'un photon rouge d'une longueur d'onde de 630 nm ?
Solution
Tout d'abord, comme nous l'avons appris plus tôt, nous pouvons trouver la fréquence du photon :
\[f= \frac{c}{ \lambda} = \frac{3 \times 10^8 \text{ m/s}}{630 \times 10^{–9} \text{ m}} = 4.8 \times 10^{14} \text{ Hz} \nonumber\]
Ensuite, nous pouvons utiliser la constante de Planck pour déterminer l'énergie (rappelez-vous qu'un Hz est identique à 1/s) :
\[E=hf= \left( 6.626 \times 10^{–34} \text{ J-s} \right) \left( 4.8 \times 10^{14} (1/\text{s}) \right)=3.2 \times 10^{–19} \text{ J} \nonumber\]
Exercice\(\PageIndex{1}\)
Quelle est l'énergie d'un photon jaune d'une fréquence de 5,5 × 10 14 Hz ?
- Réponse
-
\[E=hf= \left(6.626 \times10^{–34} \right) \left(5.5 \times 10^{14} \right) = 3.6 \times 10^{–19} \text{ J} \nonumber\]
Concepts clés et résumé
Les atomes sont constitués d'un noyau contenant un ou plusieurs protons chargés positivement. Tous les atomes, à l'exception de l'hydrogène, peuvent également contenir un ou plusieurs neutrons dans le noyau. Des électrons chargés négativement gravitent autour du noyau. Le nombre de protons définit un élément (l'hydrogène a un proton, l'hélium en a deux, etc.) de l'atome. Les noyaux contenant le même nombre de protons mais un nombre différent de neutrons sont des isotopes différents du même élément. Dans le modèle de Bohr de l'atome, les électrons sur des orbites autorisées (ou niveaux d'énergie) n'émettent aucun rayonnement électromagnétique. Mais lorsque les électrons passent d'un niveau inférieur à un niveau supérieur, ils doivent absorber un photon ayant exactement la bonne énergie, et lorsqu'ils passent d'un niveau supérieur à un niveau inférieur, ils émettent un photon ayant exactement la bonne énergie. L'énergie d'un photon est connectée à la fréquence de l'onde électromagnétique qu'il représente selon la formule de Planck,\(E=hf\).
Lexique
- niveau d'énergie
- un niveau ou une quantité particulière d'énergie possédée par un atome ou un ion au-dessus de l'énergie qu'il possède dans son état le moins énergétique ; également utilisé pour désigner les états d'énergie qu'un électron peut avoir dans un atome
- isotope
- l'une des deux ou plusieurs formes du même élément dont les atomes contiennent le même nombre de protons mais des nombres de neutrons différents
- noyau (d'un atome)
- la partie massive d'un atome, composée principalement de protons et de neutrons, et autour de laquelle tournent les électrons


