5.5 : Formation de raies spectrales
- Page ID
- 192004
Objectifs d'apprentissage
À la fin de cette section, vous serez en mesure de :
- Expliquer comment se forment les spectres des raies d'émission et des raies d'absorption
- Décrire ce que sont les ions et comment ils se forment
- Expliquer comment les raies spectrales et les niveaux d'ionisation d'un gaz peuvent nous aider à déterminer sa température
Nous pouvons utiliser le modèle atomique de Bohr pour comprendre comment se forment les raies spectrales. Le concept de niveaux d'énergie pour les orbites des électrons dans un atome permet naturellement d'expliquer pourquoi les atomes n'absorbent ou n'émettent que des énergies ou des longueurs d'onde de lumière spécifiques.
Le spectre de l'hydrogène
Examinons l'atome d'hydrogène du point de vue du modèle de Bohr. Supposons qu'un faisceau de lumière blanche (composé de photons de toutes les longueurs d'onde visibles) traverse un gaz d'hydrogène atomique. Un photon d'une longueur d'onde de 656 nanomètres possède exactement l'énergie nécessaire pour élever un électron dans un atome d'hydrogène de la deuxième à la troisième orbite. Ainsi, comme tous les photons d'énergies (ou de longueurs d'onde ou de couleurs) différentes circulent par les atomes d'hydrogène, les photons ayant cette longueur d'onde particulière peuvent être absorbés par les atomes dont les électrons sont en orbite au deuxième niveau. Lorsqu'ils seront absorbés, les électrons du deuxième niveau passeront au troisième niveau, et un certain nombre de photons de cette longueur d'onde et de cette énergie seront absents du flux général de lumière blanche.
Les autres photons auront les bonnes énergies pour faire passer les électrons de la deuxième à la quatrième orbite, ou de la première à la cinquième orbite, et ainsi de suite. Seuls les photons ayant ces énergies exactes peuvent être absorbés. Tous les autres photons passeront par les atomes sans être touchés. Ainsi, les atomes d'hydrogène n'absorbent la lumière qu'à certaines longueurs d'onde et produisent des raies sombres à ces longueurs d'onde dans le spectre que nous voyons.
Supposons que nous ayons un contenant d'hydrogène à travers lequel passent toute une série de photons, permettant à de nombreux électrons de monter à des niveaux plus élevés. Lorsque nous éteignons la source de lumière, ces électrons « retombent » sur des orbites plus grandes vers des orbites plus petites et émettent des photons de lumière, mais, encore une fois, uniquement de la lumière dont les énergies ou les longueurs d'onde correspondent à la différence d'énergie entre les orbites autorisées. Les changements orbitaux des électrons d'hydrogène qui donnent naissance à certaines raies spectrales sont illustrés sur la figure\(\PageIndex{1}\).
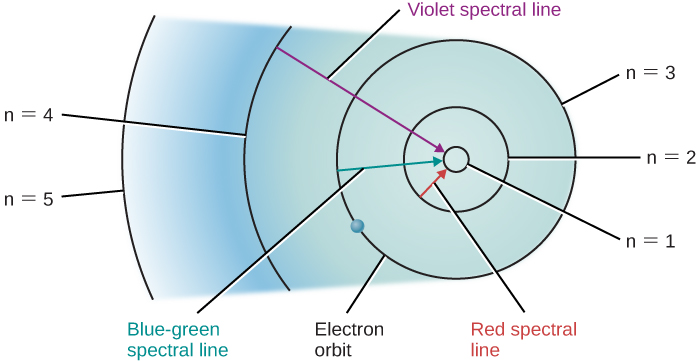
Des images similaires peuvent être dessinées pour des atomes autres que l'hydrogène. Cependant, comme ces autres atomes possèdent généralement plus d'un électron chacun, les orbites de leurs électrons sont beaucoup plus compliquées, tout comme les spectres. Pour nos besoins, la principale conclusion est la suivante : chaque type d'atome possède son propre schéma d'orbites électroniques, et il n'existe pas deux ensembles d'orbites identiques. Cela signifie que chaque type d'atome présente son propre ensemble unique de raies spectrales, produites par des électrons se déplaçant entre son ensemble unique d'orbites.
Les astronomes et les physiciens ont travaillé d'arrache-pied pour découvrir les lignes qui accompagnent chaque élément en étudiant la façon dont les atomes absorbent et émettent de la lumière dans des laboratoires ici sur Terre. Ils peuvent ensuite utiliser ces connaissances pour identifier les éléments des corps célestes. De cette façon, nous connaissons maintenant la composition chimique non pas de n'importe quelle étoile, mais aussi de galaxies d'étoiles si éloignées que leur lumière a commencé à nous atteindre bien avant la formation de la Terre.
Niveaux d'énergie et excitation
Le modèle de Bohr de l'atome d'hydrogène a constitué un grand pas en avant dans notre compréhension de l'atome. Cependant, nous savons aujourd'hui que les atomes ne peuvent pas être représentés par une image aussi simple. Par exemple, le concept d'orbites électroniques clairement définies n'est pas vraiment correct ; cependant, au niveau de ce cours d'introduction, l'idée que seules certaines énergies discrètes sont autorisées pour un atome est très utile. Les niveaux d'énergie dont nous avons discuté peuvent être considérés comme représentant certaines distances moyennes entre les orbites possibles de l'électron et le noyau atomique.
Normalement, un atome se trouve dans l'état d'énergie la plus faible possible, son état fondamental. Dans le modèle de Bohr de l'atome d'hydrogène, l'état fondamental correspond à la présence de l'électron sur l'orbite la plus interne. Un atome peut absorber de l'énergie, ce qui l'élève à un niveau d'énergie supérieur (correspondant, dans la simple image de Bohr, au mouvement d'un électron vers une orbite plus grande), c'est ce que l'on appelle l'excitation. On dit alors que l'atome est dans un état excité. En général, un atome ne reste excité que très peu de temps. Après un court intervalle, généralement un cent millionième de seconde environ, il revient spontanément à son état fondamental, avec émission simultanée de lumière. L'atome peut revenir à son état le plus bas en un seul saut, ou il peut effectuer la transition par étapes de deux sauts ou plus, s'arrêtant à des niveaux intermédiaires en descendant. À chaque saut, il émet un photon dont la longueur d'onde correspond à la différence d'énergie entre les niveaux au début et à la fin de ce saut.
Un diagramme de niveau d'énergie pour un atome d'hydrogène et plusieurs transitions atomiques possibles sont présentés sur la figure\(\PageIndex{2}\). Lorsque nous mesurons les énergies impliquées lorsque l'atome passe d'un niveau à l'autre, nous constatons que les transitions vers ou depuis l'état fondamental, appelées séries de raies de Lyman, entraînent l'émission ou l'absorption de photons ultraviolets. Mais les transitions vers ou depuis le premier état excité (marqué n = 2 dans la partie (a) de la Figure\(\PageIndex{2}\)), appelées série Balmer, produisent une émission ou une absorption dans la lumière visible. C'est d'ailleurs pour expliquer cette série de Balmer que Bohr a proposé pour la première fois son modèle de l'atome.
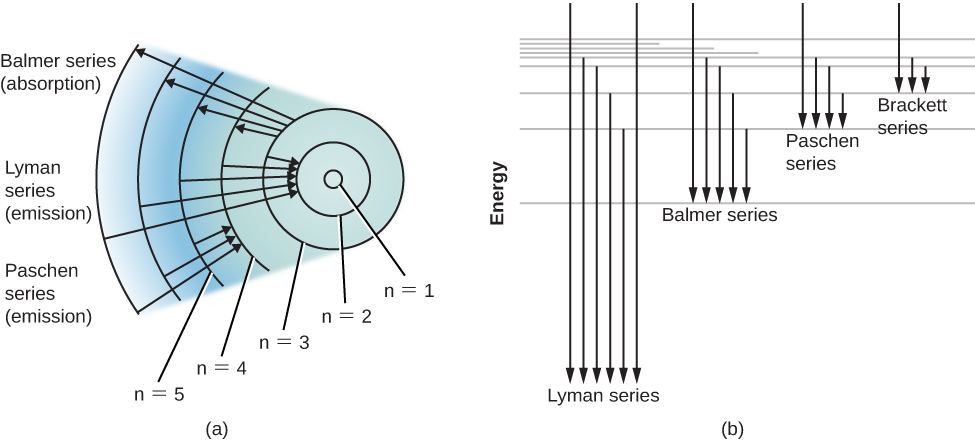
Les atomes qui ont absorbé des photons spécifiques d'un faisceau de lumière blanche et qui sont ainsi excités se désexcitent généralement eux-mêmes et émettent à nouveau cette lumière en très peu de temps. Vous vous demandez peut-être pourquoi des raies spectrales sombres sont produites. En d'autres termes, pourquoi cette lumière réémise ne « comble-t-elle » pas rapidement les lignes d'absorption les plus sombres ?
Imaginez un faisceau de lumière blanche venant vers vous à travers un gaz plus frais. Une partie de la lumière réémise est en fait renvoyée vers le faisceau de lumière blanche que vous voyez, mais cela ne remplit que légèrement les lignes d'absorption. La raison en est que les atomes du gaz réémettent de la lumière dans toutes les directions et que seule une petite fraction de la lumière réémise se trouve dans la direction du faisceau d'origine (vers vous). Dans une étoile, une grande partie de la lumière réémise va en fait dans des directions qui mènent à l'étoile, ce qui ne sert à rien les observateurs extérieurs à l'étoile.
La figure\(\PageIndex{3}\) résume les différents types de spectres dont nous avons parlé. Une ampoule à incandescence produit un spectre continu. Lorsque ce spectre continu est observé à travers un nuage de gaz plus fin, un spectre de raies d'absorption peut être observé superposé au spectre continu. Si nous ne regardons qu'un nuage d'atomes de gaz excités (sans source continue visible derrière lui), nous constatons que les atomes excités émettent un spectre de raies d'émission.
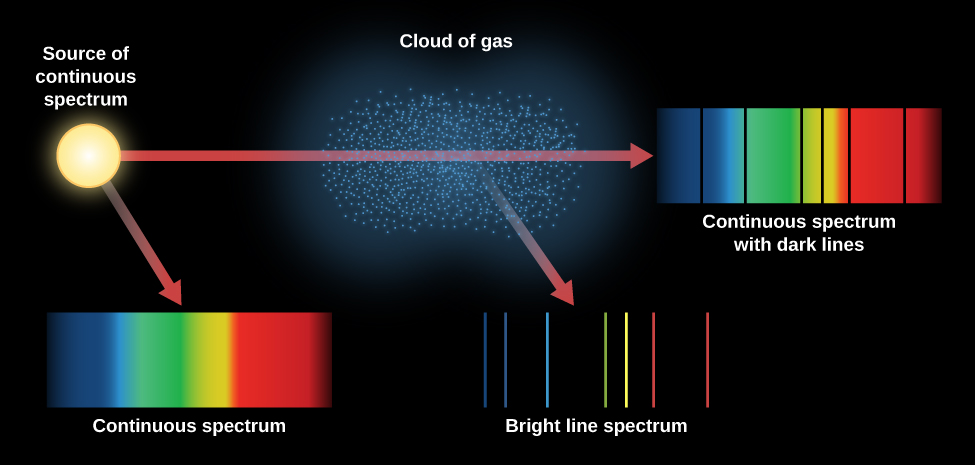
Les atomes d'un gaz chaud se déplacent à grande vitesse et entrent continuellement en collision les uns avec les autres et avec des électrons libres. Ils peuvent être excités (électrons se déplaçant vers un niveau supérieur) et désexcités (électrons se déplaçant vers un niveau inférieur) par ces collisions ainsi qu'en absorbant et en émettant de la lumière. La vitesse des atomes dans un gaz dépend de la température. Lorsque la température est plus élevée, la vitesse et l'énergie des collisions le sont également. Plus le gaz est chaud, plus les électrons sont susceptibles d'occuper les orbites les plus extérieures, qui correspondent aux niveaux d'énergie les plus élevés. Cela signifie que le niveau auquel les électrons commencent à sauter vers le haut dans un gaz peut servir d'indicateur de la température de ce gaz. Ainsi, les raies d'absorption d'un spectre fournissent aux astronomes des informations sur la température des régions d'où proviennent les raies.
Utilisez cette simulation pour jouer avec un atome d'hydrogène et voir ce qui se passe lorsque des électrons se déplacent vers des niveaux plus élevés puis émettent des photons lorsqu'ils atteignent un niveau inférieur.
Ionisation
Nous avons décrit comment certaines quantités discrètes d'énergie peuvent être absorbées par un atome, l'élevant à un état excité et éloignant l'un de ses électrons de son noyau. Si suffisamment d'énergie est absorbée, l'électron peut être complètement retiré de l'atome, c'est ce que l'on appelle l'ionisation. On dit alors que l'atome est ionisé. La quantité minimale d'énergie requise pour retirer un électron d'un atome à l'état fondamental est appelée énergie d'ionisation.
Des quantités d'énergie encore plus importantes doivent être absorbées par l'atome maintenant ionisé (appelé ion) pour éliminer un électron supplémentaire plus profondément dans la structure de l'atome. Des énergies de plus en plus importantes sont nécessaires pour retirer les troisième, quatrième, cinquième et ainsi de suite, électrons de l'atome. Si suffisamment d'énergie est disponible, un atome peut devenir complètement ionisé et perdre tous ses électrons. Un atome d'hydrogène, qui n'a qu'un électron à perdre, ne peut être ionisé qu'une seule fois ; un atome d'hélium peut être ionisé deux fois ; et un atome d'oxygène jusqu'à huit fois. Lorsque nous examinons les régions du cosmos où le rayonnement énergétique est important, comme les quartiers où de jeunes étoiles chaudes se sont récemment formées, nous voyons une forte ionisation se produire.
Un atome qui s'est ionisé positivement a perdu une charge négative, l'électron manquant, et se retrouve donc avec une charge positive nette. Il exerce donc une forte attraction sur tout électron libre. Finalement, un ou plusieurs électrons seront capturés et l'atome redeviendra neutre (ou ionisé à un degré de moins). Au cours du processus de capture d'électrons, l'atome émet un ou plusieurs photons. Les photons émis dépendent du fait que l'électron est capturé immédiatement au niveau d'énergie le plus bas de l'atome ou s'arrête à un ou plusieurs niveaux intermédiaires avant d'atteindre le niveau le plus bas disponible.
Tout comme l'excitation d'un atome peut résulter d'une collision avec un autre atome, ion ou électron (les collisions avec des électrons sont généralement les plus importantes), il en va de même pour l'ionisation. La vitesse à laquelle ces ionisations par collision se produisent dépend de la vitesse des atomes et donc de la température du gaz : plus le gaz est chaud, plus ses atomes seront ionisés.
La vitesse à laquelle les ions et les électrons se recombinent dépend également de leurs vitesses relatives, c'est-à-dire de la température. De plus, cela dépend de la densité du gaz : plus la densité est élevée, plus les chances de recapture sont grandes, car les différents types de particules sont plus étroitement entassés. À partir de la connaissance de la température et de la densité d'un gaz, il est possible de calculer la fraction d'atomes qui ont été ionisés une, deux fois, etc. Dans le Soleil, par exemple, nous constatons que la plupart des atomes d'hydrogène et d'hélium de son atmosphère sont neutres, alors que la plupart des atomes de calcium, ainsi que de nombreux autres atomes plus lourds, sont ionisés une seule fois.
Les niveaux d'énergie d'un atome ionisé sont complètement différents de ceux du même atome lorsqu'il est neutre. Chaque fois qu'un électron est retiré de l'atome, les niveaux d'énergie de l'ion, et donc les longueurs d'onde des raies spectrales qu'il peut produire, changent. Cela permet aux astronomes de différencier les ions d'un élément donné. L'hydrogène ionisé, dépourvu d'électrons, ne peut produire aucune raie d'absorption.
Concepts clés et résumé
Lorsque les électrons passent d'un niveau d'énergie supérieur à un niveau d'énergie inférieur, des photons sont émis et une raie d'émission est visible dans le spectre. Les raies d'absorption sont visibles lorsque les électrons absorbent des photons et se déplacent vers des niveaux d'énergie plus élevés. Comme chaque atome possède son propre ensemble de niveaux d'énergie, chacun est associé à un motif unique de raies spectrales. Cela permet aux astronomes de déterminer quels éléments sont présents dans les étoiles et dans les nuages de gaz et de poussière entre les étoiles. Un atome dont le niveau d'énergie est le plus bas est à l'état fondamental. Si un électron se trouve sur une orbite autre que la moins énergétique possible, on dit que l'atome est excité. Si un atome a perdu un ou plusieurs électrons, on parle d'ion et on dit qu'il est ionisé. Les spectres des différents ions ont une apparence différente et peuvent renseigner les astronomes sur la température des sources qu'ils observent.
Lexique
- excitation
- le processus qui consiste à donner à un atome ou à un ion une quantité d'énergie supérieure à celle dont il dispose dans son état énergétique le plus faible (fondamental)
- état du sol
- l'état énergétique le plus bas d'un atome
- ion
- un atome qui s'est chargé électriquement par l'ajout ou la perte d'un ou de plusieurs électrons
- ionisation
- le processus par lequel un atome gagne ou perd des électrons


