18.11 : Présence, préparation et propriétés des halogènes
- Page ID
- 193951
- Décrire la préparation, les propriétés et les utilisations des halogènes
- Décrire les propriétés, la préparation et les utilisations des composés halogénés
Les éléments du groupe 17 sont les halogènes. Ce sont les éléments fluor, chlore, brome, iode et astatine. Ces éléments sont trop réactifs pour être présents librement dans la nature, mais leurs composés sont largement distribués. Les chlorures sont les plus abondants ; bien que les fluorures, les bromures et les iodures soient moins courants, ils sont relativement disponibles. Dans cette section, nous examinerons la présence, la préparation et les propriétés des halogènes. Ensuite, nous examinerons les composés halogénés avec les métaux représentatifs, puis nous examinerons les interhalogènes. Cette section se terminera par certaines applications des halogènes.
Occurrence et préparation
Tous les halogènes sont présents dans l'eau de mer sous forme d'ions halogénures. La concentration de l'ion chlorure est de 0,54 M ; celle des autres halogénures est inférieure à 10 —4 M. Le fluorure est également présent dans des minéraux tels que le CaF 2, le Ca (PO 4) 3 F et le Na 3 AlF 6. Le chlorure est également présent dans le Grand Lac Salé et la mer Morte, ainsi que dans de vastes gisements de sel contenant du NaCl, du KCl ou du MgCl 2. Une partie du chlore de votre corps est présente sous forme d'acide chlorhydrique, un composant de l'acide gastrique. Les composés bromés sont présents dans la mer Morte et dans les saumures souterraines. Les composés iodés se trouvent en petites quantités dans le salpêtre chilien, les saumures souterraines et le varech marin. L'iode est essentiel au fonctionnement de la glande thyroïde.
Les meilleures sources d'halogènes (sauf l'iode) sont les sels halogénés. Il est possible d'oxyder les ions halogénures en molécules halogènes diatomiques libres par différentes méthodes, en fonction de la facilité d'oxydation de l'ion halogénure. Le fluorure est le plus difficile à oxyder, tandis que l'iodure est le plus facile.
La principale méthode de préparation du fluor est l'oxydation électrolytique. La procédure d'électrolyse la plus courante consiste à utiliser un mélange fondu de fluorure d'hydrogène de potassium, de KHF 2 et de fluorure d'hydrogène anhydre. L'électrolyse provoque la décomposition du HF, formant du fluor à l'anode et de l'hydrogène à la cathode. Il est nécessaire de maintenir les deux gaz séparés pour éviter leur recombinaison explosive pour reformer le fluorure d'hydrogène.
La majeure partie du chlore commercial provient de l'électrolyse de l'ion chlorure dans des solutions aqueuses de chlorure de sodium ; il s'agit du procédé chlore-alcali discuté précédemment. Le chlore est également un produit de la production électrolytique de métaux tels que le sodium, le calcium et le magnésium à partir de leurs chlorures fondus. Il est également possible de préparer du chlore par oxydation chimique de l'ion chlorure en solution acide avec des agents oxydants puissants tels que le dioxyde de manganèse (\(\ce{MnO2}\)) ou le dichromate de sodium (\(\ce{Na2Cr2O7}\)). La réaction avec le dioxyde de manganèse est :
\[\ce{MnO}_{2(s)}+\ce{2Cl^-}_{(aq)}+\ce{4H_3O^+}_{(aq)}⟶\ce{Mn}^{2+}_{(aq)}+\ce{Cl}_{2(g)}+\ce{6H_2O}_{(l)}\nonumber \]
La préparation commerciale du brome implique l'oxydation de l'ion bromure par le chlore :
\[\ce{2Br^-}_{(aq)}+\ce{Cl}_{2(g)}⟶\ce{Br}_{2(l)}+\ce{2Cl^-}_{(aq)} \nonumber \]
Le chlore est un agent oxydant plus puissant que le brome. Cette méthode est importante pour la production de la quasi-totalité du brome domestique.
Une partie de l'iode provient de l'oxydation du chlorure d'iode\(\ce{ICl}\), ou acide iodé\(\ce{HlO_3}\). La préparation commerciale d'iode utilise la réduction de l'iodate de sodium\(\ce{NaIO_3}\), une impureté présente dans les gisements de salpêtre du Chili, avec de l'hydrogénosulfite de sodium :
\[\ce{2IO^-}_{3(aq)}+\ce{5HSO^-}_{3(aq)}⟶\ce{3HSO^-}_{4(aq)}+\ce{2SO^{2-}}_{4(aq)}+\ce{H_2O}_{(l)}+\ce{I}_{2(s)} \nonumber \]
Propriétés des halogènes
Le fluor est un gaz jaune pâle, le chlore est un gaz jaune verdâtre, le brome est un liquide brun rougeâtre foncé et l'iode est un solide cristallin noir grisâtre. Le brome liquide a une pression de vapeur élevée et la vapeur rougeâtre est facilement visible sur la figure\(\PageIndex{1}\). Les cristaux d'iode ont une pression de vapeur notable. Lorsqu'ils sont chauffés doucement, ces cristaux se subliment et forment une belle vapeur d'un violet profond.

Le brome n'est que légèrement soluble dans l'eau, mais il est miscible en toutes proportions dans des solvants moins polaires (ou non polaires) tels que le chloroforme, le tétrachlorure de carbone et le disulfure de carbone, formant des solutions allant du jaune au brun rougeâtre, selon la concentration.
L'iode est soluble dans le chloroforme, le tétrachlorure de carbone, le disulfure de carbone et de nombreux hydrocarbures, donnant des solutions violettes de molécules d'I 2. L'iode ne se dissout que légèrement dans l'eau, donnant des solutions brunes. Il est assez soluble dans les solutions aqueuses d'iodures, avec lesquelles il forme des solutions brunes. Ces solutions brunes sont dues au fait que les molécules d'iode ont des orbitales de valence d vides et peuvent agir comme des acides de Lewis faibles vis-à-vis de l'ion iodure. L'équation de la réaction réversible de l'iode (acide de Lewis) avec l'ion iodure (base de Lewis) pour former l'ion triiodure,\(\ce{I3-}\), est la suivante :
\[\ce{I}_{2(s)}+\ce{I^-}_{(aq)}⟶\ce{I^-}_{3(aq)} \label{4} \]
Plus il est facile d'oxyder l'ion halogénure, plus il est difficile pour l'halogène d'agir en tant qu'agent oxydant. Le fluor oxyde généralement un élément jusqu'à son état d'oxydation le plus élevé, alors que les halogènes plus lourds ne le peuvent pas. Par exemple, lorsque l'excès de fluor réagit avec le soufre, il\(\ce{SF_6}\) se forme. Le chlore donne\(\ce{SCl_2}\) du brome,\(\ce{S_2Br_2}\). L'iode ne réagit pas avec le soufre.
Le fluor est l'agent oxydant le plus puissant des éléments connus. Il oxyde spontanément la plupart des autres éléments ; par conséquent, la réaction inverse, l'oxydation des fluorures, est très difficile à réaliser. Le fluor réagit directement et forme des fluorures binaires avec tous les éléments, à l'exception des gaz rares plus légers (He, Ne et Ar). Le fluor est un agent oxydant si puissant que de nombreuses substances s'enflamment au contact de celui-ci. Les gouttes d'eau s'enflamment dans le fluor et se forment\(\ce{O_2}\)\(\ce{OF_2}\)\(\ce{H_2O_2}\),,\(\ce{O_3}\), et\(\ce{HF}\). Le bois et l'amiante s'enflamment et brûlent sous l'effet du fluor. La plupart des métaux chauds brûlent vigoureusement dans le fluor. Cependant, il est possible de manipuler le fluor dans des récipients en cuivre, en fer ou en nickel car un film adhérent du sel de fluorure passive leurs surfaces. Le fluor est le seul élément qui réagit directement avec le gaz rare xénon.
Bien qu'il s'agisse d'un puissant agent oxydant, le chlore est moins actif que le fluor. Le fait de mélanger du chlore et de l'hydrogène dans l'obscurité ralentit imperceptiblement la réaction entre eux. L'exposition du mélange à la lumière provoque une réaction explosive des deux. Le chlore est également moins actif envers les métaux que le fluor, et les réactions d'oxydation nécessitent généralement des températures plus élevées. Le sodium fondu s'enflamme dans le chlore. Le chlore attaque la plupart des substances non métalliques (le C, le N2 et l'O2 sont des exceptions notables), formant des composés moléculaires covalents. Le chlore réagit généralement avec des composés qui ne contiennent que du carbone et de l'hydrogène (hydrocarbures) en s'ajoutant à de multiples liaisons ou par substitution.
Dans l'eau froide, le chlore subit une réaction de disproportionation :
\[\ce{Cl}_{2(aq)}+\ce{2H_2O}_{(l)}⟶\ce{HOCl}_{(aq)}+\ce{H_3O^+}_{(aq)}+\ce{Cl^-}_{(aq)} \nonumber \]
La moitié des atomes de chlore s'oxydent jusqu'à l'état d'oxydation 1+ (acide hypochloreux) et l'autre moitié se réduit à l'état d'oxydation 1− (ion chlorure). Cette dismutation étant incomplète, l'eau chlorée est un mélange équilibré de molécules de chlore, de molécules d'acide hypochloreux, d'ions hydronium et d'ions chlorure. Exposée à la lumière, cette solution subit une décomposition photochimique :
\[\ce{2HOCl}_{(aq)}+\ce{2H_2O}_{(l)}\xrightarrow{\ce{sunlight}} \ce{2H_3O^+}_{(aq)}+\ce{2Cl^-}_{(aq)}+\ce{O}_{2(g)} \nonumber \]
Le chlore non métallique est plus électronégatif que tout autre élément à l'exception du fluor, de l'oxygène et de l'azote. En général, les éléments très électronégatifs sont de bons agents oxydants ; on peut donc s'attendre à ce que le chlore élémentaire oxyde tous les autres éléments à l'exception de ces trois éléments (et des gaz rares non réactifs). Sa propriété oxydante est en effet à l'origine de son utilisation principale. Par exemple, le chlorure de phosphore (V), un intermédiaire important dans la préparation d'insecticides et d'armes chimiques, est fabriqué en oxydant le phosphore avec du chlore :
\[\ce{P}_{4(s)}+\ce{10Cl}_{2(g)}⟶\ce{4PCl}_{5(l)} \nonumber \]
Une grande quantité de chlore est également utilisée pour oxyder, et donc pour détruire, les matières organiques ou biologiques lors de la purification de l'eau et du blanchiment.
Les propriétés chimiques du brome sont similaires à celles du chlore, bien que le brome soit l'agent oxydant le plus faible et que sa réactivité soit inférieure à celle du chlore.
L'iode est le moins réactif des halogènes. C'est l'agent oxydant le plus faible et l'ion iodure est l'ion halogénure le plus facilement oxydé. L'iode réagit avec les métaux, mais le chauffage est souvent nécessaire. Il n'oxyde pas les autres ions halogénures.
Comparé aux autres halogènes, l'iode ne réagit que légèrement avec l'eau. Les traces d'iode dans l'eau réagissent avec un mélange d'amidon et d'ions iodure, formant une couleur bleu foncé. Cette réaction est un test très sensible pour détecter la présence d'iode dans l'eau.
Halogénures des métaux représentatifs
Des milliers de sels des métaux représentatifs ont été préparés. Les halogénures binaires constituent une importante sous-classe de sels. Un sel est un composé ionique composé de cations et d'anions, autres que des ions hydroxyde ou d'oxyde. D'une manière générale, il est possible de préparer ces sels à partir des métaux ou à partir d'oxydes, d'hydroxydes ou de carbonates. Nous illustrerons les types généraux de réactions de préparation de sels par le biais de réactions utilisées pour préparer des halogénures binaires.
Les composés binaires d'un métal avec les halogènes sont les halogénures. La plupart des halogénures binaires sont ioniques. Cependant, le mercure, les éléments du groupe 13 ayant des états d'oxydation 3+, l'étain (IV) et le plomb (IV) forment des halogénures binaires covalents. La réaction directe d'un métal et d'un halogène produit l'halogénure du métal. Des exemples de ces réactions d'oxydoréduction incluent :
\[\ce{Cd}_{(s)}+\ce{Cl}_{2(g)}⟶\ce{CdCl}_{2(s)} \nonumber \]
\[\ce{2Ga}_{(l)}+\ce{3Br}_{2(l)}⟶\ce{2GaBr}_{3(s)} \nonumber \]
Vidéo\(\PageIndex{1}\) : Les réactions des métaux alcalins avec les halogènes élémentaires sont très exothermiques et souvent très violentes. Dans des conditions contrôlées, ils proposent des démonstrations passionnantes aux étudiants en chimie en herbe. Vous pouvez voir le chauffage initial du sodium qui élimine le revêtement d'hydroxyde de sodium, de peroxyde de sodium et d'huile minérale résiduelle pour exposer la surface réactive. La réaction avec le chlore gazeux se déroule alors très bien.
Si un métal peut présenter deux états d'oxydation, il peut être nécessaire de contrôler la stœchiométrie afin d'obtenir l'halogénure ayant l'état d'oxydation le plus bas. Par exemple, la préparation du chlorure d'étain (II) nécessite un rapport 1:1 entre Sn et\(\ce{Cl_2}\), alors que la préparation du chlorure d'étain (IV) nécessite un rapport de 1:2 :
\[\ce{Sn}_{(s)}+\ce{Cl}_{2(g)}⟶\ce{SnCl}_{2(s)} \nonumber \]
\[\ce{Sn}_{(s)}+\ce{2Cl}_{2(g)}⟶\ce{SnCl}_{4(l)}\nonumber \]
Les métaux représentatifs actifs, ceux qui sont plus faciles à oxyder que l'hydrogène, réagissent avec des halogénures d'hydrogène gazeux pour produire des halogénures métalliques et de l'hydrogène. La réaction du zinc avec le fluorure d'hydrogène est la suivante :
\[\ce{Zn}_{(s)}+\ce{2HF}_{(g)}⟶\ce{ZnF}_{2(s)}+\ce{H}_{2(g)} \nonumber \]
Les métaux représentatifs actifs réagissent également avec des solutions d'halogénures d'hydrogène pour former de l'hydrogène et des solutions des halogénures correspondants. Des exemples de telles réactions incluent :
\[\ce{Cd}_{(s)}+\ce{2HBr}_{(aq)}⟶\ce{CdBr}_{2(aq)}+\ce{H}_{2(g)} \nonumber \]
\[\ce{Sn}_{(s)}+\ce{2HI}_{(aq)}⟶\ce{SnI}_{2(aq)}+\ce{H}_{2(g)} \nonumber \]
Les hydroxydes, les carbonates et certains oxydes réagissent avec des solutions d'halogénures d'hydrogène pour former des solutions de sels d'halogénure. Il est possible de préparer des sels supplémentaires en faisant réagir ces hydroxydes, carbonates et oxydes avec une solution aqueuse d'autres acides :
\[\ce{CaCo}_{3(s)}+\ce{2HCl}_{(aq)}⟶\ce{CaCl}_{2(aq)}+\ce{CO}_{2(g)}+\ce{H_2O}_{(l)} \nonumber \]
\[\ce{TlOH}_{(aq)}+\ce{HF}_{(aq)}⟶\ce{TlF}_{(aq)}+\ce{H_2O}_{(l)} \nonumber \]
Quelques halogénures et de nombreux autres sels des métaux représentatifs sont insolubles. Il est possible de préparer ces sels solubles par des réactions de métathèse qui se produisent lorsque des solutions de sels solubles sont mélangées (Figure\(\PageIndex{2}\)). Les réactions de métathèse sont examinées dans le chapitre sur la stœchiométrie des réactions chimiques.

Plusieurs halogénures sont présents en grande quantité dans la nature. L'océan et les saumures souterraines contiennent de nombreux halogénures. Par exemple, le chlorure de magnésium présent dans l'océan est la source des ions magnésium utilisés dans la production de magnésium. De grands gisements souterrains de chlorure de sodium, tels que la mine de sel illustrée à la figure\(\PageIndex{3}\), se trouvent dans de nombreuses régions du monde. Ces dépôts sont la source de sodium et de chlore dans presque tous les autres composés contenant ces éléments. Le procédé chlore-alcali en est un exemple.

Interhalogènes
Les composés formés à partir de deux halogènes différents ou plus sont des interhalogènes. Les molécules interhalogènes sont constituées d'un atome d'halogène le plus lourd lié par des liaisons simples à un nombre impair d'atomes de l'halogène le plus léger. Les structures de l'IF 3, de l'IF 5 et de l'IF 7 sont illustrées dans la figure. Les\(\PageIndex{4}\) formules pour d'autres interhalogènes, dont chacun provient de la réaction des halogènes respectifs, sont présentées dans le tableau\(\PageIndex{1}\).
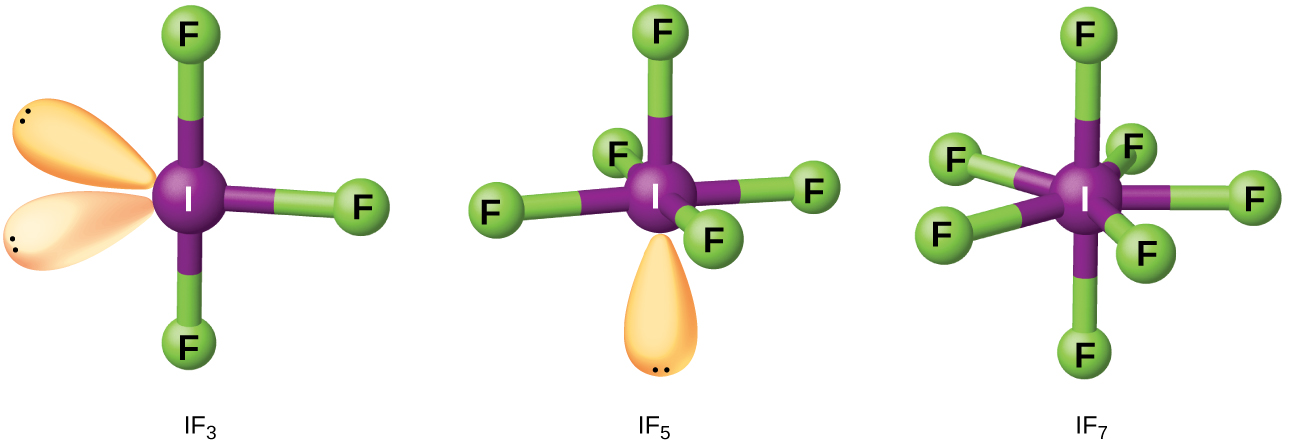
Il est noté dans le tableau\(\PageIndex{1}\) que le fluor est capable d'oxyder l'iode jusqu'à son état d'oxydation maximal, 7+, tandis que le brome et le chlore, qui sont plus difficiles à oxyder, n'atteignent que l'état d'oxydation 5+. Un état d'oxydation 7+ est la limite pour les halogènes. Comme les halogènes plus petits sont regroupés autour d'un plus gros, le nombre maximum d'atomes plus petits possible augmente à mesure que le rayon du plus gros atome augmente. Nombre de ces composés sont instables et la plupart sont extrêmement réactifs. Les interhalogènes réagissent comme les halogénures qui les composent ; les fluorures d'halogène, par exemple, sont des agents oxydants plus puissants que les chlorures d'halogène.
| YX | YX 3 | YX 5 | YX 7 |
|---|---|---|---|
| BrCl (g) | |||
| BrF (g) | BrF (3 l) | BrF (5 l) | |
| ClF (g) | ClF (g) | ClF (g) | |
| Ecran (s) | |||
| CiL (l) | iCl (3) | ||
| IF (s) | IF (3) | SI 5 (l) | SI 7 (g) |
Les polyhalogénures ioniques des métaux alcalins, tels que KI 3, KiCl 2, KiCl 4, CSiBr 2 et CsBrCl 2, qui contiennent un anion composé d'au moins trois atomes d'halogène, sont étroitement liés aux interhalogènes. Comme on l'a vu précédemment, la formation de l'anion polyhalogénure\(\ce{I_3^-}\) est responsable de la solubilité de l'iode dans les solutions aqueuses contenant un ion iodure.
Applications
L'ion fluorure et les composés fluorés ont de nombreuses utilisations importantes. Les composés de carbone, d'hydrogène et de fluor remplacent les fréons (composés de carbone, de chlore et de fluor) comme réfrigérants. Le téflon est un polymère composé d'unités -CF 2 CF 2 -. L'ion fluorure est ajouté aux réserves d'eau et à certains dentifrices sous forme de SnF 2 ou de NaF pour lutter contre la carie dentaire. Le fluorure convertit partiellement les dents du Ca 5 (PO 4) 3 (OH) en Ca 5 (PO 4) 3 F.
Le chlore est important pour blanchir la pâte de bois et les tissus de coton. Le chlore réagit avec l'eau pour former de l'acide hypochloreux, qui oxyde les substances colorées en substances incolores. De grandes quantités de chlore jouent un rôle important dans la chloration des hydrocarbures (remplacement de l'hydrogène par du chlore) pour produire des composés tels que le tétrachlorure (CCl 4), le chloroforme (CHCl 3) et le chlorure d'éthyle (C 2 H 5 Cl), ainsi que dans la production de polychlorure de vinyle (PVC) et d'autres polymères. Le chlore est également important pour tuer les bactéries présentes dans les réserves d'eau communautaires.
Le brome joue un rôle important dans la production de certains colorants, et les bromures de sodium et de potassium sont utilisés comme sédatifs. À une certaine époque, le bromure d'argent photosensible faisait partie des pellicules photographiques.
L'iode en solution alcoolique avec de l'iodure de potassium est un antiseptique (teinture d'iode). Les sels d'iodure sont essentiels au bon fonctionnement de la glande thyroïde ; une carence en iode peut entraîner le développement d'un goitre. Le sel de table iodé contient 0,023 % d'iodure de potassium. L'iodure d'argent est utile pour ensemencer les nuages afin de provoquer la pluie ; il a joué un rôle important dans la production de films photographiques et l'iodoforme, le CHI 3, est un antiseptique.
Résumé
Les halogènes forment des halogénures contenant moins d'éléments électronégatifs. Les halogénures des métaux varient d'ioniques à covalents ; les halogénures des métaux non métalliques sont covalents. Les interhalogènes se forment par la combinaison de deux halogènes différents ou plus. Tous les métaux représentatifs réagissent directement avec des halogènes élémentaires ou avec des solutions d'acides halogénés (HF, HCl, HBr et HI) pour produire des halogénures métalliques représentatifs. D'autres préparations de laboratoire impliquent l'ajout d'acides halogénés aqueux à des composés contenant de tels anions basiques, tels que des hydroxydes, des oxydes ou des carbonates.


