18.7 : Présence, préparation et propriétés de l'azote
- Page ID
- 193962
- Décrire les propriétés, la préparation et les utilisations de l'azote
La majeure partie de l'azote pur provient de la distillation fractionnée de l'air liquide. L'atmosphère est composée de 78 % d'azote en volume. Cela signifie qu'il y a plus de 20 millions de tonnes d'azote sur chaque kilomètre carré de la surface de la Terre. L'azote est un composant des protéines et du matériel génétique (ADN/ARN) de toutes les plantes et de tous les animaux.
Dans des conditions normales, l'azote est un gaz incolore, inodore et insipide. Il bout à 77 K et gèle à 63 K. L'azote liquide est un réfrigérant utile car il est peu coûteux et a un point d'ébullition bas. L'azote est très peu réactif en raison de la triple liaison très forte entre les atomes d'azote. Les seules réactions courantes à température ambiante se produisent avec le lithium pour former du Li 3 N, avec certains complexes de métaux de transition et avec l'hydrogène ou l'oxygène dans les bactéries fixatrices d'azote. Le manque général de réactivité de l'azote fait de la remarquable capacité de certaines bactéries à synthétiser des composés azotés en utilisant l'azote gazeux atmosphérique comme source l'un des événements chimiques les plus passionnants de notre planète. Ce processus est un type de fixation de l'azote. Dans ce cas, la fixation de l'azote est le processus par lequel les organismes convertissent l'azote atmosphérique en produits chimiques biologiquement utiles. La fixation de l'azote se produit également lorsque la foudre traverse l'air, provoquant la réaction de l'azote moléculaire avec l'oxygène pour former des oxydes d'azote, qui sont ensuite transportés vers le sol.
Fixation d'azote
Tous les organismes vivants ont besoin de composés azotés pour survivre. Malheureusement, la plupart de ces organismes ne peuvent pas absorber l'azote de sa source la plus abondante : l'atmosphère. L'azote atmosphérique est constitué de molécules de N 2, qui sont très peu réactives en raison de la forte triple liaison azote-azote. Cependant, quelques organismes peuvent surmonter ce problème grâce à un processus connu sous le nom de fixation de l'azote, illustré à la figure\(\PageIndex{1}\).
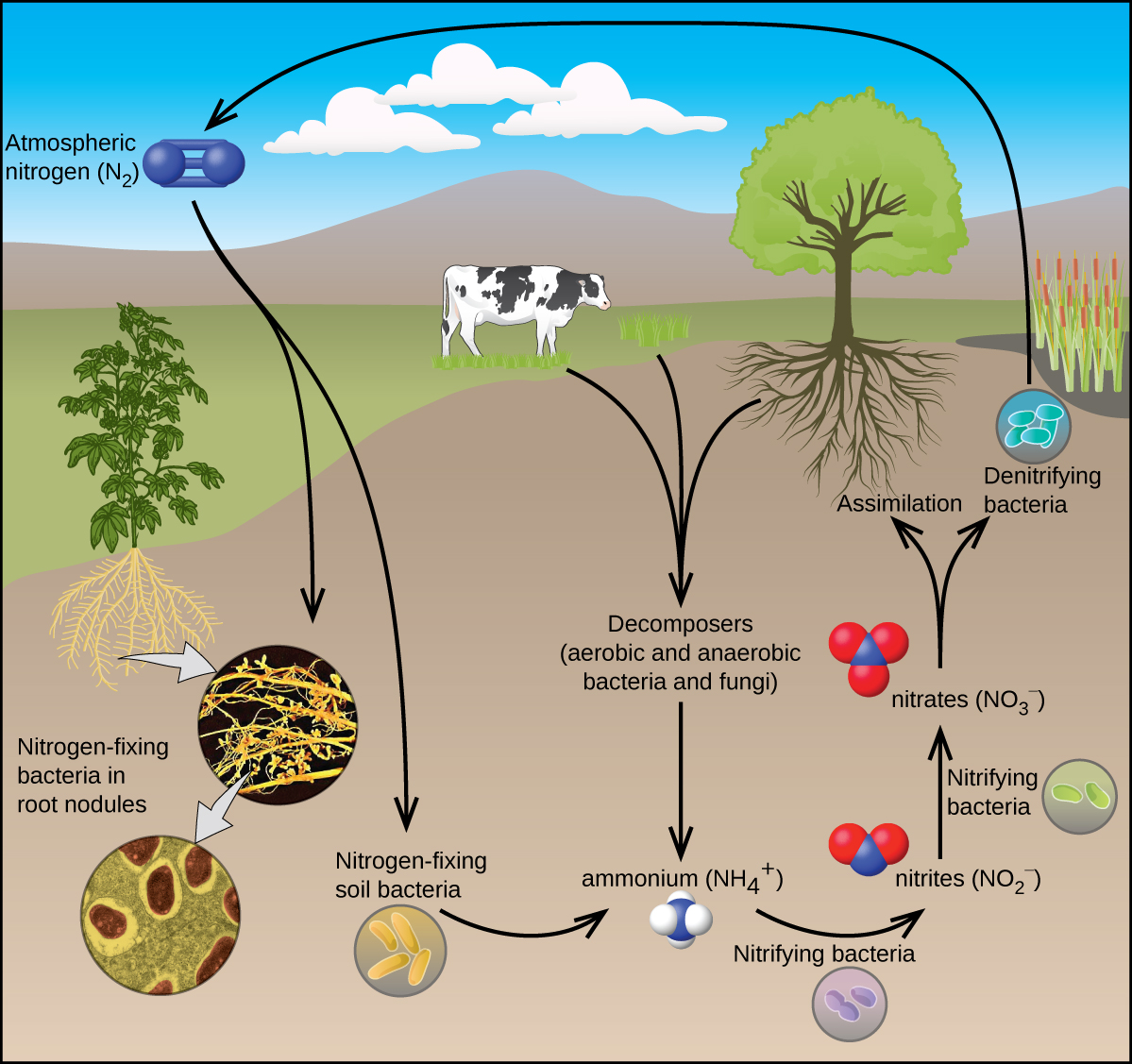
La fixation de l'azote est le processus par lequel les organismes transforment l'azote atmosphérique en produits chimiques biologiquement utiles. À ce jour, les seuls types connus d'organismes biologiques capables de fixer l'azote sont les microorganismes. Ces organismes utilisent des enzymes appelées nitrogénases, qui contiennent du fer et du molybdène. Nombre de ces microorganismes vivent en symbiose avec les plantes, l'exemple le plus connu étant la présence de rhizobiums dans les nodules racinaires des légumineuses.
De grands volumes d'azote atmosphérique sont nécessaires à la fabrication de l'ammoniac, principal matériau de départ utilisé pour la préparation de grandes quantités d'autres composés azotés. La plupart des autres utilisations de l'azote élémentaire dépendent de son inactivité. C'est utile lorsqu'un procédé chimique nécessite une atmosphère inerte. Les aliments en conserve et les viandes à déjeuner ne peuvent pas s'oxyder dans une atmosphère d'azote pur. Ils conservent donc une meilleure saveur et une meilleure couleur et se détériorent moins rapidement lorsqu'ils sont scellés dans de l'azote plutôt que dans de l'air. Cette technologie permet de disposer de produits frais toute l'année, quelle que soit la saison de croissance.
Certains composés contiennent de l'azote dans tous ses états d'oxydation allant de 3− à 5+. Une grande partie de la chimie de l'azote implique des réactions d'oxydoréduction. Certains métaux actifs (tels que les métaux alcalins et les métaux alcalino-terreux) peuvent réduire l'azote pour former des nitrures métalliques. Dans le reste de cette section, nous examinerons la chimie de l'azote et de l'oxygène.
Il existe des oxydes d'azote bien caractérisés dans lesquels l'azote présente chacun de ses indices d'oxydation positifs de 1+ à 5+. Lorsque le nitrate d'ammonium est chauffé avec soin, du protoxyde d'azote (oxyde d'azote) et de la vapeur d'eau se forment. Un chauffage plus fort génère de l'azote, de l'oxygène et de la vapeur d'eau. Personne ne devrait tenter cette réaction, elle peut être très explosive. En 1947, une importante explosion de nitrate d'ammonium s'est produite à Texas City, au Texas, et, en 2013, il y a eu une autre explosion majeure à West, au Texas. Au cours des 100 dernières années, il y a eu près de 30 catastrophes similaires dans le monde, qui ont fait de nombreuses victimes. Dans cette réaction d'oxydoréduction, l'azote de l'ion nitrate oxyde l'azote de l'ion ammonium. Le protoxyde d'azote\(\PageIndex{2}\), illustré sur la figure, est un gaz incolore possédant une odeur douce et agréable et un goût sucré. Il trouve une application comme anesthésique pour des opérations mineures, notamment en dentisterie, sous le nom de « gaz hilarant ».

De faibles rendements d'oxyde nitrique (NO) se forment lors du chauffage conjoint de l'azote et de l'oxygène. Le NO se forme également lorsque la foudre traverse l'air pendant les orages. La combustion de l'ammoniac est la méthode commerciale de préparation du monoxyde d'azote. En laboratoire, la réduction de l'acide nitrique est la meilleure méthode pour préparer du monoxyde d'azote. Lorsque le cuivre réagit avec l'acide nitrique dilué, l'oxyde nitrique est le principal produit de réduction :
\[\ce{3Cu}(s)+\ce{8HNO3}(aq)⟶\ce{2NO}(g)+\ce{3Cu(NO3)2}(aq)+\ce{4H2O}(l) \nonumber \]
L'oxyde nitrique gazeux est l'oxyde d'azote le plus stable thermiquement et la molécule thermiquement stable la plus simple connue avec un électron non apparié. C'est l'un des polluants atmosphériques générés par les moteurs à combustion interne, résultant de la réaction de l'azote atmosphérique et de l'oxygène au cours du processus de combustion.
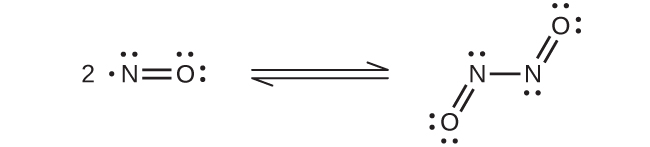
À température ambiante, l'oxyde nitrique est un gaz incolore constitué de molécules diatomiques. Comme c'est souvent le cas pour les molécules qui contiennent un électron non apparié, deux molécules se combinent pour former un dimère en appariant leurs électrons non appariés pour former une liaison. Le NO liquide et le NO solide contiennent tous deux des dimères de N 2 O 2, comme celui illustré à la figure\(\PageIndex{3}\). La plupart des substances contenant des électrons non appariés se colorent en absorbant la lumière visible ; cependant, le NO est incolore car l'absorption de la lumière ne se fait pas dans la région visible du spectre.
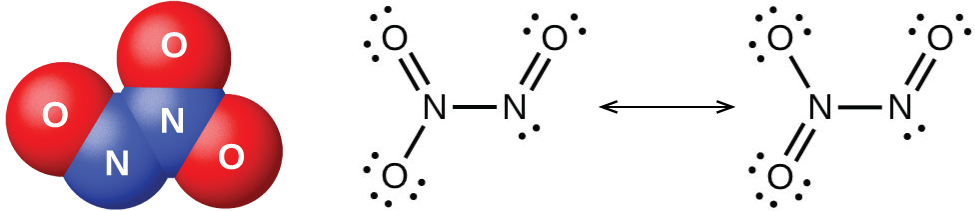
Le refroidissement d'un mélange à parts égales d'oxyde nitrique et de dioxyde d'azote à −21 °C produit du trioxyde d'azote, un liquide bleu composé de molécules de N 2 O 3 (Figure\(\PageIndex{4}\)). Le trioxyde de diazote n'existe qu'à l'état liquide et solide. Lorsqu'il est chauffé, il redevient un mélange de NO et de NO 2.
Il est possible de préparer du dioxyde d'azote en laboratoire en chauffant le nitrate d'un métal lourd ou en réduisant l'acide nitrique concentré avec du cuivre métallique, comme le montre la figure\(\PageIndex{5}\). Commercialement, il est possible de préparer du dioxyde d'azote en oxydant le monoxyde d'azote avec de l'air.

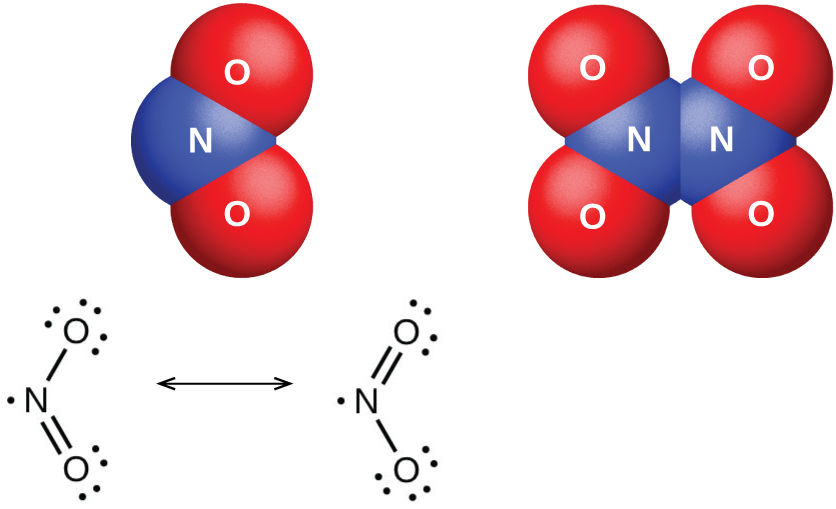
La molécule de dioxyde d'azote (Figure\(\PageIndex{6}\)) contient un électron non apparié, responsable de sa couleur et de son paramagnétisme. Il est également responsable de la dimérisation du NO 2. À basse pression ou à haute température, le dioxyde d'azote a une couleur brun foncé due à la présence de la molécule de NO 2. À basse température, la couleur disparaît presque entièrement sous forme de tétraoxyde de diazote, N 2 O 4. À température ambiante, un équilibre existe :
\[\ce{2NO2}(g)⇌\ce{N2O4}(g) \hspace{20px} K_P=6.86 \nonumber \]
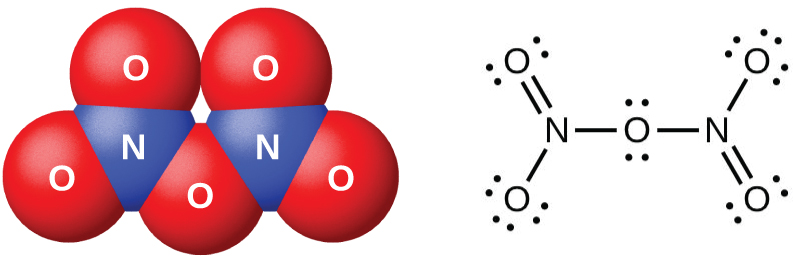
Le pentaoxyde de diazote, N 2 O 5 (Figure\(\PageIndex{7}\)), est un solide blanc formé par la déshydratation de l'acide nitrique par de l'oxyde de phosphore (V) (décoxyde de tétraphosphore) :
\[\ce{P4O10}(s)+\ce{4HNO3}(l)⟶\ce{4HPO3}(s)+\ce{2N2O5}(s) \nonumber \]
Il est instable au-dessus de la température ambiante et se décompose en N 2 O 4 et O 2.
Les oxydes d'azote (III), d'azote (IV) et d'azote (V) réagissent avec l'eau et forment des oxyacides contenant de l'azote. L'oxyde d'azote (III), N 2 O 3, est l'anhydride de l'acide nitreux ; le HNO 2 se forme lorsque le N 2 O 3 réagit avec l'eau. Il n'existe aucun oxyacide stable contenant de l'azote ayant un état d'oxydation de 4+ ; par conséquent, l'oxyde d'azote (IV), NO 2, est disproportionné de deux manières lorsqu'il réagit avec l'eau. Dans l'eau froide, un mélange de HNO 2 et de HNO 3 se forme. À des températures plus élevées, du HNO 3 et du NO se forment. L'oxyde d'azote (V), N 2 O 5, est l'anhydride de l'acide nitrique ; le HNO 3 est produit lorsque le N 2 O 5 réagit avec l'eau :
\[\ce{N2O5}(s)+\ce{H2O}(l)⟶\ce{2HNO3}(aq) \nonumber \]
Les oxydes d'azote présentent un comportement d'oxydoréduction important. L'oxyde nitreux ressemble à l'oxygène dans son comportement lorsqu'il est chauffé avec des substances combustibles. Le N 2 O est un agent oxydant puissant qui se décompose lorsqu'il est chauffé pour former de l'azote et de l'oxygène. Comme le tiers du gaz libéré est de l'oxygène, le protoxyde d'azote favorise mieux la combustion que l'air (un cinquième d'oxygène). Un éclat incandescent prend feu lorsqu'on l'enfonce dans une bouteille de ce gaz. Le monoxyde d'azote agit à la fois comme agent oxydant et comme agent réducteur. Par exemple :
\[\textrm{oxidizing agent: }\ce{P4}(s)+\ce{6NO}(g)⟶\ce{P4O6}(s)+\ce{3N2}(g) \nonumber \]
\[\textrm{reducing agent: }\ce{Cl2}(g)+\ce{2NO}(g)⟶\ce{2ClNO}(g) \nonumber \]
Le dioxyde d'azote (ou tétraoxyde de diazote) est un bon agent oxydant. Par exemple :
\[\ce{NO2}(g)+\ce{CO}(g)⟶\ce{NO}(g)+\ce{CO2}(g) \nonumber \]
\[\ce{NO2}(g)+\ce{2HCl}(aq)⟶\ce{NO}(g)+\ce{Cl2}(g)+\ce{H2O}(l) \nonumber \]
Résumé
L'azote présente des états d'oxydation allant de 3− à 5+. En raison de la stabilité de la triple liaison N105/N, elle nécessite beaucoup d'énergie pour fabriquer des composés à partir de l'azote moléculaire. Les métaux actifs tels que les métaux alcalins et les métaux alcalino-terreux peuvent réduire l'azote pour former des nitrures métalliques. Les oxydes d'azote et les hydrures d'azote sont également des substances importantes.
Lexique
- fixation de l'azote
- formation de composés azotés à partir de l'azote moléculaire


