18.5 : Présence, préparation et composés de l'hydrogène
- Page ID
- 193959
- Décrire les propriétés, la préparation et les composés de l'hydrogène
L'hydrogène est l'élément le plus abondant de l'univers. Le soleil et les autres étoiles sont composés en grande partie d'hydrogène. Les astronomes estiment que 90 % des atomes de l'univers sont des atomes d'hydrogène. L'hydrogène est un composant d'un plus grand nombre de composés que tout autre élément. L'eau est le composé d'hydrogène le plus abondant sur Terre. L'hydrogène est une partie importante du pétrole, de nombreux minéraux, de la cellulose et de l'amidon, du sucre, des graisses, des huiles, des alcools, des acides et de milliers d'autres substances.
Aux températures ordinaires, l'hydrogène est un gaz incolore, inodore, insipide et non toxique constitué de la molécule diatomique H 2. L'hydrogène est composé de trois isotopes et, contrairement aux autres éléments, ces isotopes portent des noms et des symboles chimiques différents : protium, 1 H, deutérium, 2 H (ou « D ») et tritium 3 H (ou « T »). Dans un échantillon naturel d'hydrogène, il y a un atome de deutérium pour 7 000 atomes H et un atome de tritium radioactif pour 10 atomes de 18 H. Les propriétés chimiques des différents isotopes sont très similaires parce qu'ils ont des structures électroniques identiques, mais ils diffèrent dans certaines propriétés physiques en raison de leurs masses atomiques différentes. Le deutérium et le tritium élémentaires ont une pression de vapeur inférieure à celle de l'hydrogène ordinaire. Par conséquent, lorsque l'hydrogène liquide s'évapore, les isotopes les plus lourds sont concentrés dans les dernières parties avant de s'évaporer. L'électrolyse de l'eau lourde, D 2 O, produit du deutérium. La majeure partie du tritium provient de réactions nucléaires.
Préparation de l'hydrogène
L'hydrogène élémentaire doit être préparé à partir de composés en rompant les liaisons chimiques. Les méthodes les plus courantes de préparation de l'hydrogène sont les suivantes.
À partir de vapeur et de carbone ou d'hydrocarbures
L'eau est la source d'hydrogène la moins chère et la plus abondante. Le passage de la vapeur sur du coke (une forme impure de carbone élémentaire) à 1000 °C produit un mélange de monoxyde de carbone et d'hydrogène connu sous le nom de gaz d'eau :
\[\ce{C}(s)+\ce{H2O}(g)\:\mathrm{\xrightarrow{1000\:°C}}\:\underset{\Large\mathrm{water\: gas}}{\ce{CO}(g)+\ce{H2}(g)} \nonumber \]
Le gaz d'eau est utilisé comme combustible industriel. Il est possible de produire de l'hydrogène supplémentaire en mélangeant l'eau gazeuse avec de la vapeur en présence d'un catalyseur pour convertir le CO en CO 2. Cette réaction est la réaction de déplacement des gaz de l'eau.
Il est également possible de préparer un mélange d'hydrogène et de monoxyde de carbone en faisant passer des hydrocarbures provenant du gaz naturel ou du pétrole et de la vapeur d'eau sur un catalyseur à base de nickel. Le propane est un exemple de réactif hydrocarboné :
\[\ce{C3H8}(g)+\ce{3H2O}(g)\:\mathrm{\underset{catalyst}{\xrightarrow{900\:°C}}}\:\ce{3CO}(g)+\ce{7H2}(g) \nonumber \]
Électrolyse
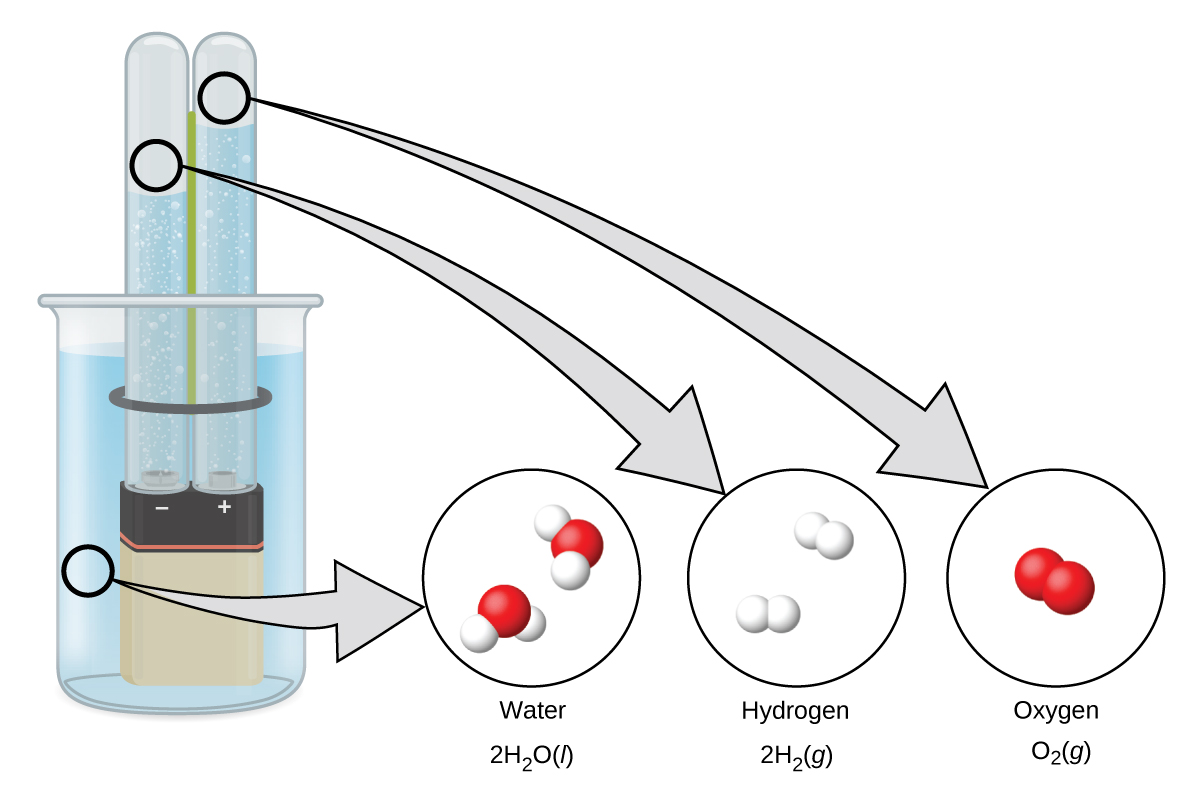
L'hydrogène se forme lorsque de l'électricité en courant continu traverse de l'eau (électrolyse) contenant un électrolyte tel que H 2 SO 4 (Figure\(\PageIndex{1}\).) Des bulles d'hydrogène se forment à la cathode et de l'oxygène se développe à l'anode. La réaction nette est la suivante :
\[\ce{2H2O}(l)+\ce{electrical\: energy}⟶\ce{2H2}(g)+\ce{O2}(g) \nonumber \]
Réaction des métaux avec les acides
Il s'agit de la méthode de laboratoire la plus pratique pour produire de l'hydrogène. Les métaux ayant un potentiel de réduction plus faible réduisent l'ion hydrogène dans les acides dilués pour produire de l'hydrogène gazeux et des sels métalliques. Par exemple, comme le montre la figure\(\PageIndex{2}\), le fer contenu dans l'acide chlorhydrique dilué produit de l'hydrogène gazeux et du chlorure de fer (II) :
\[\ce{Fe}(s)+\ce{2H3O+}(aq)+\ce{2Cl-}(aq)⟶\ce{Fe^2+}(aq)+\ce{2Cl-}(aq)+\ce{H2}(g)+\ce{2H2O}(l) \nonumber \]

Réaction des hydrures métalliques ioniques avec de l'eau
Il est possible de produire de l'hydrogène à partir de la réaction des hydrures des métaux actifs, qui contiennent l'anion H − très fortement basique, avec de l'eau :
\[\ce{CaH2}(s)+\ce{2H2O}(l)⟶\ce{Ca^2+}(aq)+\ce{2OH-}(aq)+\ce{2H2}(g) \nonumber \]
Les hydrures métalliques sont des sources d'hydrogène coûteuses mais pratiques, en particulier lorsque l'espace et le poids sont des facteurs importants. Ils jouent un rôle important dans le gonflage des gilets de sauvetage, des radeaux de sauvetage et des ballons militaires.
Réactions
Dans des conditions normales, l'hydrogène est relativement inactif chimiquement, mais lorsqu'il est chauffé, il entre dans de nombreuses réactions chimiques.
Les deux tiers de la production mondiale d'hydrogène sont consacrés à la fabrication d'ammoniac, qui est un engrais utilisé dans la fabrication d'acide nitrique. De grandes quantités d'hydrogène jouent également un rôle important dans le processus d'hydrogénation, dont il est question dans le chapitre sur la chimie organique.
Il est possible d'utiliser l'hydrogène comme carburant non polluant. La réaction de l'hydrogène avec l'oxygène est une réaction très exothermique, libérant 286 kJ d'énergie par mole d'eau formée. L'hydrogène brûle sans explosion dans des conditions contrôlées. La torche oxygène-hydrogène, en raison de la chaleur élevée de combustion de l'hydrogène, peut atteindre des températures allant jusqu'à 2800 °C. La flamme chaude de cette torche est utile pour couper des tôles épaisses de nombreux métaux. L'hydrogène liquide est également un carburant important pour les fusées (Figure\(\PageIndex{3}\)).

Un atome d'hydrogène non combiné est constitué d'un noyau et d'un électron de valence sur l'orbitale 1 s. La couche de valence n = 1 a une capacité de deux électrons, et l'hydrogène peut légitimement occuper deux emplacements dans le tableau périodique. Il est possible de considérer l'hydrogène comme un élément du groupe 1 car l'hydrogène peut perdre un électron pour former le cation, H +. Il est également possible de considérer l'hydrogène comme un élément du groupe 17 parce qu'il n'a besoin que d'un électron pour remplir son orbitale de valence pour former un ion hydrure, H −, ou parce qu'il peut partager un électron pour former une liaison covalente unique. En réalité, l'hydrogène est un élément unique qui mérite presque sa propre place dans le tableau périodique.
Réactions avec les éléments
Lorsqu'il est chauffé, l'hydrogène réagit avec les métaux du groupe 1 et avec le Ca, le Sr et le Ba (les métaux les plus actifs du groupe 2). Les composés formés sont des hydrures ioniques cristallins qui contiennent l'anion hydrure, H −, un agent réducteur puissant et une base forte, qui réagit vigoureusement avec l'eau et d'autres acides pour former de l'hydrogène gazeux.
Les réactions de l'hydrogène avec des éléments non métalliques produisent généralement des composés hydrogénés acides avec de l'hydrogène à l'état d'oxydation 1+. Les réactions deviennent plus exothermiques et plus vigoureuses à mesure que l'électronégativité du non-métal augmente. L'hydrogène ne réagit avec l'azote et le soufre que lorsqu'il est chauffé, mais il réagit de manière explosive avec le fluor (formant du HF) et, dans certaines conditions, avec le chlore (formant du HCl). Un mélange d'hydrogène et d'oxygène explose s'il est enflammé. En raison de la nature explosive de la réaction, il est nécessaire de faire preuve de prudence lors de la manipulation d'hydrogène (ou de tout autre gaz combustible) afin d'éviter la formation d'un mélange explosif dans un espace confiné. Bien que la plupart des hydrures non métalliques soient acides, l'ammoniac et la phosphine (PH 3) sont des acides très, très faibles et fonctionnent généralement comme des bases. Ces réactions de l'hydrogène avec les éléments sont résumées dans le tableau\(\PageIndex{1}\).
| Équation générale | Commentaires |
|---|---|
| \(\ce{MH\: or\: MH2⟶MOH\: or\: M(OH)2 + H2}\) | hydrures ioniques avec le groupe 1 et Ca, Sr et Ba |
| \(\ce{H2 + C⟶ (no\: reaction)}\) | |
| \(\ce{3H2 + N2 ⟶ 2NH3}\) | nécessite une pression et une température élevées ; faible rendement |
| \(\ce{2H2 + O2 ⟶ 2H2O}\) | exothermique et potentiellement explosif |
| \(\ce{H2 + S ⟶ H2S}\) | nécessite un chauffage ; faible rendement |
| \(\ce{H2 + X2 ⟶ 2HX}\) | X = F, Cl, Br et I ; explosif avec F 2 ; faible rendement avec I 2 |
Réaction avec des composés
L'hydrogène réduit les oxydes chauffés de nombreux métaux, ce qui entraîne la formation du métal et de la vapeur d'eau. Par exemple, le passage d'hydrogène sur du CuO chauffé forme du cuivre et de l'eau. L'hydrogène peut également réduire les ions métalliques de certains oxydes métalliques pour abaisser les états d'oxydation :
\[\ce{H2}(g)+\ce{MnO2}(s)\xrightarrow{Δ}\ce{MnO}(s)+\ce{H2O}(g) \nonumber \]
Composés d'hydrogène
Outre les gaz rares, chacun des non-métaux forme des composés avec l'hydrogène. Par souci de concision, nous n'aborderons ici que quelques composés hydrogénés des non-métaux.
Composés hydrogénés
L'ammoniac, NH 3, se forme naturellement lorsqu'une matière organique contenant de l'azote se décompose en l'absence d'air. La préparation en laboratoire de l'ammoniac se fait par la réaction d'un sel d'ammonium avec une base forte telle que l'hydroxyde de sodium. La réaction acide-base avec l'ion ammonium faiblement acide donne de l'ammoniac, illustré à la figure\(\PageIndex{4}\). L'ammoniac se forme également lorsque les nitrures ioniques réagissent avec l'eau. L'ion nitrure est une base beaucoup plus forte que l'ion hydroxyde :
\[\ce{Mg3N2}(s)+\ce{6H2O}(l)⟶\ce{3Mg(OH)2}(s)+\ce{2NH3}(g) \nonumber \]
La production commerciale d'ammoniac se fait par la combinaison directe des éléments du procédé Haber :
\[\ce{N2}(g)+\ce{3H2}(g)\xrightleftharpoons{\ce{catalyst}}\ce{2NH3}(g) \hspace{20px} ΔH°=\mathrm{−92\: kJ} \nonumber \]
L'ammoniac est un gaz incolore à l'odeur forte et piquante. Les sels odorants utilisent cette puissante odeur. L'ammoniac gazeux se liquéfie facilement pour donner un liquide incolore qui bout à −33 °C. En raison de la liaison hydrogène intermoléculaire, l'enthalpie de vaporisation de l'ammoniac liquide est plus élevée que celle de tout autre liquide à l'exception de l'eau, de sorte que l'ammoniac est utile comme réfrigérant. L'ammoniac est très soluble dans l'eau (658 L au STP se dissolvent dans 1 L d'H 2 O).
Les propriétés chimiques de l'ammoniac sont les suivantes :
- L'ammoniac agit comme une base de Brønsted, comme indiqué dans le chapitre sur la chimie acido-basique. L'ion ammonium a une taille similaire à celle de l'ion potassium ; les composés des deux ions présentent de nombreuses similitudes dans leurs structures et leurs solubilités.
- L'ammoniac peut présenter un comportement acide, bien qu'il soit beaucoup plus faible que l'eau. Comme les autres acides, l'ammoniac réagit avec les métaux, bien qu'il soit si faible que des températures élevées sont nécessaires. De l'hydrogène et (selon la stœchiométrie) des amides (sels de\(\ce{NH2-}\)), des imides (sels de NH 2 −) ou des nitrures (sels de N 3−) se forment.
- L'atome d'azote de l'ammoniac possède son état d'oxydation le plus bas possible (3−) et n'est donc pas susceptible de réduction. Cependant, il peut être oxydé. L'ammoniac brûle dans l'air et donne du NO et de l'eau. L'ammoniac chaud et l'ion ammonium sont des agents réducteurs actifs. Les oxydations de l'ion ammonium par l'ion nitrite, pour obtenir de l'azote pur\(\ce{NO2-}\), et par l'ion nitrate pour produire du protoxyde d'azote, N 2 O.
- Il existe un certain nombre de composés que nous pouvons considérer comme des dérivés de l'ammoniac en remplaçant un ou plusieurs atomes d'hydrogène par un autre atome ou groupe d'atomes. Les dérivés inorganiques incluent la chloramine, NH 2 Cl et l'hydrazine, N 2 H 4 :
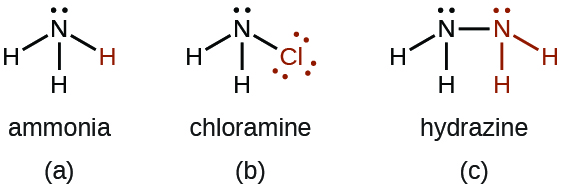
La chloramine, NH 2 Cl, résulte de la réaction de l'hypochlorite de sodium, NaOCl, avec de l'ammoniac en solution basique. En présence d'un grand excès d'ammoniac à basse température, la chloramine réagit davantage pour produire de l'hydrazine, N 2 H 4 :
\[\ce{NH3}(aq)+\ce{OCl-}(aq)⟶\ce{NH2Cl}(aq)+\ce{OH-}(aq) \nonumber \]
\[\ce{NH2Cl}(aq)+\ce{NH3}(aq)+\ce{OH-}(aq)⟶\ce{N2H4}(aq)+\ce{Cl-}(aq)+\ce{H2O}(l) \nonumber \]
L'hydrazine anhydre est relativement stable malgré son énergie libre positive de formation :
\[\ce{N2}(g)+\ce{2H2}(g)⟶\ce{N2H4}(l) \hspace{20px} ΔG^\circ_\ce{f}=\mathrm{149.2\:kJ\:mol^{−1}} \nonumber \]
L'hydrazine est un liquide fumant et incolore qui possède certaines propriétés physiques remarquablement similaires à celles de l'H 2 O (elle fond à 2 °C, bout à 113,5 °C et a une densité à 25 °C de 1,00 g/mL). Il brûle rapidement et complètement dans l'air avec un dégagement de chaleur important :
\[\ce{N2H4}(l)+\ce{O2}(g)⟶\ce{N2}(g)+\ce{2H2O}(l) \hspace{20px} ΔH°=\mathrm{−621.5\:kJ\:mol^{−1}} \nonumber \]
Comme l'ammoniac, l'hydrazine est à la fois une base de Brønsted et une base de Lewis, bien qu'elle soit plus faible que l'ammoniac. Il réagit avec les acides forts et forme deux séries de sels contenant respectivement\(\ce{N2H6^2+}\) les ions\(\ce{N2H5+}\) et. Certaines fusées utilisent de l'hydrazine comme carburant.
Composés hydrogénés
L'hydrure de phosphore le plus important est la phosphine, PH 3, un analogue gazeux de l'ammoniac en termes de formule et de structure. Contrairement à l'ammoniac, il n'est pas possible de former de la phosphine par union directe des éléments. Il existe deux méthodes de préparation de la phosphine. Une méthode consiste à faire agir un acide sur un phosphure ionique. L'autre méthode est la dismutation du phosphore blanc avec une base concentrée chaude pour produire de la phosphine et l'ion hydrogénophosphite :
\[\ce{AlP}(s)+\ce{3H3O+}(aq)⟶\ce{PH3}(g)+\ce{Al^3+}(aq)+\ce{3H2O}(l) \nonumber \]
\[\ce{P4}(s)+\ce{4OH-}(aq)+\ce{2H2O}(l)⟶\ce{2HPO3^2-}(aq)+\ce{2PH3}(g) \nonumber \]
La phosphine est un gaz incolore et très toxique qui a une odeur similaire à celle du poisson en décomposition. La chaleur décompose facilement la phosphine\((\ce{4PH3}⟶\ce{P4}+\ce{6H2})\) et le composé brûle dans l'air. La phosphine est principalement utilisée comme fumigant pour les céréales et dans le traitement des semi-conducteurs. Comme l'ammoniac, la phosphine gazeuse s'unit aux halogénures d'hydrogène gazeux pour former des composés de phosphonium tels que le PH 4 Cl et le PH 4 I. La phosphine est une base beaucoup plus faible que l'ammoniac ; par conséquent, ces composés se décomposent dans l'eau et le PH 3 insoluble s'échappe de la solution.
Composés soufrés
Le sulfure d'hydrogène, H 2 S, est un gaz incolore responsable de l'odeur désagréable des œufs pourris et de nombreuses sources chaudes. Le sulfure d'hydrogène est aussi toxique que le cyanure d'hydrogène ; il est donc nécessaire de le manipuler avec la plus grande prudence. Le sulfure d'hydrogène est particulièrement trompeur car il paralyse les nerfs olfactifs ; après une courte exposition, on ne le sent plus.
La production de sulfure d'hydrogène par réaction directe des éléments (H 2 + S) n'est pas satisfaisante car le rendement est faible. Une méthode de préparation plus efficace consiste à faire réagir un sulfure métallique avec un acide dilué. Par exemple :
\[\ce{FeS}(s)+\ce{2H3O+}(aq)⟶\ce{Fe^2+}(aq)+\ce{H2S}(g)+\ce{2H2O}(l) \nonumber \]
Il est facile d'oxyder le soufre dans les sulfures métalliques et dans le sulfure d'hydrogène, ce qui fait des sulfures métalliques et de l'H 2 S de bons agents réducteurs. Dans les solutions acides, le sulfure d'hydrogène réduit le Fe 3 + en Fe 2 +,\(\ce{MnO4-}\) en Mn 2 +,\(\ce{Cr2O7^2-}\) en Cr 3 + et le HNO 3 en NO 2. Le soufre contenu dans l'H 2 S s'oxyde généralement en soufre élémentaire, à moins qu'un excès important d'agent oxydant ne soit présent. Dans ce cas, le sulfure peut s'oxyder en\(\ce{SO3^2-}\) ou\(\ce{SO4^2-}\) (ou en SO 2 ou SO 3 en l'absence d'eau) :
\[\ce{2H2S}(g)+\ce{O2}(g)⟶\ce{2S}(s)+\ce{2H2O}(l) \nonumber \]
Ce processus d'oxydation permet d'éliminer le sulfure d'hydrogène présent dans de nombreuses sources de gaz naturel. Les dépôts de soufre dans les régions volcaniques peuvent être le résultat de l'oxydation de l'H 2 S présent dans les gaz volcaniques.
Le sulfure d'hydrogène est un acide diprotique faible qui se dissout dans l'eau pour former de l'acide hydrosulfurique. L'acide s'ionise en deux étapes, produisant des ions sulfure d'hydrogène, HS −, dans la première étape et des ions sulfure, S 2−, dans la seconde. Le sulfure d'hydrogène étant un acide faible, les solutions aqueuses de sulfures solubles et de sulfures d'hydrogène sont basiques :
\[\ce{S^2-}(aq)+\ce{H2O}(l)⇌\ce{HS-}(aq)+\ce{OH-}(aq) \nonumber \]
\[\ce{HS-}(aq)+\ce{H2O}(l)⇌\ce{H2S}(g)+\ce{OH-}(aq) \nonumber \]
Composés halogénés
Les composés binaires contenant uniquement de l'hydrogène et un halogène sont des halogénures d'hydrogène. À température ambiante, les halogénures d'hydrogène purs HF, HCl, HBr et HI sont des gaz.
D'une manière générale, il est possible de préparer les halogénures par les techniques générales utilisées pour préparer d'autres acides. Le fluor, le chlore et le brome réagissent directement avec l'hydrogène pour former l'halogénure d'hydrogène correspondant. Il s'agit d'une réaction commercialement importante pour la préparation de chlorure d'hydrogène et de bromure d'hydrogène.
La réaction acide-base entre un acide fort non volatil et un halogénure métallique produira un halogénure d'hydrogène. L'échappement de l'halogénure d'hydrogène gazeux entraîne la fin de la réaction. Par example, la méthode habituelle de préparation du fluorure d'hydrogène consiste à chauffer un mélange de fluorure de calcium, de CaF 2 et d'acide sulfurique concentré :
\[\ce{CaF2}(s)+\ce{H2SO4}(aq)⟶\ce{CaSO4}(s)+\ce{2HF}(g) \nonumber \]
Le fluorure d'hydrogène gazeux est également un sous-produit de la préparation d'engrais phosphatés par la réaction de la fluoroapatite, Ca 5 (PO 4) 3 F, avec de l'acide sulfurique. La réaction de l'acide sulfurique concentré avec un sel de chlorure produit du chlorure d'hydrogène à la fois commercialement et en laboratoire.
Dans la plupart des cas, le chlorure de sodium est le chlorure de choix car c'est le chlorure le moins cher. Le bromure d'hydrogène et l'iodure d'hydrogène ne peuvent pas être préparés à l'aide d'acide sulfurique car cet acide est un agent oxydant capable d'oxyder à la fois le bromure et l'iodure. Cependant, il est possible de préparer à la fois du bromure d'hydrogène et de l'iodure d'hydrogène en utilisant un acide tel que l'acide phosphorique car il s'agit d'un agent oxydant plus faible. Par exemple :
\[\ce{H3PO4}(l)+\ce{Br-}(aq)⟶\ce{HBr}(g)+\ce{H2PO4-}(aq) \nonumber \]
Tous les halogénures d'hydrogène sont très solubles dans l'eau et forment des acides halogénés. À l'exception du fluorure d'hydrogène, qui possède une forte liaison hydrogène-fluorure, ce sont des acides forts. Les réactions des acides halogénés avec des métaux, des hydroxydes métalliques, des oxydes ou des carbonates produisent des sels des halogénures. La plupart des sels de chlorure sont solubles dans l'eau. L'AgCl, le PbCl 2 et le Hg 2 Cl 2 sont les exceptions les plus fréquemment rencontrées.
Les ions halogénures confèrent aux substances les propriétés associées à X − (aq). Les ions halogénures les plus lourds (Cl −, Br − et I −) peuvent agir comme des agents réducteurs, et les halogènes plus légers ou d'autres agents oxydants les oxyderont :
\ [\ ce {Cl2} (aq) + \ ce {2e-} ⟶ \ ce {2Cl-} (aq) \ hspace {1080p} E°= \ mathrm {1,36 \ :V} \
\ ce {Br2} (aq) + \ ce {2e-} ⟶ \ ce {2Br-} (aq) \ hspace {1080p} E°= \ mathrm {1,09 \ :V} \ \
\ ce {I2} (aq) + \ ce {2e-} ⟶ \ ce {2I-} (aq) \ hspace {1080p} E°= \ mathrm {0,54 \ :V} \ nonnumber \]
Par exemple, le brome oxyde l'iode :
\[\ce{Br2}(aq)+\ce{2HI}(aq)⟶\ce{2HBr}(aq)+\ce{I2}(aq) \hspace{20px} E°=\mathrm{0.55\:V} \nonumber \]
L'acide fluorhydrique est unique dans ses réactions avec le sable (dioxyde de silicium) et avec le verre, qui est un mélange de silicates :
\[\ce{SiO2}(s)+\ce{4HF}(aq)⟶\ce{SiF4}(g)+\ce{2H2O}(l) \nonumber \]
\[\ce{CaSiO3}(s)+\ce{6HF}(aq)⟶\ce{CaF2}(s)+\ce{SiF4}(g)+\ce{3H2O}(l) \nonumber \]
Le tétrafluorure de silicium volatil échappe à ces réactions. Comme le fluorure d'hydrogène attaque le verre, il peut geler ou graver le verre et est utilisé pour graver des marques sur les thermomètres, les burts et autres articles en verre.
Le fluorure d'hydrogène est principalement utilisé dans la production d'hydrochlorofluorocarbures pour les réfrigérants, les plastiques et les propulseurs. La deuxième utilisation la plus importante concerne la fabrication de la cryolite, Na 3 AlF 6, qui joue un rôle important dans la production d'aluminium. L'acide joue également un rôle important dans la production d'autres fluorures inorganiques (tels que le BF 3), qui servent de catalyseurs dans la synthèse industrielle de certains composés organiques.
L'acide chlorhydrique est relativement peu coûteux. C'est un acide important et polyvalent dans l'industrie et il est important pour la fabrication de chlorures métalliques, de colorants, de colle, de glucose et de divers autres produits chimiques. Une quantité considérable est également importante pour l'activation des puits de pétrole et sous forme de liqueur de cornichon, un acide utilisé pour éliminer la couche d'oxyde du fer ou de l'acier destiné à être galvanisé, étamé ou émaillé. Les quantités d'acide bromhydrique et d'acide iodhydrique utilisées dans le commerce sont insignifiantes en comparaison.
Résumé
L'hydrogène est l'élément le plus abondant de l'univers et sa chimie est vraiment unique. Bien que sa réactivité chimique soit similaire à celle des métaux alcalins, l'hydrogène possède bon nombre des propriétés chimiques d'un non-métal avec une électronégativité relativement faible. Il forme des hydrures ioniques avec des métaux actifs, des composés covalents dans lesquels il a un état d'oxydation de 1− avec moins d'éléments électronégatifs, et des composés covalents dans lesquels il a un état d'oxydation de 1+ avec un plus grand nombre de non-métaux électronégatifs. Il réagit de manière explosive avec l'oxygène, le fluor et le chlore, moins facilement avec le brome et beaucoup moins facilement avec l'iode, le soufre et l'azote. L'hydrogène réduit les oxydes de métaux ayant un potentiel de réduction inférieur à celui du chrome pour former le métal et l'eau. Les halogénures d'hydrogène sont tous acides lorsqu'ils sont dissous dans l'eau.
Lexique
- Procédé Haber
- principal procédé industriel utilisé pour produire de l'ammoniac à partir d'azote et d'hydrogène ; implique l'utilisation d'un catalyseur à base de fer et des températures et des pressions élevées
- halogénure d'hydrogène
- composé binaire formé entre l'hydrogène et les halogènes : HF, HCl, HBr et HI
- hydrogénation
- ajout d'hydrogène (H 2) pour réduire un composé


