16.E : Thermodynamique (exercices)
- Page ID
- 193879
16.1 : Exercices de spontanéité
Q16.1.1
Qu'est-ce qu'une réaction spontanée ?
ARTICLE 16.1.1
Une réaction a tendance naturelle à se produire et se produit sans apport continu d'énergie provenant d'une source externe.
Q16.1.2
Qu'est-ce qu'une réaction non spontanée ?
Q16.1.3
Indiquez si les processus suivants sont spontanés ou non spontanés.
- Eau liquide gelant à une température inférieure à son point de congélation
- Eau liquide gelant à une température supérieure à son point de congélation
- La combustion de l'essence
- Une balle lancée en l'air
- Une goutte de pluie qui tombe au sol
- Le fer rouille dans une atmosphère humide
ARTICLE 16.1.2
spontané ; non spontané ; spontané ; non spontané ; spontané ; spontané
Q16.1.4
Un ballon rempli d'hélium se dégonfle spontanément pendant la nuit lorsque les atomes de He se diffusent à travers la paroi du ballon. Décrivez la redistribution de la matière et/ou de l'énergie qui accompagne ce processus.
Q16.1.5
De nombreuses matières plastiques sont des polymères organiques contenant du carbone et de l'hydrogène. L'oxydation de ces plastiques dans l'air pour former du dioxyde de carbone et de l'eau est un processus spontané ; toutefois, les matières plastiques ont tendance à persister dans l'environnement. Expliquez.
ARTICLE 16.1.5
Bien que l'oxydation des plastiques soit spontanée, la vitesse d'oxydation est très lente. Les plastiques sont donc cinétiquement stables et ne se décomposent pas de manière appréciable, même sur des périodes relativement longues.
16.2 : Exercices d'entropie
Q16.2.1
Dans la figure ci-dessous, toutes les distributions et tous les microétats possibles sont présentés pour quatre particules différentes partagées entre deux boîtes. Déterminez le changement d'entropie, Δ S, si les particules sont initialement réparties uniformément entre les deux boîtes, mais qu'après la redistribution, elles finissent toutes dans la boîte (b).
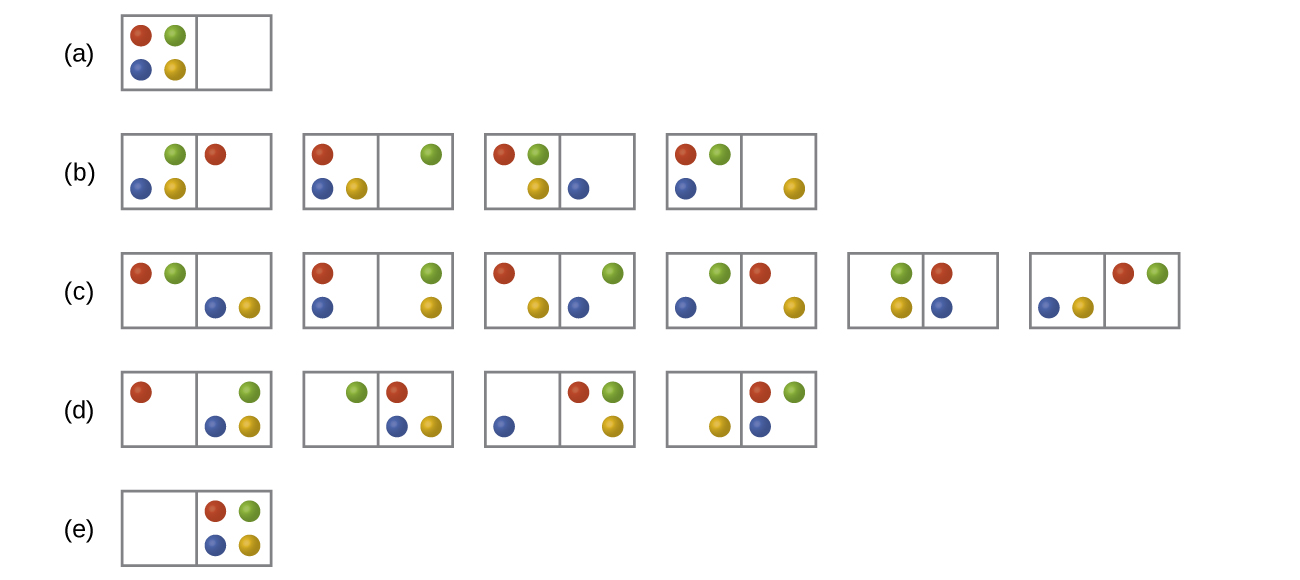
Q16.2.2
Dans la figure, toutes les distributions et tous les microétats possibles sont présentés pour quatre particules différentes partagées entre deux boîtes. Déterminez le changement d'entropie, Δ S, pour le système lorsqu'il passe de la distribution à la distribution (d).

ARTICLE 16.2.2
Il existe quatre microétats initiaux et quatre microétats finaux.
\[ΔS=k\ln\dfrac{W_\ce{f}}{W_\ce{i}}=\mathrm{1.38×10^{−23}\:J/K×\ln\dfrac{4}{4}=0}\]
Q16.2.3
Quel est le lien entre le processus décrit dans l'article précédent et le système présenté dans [lien] ?
Q16.2.4
Prenons un système similaire à celui ci-dessous, sauf qu'il contient six particules au lieu de quatre. Quelle est la probabilité que toutes les particules se trouvent dans une seule des deux cases du boîtier ? Comparez cela à la probabilité similaire pour le système de quatre particules que nous avons déterminé comme étant égal à\(\dfrac{1}{8}\). Que nous apprend cette comparaison sur des systèmes encore plus grands ?

ARTICLE 16.2.4
La probabilité que toutes les particules se trouvent d'un côté est de\(\dfrac{1}{32}\). Cette probabilité est nettement inférieure au\(\dfrac{1}{8}\) résultat obtenu pour le système à quatre particules. La conclusion que nous pouvons tirer est que la probabilité que toutes les particules restent dans une seule partie du système diminuera rapidement à mesure que le nombre de particules augmente et, par exemple, la probabilité que toutes les molécules de gaz se rassemblent d'un seul côté d'une pièce à la température et à la pression ambiantes est négligeable car le nombre de molécules de gaz dans la pièce est très important.
Q16.2.5
Considérez le système illustré à la figure. Quel est le changement d'entropie pour le processus où l'énergie est initialement associée uniquement à la particule A, mais où, à l'état final, l'énergie est distribuée entre deux particules différentes ?

Q16.2.6
Considérez le système illustré à la figure. Quel est le changement d'entropie pour le processus où l'énergie est initialement associée aux particules A et B, et où l'énergie est distribuée entre deux particules dans des boîtes différentes (l'une en A-B, l'autre en C-D) ?
ARTICLE 16.2.6
Il n'y a qu'un seul état initial. Pour l'état final, l'énergie peut être contenue dans les paires A-C, A-D, B-C ou B-D. Il existe donc quatre derniers états possibles.
\[ΔS=k\ln\left(\dfrac{W_\ce{f}}{W_\ce{i}}\right)=\mathrm{1.38×10^{−23}\:J/K×\ln\left(\dfrac{4}{1}\right)=1.91×10^{−23}\:J/K}\]
Q16.2.7
Organisez les ensembles de systèmes suivants par ordre d'augmentation de l'entropie. Supposons une mole de chaque substance et la même température pour chaque élément d'un ensemble.
- H (2 g), HBrO (4 g), HBr (g)
- H 2 O (l), H 2 O (g), H 2 O (s)
- He (g), Cl 2 (g), P 4 (g)
Q16.2.8
À température ambiante, l'entropie des halogènes augmente de I 2 à Br 2 en passant par Cl 2. Expliquez.
ARTICLE 16.2.8
La masse de ces molécules suggère une tendance inverse de leurs entropies. La tendance observée est le résultat de la variation plus significative de l'entropie en fonction de l'état physique. À température ambiante, I 2 est un solide, Br 2 est un liquide et Cl 2 est un gaz.
Q16.2.9
Envisagez deux processus : la sublimation de l'I 2 (s) et la fusion de l'I 2 (s) (Remarque : ce dernier processus peut avoir lieu à la même température mais à une pression légèrement plus élevée).
\[\ce{I2}(s)⟶\ce{I2}(g)\]
\[\ce{I2}(s)⟶\ce{I2}(l)\]
Le Δ S est-il positif ou négatif dans ces processus ? Dans lequel des processus l'ampleur du changement d'entropie sera-t-elle la plus grande ?
Q16.2.11
Indiquez quelle substance parmi les paires données possède la valeur d'entropie la plus élevée. Expliquez vos choix.
- C 2 H 5 OH (l) ou C 3 H 7 OH (l)
- C 2 H 5 OH (l) ou C 2 H 5 OH (g)
- 2 heures (H)
16.2.11
C 3 H 7 OH (l) car il s'agit d'une molécule plus grosse (plus complexe et plus massive), et donc un plus grand nombre de microétats décrivant ses mouvements sont disponibles à une température donnée. C 2 H 5 OH (g) tel qu'il est à l'état gazeux. 2H (g), puisque l'entropie est une propriété étendue, de sorte que deux atomes H (ou deux moles d'atomes H) possèdent deux fois plus d'entropie qu'un atome (ou une mole d'atomes).
Q16.2.11
Prédisez le signe du changement d'entropie pour les processus suivants :
- Un glaçon est réchauffé à une température proche de son point de fusion.
- L'haleine expirée forme du brouillard par une matinée froide.
- La neige fond.
Q16.2.12
Prédisez le signe du changement d'enthalpie pour les processus suivants. Donnez une raison à votre prédiction.
- \(\ce{Pb^2+}(aq)+\ce{S^2-}(aq)⟶\ce{PbS}(s)\)
- \(\ce{2Fe}(s)+\ce{3O2}(g)⟶\ce{Fe2O3}(s)\)
- \(\ce{2C6H14}(l)+\ce{19O2}(g)⟶\ce{14H2O}(g)+\ce{12CO2}(g)\)
16.2.12
Négatif. La précipitation relativement ordonnée des solides diminue le nombre d'ions mobiles en solution. Négatif. Il y a une perte nette de trois moles de gaz des réactifs vers les produits. Positif. Il y a une augmentation nette de sept moles de gaz provenant des réactifs vers les produits.
Q16.2.13
Écrivez l'équation chimique équilibrée pour la combustion du méthane, CH 4 (g), pour obtenir du dioxyde de carbone et de la vapeur d'eau. Expliquez pourquoi il est difficile de prédire si Δ S est positif ou négatif pour cette réaction chimique.
Q16.2.14
Écrivez l'équation chimique équilibrée pour la combustion du benzène, C 6 H 6 (l), pour obtenir du dioxyde de carbone et de la vapeur d'eau. Vous attendriez-vous à ce que Δ S soit positif ou négatif dans ce processus ?
16.2.14
\[\ce{C6H6}(l)+7.5\ce{O2}(g)⟶\ce{3H2O}(g)+\ce{6CO2}(g)\]
Il y a 7,5 moles de gaz au départ et 3 + 6 = 9 moles de gaz au final. Par conséquent, il est probable que l'entropie augmente à la suite de cette réaction, et Δ S est positif.
16.3 : La deuxième et la troisième loi
Q16.3.0
Quelle est la différence entre Δ S, Δ S° et\(ΔS^\circ_{298}\) pour un changement chimique ?
Q16.3.1
Calculez\(ΔS^\circ_{298}\) les modifications suivantes.
- \(\ce{SnCl4}(l)⟶\ce{SnCl4}(g)\)
- \(\ce{CS2}(g)⟶\ce{CS2}(l)\)
- \(\ce{Cu}(s)⟶\ce{Cu}(g)\)
- \(\ce{H2O}(l)⟶\ce{H2O}(g)\)
- \(\ce{2H2}(g)+\ce{O2}(g)⟶\ce{2H2O}(l)\)
- \(\ce{2HCl}(g)+\ce{Pb}(s)⟶\ce{PbCl2}(s)+\ce{H2}(g)\)
- \(\ce{Zn}(s)+\ce{CuSO4}(s)⟶\ce{Cu}(s)+\ce{ZnSO4}(s)\)
16.3.1
107 J/K ; −86,4 J/K ; 133,2 J/K ; 118,8 J/K ; −326,6 J/K ; −171,9 J/K ; (g) −7,2 J/K
Q16.3.2
Déterminer le changement d'entropie lors de la combustion de l'éthanol liquide, C 2 H 5 OH, dans des conditions d'état standard pour donner du dioxyde de carbone gazeux et de l'eau liquide.
Q16.3.3
Déterminer le changement d'entropie lors de la combustion du propane gazeux, C 3 H 8, dans des conditions d'état standard pour donner du dioxyde de carbone gazeux et de l'eau.
ARTICLE 16.3.3
10,6 KG/KG
Q16.3.4
Les réactions « thermites » ont été utilisées pour souder des pièces métalliques telles que des rails de chemin de fer et pour l'affinage des métaux. L'une de ces réactions de thermite est :
\[\ce{Fe2O3}(s)+\ce{2Al}(s)⟶\ce{Al2O3}(s)+\ce{2Fe}(s)\]
La réaction est-elle spontanée à température ambiante dans des conditions standard ? Pendant la réaction, l'environnement absorbe 851,8 kJ/mol de chaleur.
Q16.3.5
À l'aide des\(S^\circ_{298}\) valeurs pertinentes répertoriées à l'annexe G, calculez\(S^\circ_{298}\) les modifications suivantes :
- \(\ce{N2}(g)+\ce{3H2}(g)⟶\ce{2NH3}(g)\)
- \(\ce{N2}(g)+\dfrac{5}{2}\ce{O2}(g)⟶\ce{N2O5}(g)\)
ARTICLE 16.3.5
−19,1 J/K ; −348,9 J/K
Q16.3.6
À partir des informations suivantes,\(ΔS^\circ_{298}\) déterminez ce qui suit :
- \(\ce{N}(g)+\ce{O}(g)⟶\ce{NO}(g) \hspace{20px} ΔS^\circ_{298}=\,?\)
- \(\ce{N2}(g)+\ce{O2}(g)⟶\ce{2NO}(g) \hspace{20px} ΔS^\circ_{298}=\mathrm{24.8\: J/K}\)
- \(\ce{N2}(g)⟶\ce{2N}(g) \hspace{20px} ΔS^\circ_{298}=\mathrm{115.0\: J/K}\)
- \(\ce{O2}(g)⟶\ce{2O}(g) \hspace{20px} ΔS^\circ_{298}=\mathrm{117.0\: J/K}\)
Q16.3.7
En calculant Δ S univ à chaque température, déterminez si la fusion d'une mole de NaCl (s) est spontanée à 500 °C et à 700 °C.
\[S^\circ_{\ce{NaCl}(s)}=\mathrm{72.11\:\dfrac{J}{mol⋅K}}\hspace{40px} S^\circ_{\ce{NaCl}(l)}=\mathrm{95.06\:\dfrac{J}{mol⋅K}}\hspace{40px ΔH^\circ_\ce{fusion}=\mathrm{27.95\: kJ/mol}\]
Quelles sont les hypothèses émises concernant les informations thermodynamiques (valeurs d'entropie et d'enthalpie) utilisées pour résoudre ce problème ?
ARTICLE 16.3.7
Comme Δ S univ < 0 à chacune de ces températures, la fusion n'est spontanée à aucune de ces températures. Les valeurs données pour l'entropie et l'enthalpie concernent le NaCl à 298 K. On suppose qu'elles ne changent pas de manière significative aux températures plus élevées utilisées pour résoudre le problème.
Q16.3.8
Utilisez les données d'entropie standard de l'annexe G pour déterminer le changement d'entropie pour chacune des réactions répertoriées dans [lien]. Tous fonctionnent dans des conditions normales et à 25 °C.
Q16.3.8
2,86 J/K ; 24,8 J/K ; −113,2 J/K ; −24,7 J/K ; 15,5 J/K ; 290,0 J/K
16.4 : Énergie gratuite
Q16.4.1
Quelle est la différence entre Δ G, Δ G° et\(ΔG^\circ_{298}\) pour un changement chimique ?
Q16.4.2
Une réaction a\(ΔH^\circ_{298}\) = 100 kJ/mol et\(ΔS^\circ_{298}=\textrm{250 J/mol⋅K}\). La réaction est-elle spontanée à température ambiante ? Sinon, dans quelles conditions de température deviendra-t-il spontané ?
S16.4.2
La réaction n'est pas spontanée à température ambiante. Au-delà de 400 K, Δ G deviendra négatif et la réaction deviendra spontanée.
Q16.4.3
Expliquez ce qui se passe lorsqu'une réaction commence par Δ G < 0 (négatif) et atteint le point où Δ G = 0.
Utilisez les données standard sur l'énergie libre de formation présentées à l'annexe G pour déterminer le changement d'énergie libre pour chacune des réactions suivantes, qui sont effectuées dans des conditions d'état standard et à 25 °C. Identifiez chacune comme étant spontanée ou non spontanée dans ces conditions.
- \(\ce{MnO2}(s)⟶\ce{Mn}(s)+\ce{O2}(g)\)
- \(\ce{H2}(g)+\ce{Br2}(l)⟶\ce{2HBr}(g)\)
- \(\ce{Cu}(s)+\ce{S}(g)⟶\ce{CuS}(s)\)
- \(\ce{2LiOH}(s)+\ce{CO2}(g)⟶\ce{Li2CO3}(s)+\ce{H2O}(g)\)
- \(\ce{CH4}(g)+\ce{O2}(g)⟶\ce{C}(s,\,\ce{graphite})+\ce{2H2O}(g)\)
- \(\ce{CS2}(g)+\ce{3Cl2}(g)⟶\ce{CCl4}(g)+\ce{S2Cl2}(g)\)
ARTICLE 16.4.3
465,1 kJ non spontané ; −106,86 kJ spontané ; −53,6 kJ spontané ; −83,4 kJ spontané ; −406,7 kJ spontané ; −30,0 kJ spontané
Q16.4.4
Utilisez les données d'énergie libre standard de l'annexe G pour déterminer le changement d'énergie libre pour chacune des réactions suivantes, qui sont effectuées dans des conditions d'état standard et à 25 °C. Identifiez chacune comme spontanée ou non spontanée dans ces conditions.
- \(\ce{C}(s,\, \ce{graphite})+\ce{O2}(g)⟶\ce{CO2}(g)\)
- \(\ce{O2}(g)+\ce{N2}(g)⟶\ce{2NO}(g)\)
- \(\ce{2Cu}(s)+\ce{S}(g)⟶\ce{Cu2S}(s)\)
- \(\ce{CaO}(s)+\ce{H2O}(l)⟶\ce{Ca(OH)2}(s)\)
- \(\ce{Fe2O3}(s)+\ce{3CO}(g)⟶\ce{2Fe}(s)+\ce{3CO2}(g)\)
- \(\ce{CaSO4⋅2H2O}(s)⟶\ce{CaSO4}(s)+\ce{2H2O}(g)\)
Étant donné :
\[\ce{P4}(s)+\ce{5O2}(g)⟶\ce{P4O10}(s) \hspace{20px} ΔG^\circ_{298}=\mathrm{−2697.0\: kJ/mol}\]
\[\ce{2H2}(g)+\ce{O2}(g)⟶\ce{2H2O}(g) \hspace{20px} ΔG^\circ_{298}=\mathrm{−457.18\: kJ/mol}\]
\[\ce{6H2O}(g)+\ce{P4O10}(g)⟶\ce{4H3PO4}(l) \hspace{20px} ΔG^\circ_{298}=\mathrm{−428.66\: kJ/mol}\]
Q16.4.5
- Déterminez l'énergie libre standard de formation,\(ΔG^\circ_\ce{f}\), pour l'acide phosphorique.
- Comment votre résultat calculé se compare-t-il à la valeur de l'annexe G ? Expliquez.
ARTICLE 16.4.5
−1124,3 kJ/mol pour la variation d'énergie libre standard. Le calcul est conforme à la valeur de l'annexe G parce que l'énergie libre est une fonction d'état (tout comme l'enthalpie et l'entropie), de sorte que son changement dépend uniquement des états initial et final, et non du chemin qui les sépare.
Q16.4.6
La formation d'ozone (O 3 (g)) à partir de l'oxygène (O 2 (g)) est-elle spontanée à température ambiante dans des conditions normales ?
Q16.4.7
Envisagez la décomposition de l'oxyde de mercure rouge (II) dans des conditions d'état standard.
\[\ce{2HgO}(s,\,\ce{red})⟶\ce{2Hg}(l)+\ce{O2}(g)\]
- La décomposition est-elle spontanée dans des conditions normales ?
- Au-delà de quelle température la réaction devient-elle spontanée ?
ARTICLE 16.4.7
La réaction n'est pas spontanée ; au-dessus de 566 °C, le processus est spontané.
Q16.4.8
Entre autres choses, un carburant idéal pour les propulseurs de commande d'un véhicule spatial devrait se décomposer par une réaction exothermique spontanée lorsqu'il est exposé au catalyseur approprié. Évaluez les substances suivantes dans des conditions d'état standard en tant que substances candidates appropriées pour les carburants.
- Ammoniac :\(\ce{2NH3}(g)⟶\ce{N2}(g)+\ce{3H2}(g)\)
- Diborane :\(\ce{B2H6}(g)⟶\ce{2B}(g)+\ce{3H2}(g)\)
- Hydrazine :\(\ce{N2H4}(g)⟶\ce{N2}(g)+\ce{2H2}(g)\)
- Peroxyde d'hydrogène :\(\ce{H2O2}(l)⟶\ce{H2O}(g)+\dfrac{1}{2}\ce{O2}(g)\)
Q16.4.9
Calculer Δ G° pour chacune des réactions suivantes à partir de la constante d'équilibre à la température donnée.
- \(\ce{N2}(g)+\ce{O2}(g)⟶\ce{2NO}(g) \hspace{20px} \mathrm{T=2000\:°C} \hspace{20px} K_p=4.1×10^{−4}\)
- \(\ce{H2}(g)+\ce{I2}(g)⟶\ce{2HI}(g) \hspace{20px} \mathrm{T=400\:°C} \hspace{20px} K_p=50.0\)
- \(\ce{CO2}(g)+\ce{H2}(g)⟶\ce{CO}(g)+\ce{H2O}(g) \hspace{20px} \mathrm{T=980\:°C} \hspace{20px} K_p=1.67\)
- \(\ce{CaCO3}(s)⟶\ce{CaO}(s)+\ce{CO2}(g) \hspace{20px} \mathrm{T=900\:°C} \hspace{20px} K_p=1.04\)
- \(\ce{HF}(aq)+\ce{H2O}(l)⟶\ce{H3O+}(aq)+\ce{F-}(aq) \hspace{20px} \mathrm{T=25\:°C} \hspace{20px} K_p=7.2×10^{−4}\)
- \(\ce{AgBr}(s)⟶\ce{Ag+}(aq)+\ce{Br-}(aq) \hspace{20px} \mathrm{T=25\:°C} \hspace{20px} K_p=3.3×10^{−13}\)
16.4.9
1,5 × 10 2 kJ ; −21,9 kJ ; −5,34 kJ ; −0,383 kJ ; 18 kJ ; 71 kJ
Q16.4.10
Calculer Δ G° pour chacune des réactions suivantes à partir de la constante d'équilibre à la température donnée.
- \(\ce{Cl2}(g)+\ce{Br2}(g)⟶\ce{2BrCl}(g) \hspace{20px} \mathrm{T=25\:°C} \hspace{20px} K_p=4.7×10^{−2}\)
- \(\ce{2SO2}(g)+\ce{O2}(g)⇌\ce{2SO3}(g) \hspace{20px} \mathrm{T=500\:°C} \hspace{20px} K_p=48.2\)
- \(\ce{H2O}(l)⇌\ce{H2O}(g) \hspace{20px} \mathrm{T=60\:°C} \hspace{20px} K_p=\mathrm{0.196\: atm}\)
- \(\ce{CoO}(s)+\ce{CO}(g)⇌\ce{Co}(s)+\ce{CO2}(g) \hspace{20px} \mathrm{T=550\:°C} \hspace{20px} K_p=4.90×10^2\)
- \(\ce{CH3NH2}(aq)+\ce{H2O}(l)⟶\ce{CH3NH3+}(aq)+\ce{OH-}(aq) \hspace{20px} \mathrm{T=25\:°C} \hspace{20px} K_p=4.4×10^{−4}\)
- \(\ce{PbI2}(s)⟶\ce{Pb^2+}(aq)+\ce{2I-}(aq) \hspace{20px} \mathrm{T=25\:°C} \hspace{20px} K_p=8.7×10^{−9}\)
Q16.4.11
Calculer la constante d'équilibre à 25 °C pour chacune des réactions suivantes à partir de la valeur de Δ G° donnée.
- \(\ce{O2}(g)+\ce{2F2}(g)⟶\ce{2OF2}(g) \hspace{20px} ΔG°=\mathrm{−9.2\: kJ}\)
- \(\ce{I2}(s)+\ce{Br2}(l)⟶\ce{2IBr}(g) \hspace{20px} ΔG°=\mathrm{7.3\: kJ}\)
- \(\ce{2LiOH}(s)+\ce{CO2}(g)⟶\ce{Li2CO3}(s)+\ce{H2O}(g) \hspace{20px} ΔG°=\mathrm{−79\: kJ}\)
- \(\ce{N2O3}(g)⟶\ce{NO}(g)+\ce{NO2}(g) \hspace{20px} ΔG°=\mathrm{−1.6\: kJ}\)
- \(\ce{SnCl4}(l)⟶\ce{SnCl4}(l) \hspace{20px} ΔG°=\mathrm{8.0\: kJ}\)
16.4.11
K = 41 ; K = 0,053 ; K = 6,9 × 10 13 ; K = 1,9 ; K = 0,04
Q16.4.2
Calculer la constante d'équilibre à 25 °C pour chacune des réactions suivantes à partir de la valeur de Δ G° donnée.
- \(\ce{I2}(s)+\ce{Cl2}(g)⟶\ce{2ICl}(g) \hspace{20px} ΔG°=\mathrm{−10.88\: kJ}\)
- \(\ce{H2}(g)+\ce{I2}(s)⟶\ce{2HI}(g) \hspace{20px} ΔG°=\mathrm{3.4\: kJ}\)
- \(\ce{CS2}(g)+\ce{3Cl2}(g)⟶\ce{CCl4}(g)+\ce{S2Cl2}(g) \hspace{20px} ΔG°=\mathrm{−39\: kJ}\)
- \(\ce{2SO2}(g)+\ce{O2}(g)⟶\ce{2SO3}(g) \hspace{20px} ΔG°=\mathrm{−141.82\: kJ}\)
- \(\ce{CS2}(g)⟶\ce{CS2}(l) \hspace{20px} ΔG°=\mathrm{−1.88\: kJ}\)
Q16.4.13
Calculez la constante d'équilibre à la température indiquée.
- (a)\(\ce{O2}(g)+\ce{2F2}(g)⟶\ce{2F2O}(g) \hspace{20px} \mathrm{(T=100\:°C)}\)
- \(\ce{I2}(s)+\ce{Br2}(l)⟶\ce{2IBr}(g) \hspace{20px} \mathrm{(T=0.0\:°C)}\)
- \(\ce{2LiOH}(s)+\ce{CO2}(g)⟶\ce{Li2CO3}(s)+\ce{H2O}(g) \hspace{20px} \mathrm{(T=575\:°C)}\)
- \(\ce{N2O3}(g)⟶\ce{NO}(g)+\ce{NO2}(g) \hspace{20px} \mathrm{(T=−10.0\:°C)}\)
- \(\ce{SnCl4}(l)⟶\ce{SnCl4}(g) \hspace{20px} \mathrm{(T=200\:°C)}\)
16.4.13
Dans chacun des cas suivants, la valeur de Δ G n'est pas donnée à la température de la réaction. Par conséquent, nous devons calculer Δ G° à partir des valeurs Δ H° et Δ S°, puis calculer Δ G à partir de la relation ΔG° = ΔH° − TΔS°.
- K = 1,29
- K = 2,51 × 10 −3
- K = 4,83 × 10 3
- K = 0,219
- K = 16,1
Q16.4.14
Calculez la constante d'équilibre à la température indiquée.
- (a)\(\ce{I2}(s)+\ce{Cl2}(g)⟶\ce{2ICl}(g) \hspace{20px} \mathrm{(T=100\:°C)}\)
- \(\ce{H2}(g)+\ce{I2}(s)⟶\ce{2HI}(g) \hspace{20px} \mathrm{(T=0.0\:°C)}\)
- \(\ce{CS2}(g)+\ce{3Cl2}(g)⟶\ce{CCl4}(g)+\ce{S2Cl2}(g) \hspace{20px} \mathrm{(T=125\:°C)}\)
- \(\ce{2SO2}(g)+\ce{O2}(g)⟶\ce{2SO3}(g) \hspace{20px} \mathrm{(T=675\:°C)}\)
- \(\ce{CS2}(g)⟶\ce{CS2}(l) \hspace{20px} \mathrm{(T=90\:°C)}\)
Q16.4.15
Considérez la réaction suivante à 298 K :
\[\ce{N2O4}(g)⇌\ce{2NO2}(g) \hspace{20px} K_P=0.142\]
Quel est le changement d'énergie libre standard à cette température ? Décrivez ce qui arrive au système initial, dans lequel les réactifs et les produits sont dans des états standard, lorsqu'il approche de l'équilibre.
16.4.16
Le changement d'énergie gratuit standard est\(ΔG^\circ_{298}=−RT\ln K=\mathrm{4.84\: kJ/mol}\). Lorsque les réactifs et les produits sont dans leur état standard (1 bar ou 1 atm), Q = 1. Lorsque la réaction se dirige vers l'équilibre, elle se déplace vers la gauche (la quantité de produits diminue alors que la quantité de réactifs augmente) : Q < 1, et\(ΔG_{298}\) devient moins positive lorsqu'elle approche de zéro. À l'équilibre, Q = K et Δ G = 0.
Q16.4.17
Déterminer le point d'ébullition normal (en kelvins) du dichloroéthane, CH 2 Cl 2. Trouvez le point d'ébullition réel à l'aide d'Internet ou d'une autre source et calculez le pourcentage d'erreur de température. Expliquez les différences, le cas échéant, entre les deux valeurs.
Q16.4.18
Dans quelles conditions est\(\ce{N2O3}(g)⟶\ce{NO}(g)+\ce{NO2}(g)\) spontané ?
16.4.18
La réaction sera spontanée à des températures supérieures à 287 K.
Q16.4.19
À température ambiante, la constante d'équilibre (K w) pour l'auto-ionisation de l'eau est de 1,00 × 10 −14. À l'aide de ces informations, calculez la variation d'énergie libre standard pour la réaction aqueuse de l'ion hydrogène avec l'ion hydroxyde pour produire de l'eau. (Conseil : la réaction est l'inverse de la réaction d'auto-ionisation.)
Q16.4.20
Le sulfure d'hydrogène est un polluant présent dans le gaz naturel. Après son élimination, il est transformé en soufre par la réaction\(\ce{2H2S}(g)+\ce{SO2}(g)⇌\dfrac{3}{8}\ce{S8}(s,\,\ce{rhombic})+\ce{2H2O}(l)\). Quelle est la constante d'équilibre de cette réaction ? La réaction est-elle endothermique ou exothermique ?
16.4.20
K = 5,35 × 10 15
Le processus est exothermique.
Q16.4.21
Considérons la décomposition du CaCO 3 (s) en CaO (s) et en CO 2 (g). Quelle est la pression partielle d'équilibre du CO 2 à température ambiante ?
Q16.4.2
En laboratoire, le chlorure d'hydrogène (HCl (g)) et l'ammoniac (NH 3 (g)) s'échappent souvent des bouteilles de leurs solutions et réagissent pour former le chlorure d'ammonium (NH 4 Cl (s)), la glaçure blanche que l'on retrouve souvent sur la verrerie. En supposant que le nombre de moles de chaque gaz qui s'échappe dans la pièce est le même, quelle est la pression partielle maximale de HCl et de NH 3 dans le laboratoire à température ambiante ? (Conseil : les pressions partielles seront égales et atteindront leur valeur maximale à l'équilibre.)
16.4.2
1,0 × 10 −8 atm. Il s'agit de la pression maximale des gaz dans les conditions indiquées.
Q16.4.23
Le benzène peut être préparé à partir d'acétylène. \(\ce{3C2H2}(g)⇌\ce{C6H6}(g)\). Déterminez la constante d'équilibre à 25 °C et à 850 °C. La réaction est-elle spontanée à l'une ou l'autre de ces températures ? Pourquoi tout l'acétylène ne se trouve-t-il pas sous forme de benzène ?
Q16.4.24
Le dioxyde de carbone se décompose en CO et O 2 à des températures élevées. Quelle est la pression partielle d'équilibre de l'oxygène dans un échantillon à 1000 °C pour lequel la pression initiale de CO 2 était de 1,15 atm ?
\[x=\mathrm{1.29×10^{−5}\:atm}=P_{\ce{O2}}\]
Q16.4.25
Le tétrachlorure de carbone, solvant industriel important, est préparé par chloration du méthane à 850 K.
\[\ce{CH4}(g)+\ce{4Cl2}(g)⟶\ce{CCl4}(g)+\ce{4HCl}(g)\]
Quelle est la constante d'équilibre de la réaction à 850 K ? La cuve de réaction devrait-elle être chauffée ou refroidie pour maintenir la température de la réaction constante ?
Q16.4.25B
L'acide acétique, CH 3 CO 2 H, peut former un dimère, (CH 3 CO 2 H) 2, en phase gazeuse.
\[\ce{2CH3CO2H}(g)⟶\ce{(CH3CO2H)2}(g)\]
Le dimère est maintenu ensemble par deux liaisons hydrogène d'une résistance totale de 66,5 kJ par mole de dimère.
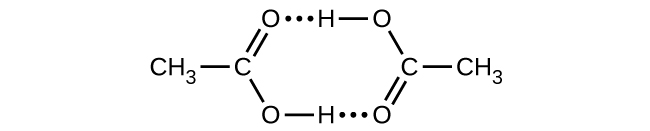
À 25 °C, la constante d'équilibre pour la dimérisation est de 1,3 × 10 3 (pression en atm). Qu'est-ce que Δ S° pour la réaction ?
S16.4.25B
−0,16 kJ
Q16.4.26
L'acide nitrique, HNO 3, peut être préparé par la séquence de réactions suivante :
\[\ce{4NH3}(g)+\ce{5O2}(g)⟶\ce{4NO}(g)+\ce{6H2O}(g)\]
\[\ce{2NO}(g)+\ce{O2}(g)⟶\ce{2NO2}(g)\]
\[\ce{3NO2}(g)+\ce{H2O}(l)⟶\ce{2HNO3}(l)+\ce{NO}(g)\]
How much heat is evolved when 1 mol of NH3(g) is converted to HNO3(l)? Assume standard states at 25 °C.
Q16.4.27A
Determine ΔG for the following reactions.
(a) Antimony pentachloride decomposes at 448 °C. The reaction is:
\[\ce{SbCl5}(g)⟶\ce{SbCl3}(g)+\ce{Cl2}(g)\]
An equilibrium mixture in a 5.00 L flask at 448 °C contains 3.85 g of SbCl5, 9.14 g of SbCl3, and 2.84 g of Cl2.
Chlorine molecules dissociate according to this reaction:
\[\ce{Cl2}(g)⟶\ce{2Cl}(g)\]
1.00% of Cl2 molecules dissociate at 975 K and a pressure of 1.00 atm.
S16.4.27A
- (a) −22.1 kJ;
- 61.6 kJ/mol
Q16.4.27
Given that the \(ΔG^\circ_\ce{f}\) for Pb2+(aq) and Cl−(aq) is −24.3 kJ/mole and −131.2 kJ/mole respectively, determine the solubility product, Ksp, for PbCl2(s).
Q16.4.28
Determine the standard free energy change, \(ΔG^\circ_\ce{f}\), for the formation of S2−(aq) given that the \(ΔG^\circ_\ce{f}\) for Ag+(aq) and Ag2S(s) are 77.1 k/mole and −39.5 kJ/mole respectively, and the solubility product for Ag2S(s) is 8 × 10−51.
S16.4.28
90 kJ/mol
Q16.4.29
Determine the standard enthalpy change, entropy change, and free energy change for the conversion of diamond to graphite. Discuss the spontaneity of the conversion with respect to the enthalpy and entropy changes. Explain why diamond spontaneously changing into graphite is not observed.
Q16.4.30
The evaporation of one mole of water at 298 K has a standard free energy change of 8.58 kJ.
\[\ce{H2O}(l)⇌\ce{H2O}(g) \hspace{20px} ΔG^\circ_{298}=\mathrm{8.58\: kJ}\]
- (a) Is the evaporation of water under standard thermodynamic conditions spontaneous?
- Determine the equilibrium constant, KP, for this physical process.
- By calculating ∆G, determine if the evaporation of water at 298 K is spontaneous when the partial pressure of water, \(P_{\ce{H2O}}\), is 0.011 atm.
- If the evaporation of water were always nonspontaneous at room temperature, wet laundry would never dry when placed outside. In order for laundry to dry, what must be the value of \(P_{\ce{H2O}}\) in the air?
S16.4.30
(a) Under standard thermodynamic conditions, the evaporation is nonspontaneous; Kp = 0.031; The evaporation of water is spontaneous; \(P_{\ce{H2O}}\) must always be less than Kp or less than 0.031 atm. 0.031 atm represents air saturated with water vapor at 25 °C, or 100% humidity.
Q16.4.31
In glycolysis, the reaction of glucose (Glu) to form glucose-6-phosphate (G6P) requires ATP to be present as described by the following equation:
\[\mathrm{Glu + ATP ⟶ G6P + ADP} \hspace{20px} ΔG^\circ_{298}=\mathrm{−17\: kJ}\]
In this process, ATP becomes ADP summarized by the following equation:
\[\mathrm{ATP⟶ADP} \hspace{20px} ΔG^\circ_{298}=\mathrm{−30\: kJ}\]
Determine the standard free energy change for the following reaction, and explain why ATP is necessary to drive this process:
\[\mathrm{Glu⟶G6P} \hspace{20px} ΔG^\circ_{298}=\:?\]
Q16.4.32
One of the important reactions in the biochemical pathway glycolysis is the reaction of glucose-6-phosphate (G6P) to form fructose-6-phosphate (F6P):
\[\mathrm{G6P⇌F6P} \hspace{20px} ΔG^\circ_{298}=\mathrm{1.7\: kJ}\]
- (a) Is the reaction spontaneous or nonspontaneous under standard thermodynamic conditions?
- Standard thermodynamic conditions imply the concentrations of G6P and F6P to be 1 M, however, in a typical cell, they are not even close to these values. Calculate ΔG when the concentrations of G6P and F6P are 120 μM and 28 μM respectively, and discuss the spontaneity of the forward reaction under these conditions. Assume the temperature is 37 °C.
S16.4.32
(a) Nonspontaneous as \(ΔG^\circ_{298}>0\); \(ΔG^\circ_{298}=−RT\ln K,\) \(ΔG = 1.7×10^3 + \left(8.314 × 335 × \ln\dfrac{28}{128}\right) = \mathrm{−2.5\: kJ}\). The forward reaction to produce F6P is spontaneous under these conditions.
Q16.4.33
Without doing a numerical calculation, determine which of the following will reduce the free energy change for the reaction, that is, make it less positive or more negative, when the temperature is increased. Explain.
- (a) \(\ce{N2}(g)+\ce{3H2}(g)⟶\ce{2NH3}(g)\)
- \(\ce{HCl}(g)+\ce{NH3}(g)⟶\ce{NH4Cl}(s)\)
- \(\ce{(NH4)2Cr2O7}(s)⟶\ce{Cr2O3}(s)+\ce{4H2O}(g)+\ce{N2}(g)\)
- \(\ce{2Fe}(s)+\ce{3O2}(g)⟶\ce{Fe2O3}(s)\)
When ammonium chloride is added to water and stirred, it dissolves spontaneously and the resulting solution feels cold. Without doing any calculations, deduce the signs of ΔG, ΔH, and ΔS for this process, and justify your choices.
S16.4.33
ΔG is negative as the process is spontaneous. ΔH is positive as with the solution becoming cold, the dissolving must be endothermic. ΔS must be positive as this drives the process, and it is expected for the dissolution of any soluble ionic compound.
Q16.4.34
An important source of copper is from the copper ore, chalcocite, a form of copper(I) sulfide. When heated, the Cu2S decomposes to form copper and sulfur described by the following equation:
\[\ce{Cu2S}(s)⟶\ce{Cu}(s)+\ce{S}(s)\]
- (a) Determine \(ΔG^\circ_{298}\) for the decomposition of Cu2S(s).
- The reaction of sulfur with oxygen yields sulfur dioxide as the only product. Write an equation that describes this reaction, and determine \(ΔG^\circ_{298}\) for the process.
- The production of copper from chalcocite is performed by roasting the Cu2S in air to produce the Cu. By combining the equations from Parts (a) and (b), write the equation that describes the roasting of the chalcocite, and explain why coupling these reactions together makes for a more efficient process for the production of the copper.
Q16.4.35
What happens to \(ΔG^\circ_{298}\) (becomes more negative or more positive) for the following chemical reactions when the partial pressure of oxygen is increased?
- (a) \(\ce{S}(s)+\ce{O2}(g)⟶\ce{SO2}(g)\)
- \(\ce{2SO2}(g)+\ce{O2}(g)⟶\ce{SO3}(g)\)
- \(\ce{HgO}(s)⟶\ce{Hg}(l)+\ce{O2}(g)\)
S16.4.35
- (a) Increasing \(P_{\ce{O2}}\) will shift the equilibrium toward the products, which increases the value of K. \(ΔG^\circ_{298}\) therefore becomes more negative.
- Increasing \(P_{\ce{O2}}\) will shift the equilibrium toward the products, which increases the value of K. \(ΔG^\circ_{298}\) therefore becomes more negative.
- Increasing \(P_{\ce{O2}}\) will shift the equilibrium the reactants, which decreases the value of K. \(ΔG^\circ_{298}\) therefore becomes more positive.


