16.1 : Spontanéité
- Page ID
- 193884
⋅
- Distinguer les processus spontanés et non spontanés
- Décrire la dispersion de la matière et de l'énergie qui accompagne certains processus spontanés
Dans cette section, examinez les différences entre deux types de changements dans un système : ceux qui se produisent spontanément et ceux qui se produisent uniquement avec un apport continu d'énergie. Ce faisant, nous comprendrons pourquoi certains systèmes sont naturellement enclins à changer dans une direction dans certaines conditions. Nous verrons également comment la spontanéité d'un processus affecte la distribution de l'énergie et de la matière au sein du système.
Processus spontanés et non spontanés
Les processus ont naturellement tendance à se produire dans une direction dans un ensemble de conditions donné. L'eau s'écoule naturellement vers le bas, mais le débit ascendant nécessite une intervention extérieure, telle que l'utilisation d'une pompe. Un processus spontané est un processus qui se produit naturellement dans certaines conditions. Un processus non spontané, en revanche, n'aura pas lieu à moins qu'il ne soit « entraîné » par l'apport continu d'énergie provenant d'une source externe. Un processus qui est spontané dans un sens dans un ensemble particulier de conditions est non spontané dans le sens inverse. À température ambiante et à pression atmosphérique normale, par exemple, la glace fond spontanément, mais l'eau ne gèle pas spontanément.
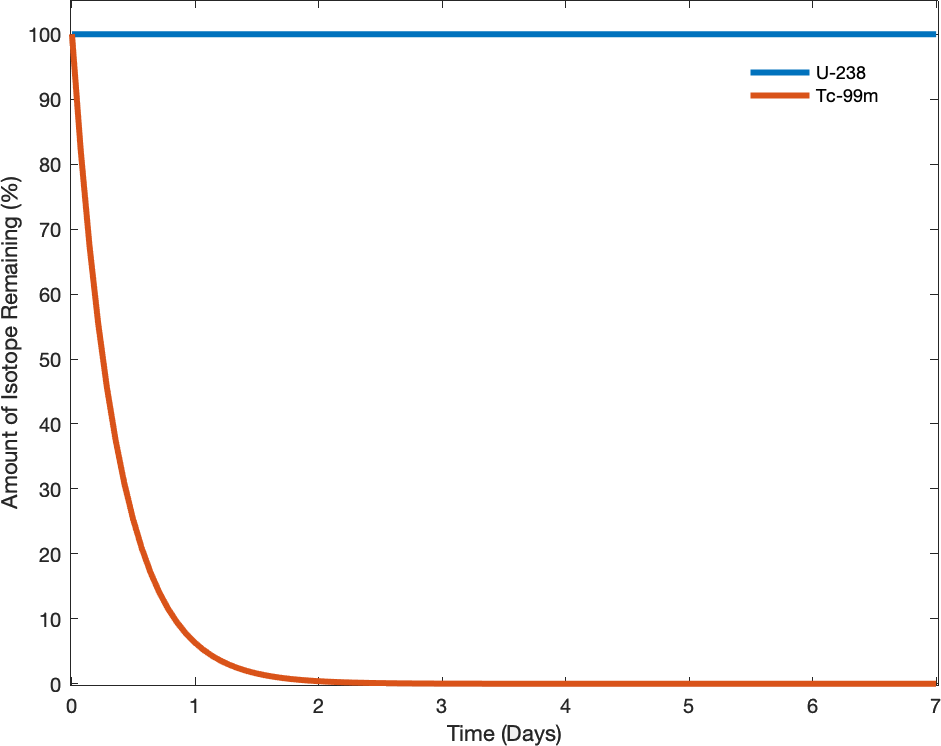
La spontanéité d'un processus n'est pas corrélée à sa rapidité. Un changement spontané peut être si rapide qu'il est essentiellement instantané ou si lent qu'il ne peut être observé sur aucune période pratique. Pour illustrer ce concept, considérez la désintégration des isotopes radioactifs, un sujet traité de manière plus approfondie dans le chapitre sur la chimie nucléaire. La désintégration radioactive est par définition un processus spontané dans lequel les noyaux d'isotopes instables émettent des radiations lorsqu'ils sont convertis en noyaux plus stables. Tous les processus de désintégration se produisent spontanément, mais les vitesses de désintégration des différents isotopes varient considérablement. Le technétium-99m est un radio-isotope populaire pour les études d'imagerie médicale qui se dégrade relativement rapidement et présente une demi-vie d'environ six heures. L'uranium 238 est l'isotope le plus abondant de l'uranium, et sa désintégration se produit beaucoup plus lentement, avec une demi-vie de plus de quatre milliards d'années (Figure\(\PageIndex{1}\)).
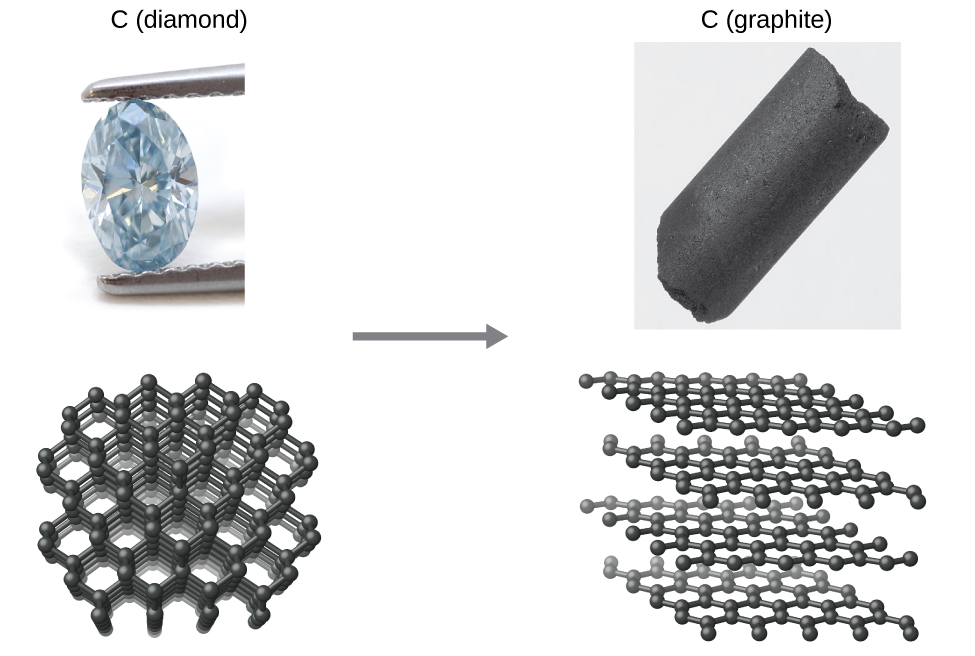
Comme autre exemple, considérez la conversion du diamant en graphite (Figure\(\PageIndex{2}\)).
\[\ce{C(s, diamond)}⟶\ce{C(s, graphite)} \label{Eq1} \]
Le diagramme de phase du carbone indique que le graphite est la forme stable de cet élément sous la pression atmosphérique ambiante, tandis que le diamant est l'allotrope stable à des pressions très élevées, telles que celles présentes lors de sa formation géologique. Les calculs thermodynamiques du type décrit dans la dernière section de ce chapitre indiquent que la conversion du diamant en graphite à la pression ambiante se produit spontanément, mais que des diamants existent et persistent dans ces conditions. Bien que le processus soit spontané dans des conditions ambiantes typiques, sa vitesse est extrêmement lente, de sorte que, à toutes fins pratiques, les diamants sont effectivement « éternels ». De telles situations mettent l'accent sur la distinction importante entre les aspects thermodynamiques et cinétiques d'un processus. Dans ce cas particulier, les diamants sont considérés comme thermodynamiquement instables mais cinétiquement stables dans des conditions ambiantes.
Dispersion de la matière et de l'énergie
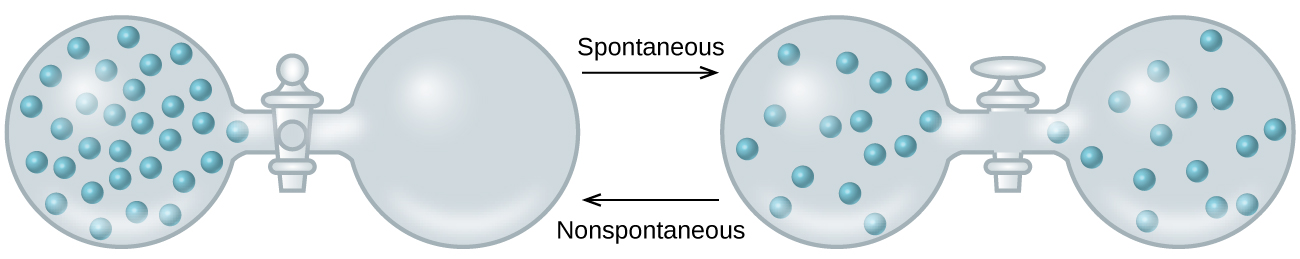
Alors que nous étendons notre discussion sur les concepts thermodynamiques dans le but de prédire la spontanéité, considérons maintenant un système isolé composé de deux flacons reliés par une vanne fermée. Au départ, il y a un gaz idéal sur la gauche et un vide sur la droite (Figure\(\PageIndex{3}\)). Lorsque la vanne est ouverte, le gaz se dilate spontanément pour remplir les deux flacons. En rappelant la définition du travail pression/volume du chapitre sur la thermochimie, il convient de noter qu'aucun travail n'a été effectué car la pression dans le vide est nulle.
\[ \begin{align} w&=−PΔV \\[4pt]&=0 \,\,\, \mathrm{(P=0\: in\: a\: vaccum)} \label{Eq2} \end{align} \]
Notez également que le système étant isolé, aucun échange de chaleur n'a été effectué avec l'environnement (q = 0). La première loi de la thermodynamique confirme qu'il n'y a pas eu de changement de l'énergie interne du système à la suite de ce processus.
\[ \begin{align} ΔU&=q+w \tag{First Law of Thermodynamics} \\[4pt] &=0+0=0 \label{Eq3}\end{align} \]
La spontanéité de ce processus n'est donc pas la conséquence d'un changement d'énergie qui accompagne le processus. Le mouvement du gaz semble plutôt être lié à la dispersion plus importante et plus uniforme de la matière qui se produit lorsque l'on laisse le gaz se dilater. À l'origine, le système était composé d'un flacon contenant de la matière et d'un autre flacon ne contenant rien. Après le processus spontané, la matière a été distribuée à la fois plus largement (occupant le double de son volume initial) et plus uniformément (présente en quantités égales dans chaque flacon).
Considérons maintenant deux objets à des températures différentes : l'objet X à la température T X et l'objet Y à la température T Y, avec T X > T Y (Figure\(\PageIndex{4}\)). Lorsque ces objets entrent en contact, la chaleur s'écoule spontanément de l'objet le plus chaud (X) vers l'objet le plus froid (Y). Cela correspond à une perte d'énergie thermique par X et à un gain d'énergie thermique par Y.
\[q_\ce{X}<0 \hspace{20px} \ce{and} \hspace{20px} q_\ce{Y}=−q_\ce{X}>0 \label{Eq4} \]
Du point de vue de ce système à deux objets, il n'y a pas eu de gain ou de perte net d'énergie thermique, mais l'énergie thermique disponible a été redistribuée entre les deux objets. Ce processus spontané a entraîné une dispersion plus uniforme de l'énergie.

Comme l'illustrent les deux processus décrits, un facteur important pour déterminer la spontanéité d'un processus est la mesure dans laquelle il modifie la dispersion ou la distribution de la matière et/ou de l'énergie. Dans chaque cas, un processus spontané s'est produit qui a entraîné une distribution plus uniforme de la matière ou de l'énergie.
Décrivez comment la matière et l'énergie sont redistribuées lorsque les processus spontanés suivants se produisent :
- Un solide sublime.
- Un gaz se condense.
- Une goutte de colorant alimentaire ajoutée à un verre d'eau forme une solution de couleur uniforme.
Solution

- La sublimation est la conversion d'un solide (densité relativement élevée) en gaz (densité bien moindre). Ce processus permet une dispersion beaucoup plus importante de la matière, puisque les molécules occuperont un volume beaucoup plus important après la transition solide-gaz. Cependant, un apport d'énergie provenant de l'environnement est nécessaire pour que les molécules quittent la phase solide et entrent dans la phase gazeuse.
- La condensation est la conversion d'un gaz (densité relativement faible) en liquide (densité beaucoup plus élevée). Ce processus permet une bien moindre dispersion de la matière, puisque les molécules occuperont un volume beaucoup plus faible après la transition gaz-liquide. Lorsque les molécules de gaz se déplacent ensemble pour former les gouttelettes de liquide, elles forment des forces intermoléculaires et libèrent ainsi de l'énergie dans l'environnement.
- Le procédé en question est la dilution. Les molécules de colorant alimentaire occupent initialement un volume beaucoup plus petit (la goutte de solution colorante) qu'elles n'en occupent une fois le processus terminé (dans un grand verre d'eau). Le procédé implique donc une plus grande dispersion de la matière. Le procédé peut également permettre une dispersion plus uniforme de la matière, étant donné que l'état initial du système implique deux régions de concentrations de colorant différentes (haute dans la goutte, zéro dans l'eau), et que l'état final du système contient une seule concentration de colorant dans l'ensemble. Ce processus peut se produire sans changement d'énergie car les molécules ont une énergie cinétique relative à la température de l'eau et seront donc constamment en mouvement.
Décrivez comment la matière et l'énergie sont redistribuées lorsque vous videz un bidon d'air comprimé dans une pièce.
- Réponse
-
Ce processus implique une dispersion plus importante et plus uniforme de la matière, car l'air comprimé contenu dans la cartouche peut se dilater dans l'air à basse pression de la pièce. Le processus nécessite également un apport d'énergie pour perturber les forces intermoléculaires entre les molécules de gaz étroitement espacées qui sont initialement comprimées dans le récipient. Si vous touchiez la buse de la cartouche, vous remarquerez qu'il fait froid parce que les molécules sortantes retirent de l'énergie de leur environnement et que la cartouche fait partie de l'environnement.
Résumé
Les processus chimiques et physiques ont naturellement tendance à se produire dans une seule direction dans certaines conditions. Un processus spontané se produit sans avoir besoin d'un apport continu d'énergie provenant d'une source externe, alors qu'un processus non spontané l'exige. Les systèmes soumis à un processus spontané peuvent ou non subir un gain ou une perte d'énergie, mais ils connaîtront un changement dans la façon dont la matière et/ou l'énergie sont distribuées au sein du système. Dans cette section, nous n'avons abordé que la désintégration nucléaire, les modifications physiques des substances pures et les événements macroscopiques tels que l'écoulement de l'eau en descente. Dans les sections suivantes, nous aborderons les mélanges et les réactions chimiques, des situations dans lesquelles la description de la sponténie devient plus difficile.
Lexique
- processus non spontané
- processus qui nécessite un apport continu d'énergie provenant d'une source externe
- changement spontané
- processus qui se déroule sans apport continu d'énergie provenant d'une source externe


