14.E : Équilibres acido-basiques (exercices)
- Page ID
- 194089
14.1 : Acides et bases de Brønsted-Lowry
Q14.1.1
Écrivez des équations qui montrent que le NH 3 est à la fois un acide conjugué et une base conjuguée.
ARTICLE 14.1.1
Un exemple de NH 3 en tant qu'acide conjugué :\(\ce{NH2- + H+ ⟶ NH3}\) ; en tant que base conjuguée :\(\ce{NH4+}(aq)+\ce{OH-}(aq)⟶\ce{NH3}(aq)+\ce{H2O}(l)\)
Q14.1.2
Écrivez des équations qui montrent qu'il\(\ce{H2PO4-}\) agit à la fois comme un acide et comme une base.
Q14.1.3
Démontrer par des équations ioniques nettes appropriées que chacune des espèces suivantes peut agir comme un acide de Brønsted-Lowry :
- \(\ce{H3O+}\)
- HCl
- NH 3
- CH 3 CO 2 H
- \(\ce{NH4+}\)
- \(\ce{HSO4-}\)
ARTICLE 14.1.3
- \(\ce{H3O+}(aq)⟶\ce{H+}(aq)+ \ce{H_2O}_{(l)}\);
- \(\ce{HCl}(l)⟶\ce{H+}(aq)+\ce{Cl-}(aq)\);
- \(\ce{NH3}(aq)⟶\ce{H+}(aq)+\ce{NH2-}(aq)\);
- \(\ce{CH3CO2H}(aq)⟶\ce{H+}(aq)+\ce{CH3CO2-}(aq)\);
- \(\ce{NH4+}(aq)⟶\ce{H+}(aq)+\ce{NH3}(aq)\);
- \(\ce{HSO4-}(aq)⟶\ce{H+}(aq)+\ce{SO4^2-}(aq)\)
Q14.1.4
Démontrer par des équations ioniques nettes appropriées que chacune des espèces suivantes peut agir comme un acide de Brønsted-Lowry :
- N° 3
- \(\ce{PH4+}\)
- H 2 S
- CH 3 CH 2 CUISINES
- \(\ce{H2PO4-}\)
- HS −
Q14.1.5
Démontrer par des équations ioniques nettes appropriées que chacune des espèces suivantes peut agir comme base de Brønsted-Lowry :
- H 2 O
- \(\ce{OH-}\)
- NH 3
- CN −
- S 2−
- \(\ce{H2PO4-}\)
ARTICLE 14.1.5
- \(\ce{H_2O}_{(l)} + \ce{H^+} (aq)⟶\ce{H3O+}(aq)\)
- \(\ce{OH-} (aq) + \ce{H^+} (aq)⟶ \ce{H_2O}_{(l)}\)
- \(\ce{NH3}(aq) + \ce{H^+} (aq)⟶\ce{NH4+}(aq)\);
- \(\ce{CN-}(aq) + \ce{H^+} (aq)⟶\ce{HCN}(aq)\)
- \(\ce{S^2-}(aq) + \ce{H^+} (aq)⟶\ce{HS-}(aq)\)
- \(\ce{H2PO4-}(aq) + \ce{H^+} (aq)⟶\ce{H3PO4}(aq)\)
Q14.1.6
Démontrer par des équations ioniques nettes appropriées que chacune des espèces suivantes peut agir comme base de Brønsted-Lowry :
- HS −
- \(\ce{PO4^3-}\)
- \(\ce{NH2-}\)
- C 2 H 5 OHM
- O 2−
- \(\ce{H2PO4-}\)
Q14.1.7
Quel est l'acide conjugué de chacun des composés suivants ? Quelle est la base conjuguée de chacune d'elles ?
- \(\ce{OH-}\)
- H 2 O
- \(\ce{HCO3-}\)
- NH 3
- \(\ce{HSO4-}\)
- H 2 OU 2
- HS −
- \(\ce{H5N2+}\)
ARTICLE 14.1.7
H 2 O, O 2− ; H 3 O +,\(\ce{OH^-}\) ; H 2 CO 3,\(\ce{CO3^2-}\) ;\(\ce{NH4+}\),\(\ce{NH2-}\) ; H 2 SO 4,\(\ce{SO4^2-}\) ;\(\ce{H3O2+}\),\(\ce{HO2-}\) ; H 2 S ; S 2− ;\(\ce{H6N2^2+}\) H 4 N 2
Q14.1.8
Quel est l'acide conjugué de chacun des composés suivants ? Quelle est la base conjuguée de chacune d'elles ?
- H 2 S
- \(\ce{H2PO4-}\)
- PH 3
- HS −
- \(\ce{HSO3-}\)
- \(\ce{H3O2+}\)
- H 4 N 2
- CH 3 OHL
Q14.1.9
Identifier et étiqueter l'acide de Brønsted-Lowry, sa base conjuguée, la base de Brønsted-Lowry et son acide conjugué dans chacune des équations suivantes :
- \(\ce{HNO3 + H2O ⟶ H3O+ + NO3-}\)
- \(\ce{CN- + H2O ⟶ HCN + OH-}\)
- \(\ce{H2SO4 + Cl- ⟶ HCl + HSO4-}\)
- \(\ce{HSO4- + OH- ⟶ SO4^2- + H2O}\)
- \(\ce{O^2- + H2O ⟶ 2OH-}\)
- \(\ce{[Cu(H2O)3(OH)]+ + [Al(H2O)6]^3+ ⟶ [Cu(H2O)4]^2+ + [Al(H2O)5(OH)]^2+}\)
- \(\ce{H2S + NH2- ⟶ HS- + NH3}\)
ARTICLE 14.1.9
Les étiquettes sont l'acide de Brønsted-Lowry = BA ; sa base conjuguée = CB ; la base de Brønsted-Lowry = BB ; son acide conjugué = CA. HNO 3 (BA), H 2 O (BB), H 3 O + (CA),\(\ce{NO3- (CB)}\) CN − (BB), H 2 O (BA), HCN (CA),\(\ce{OH^-}\) (CB) ; H 2 SO 4 (BA), Cl − (BB), HCl (CA)\(\ce{HSO4- (BA)}\),\(\ce{HSO4- (CB)}\) OH - (BB)\(\ce{SO4^2- (CB)}\), H 2 O (CA) ; O 2− (BB), H2O (BA)\(\ce{OH^-}\) (CB et CA) ; [Cu (H 2 O) 3 (OH)] + (BB), [Al (H 2 O) 6] 3+ (BA), [Cu (H 2 O) 4] 2+ (CA), [Al (H 2 O) 5 ( OH)] 2+ (CB) ; H 2 S (BA)\(\ce{NH2- (BB)}\), HS − (CB), NH 3 (CA)
Q14.1.10
Identifier et étiqueter l'acide de Brønsted-Lowry, sa base conjuguée, la base de Brønsted-Lowry et son acide conjugué dans chacune des équations suivantes :
- \(\ce{NO2- + H2O ⟶ HNO2 + OH-}\)
- \(\ce{HBr + H2O ⟶ H3O+ + Br-}\)
- \(\ce{HS- + H2O ⟶ H2S + OH-}\)
- \(\ce{H2PO4- + OH- ⟶HPO4^2- + H2O}\)
- \(\ce{H2PO4- + HCl ⟶ H3PO4 + Cl-}\)
- \(\ce{[Fe(H2O)5(OH)]^2+ + [Al(H2O)6]^3+ ⟶ [Fe(H2O)6]^3+ + [Al(H2O)5(OH)]^2+}\)
- \(\ce{CH3OH + H- ⟶ CH3O- + H2}\)
Q14.1.11
Que sont les espèces amphiprotiques ? Illustrez avec des équations
S14.1.11
Les espèces amphiprotiques peuvent gagner ou perdre un proton lors d'une réaction chimique, agissant ainsi comme une base ou un acide. Un exemple est H 2 O.
- En tant qu'acide :\(\ce{H2O}(aq) + \ce{NH3}(aq) \rightleftharpoons \ce{NH4+}(aq) + \ce{OH-}(aq)\).
- Comme base :\(\ce{H2O}(aq) + \ce{HCl}(aq) \rightleftharpoons \ce{H3O+}(aq) + \ce{Cl-}(aq)\)
Q14.1.12
Indiquez laquelle des espèces suivantes est amphiprotique et rédigez des équations chimiques illustrant le caractère amphiprotique de ces espèces :
- H 2 O
- \(\ce{H2PO4-}\)
- S 2−
- \(\ce{CO3^2-}\)
- \(\ce{HSO4-}\)
Q14.1.13
Indiquez laquelle des espèces suivantes est amphiprotique et rédigez des équations chimiques illustrant le caractère amphiprotique de ces espèces.
- NH 3
- \(\ce{HPO4-}\)
- Bar −
- \(\ce{NH4+}\)
- \(\ce{ASO4^3-}\)
ARTICLE 14.113
amphiprotique :\(\ce{NH3 + H3O+ ⟶ NH4OH + H2O}\),\(\ce{NH3 + OCH3- ⟶ NH2- + CH3OH}\) ;\(\ce{HPO4^2- + OH- ⟶ PO4^3- + H2O}\),\(\ce{HPO4^2- + HClO4 ⟶ H2PO4- + ClO4-}\) ; non amphiprotique : Br − ;\(\ce{NH4+}\) ;\(\ce{AsO4^3-}\)
Q14.1.14
L'auto-ionisation de l'eau est-elle endothermique ou exothermique ? La constante d'ionisation de l'eau (K w) est\(2.9 \times 10^{-14}\) à 40 °C et\(9.6 \times 10^{-14}\) à 60 °C.
14.2 : pH et PoH
Q14.2.1
Expliquez pourquoi un échantillon d'eau pure à 40 °C est neutre même si [H 3 O +] = 1,7 × 10 −7 M. K w est de 2,9 × 10 −14 à 40 °C.
ARTICLE 14.2.1
Dans une solution neutre [H 3 O +] = [OH −]. À 40 °C,
[H 3 O +] = [OH −] = (2,910 −14) 1/2 = 1,7 × 10 −7.
Q14.2.2
La constante d'ionisation de l'eau (K w) est de 2,9 × 10 −14 à 40 °C. Calculez [H 3 O +], [OH −], le pH et le PoH pour de l'eau pure à 40 °C.
Q14.2.3
La constante d'ionisation de l'eau (K w) est de 9,614 × 10 −14 à 60 °C. Calculez [H 3 O +], [OH −], le pH et le PoH pour de l'eau pure à 60 °C.
ARTICLE 14.2.3
x = 3,101 × 10 −7 M = [H 3 O +] = [OH −]
pH = -log 3,101 × 10 −7 = − (−6,5085) = 6,5085
pH = pH = 6,5085
Q14.2.4
Calculer le pH et le pOH de chacune des solutions suivantes à 25 °C pour lesquelles les substances s'ionisent complètement :
- 0,200 M de HCl
- 0,0143 M de NaOH
- 3,0 MM HNO 3
- 0,0031 Mo Ca (OH) 2
Q14.2.5
Calculer le pH et le pOH de chacune des solutions suivantes à 25 °C pour lesquelles les substances s'ionisent complètement :
- 0,000259 M de ChLo 4
- NaOH 0,21 mg
- 0,000071 MB Bar (OH) 2
- 2,5 KM DE KOH
ARTICLE 14.2.5
pH = 3,587 ; pH = 10,413 ; pH = 0,68 ; pH = 13,32 ; pOH = 3,85 ; pH = 10,15 ; pH = −0,40 ; pOH = 14,4
Q14.2.6
Quels sont le pH et le POH d'une solution de HCl 2,0 M qui s'ionise complètement ?
Q14.2.6
Quelles sont les concentrations en ions hydronium et hydroxyde dans une solution dont le pH est de 6,52 ?
ARTICLE 14.2.6
[H 3 O +] = 3,0 × 10 −7 M ; [OH −] = 3,3 × 10 −8 M
Q14.2.7
Calculez la concentration en ions hydrogène et en ions hydroxyde dans le vin à partir de son pH. Voir la figure ci-dessous pour des informations utiles.
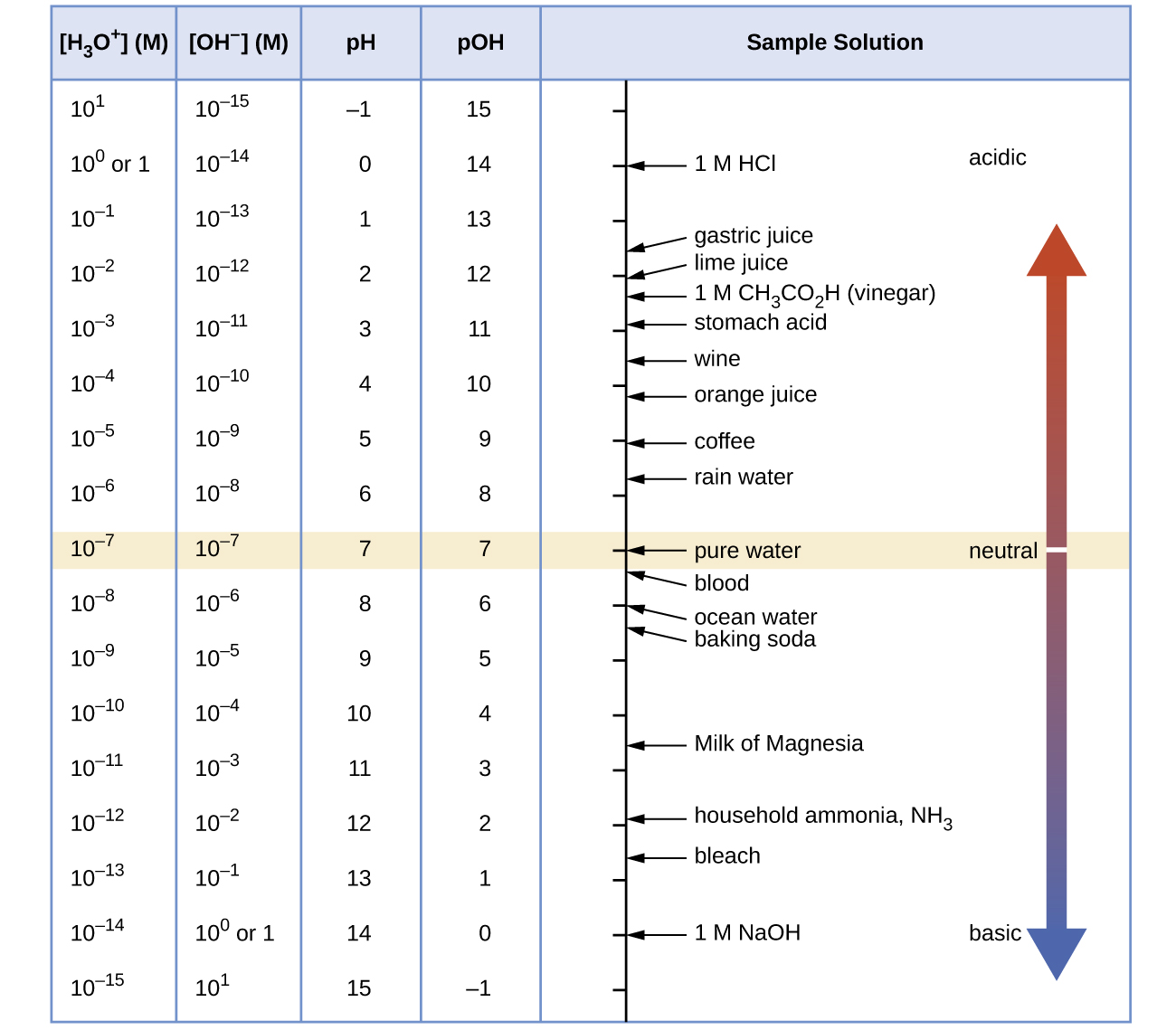
Q14.2.8
Calculez la concentration en ions hydronium et en ions hydroxyde dans le jus de citron vert à partir de son pH. Voir la figure pour des informations utiles.
ARTICLE 14.2.9
[H 3 O +] = 1 × 10 −2 M ; [OH −] = 1 × 10 −12 M
Q14.2.9
La concentration en ions hydronium dans un échantillon d'eau de pluie est de 1,7 × 10 −6 M à 25 °C. Quelle est la concentration d'ions hydroxyde dans l'eau de pluie ?
Q14.2.10
La concentration en ions hydroxyde dans l'ammoniac domestique est de 3,2 × 10 −3 M à 25 °C. Quelle est la concentration d'ions hydronium dans la solution ?
ARTICLE 14.2.10
[OH −] = 3,1 × 10 −12 M
14.3 : Fortes relatives des acides et des bases
Q14.3.1
Expliquez pourquoi la réaction de neutralisation d'un acide fort et d'une base faible donne une solution faiblement acide.
Q14.3.2
Expliquez pourquoi la réaction de neutralisation d'un acide faible et d'une base forte donne une solution faiblement basique.
Le sel s'ionise en solution, mais l'anion réagit légèrement avec l'eau pour former l'acide faible. Cette réaction forme également OH -, ce qui rend la solution basique.
Q14.3.3
Utilisez cette liste de composés industriels importants (et figure) pour répondre aux questions suivantes concernant : CaO, Ca (OH) 2, CH 3 CO 2 H, CO 2, HCl, H 2 CO 3, HF, HNO 2, HNO 3, H 3 PO 4, H 2 SO 4, NH 3, NaOH, Na 2 CO 3.
- Identifiez les acides forts de Brønsted-Lowry et les bases fortes de Brønsted-Lowry.
- Énumérez les composés qui peuvent se comporter comme des acides de Brønsted-Lowry dont les forces se situent entre celles de H 3 O + et de H 2 O.
- Énumérez les composés qui peuvent se comporter comme des bases de Brønsted-Lowry avec des forces comprises entre celles de H 2 O et OH −.
Q14.3.4
L'odeur du vinaigre est due à la présence d'acide acétique, CH 3 CO 2 H, un acide faible. Énumérer, par ordre décroissant de concentration, toutes les espèces ioniques et moléculaires présentes dans une solution aqueuse à 1 M de cet acide.
ARTICLE 14.3.4
[H 2 O] > [CH 3 CO 2 H] >\(\ce{[H3O+]}\) ≈\(\ce{[CH3CO2- ]}\) > [OH −]
Q14.3.5
L'ammoniac domestique est une solution de NH 3, une base faible, dans l'eau. Énumérer, par ordre décroissant de concentration, toutes les espèces ioniques et moléculaires présentes dans une solution aqueuse à 1 M de cette base.
Q14.3.4
Expliquez pourquoi la constante d'ionisation K a pour H 2 SO 4 est supérieure à la constante d'ionisation pour H 2 SO 3.
ARTICLE 14.3.4
L'état d'oxydation du soufre dans H 2 SO 4 est supérieur à l'état d'oxydation du soufre dans H 2 SO 3.
Q14.3.7
Expliquez pourquoi la constante d'ionisation K a pour HI est plus grande que la constante d'ionisation pour HF.
Q14.3.8
Le suc gastrique, le liquide digestif produit dans l'estomac, contient de l'acide chlorhydrique, du HCl. Le lait de magnésie, une suspension de Mg (OH) 2 solide dans un milieu aqueux, est parfois utilisé pour neutraliser l'excès d'acide gastrique. Écrivez une équation équilibrée complète pour la réaction de neutralisation et identifiez les paires acide-base conjuguées.
ARTICLE 14.3.8
\(\underset{\large\ce{BB}}{\ce{Mg(OH)2}(s)}+\underset{\large\ce{BA}}{\ce{HCl}(aq)}⟶\underset{\large\ce{CB}}{\ce{Mg^2+}(aq)}+\underset{\large\ce{CA}}{\ce{2Cl-}(aq)}+\underset{\:}{\ce{2H2O}(l)}\)
Q14.3.9
L'acide nitrique réagit avec l'oxyde de cuivre (II) insoluble pour former du nitrate de cuivre (II) soluble, le Cu (NO 3) 2, un composé utilisé pour empêcher la croissance des algues dans les piscines. Ecrire l'équation chimique équilibrée pour la réaction d'une solution aqueuse de HNO 3 avec CuO.
Q14.3.10
Quelle est la constante d'ionisation à 25 °C pour l'acide faible\(\ce{CH3NH3+}\), l'acide conjugué de la base faible CH 3 NH 2, K b = 4,4 × 10 −4.
ARTICLE 14.3.10
\(K_\ce{a}=2.3×10^{−11}\)
Q14.3.11
Quelle est la constante d'ionisation à 25 °C pour l'acide faible\(\ce{(CH3)2NH2+}\), l'acide conjugué de la base faible (CH 3) 2 NH, K b = 7,4 × 10 −4 ?
Q14.3.12
Quelle base, CH 3 NH 2 ou (CH 3) 2 NH, est la base la plus forte ? Quel acide conjugué,\(\ce{(CH3)2NH2+}\) ou (CH 3) 2 NH, est l'acide le plus puissant ?
ARTICLE 14.3.12
La base la plus forte ou l'acide le plus fort est celui dont le K b ou le K a est le plus élevé, respectivement. Dans ces deux exemples, il s'agit de (CH 3) 2 NH et\(\ce{CH3NH3+}\).
Q14.3.3
Quel est l'acide le plus fort,\(\ce{NH4+}\) ou HBrO ?
Q14.3.14
Quelle est la base la plus solide, (CH 3) 3 N ou\(\ce{H2BO3-}\) ?
ARTICLE 14.3.14
triéthylamine.
Q14.3.15
Prédisez quel acide de chacune des paires suivantes est le plus fort et expliquez votre raisonnement pour chacune d'entre elles.
- H 2 O ou HF
- B (OH) 3 ou Al (OH) 3
- \(\ce{HSO3-}\)ou\(\ce{HSO4-}\)
- NH 3 ou H 2 S
- H 2 O ou H 2 Te
Q14.3.16
Prédisez quel composé de chacune des paires de composés suivantes est le plus acide et expliquez votre raisonnement pour chacun d'entre eux.
- \(\ce{HSO4-}\)ou\(\ce{HSeO4-}\)
- NH 3 ou H 2 O
- PH 3 ou HI
- NH 3 ou PH 3
- H 2 S ou HBr
S14.3.16
- \(\ce{HSO4-}\); électronégativité plus élevée de l'ion central. H 2 O ;
- NH 3 est une base et l'eau est neutre, ou décidez sur la base des valeurs de K a. BONJOUR ;
- Le PH 3 est plus faible que le HCl ; le HCl est plus faible que le HI. Ainsi, le PH 3 est plus faible que le HI.
- PH 3 ; dans les composés binaires d'hydrogène et de non-métaux, l'acidité augmente pour l'élément le plus bas d'un groupe.
- HBr ; au cours d'une période, l'acidité augmente de gauche à droite ; dans un groupe, elle augmente de haut en bas. Br se trouve à gauche et en dessous de S, donc HBr est l'acide le plus fort.
Q14.3.17
Classez les composés dans chacun des groupes suivants par ordre croissant d'acidité ou de basicité, comme indiqué, et expliquez l'ordre que vous leur attribuez.
- acidité : HCl, HBr, HI
- basicité : H 2 O, OH −, H −, Cl −
- basicité : Mg (OH) 2, Si (OH) 4, ClO 3 (OH) (indice : la formule pourrait également être écrite comme HClO 4).
- acidité : HF, H 2 O, NH 3, CH 4
Q14.3.18
Classez les composés dans chacun des groupes suivants par ordre croissant d'acidité ou de basicité, comme indiqué, et expliquez l'ordre que vous leur attribuez.
- acidité : NaHSO 3, NaHSEO 3, NaHSO 4
- basicité :\(\ce{BrO2-}\)\(\ce{ClO2-}\),\(\ce{IO2-}\)
- acidité : HOCl, HOBr, HOI
- acidité : HOCl, HOClo, HOClo 2, HOClo 3
- basicité :\(\ce{NH2-}\), HS −, The −,\(\ce{PH2-}\)
- basicité : BrO −\(\ce{BrO2-}\),\(\ce{BrO3-}\),\(\ce{BrO4-}\)
S14.3.18
- NaHSEO 3 < NaHSO 3 < NaHSO 4 ; dans les polyoxyacides, l'élément central le plus électronégatif, S, dans ce cas, forme l'acide le plus fort. Le plus grand nombre d'atomes d'oxygène sur l'atome central (ce qui lui confère un état d'oxydation plus élevé) crée également une plus grande libération d'atomes d'hydrogène, ce qui se traduit par un acide plus fort. En tant que sel, l'acidité augmente de la même manière.
- \(\ce{ClO2- < BrO2- < IO2-}\); la basicité des anions dans une série d'acides sera opposée à l'acidité de leurs oxyacides. L'acidité augmente à mesure que l'électronégativité de l'atome central augmente. Cl est plus électronégatif que Br, et I est le moins électronégatif des trois.
- HOI < HOBr < HOCl ; dans une série de mêmes formes d'oxyacides, l'acidité augmente à mesure que l'électronégativité de l'atome central augmente. Cl est plus électronégatif que Br, et I est le moins électronégatif des trois.
- HOCl < HOClO < HOClO 2 < HOClO 3 ; dans une série d'oxyacides du même élément central, l'acidité augmente à mesure que le nombre d'atomes d'oxygène augmente (ou lorsque l'état d'oxydation de l'atome central augmente).
- \(\ce{HTe- < HS- << PH2- < NH2-}\);\(\ce{PH2-}\) et\(\ce{NH2-}\) sont des anions de bases faibles, ils agissent donc comme des bases fortes vers H +. \(\ce{HTe-}\)et HS - sont des anions d'acides faibles, ils ont donc un caractère moins basique. Dans un groupe périodique, l'élément le plus électronégatif possède l'anion le plus basique.
- \(\ce{BrO4- < BrO3- < BrO2- < BrO-}\); avec un plus grand nombre d'atomes d'oxygène (c'est-à-dire lorsque l'état d'oxydation de l'ion central augmente), l'acide correspondant devient plus acide et l'anion par conséquent moins basique.
Q14.3.19
Le HF et le HCN s'ionisent dans l'eau dans une mesure limitée. Laquelle des bases conjuguées, F − ou CN −, est la base la plus forte ? Voir le tableau.
Q14.3.20
L'ingrédient actif formé par l'aspirine dans le corps est l'acide salicylique, C 6 H 4 OH (CO 2 H). Le groupe carboxyle (-CO 2 H) agit comme un acide faible. Le groupe phénol (un groupe OH lié à un cycle aromatique) agit également comme un acide mais un acide beaucoup plus faible. Énumérer, par ordre décroissant de concentration, toutes les espèces ioniques et moléculaires présentes dans une solution aqueuse à 0,001- M de C 6 H 4 OH (CO 2 H).
\(\ce{[H2O] > [C6H4OH(CO2H)] > [H+]0 > [C6H4OH(CO2)- ] ≫ [C6H4O(CO2H)- ] > [OH- ]}\)
Que représentons-nous lorsque nous écrivons :
\[\ce{CH3CO2H}(aq)+\ce{H2O}(l)⇌\ce{H3O+}(aq)+\ce{CH3CO2-}(aq)?\]
Q14.3.21
Expliquez pourquoi les calculs d'équilibre ne sont pas nécessaires pour déterminer les concentrations ioniques dans les solutions de certains électrolytes puissants tels que le NaOH et le HCl. Dans quelles conditions les calculs d'équilibre sont-ils nécessaires pour déterminer les concentrations de tous les ions de certains autres électrolytes forts en solution ?
ARTICLE 14.3.21
Les électrolytes forts sont ionisés à 100 % et, tant que les ions qui les composent ne sont ni des acides faibles ni des bases faibles, les espèces ioniques présentes résultent de la dissociation de l'électrolyte fort. Des calculs d'équilibre sont nécessaires lorsqu'un (ou plusieurs) des ions est un acide faible ou une base faible.
Q14.3.2
Les concentrations d'ions hydronium et d'ion hydroxyde dans une solution d'un acide ou d'une base dans l'eau sont-elles directement proportionnelles ou inversement proportionnelles ? Expliquez votre réponse.
Q14.3.23
Quelles sont les deux hypothèses courantes qui peuvent simplifier le calcul des concentrations d'équilibre dans une solution d'un acide faible ?
ARTICLE 14.3.23
- Supposons que la variation de la concentration initiale de l'acide lorsque l'équilibre est établi puisse être négligée, de sorte que cette concentration peut être supposée constante et égale à la valeur initiale de la concentration totale en acide.
- Supposons que l'on puisse négliger la contribution de l'eau à la concentration d'équilibre de H 3 O +.
Q14.3.24
Quelles sont les deux hypothèses courantes qui peuvent simplifier le calcul des concentrations d'équilibre dans une solution d'une base faible ?
Q14.3.25
Lequel des facteurs suivants augmentera le pourcentage de NH 3 converti en ions ammonium dans l'eau (indice : utilisez le principe de LeChâtelier.) ?
- ajout de NaOH
- ajout de HCl
- ajout de NH 4 Cl
ARTICLE 14.3.25
L'ajout de HCl
Q14.3.26
Lequel des éléments suivants augmentera le pourcentage de HF converti en ion fluorure dans l'eau ?
- ajout de NaOH
- ajout de HCl
- ajout de NaF
Q14.3.27
Quel est l'effet sur les concentrations de\(\ce{NO2-}\), de HNO 2 et de OH − lorsque les substances suivantes sont ajoutées à une solution de KNO 2 dans l'eau :
- HCl
- N° 2
- NaOH
- NaCl
- SAVOIR
L'équation de l'équilibre est la suivante :
\[\ce{NO2-}(aq)+\ce{H2O}(l)⇌\ce{HNO2}(aq)+\ce{OH-}(aq)\]ARTICLE 14.3.27
- L'ajout de HCl ajoutera des ions H 3 O +, qui réagiront ensuite avec les ions OH −, diminuant ainsi leur concentration. L'équilibre se déplacera vers la droite, augmentant la concentration de HNO 2 et diminuant la concentration d'\(\ce{NO2-}\)ions.
- L'ajout de HNO 2 augmente la concentration de HNO 2 et déplace l'équilibre vers la gauche, augmentant la concentration en\(\ce{NO2-}\) ions et diminuant la concentration en ions OH −.
- L'ajout de NaOH ajoute des ions OH −, ce qui déplace l'équilibre vers la gauche, augmentant la concentration des\(\ce{NO2-}\) ions et diminuant les concentrations de HNO 2.
- L'ajout de NaCl n'a aucun effet sur les concentrations des ions.
- L'ajout de KNO 2 ajoute\(\ce{NO2-}\) des ions et déplace l'équilibre vers la droite, augmentant ainsi les concentrations en ions HNO 2 et OH −.
Q14.3.28
Quel est l'effet sur la concentration d'acide fluorhydrique, d'ion hydronium et d'ion fluorure lorsque les substances suivantes sont ajoutées à des solutions séparées d'acide fluorhydrique ?
- HCl
- KF
- NaCl
- KOH
- HF
L'équation de l'équilibre est la suivante :
\[\ce{HF}(aq)+\ce{H2O}(l)⇌\ce{H3O+}(aq)+\ce{F-}(aq)\]Q14.3.29
Pourquoi la concentration en ions hydronium dans une solution de 0,10 M dans le HCl et de 0,10 M dans le HCOOH est-elle déterminée par la concentration de HCl ?
ARTICLE 14.3.29
Il s'agit d'un cas où la solution contient un mélange d'acides de différentes forces d'ionisation. En solution, le HCO 2 H existe principalement sous forme de molécules de HCO 2 H car l'ionisation de l'acide faible est supprimée par l'acide fort. Par conséquent, le HCO 2 H apporte une quantité négligeable d'ions hydronium à la solution. L'acide le plus fort, le HCl, est le principal producteur d'ions hydronium car il est complètement ionisé. Dans une telle solution, l'acide le plus fort détermine la concentration en ions hydronium, et l'ionisation de l'acide le plus faible est fixée par le [H 3 O +] produit par l'acide le plus fort.
Q14.3.30
À partir des concentrations d'équilibre données, calculez K a pour chacun des acides faibles et K b pour chacune des bases faibles.
CH 3 CO 2 H :\(\ce{[H3O+]}\) = 1,34 × 10 -3 M ;
\(\ce{[CH3CO2- ]}\)= 1,34 × 10 -3 M ;[CH 3 CO 2 H] = 9,866 × 10 -2 M ;
ClO − : [OH −] = 4,0 × 10 -4 M ;
[HClO] = 2,38 × 10 −5 M ;
[ClO −] = 0,273 M ;
HCO 2 H : [HCO 2 H] = 0,524 M ;
\(\ce{[H3O+]}\)= 9,8 × 10 -3 M ;\(\ce{[HCO2- ]}\) = 9,8 × 10 -3 M ;\(\ce{C6H5NH3+ : [C6H5NH3+]}\)= 0,233 M ;
[C 6 H 5 NH 2] = 2,3 × 10 -3 M ;
\(\ce{[H3O+]}\)= 2,3 × 10 −3 MÀ partir des concentrations d'équilibre données, calculez K a pour chacun des acides faibles et K b pour chacune des bases faibles.
NH 3 : [OH −] = 3,1 × 10 -3 M ;
\(\ce{[NH4+]}\)= 3,1 × 10 -3 M ;[NH 3] = 0,533 M ;
NO 2 :\(\ce{[H3O+]}\) 0,011 M ;
\(\ce{[NO2- ]}\)= 0,0438 M ;[NO 2] = 1,07 M ;
(CH 3) 3 N : [(CH 3) 3 N] = 0,25 M ;
[(CH 3) 3 NH +] = 4,3 × 10 -3 M ;[OH −] = 4,3 × 10 -3 M ;
\(\ce{NH4+ : [NH4+]}\)= 0,100 M ;
[NH 3] = 7,5 × 10 −6 M ;
[H 3 O +] = 7,5 × 10 −6 M- \(K_\ce{b}=1.8×10^{−5};\)
- \(K_\ce{a}=4.5×10^{−4};\)
- \(K_\ce{b}=7.4×10^{−5};\)
- \(K_\ce{a}=5.6×10^{−10}\)
Q14.3.31
Déterminez K b pour l'ion nitrite,\(\ce{NO2-}\). Dans une solution à 0,10- M, cette base est ionisée à 0,0015 %.
Q14.3.32
Déterminez K a pour l'ion sulfate d'hydrogène,\(\ce{HSO4-}\). Dans une solution à 0,10- M, l'acide est ionisé à 29 %.
ARTICLE 14.3.32
\(K_\ce{a}=1.2×10^{−2}\)
Q14.3.3
Calculez la constante d'ionisation pour chacun des acides ou bases suivants à partir de la constante d'ionisation de sa base conjuguée ou de son acide conjugué :
- F −
- \(\ce{NH4+}\)
- \(\ce{AsO4^3-}\)
- \(\ce{(CH3)2NH2+}\)
- \(\ce{NO2-}\)
- \(\ce{HC2O4-}\)(comme base)
Q14.3.52
Calculez la constante d'ionisation pour chacun des acides ou bases suivants à partir de la constante d'ionisation de sa base conjuguée ou de son acide conjugué :
- Le − (comme base)
- \(\ce{(CH3)3NH+}\)
- \(\ce{HAsO4^3-}\)(comme base)
- \(\ce{HO2-}\)(comme base)
- \(\ce{C6H5NH3+}\)
- \(\ce{HSO3-}\)(comme base)
S14.3.52
- \(K_\ce{b}=4.3×10^{−12};\)
- \(K_\ce{a}=1.4×10^{−10};\)
- \(K_\ce{b}=1×10^{−7};\)
- \(K_\ce{b}=4.2×10^{−3};\)
- \(K_\ce{b}=4.2×10^{−3};\)
- \(K_\ce{b}=8.3×10^{−13}\)
Q14.3.53
Parmi les solutions suivantes, laquelle doit-on prendre en compte l'ionisation de l'eau lors du calcul du pH ou du PoH ?
- 3 × 10 −8 M N° 3
- 0,10 g de HCl dans 1,0 L de solution
- 0,00080 g de NaOH dans 0,50 L de solution
- 1 × 10 −7 M Ca (OH) 2
- 0,0245 MM NŒUD 3
Q14.3.54
Même si le NH 3 et le C 6 H 5 NH 2 sont des bases faibles, le NH 3 est un acide beaucoup plus fort que le C 6 H 5 NH 2. Lequel des énoncés suivants est correct à l'équilibre pour une solution qui est initialement de 0,10 M dans le NH 3 et de 0,10 M dans le C 6 H 5 NH 2 ?
- \(\ce{[OH- ]}=\ce{[NH4+]}\)
- \(\ce{[NH4+]}=\ce{[C6H5NH3+]}\)
- \(\ce{[OH- ]}=\ce{[C6H5NH3+]}\)
- [NH 3] = [C 6 H 5 NH 2]
- a et b sont corrects
est la bonne déclaration.
Q14.3.5
Calculer la concentration d'équilibre des acides non ionisés et de tous les ions dans une solution de 0,25 M dans le HCO 2 H et de 0,10 M dans le HClO.
Q14.3.56
Calculez la concentration d'équilibre des acides non ionisés et de tous les ions dans une solution qui est de 0,134 M dans le HNO 2 et de 0,120 M dans le HBrO.
ARTICLE 14.3.56
[H 3 O +] = 7,5 × 10 -3 M
[HNO 2] = 0,126 [OH −] = 1,3 × 10 −12 M [BrO −] = 3,2 × 10 −8 M [HBrO] = 0,120 MQ14.3.57
Calculer la concentration d'équilibre des bases non ionisées et de tous les ions dans une solution qui est de 0,25 M dans le CH 3 NH 2 et de 0,10 M dans le C 5 H 5 N (K b = 1,7 × 10 −9).
Q14.3.58
Calculer la concentration d'équilibre des bases non ionisées et de tous les ions dans une solution qui est de 0,115 M dans le NH 3 et de 0,100 M dans le C 6 H 5 NH 2.
S14.3.58
[OH −]\(\ce{[NO4+]}\) = 0,0014 M
[NH 3] = 0,144 M [H 3 O +] = 6,9 × 10 −12 M\(\ce{[C6H5NH3+]}\) = 3,9 × 10 −8 M [C 6 H 5 NH 2] = 0,100 MQ14.3.59
À l'aide des valeurs K a de l'annexe H,\(\ce{Al(H2O)6^3+}\) placez-les au bon endroit sur la figure.
Q14.3.60
Calculez la concentration de toutes les espèces de solutés dans chacune des solutions d'acides ou de bases suivantes. Supposons que l'ionisation de l'eau puisse être négligée et montrez que la modification des concentrations initiales peut être négligée. Les constantes d'ionisation se trouvent à l'annexe H et à l'annexe I.
- 0,0092 M de HClO, un acide faible
- 0,0784 M C 6 H 5 NH 2, une base faible
- 0,0810 M de HCN, un acide faible
- 0,11 M (CH 3) 3 N, base faible
- 0,120 M\(\ce{Fe(H2O)6^2+}\) est un acide faible, K a = 1,6 × 10 −7
ARTICLE 14.3.60
\(\ce{\dfrac{[H3O+][ClO- ]}{[HClO]}}=\dfrac{(x)(x)}{(0.0092−x)}≈\dfrac{(x)(x)}{0.0092}=3.5×10^{−8}\)
La résolution de x donne 1,79 × 10 −5 M. Cette valeur est inférieure à 5 % de 0,0092, de sorte que l'hypothèse selon laquelle elle peut être négligée est valide. Ainsi, les concentrations des espèces de solutés à l'équilibre sont les suivantes :
[H 3 O +] = [ClO] = 1,8 × 10 −5 M [HClO] = 0,00092 M [OH −] = 5,6 × 10 −10 M ;
\(\ce{\dfrac{[C6H5NH3+][OH- ]}{[C6H5NH2]}}=\dfrac{(x)(x)}{(0.0784−x)}≈\dfrac{(x)(x)}{0.0784}=4.6×10^{−10}\)
La résolution de x donne 6,01 × 10 −6 M.
Cette valeur est inférieure à 5 % de 0,0784, de sorte que l'hypothèse selon laquelle elle peut être négligée est valide. Ainsi, les concentrations des espèces de solutés à l'équilibre sont les suivantes :\(\ce{[CH3CO2- ]}\) = [OH −] = 6,0 × 10 −6 M [C 6 H 5 NH 2] = 0,00784 [H 3 O +] = 1,7 × 10 −9 M ;\(\ce{\dfrac{[H3O+][CN- ]}{[HCN]}}=\dfrac{(x)(x)}{(0.0810−x)}≈\dfrac{(x)(x)}{0.0810}=4×10^{−10}\) Résolution pour x donne 5,69 × 10 −6 M. Cette valeur est inférieure à 5 % de 0,0810, de sorte que l'hypothèse selon laquelle elle peut être négligée est valide. Ainsi, les concentrations des espèces de solutés à l'équilibre sont les suivantes : [H 3 O +] = [CN −] = 5,7 × 10 −6 M [HCN] = 0,0810 M [OH −] = 1,8 × 10 −9 M ; la\(\ce{\dfrac{[(CH3)3NH+][OH- ]}{[(CH3)3N]}}=\dfrac{(x)(x)}{(0.11−x)}≈\dfrac{(x)(x)}{0.11}=7.4×10^{−5}\) résolution pour x donne 2,85 × 10 -3 M. Cette valeur est inférieure à 5 % de 0,11, de sorte que l'hypothèse selon laquelle elle peut être négligée est valide. Ainsi, les concentrations des espèces de solutés à l'équilibre sont les suivantes : [(CH 3) 3 NH +] = [OH −] = 2,9 × 10 −3 M [(CH 3) 3 N] = 0,11 M [H 3 O +] = 3,5 × 10 −12 M ;\(\ce{\dfrac{[Fe(H2O)5(OH)+][H3O+]}{[Fe(H2O)6^2+]}}=\dfrac{(x)(x)}{(0.120−x)}≈\dfrac{(x)(x)}{0.120}=1.6×10^{−7}\) La résolution de x donne 1,39 × 10 −4 M. Cette valeur est inférieure à 5 % de 0,120, de sorte que l'hypothèse selon laquelle elle peut être négligée est valide. Ainsi, les concentrations des espèces de solutés à l'équilibre sont les suivantes : [Fe (H 2 O) 5 (OH) +] = [H 3 O +] = 1,4 × 10 −4 M\(\ce{[Fe(H2O)6^2+]}\) = 0,120 M [OH −] = 7,2 × 10 −11 M
Q14.3.61
L'acide propionique, C 2 H 5 CO 2 H (K a = 1,34 × 10 −5), est utilisé dans la fabrication du propionate de calcium, un conservateur alimentaire. Quelle est la concentration en ions hydronium dans une solution à 0,698- M de C 2 H 5 CO 2 H ?
Q14.3.62
Le vinaigre blanc est une solution à 5,0 % en masse d'acide acétique dans de l'eau. Si la densité du vinaigre blanc est de 1,007 g/cm 3, quel est le pH ?
S14.3.62
pH = 2,41
Q14.3.63
La constante d'ionisation de l'acide lactique, CH 3 CH (OH) CO 2 H, un acide présent dans le sang après un effort intense, est de 1,36 × 10 −4. Si 20,0 g d'acide lactique sont utilisés pour préparer une solution d'un volume de 1,00 L, quelle est la concentration en ions hydronium dans la solution ?
Q14.3.64
La nicotine, C 10 H 14 N 2, est une base qui accepte deux protons (K 1 = 7 × 10 −7, K 2 = 1,4 × 10 −11). Quelle est la concentration de chaque espèce présente dans une solution de nicotine à 0,050- M ?
ARTICLE 14.3.64
[C 10 H 14 N 2] = 0,049 M
[C 10 H 14 N 2 H +] = 1,9 × 10 −4 M\(\ce{[C10H14N2H2^2+]}\) = 1,4 × 10 −11 M [OH −] = 1,9 × 10 −4 M [H 3 O +] = 5,3 × 10 −11 MQ14.3.65
Le pH d'une solution de HF à 0,20- M est de 1,92. Déterminez K a pour HF à partir de ces données.
Q14.3.6
Le pH d'une solution à 0,15- M de\(\ce{HSO4-}\) est de 1,43. Déterminez K a pour\(\ce{HSO4-}\) à partir de ces données.
S14.3.6
\(K_\ce{a}=1.2×10^{−2}\)
Q14.3.67
Le pH d'une solution de caféine à 0,10- M est de 11,16. Déterminez le K b pour la caféine à partir de ces données
\(\ce{C8H10N4O2}(aq)+\ce{H2O}(l)⇌\ce{C8H10N4O2H+}(aq)+\ce{OH-}(aq)\)Q14.3.68
Le pH d'une solution d'ammoniaque domestique, une solution de NH 3 à 0,950 M, est de 11,612. Déterminez K b pour NH 3 à partir de ces données.
S14.3.68
\(K_\ce{b}=1.77×10^{−5}\)
14.4 : Hydrolyse des solutions salines
Q14.4.1
Déterminer si les solutions aqueuses des sels suivants sont acides, basiques ou neutres :
- Al (NO 33)
- RBI
- KHCO 2
- CH 3 NH 3 BR
Q14.4.2
Déterminer si les solutions aqueuses des sels suivants sont acides, basiques ou neutres :
- FéCl 3
- K 2 CO 3
- NH 4 Bar
- KClO 4
ARTICLE 14.4.2
acide ; basique ; acide ; neutre
Q14.4.3
La novocaïne, C 13 H 21 O 2 N 2 Cl, est le sel de la base procaïne et de l'acide chlorhydrique. La constante d'ionisation de la procaïne est de 7 × 10 −6. Une solution de novocaïne est-elle acide ou basique ? Quels sont [H 3 O +], [OH −] et le pH d'une solution à 2,0 % en masse de novocaïne, en supposant que la densité de la solution est de 1,0 g/mL.
14.5 : Acides polyprotiques
Q15.5.1
Laquelle des concentrations suivantes serait pratiquement égale dans le calcul des concentrations d'équilibre dans une solution à 0,134- M de H 2 CO 3, un acide diprotique :
- \(\ce{[H3O+]}\),
- \([OH^−]\)
- \([H_2CO_3]\)
- \(\ce{[HCO3- ]}\)
- \(\ce{[CO3^2- ]}\)
Aucun calcul n'est nécessaire pour répondre à cette question.
ARTICLE 15.5.1
[H 3 O +] et\(\ce{[HCO3- ]}\) sont égaux, H 3 O + et\(\ce{HCO3-}\) sont pratiquement égaux
Q15.5.2
Calculer la concentration de chaque espèce présente dans une solution à 0,050- M de H 2 S.
Q15.5.3
Calculer la concentration de chaque espèce présente dans une solution 0,010- M d'acide phtalique, C 6 H 4 (CO 2 H) 2.
ARTICLE 15.5.3
\(\ce{C6H4(CO2H)2}(aq)+\ce{H2O}(l)⇌\ce{H3O+}(aq)+\ce{C6H4(CO2H)(CO2)-}(aq) \hspace{20px} K_\ce{a}=1.1×10^{−3}\)
\(\ce{C6H4(CO2H)(CO2)}(aq)+\ce{H2O}(l)⇌\ce{H3O+}(aq)+\ce{C6H4(CO2)2^2-}(aq) \hspace{20px} K_\ce{a}=3.9×10^{−6}\)
[C 6 H 4 (CO 2 H) 2] 7,2 × 10 −3 M, [C 6 H 4 (CO 2 H) (CO 2) −] = [H 3 O +] 2,8 × 10 −3 M,\(\ce{[C6H4(CO2)2^2- ]}\) 3,9 × 10 −6 M, [OH −] 3,6 × 10 −12 M
Q15.5.4
L'acide salicylique, HOC 6 H 4 CO 2 H, et ses dérivés sont utilisés depuis longtemps comme analgésiques. L'acide salicylique est présent en petites quantités dans les feuilles, l'écorce et les racines de certains végétaux (plus particulièrement, historiquement, dans l'écorce du saule). Des extraits de ces plantes sont utilisés comme médicaments depuis des siècles. L'acide a été isolé pour la première fois en laboratoire en 1838.
- Les deux groupes fonctionnels de l'acide salicylique s'ionisent dans l'eau, avec K a = 1,0 × 10 −3 pour le groupe—CO 2 H et 4,2 × 10 −13 pour le groupe −OH. Quel est le pH d'une solution saturée de l'acide (solubilité = 1,8 g/L).
- L'aspirine a été découverte grâce à des efforts visant à produire un dérivé de l'acide salicylique qui n'irriterait pas la muqueuse de l'estomac. L'aspirine est l'acide acétylsalicylique, CH 3 CO 2 C 6 H 4 CO 2 H. Le groupe fonctionnel −CO 2 H est toujours présent, mais son acidité est réduite, K a = 3,0 × 10 −4. Quel est le pH d'une solution d'aspirine ayant la même concentration qu'une solution saturée d'acide salicylique (voir partie a).
- Dans certaines conditions, l'aspirine réagit avec l'eau et forme une solution d'acide salicylique et d'acide acétique :
\[\ce{CH3CO2C6H4CO2H}(aq)+\ce{H2O}(l)⟶\ce{HOC6H4CO2H}(aq)+\ce{CH3CO2H}(aq)\]
- Lequel des acides, l'acide salicylique ou l'acide acétique, produit le plus d'ions hydronium en solution dans une telle solution ?
- Quelles sont les concentrations de molécules et d'ions dans une solution produite par hydrolyse de 0,50 g d'aspirine dissous dans suffisamment d'eau pour donner 75 ml de solution ?
Q15.5.5
L'ion He − est une espèce amphiprotique ; il peut agir soit comme un acide soit comme une base.
- Qu'est-ce que K a pour la réaction acide de He − avec H 2 O ?
- Qu'est-ce que K b pour la réaction dans laquelle Hte − fonctionne comme base dans l'eau ?
- Démontrer si la deuxième ionisation de H 2 Te peut être négligée dans le calcul de [hE −] dans une solution de H 2 Te à 0,10 M.
S15.5.5
- \(K_{\ce a2}=1×10^{−5};\)
- \(K_\ce{b}=4.3×10^{−12};\)
- \(\ce{\dfrac{[Te^2- ][H3O+]}{[HTe- ]}}=\dfrac{(x)(0.0141+x)}{(0.0141−x)}≈\dfrac{(x)(0.0141)}{0.0141}=1×10^{−5}\). La résolution de x donne 1 × 10 −5 M. Par conséquent, par rapport à 0,014 M, cette valeur est négligeable (0,071 %).
14.6 : Tampons
Q14.6.1
Expliquez pourquoi un tampon peut être préparé à partir d'un mélange de NH 4 Cl et de NaOH, mais pas à partir de NH 3 et de NaOH.
Q14.6.2
Expliquez pourquoi le pH ne change pas de façon significative lorsqu'une petite quantité d'un acide ou d'une base est ajoutée à une solution contenant des quantités égales d'acide H 3 PO 4 et d'un sel de sa base conjuguée NaH 2 PO 4.
ARTICLE 14.6.2
L'excès d'H 3 O + est éliminé principalement par la réaction :
\(\ce{H3O+}(aq)+\ce{H2PO4-}(aq)⟶\ce{H3PO4}(aq)+\ce{H2O}(l)\)L'excès de base est éliminé par la réaction :\(\ce{OH-}(aq)+\ce{H3PO4}(aq)⟶\ce{H2PO4-}(aq)+\ce{H2O}(l)\)
Q14.6.3
Expliquez pourquoi le pH ne change pas de façon significative lorsqu'une petite quantité d'un acide ou d'une base est ajoutée à une solution contenant des quantités égales de NH 3 base et d'un sel de son acide conjugué NH 4 Cl.
Q14.6.4
Qu'est-ce que [H 3 O +] dans une solution de 0,25 M de CH 3 CO 2 H et de 0,030 M de NaCH 3 CO 2 ?
\(\ce{CH3CO2H}(aq)+\ce{H2O}(l)⇌\ce{H3O+}(aq)+\ce{CH3CO2-}(aq) \hspace{20px} K_\ce{a}=1.8×10^{−5}\)
ARTICLE 14.6.4
[H 3 O +] = 1,5 × 10 −4 M
Q14.6.5
Qu'est-ce que [H 3 O +] dans une solution de 0,075 M de HNO 2 et de 0,030 M de NaNO 2 ?
ARTICLE 14.6.6
\(\ce{HNO2}(aq)+\ce{H2O}(l)⇌\ce{H3O+}(aq)+\ce{NO2-}(aq) \hspace{20px} K_\ce{a}=4.5×10^{−5}\)Q14.6.6
Que contient [OH −] dans une solution de 0,125 M de CH 3 NH 2 et de 0,130 M de CH 3 NH 3 Cl ?
ARTICLE 14.6.6
\(\ce{CH3NH2}(aq)+\ce{H2O}(l)⇌\ce{CH3NH3+}(aq)+\ce{OH-}(aq) \hspace{20px} K_\ce{b}=4.4×10^{−4}\)[OH −] = 4,2 × 10 −4 M
Q14.6.7
Que contient [OH −] dans une solution de 1,25 M NH 3 et 0,78 M de NH 4 NO 3 ?
ARTICLE 14.6.7
\(\ce{NH3}(aq)+\ce{H2O}(l)⇌\ce{NH4+}(aq)+\ce{OH-}(aq) \hspace{20px} K_\ce{b}=1.8×10^{−5}\)Q14.6.8
Quelle est la concentration de NH 4 NO 3 requise pour obtenir [OH −] = 1,0 × 10 −5 dans une solution de NH 3 à 0,200- M ?
ARTICLE 14.6.8
[NH 4 NO 3] = 0,36 M
Q14.6.9 A
Quelle est la concentration de NaF requise pour obtenir [H 3 O +] = 2,3 × 10 −4 dans une solution de HF à 0,300- M ?
Q14.6.9 B
Quel est l'effet sur la concentration d'acide acétique, d'ion hydronium et d'ion acétate lorsque les substances suivantes sont ajoutées à une solution tampon acide contenant des concentrations égales d'acide acétique et d'acétate de sodium :
- HCl
- KCH 3 CO 2
- NaCl
- KOH
- CH 3 CO 2 H
ARTICLE 14.6.10
- Le HCl ajouté augmentera légèrement la concentration de H 3 O +, qui réagira avec le CH 3 CO 2 H\(\ce{CH3CO2-}\) et produira du CH 3 CO 2 H au cours du processus. Ainsi,\(\ce{[CH3CO2- ]}\) diminue et [CH 3 CO 2 H] augmente.
- Le KCH 3 CO 2 ajouté augmentera la concentration de\(\ce{[CH3CO2- ]}\) ce composé, qui réagira avec H 3 O + et produira du CH 3 CO 2 H au cours du processus. Ainsi, [H 3 O +] diminue légèrement et [CH 3 CO 2 H] augmente.
- Le NaCl ajouté n'aura aucun effet sur la concentration des ions.
- Le KOH ajouté produira des ions OH − qui réagiront avec le H 3 O +, réduisant ainsi [H 3 O +]. Une partie supplémentaire du CH 3 CO 2 H se dissociera et produira\(\ce{[CH3CO2- ]}\) des ions au cours du processus. Ainsi, le [CH 3 CO 2 H] diminue légèrement et\(\ce{[CH3CO2- ]}\) augmente.
- Le CH 3 CO 2 H ajouté augmentera sa concentration, provoquant la dissociation d'une plus grande partie de celui-ci et la production de H 3 O + au cours du processus.\(\ce{[CH3CO2- ]}\) Ainsi, [H 3 O +] augmente légèrement et\(\ce{[CH3CO2- ]}\) augmente.
Q14.6.11
Quel est l'effet sur la concentration d'ammoniac, d'ions hydroxyde et d'ions ammonium lorsque les substances suivantes sont ajoutées à une solution tampon basique contenant des concentrations égales d'ammoniac et de nitrate d'ammonium :
- KI
- NH 3
- SALUT.
- NaOH
- NH 4 Cl
Quel sera le pH d'une solution tampon préparée à partir de 0,20 mol de NH 3, 0,40 mol de NH 4 NO 3 et juste assez d'eau pour obtenir 1,00 L de solution ?
pH = 8,95
Calculer le pH d'une solution tampon préparée à partir de 0,155 mol d'acide phosphorique, 0,250 mole de KH 2 PO 4 et suffisamment d'eau pour obtenir 0,500 L de solution.
Quelle quantité de NaCH 3 CO 2 •3H 2 O solide doit être ajoutée à 0,300 L d'une solution d'acide acétique à 0,50- M pour obtenir un tampon ayant un pH de 5,00 ? (Conseil : supposons un changement de volume négligeable lorsque le solide est ajouté.)
37 g (0,27 mol)
Quelle masse de NH 4 Cl doit être ajoutée à 0,750 L d'une solution de NH 3 à 0,100 M pour obtenir une solution tampon ayant un pH de 9,26 ? (Conseil : supposons un changement de volume négligeable lorsque le solide est ajouté.)
Q14.6.1
Une solution tampon est préparée à partir de volumes égaux d'acide acétique de 0,200 M et d'acétate de sodium de 0,200 M. Utiliser 1,80 × 10 −5 comme K a pour l'acide acétique.
- Quel est le pH de la solution ?
- La solution est-elle acide ou basique ?
Q14.6.1
Quel est le pH d'une solution obtenu lorsque 3,00 ml de HCl 0,034 M sont ajoutés à 0,200 L du tampon d'origine ?
- pH = 5,222 ;
- La solution est acide. (c) pH = 5,221
Q14.6.1
Un échantillon de 5,36 g de NH 4 Cl a été ajouté à 25,0 ml de NaOH 1,00 M et la solution résultante a été diluée à 0,100 L.
- Quel est le pH de cette solution tampon ?
- La solution est-elle acide ou basique ?
- Quel est le pH d'une solution obtenu lorsque 3,00 ml de HCl 0,034 M sont ajoutés à la solution ?
Quel acide de [lien] convient le mieux à la préparation d'une solution tampon avec un pH de 3,1 ? Expliquez votre choix.
Pour préparer le meilleur tampon pour un HA faiblement acide et son sel, le ratio\(\dfrac{\ce{[H3O+]}}{K_\ce{a}}\) doit être aussi proche de 1 que possible pour une action tampon efficace. La concentration de [H 3 O +] dans un tampon de pH 3,1 est [H 3 O +] = 10 −3,1 = 7,94 × 10 −4 M
On peut maintenant calculer K a du meilleur acide de la façon suivante :\(\dfrac{\ce{[H3O+]}}{K_\ce{a}}=1\)
\(K_\ce{a}=\dfrac{\ce{[H3O+]}}{1}=7.94×10^{−4}\)
Dans [lien], l'acide dont le K a est le plus proche de 7,94 × 10 −4 est le HF, avec un K a de 7,2 × 10 −4.Quel acide de [lien] convient le mieux à la préparation d'une solution tampon avec un pH de 3,7 ? Expliquez votre choix.
Quelle base de [lien] est la plus appropriée pour la préparation d'une solution tampon avec un pH de 10,65 ? Expliquez votre choix.
Pour les tampons dont le pH est supérieur à 7, vous devez utiliser une base faible et son sel. Le tampon le plus efficace aura un ratio\(\dfrac{\ce{[OH- ]}}{K_\ce{b}}\) aussi proche de 1 que possible. Le PoH du tampon est de 14,00 − 10,65 = 3,35. Par conséquent, [OH −] est [OH −] = 10 −POH = 10 −3,35 = 4,467 × 10 −4 M.
Nous pouvons maintenant résoudre K b de la meilleure base comme suit :\(\dfrac{\ce{[OH- ]}}{K_\ce{b}}=1\) K b = [OH −] = 4,47 × 10 −4 Dans [lien], la base avec le K b le plus proche de 4,47 × 10 −4 est CH 3 NH 2, avec un K b = 4,4 × 10 −4.Quelle base de [lien] est la plus appropriée pour la préparation d'une solution tampon avec un pH de 9,20 ? Expliquez votre choix.
Q14.6.4
La saccharine, C 7 H 4 NSO 3 H, est un acide faible (K a = 2,1 × 10 −2). Si 0,250 L de cola diététique avec un pH tamponné de 5,48 a été préparé à partir de 2,00 × 10 −3 g de saccharide de sodium, Na (C 7 H 4 NSO 3), quelles sont les concentrations finales de saccharine et de saccharide de sodium dans la solution ?
ARTICLE 14.6.4
La masse molaire du saccharide de sodium est de 205,169 g/mol. En utilisant les abréviations HA pour saccharine et NaA pour saccharide de sodium, le nombre de moles de NaA dans la solution est le suivant :
9,75 × 10 −6 mol. Celui-ci s'ionise initialement pour former des ions saccharine, A −, avec : [A −] = 3,9 × 10 −5 MQ14.6.5
Quel est le pH de 1 000 L d'une solution de 100,0 g d'acide glutamique (C 5 H 9 NO 4, un acide diprotique ; K 1 = 8,5 × 10 −5, K 2 = 3,39 × 10 −10 −10) à laquelle ont été ajoutés 20,0 g de NaOH pendant la préparation du glutamate monosodique, l'agent aromatisant ? Quel est le pH lorsque exactement 1 mol de NaOH par mole d'acide a été ajoutée ?
14.7 : Titrages acido-basiques
Q14.7.1
Expliquez comment choisir l'indicateur acido-basique approprié pour le titrage d'une base faible par un acide fort.
ARTICLE 14.7.1
Au point d'équivalence lors du titrage d'une base faible avec un acide fort, la solution obtenue est légèrement acide en raison de la présence de l'acide conjugué. Choisissez donc un indicateur qui change de couleur dans la plage acide et qui place entre parenthèses le pH au point d'équivalence. L'orange méthylique en est un bon exemple.
Q14.7.2
Expliquez pourquoi un indicateur acido-basique change de couleur sur une plage de valeurs de pH plutôt qu'à un pH spécifique.
Q14.7.3
Pourquoi ne pas tenir compte de la contribution de l'eau aux concentrations de H 3 O + dans les solutions des acides suivants :
- 0,0092 M de HClO, un acide faible
- 0,0810 M de HCN, un acide faible
- 0,120 M\(\ce{Fe(H2O)6^2+}\) est un acide faible, K a = 1,6 × 10 −7
mais pas la contribution de l'eau à la concentration de OH - ?
ARTICLE 14.7.3
Dans une solution acide, la seule source d'ions OH − est l'eau. Nous utilisons K w pour calculer la concentration. Si la contribution de l'eau était négligée, la concentration de OH − serait nulle.
Q14.7.4
On peut ignorer la contribution de l'eau à la concentration de OH − dans une solution des bases suivantes :
0,0784 M C 6 H 5 NH 2, une base faible
0,11 M (CH 3) 3 N, base faible
mais pas la contribution de l'eau à la concentration de H 3 O + ?
Q14.7.5
Tracez une courbe pour une série de solutions de HF. Tracez [H 3 O +] total sur l'axe vertical et la concentration totale de HF (somme des concentrations des molécules de HF ionisées et non ionisées) sur l'axe horizontal. Supposons que la concentration totale de HF varie de 1 × 10 -10 M à 1 × 10 -2 M.
![Un graphique intitulé « Diagramme de [indice H 3 O exposant +] par rapport à [H F] » est affiché. L'axe horizontal est étiqueté « [H F], M. » L'axe commence à 10 exposants moins 10 et inclut des marques tous les 10 exposants (2 unités jusqu'à 1,0). L'axe vertical est intitulé « [indice H 3 O exposant plus], M » et commence à 10 exposant moins 10 et augmente de 10 exposant 2 jusqu'à 1,0. Une courbe noire commence sur le côté gauche du graphique à (10 exposants moins 10, 10 exposants moins 7). La ligne s'étend horizontalement jusqu'à une valeur d'axe horizontal de 10 exposants moins 8. Ensuite, la ligne augmente progressivement à un rythme constant jusqu'à une valeur légèrement supérieure à 10 exposant moins 3 à une valeur sur l'axe horizontal de 10 exposant moins 2.](http://cnx.org/resources/bbd3359c4d4d301b0f4471bd309310444779db56/CNX_Chem_14_07_Exercise5_img.jpg)
Q14.7.6
Tracez une courbe similaire à celle de la figure pour une série de solutions de NH 3. Tracez [OH −] sur l'axe vertical et la concentration totale de NH 3 (molécules de NH 3 ionisées et non ionisées) sur l'axe horizontal. Supposons que la concentration totale de NH 3 varie de 1 × 10 -10 M à 1 × 10 −2 M.
Q14.7.7
Calculer le pH aux points suivants en titrant 40 ml (0,040 L) d'acide barbiturique à 0,100 M (K a = 9,8 × 10 −5) avec 0,100 M de KOH.
- aucun KOH ajouté
- 20 ml de solution de KOH ajoutés
- 39 ml de solution de KOH ajoutés
- 40 ml de solution de KOH ajoutés
- 41 ml de solution de KOH ajoutés
ARTICLE 14.7.7
- pH = 2,50 ;
- pH = 4,01 ;
- pH = 5,60 ;
- pH = 8,35 ;
- pH = 11,08
Q14.7.8
Le dinitrophénol indicateur est un acide dont le K a est égal à 1,1 × 10 -4. Dans une solution à 1,0 × 10 −4 - M, il est incolore en acide et jaune en base. Calculez la plage de pH sur laquelle il passe de 10 % ionisé (incolore) à 90 % ionisé (jaune).


