14.1 : Acides et bases de Brønsted-Lowry
- Page ID
- 194079
- Identifier les acides, les bases et les paires acide-base conjuguées selon la définition de Brønsted-Lowry
- Écrire des équations pour les réactions d'ionisation acide et basique
- Utiliser la constante du produit ionique pour l'eau pour calculer les concentrations d'hydronium et d'ions hydroxyde
- Décrire le comportement acido-basique des substances amphiprotiques
Les acides et les bases sont connus depuis longtemps. Lorsque Robert Boyle les a caractérisés en 1680, il a noté que les acides dissolvent de nombreuses substances, modifient la couleur de certains colorants naturels (par exemple, ils font passer le litmus du bleu au rouge) et perdent ces propriétés caractéristiques après avoir été en contact avec des alcalis (bases). Au XVIIIe siècle, il a été reconnu que les acides avaient un goût amer, réagissaient avec le calcaire pour libérer une substance gazeuse (aujourd'hui connue sous le nom de CO 2) et interagissaient avec les alcalis pour former des substances neutres. En 1815, Humphry Davy a grandement contribué au développement du concept acide-base moderne en démontrant que l'hydrogène est le constituant essentiel des acides. À peu près à la même époque, Joseph Louis Gay-Lussac a conclu que les acides sont des substances capables de neutraliser les bases et que ces deux catégories de substances ne peuvent être définies que l'une par rapport à l'autre. L'importance de l'hydrogène a été soulignée à nouveau en 1884 lorsque Svante Arrhenius a défini un acide comme un composé qui se dissout dans l'eau pour produire des cations hydrogène (aujourd'hui reconnus comme des ions hydronium) et une base comme un composé qui se dissout dans l'eau pour produire des anions hydroxyde.
Dans un chapitre précédent sur les réactions chimiques, nous avons défini les acides et les bases comme Arrhenius l'a fait : nous avons identifié un acide comme un composé qui se dissout dans l'eau pour produire des ions hydronium (H 3 O +) et une base comme un composé qui se dissout dans l'eau pour produire des ions hydroxyde (\(\ce{OH-}\)). Cette définition n'est pas fausse ; elle est simplement limitée.
Plus tard, nous avons élargi la définition d'un acide ou d'une base en utilisant la définition plus générale proposée en 1923 par le chimiste danois Johannes Brønsted et le chimiste anglais Thomas Lowry. Leur définition est centrée sur le proton,\(\ce{H^+}\). Un proton est ce qui reste lorsqu'un atome d'hydrogène normal perd un électron.\(\ce{^1_1H}\) Un composé qui donne un proton à un autre composé est appelé acide de Brønsted-Lowry, et un composé qui accepte un proton est appelé base de Brønsted-Lowry. Une réaction acide-base est le transfert d'un proton d'un donneur de protons (acide) à un accepteur de protons (base). Dans un chapitre suivant de ce texte, nous présenterons le modèle le plus général de comportement acido-basique introduit par le chimiste américain G. N. Lewis.
Les acides peuvent être des composés tels que HCl ou H 2 SO 4, des acides organiques tels que l'acide acétique (\(\ce{CH_3COOH}\)) ou l'acide ascorbique (vitamine C), ou H 2 O. Les anions (tels que\(\ce{HSO_4^-}\)\(\ce{H_2PO_4^-}\)\(\ce{HS^-}\),, et\(\ce{HCO_3^-}\)) et les cations (tels que\(\ce{H_3O^+}\)\(\ce{NH_4^+}\), et\(\ce{[Al(H_2O)_6]^{3+}}\)) peuvent agissent également comme des acides. Les bases se répartissent dans les trois mêmes catégories. Les bases peuvent être des molécules neutres (telles que\(\ce{H_2O}\)\(\ce{NH_3}\), et\(\ce{CH_3NH_2}\)), des anions (tels que\(\ce{OH^-}\)\(\ce{HS^-}\),\(\ce{HCO_3^-}\),\(\ce{CO_3^{2−}}\),\(\ce{F^-}\), et\(\ce{PO_4^{3−}}\)) ou des cations (tels que\(\ce{[Al(H_2O)_5OH]^{2+}}\)). Les bases les plus connues sont des composés ioniques tels que\(\ce{NaOH}\) et\(\ce{Ca(OH)_2}\), qui contiennent l'ion hydroxyde,\(\ce{OH^-}\). L'ion hydroxyde de ces composés accepte un proton provenant des acides pour former de l'eau :
\[\ce{H^+ + OH^- \rightarrow H_2O} \label{14.11} \]
Nous appelons le produit qui reste après qu'un acide donne un proton la base conjuguée de l'acide. Cette espèce est une base car elle peut accepter un proton (pour reformer l'acide) :
\[\text{acid} \rightleftharpoons \text{proton} + \text{conjugate base}\label{14.12a} \]
\[\ce{HF \rightleftharpoons H^+ + F^-} \label{14.12b} \]
\[\ce{H_2SO_4 \rightleftharpoons H^+ + HSO_4^{−}}\label{14.12c} \]
\[\ce{H_2O \rightleftharpoons H^+ + OH^-}\label{14.12d} \]
\[\ce{HSO_4^- \rightleftharpoons H^+ + SO_4^{2−}}\label{14.12e} \]
\[\ce{NH_4^+ \rightleftharpoons H^+ + NH_3} \label{14.12f} \]
Nous appelons le produit obtenu lorsqu'une base accepte un proton l'acide conjugué de la base. Cette espèce est un acide car elle peut libérer un proton (et ainsi reformer la base) :
\[\text{base} + \text{proton} \rightleftharpoons \text{conjugate acid} \label{14.13a} \]
\[\ce{OH^- +H^+ \rightleftharpoons H2O}\label{14.13b} \]
\[\ce{H_2O + H^+ \rightleftharpoons H3O+}\label{14.13c} \]
\[\ce{NH_3 +H^+ \rightleftharpoons NH4+}\label{14.13d} \]
\[\ce{S^{2-} +H^+ \rightleftharpoons HS-}\label{14.13e} \]
\[\ce{CO_3^{2-} +H^+ \rightleftharpoons HCO3-}\label{14.13f} \]
\[\ce{F^- +H^+ \rightleftharpoons HF} \label{14.13g} \]
Dans ces deux ensembles d'équations, les comportements des acides en tant que donneurs de protons et des bases en tant qu'accepteurs de protons sont représentés isolément. En réalité, toutes les réactions acide-base impliquent le transfert de protons entre les acides et les bases. Par exemple, considérez la réaction acide-base qui se produit lorsque l'ammoniac est dissous dans de l'eau. Une molécule d'eau (agissant comme un acide) transfère un proton vers une molécule d'ammoniac (fonctionnant comme une base), produisant la base conjuguée de l'eau et l'acide conjugué de l'ammoniac,\(\ce{NH4+}\) :\(\ce{OH^-}\)
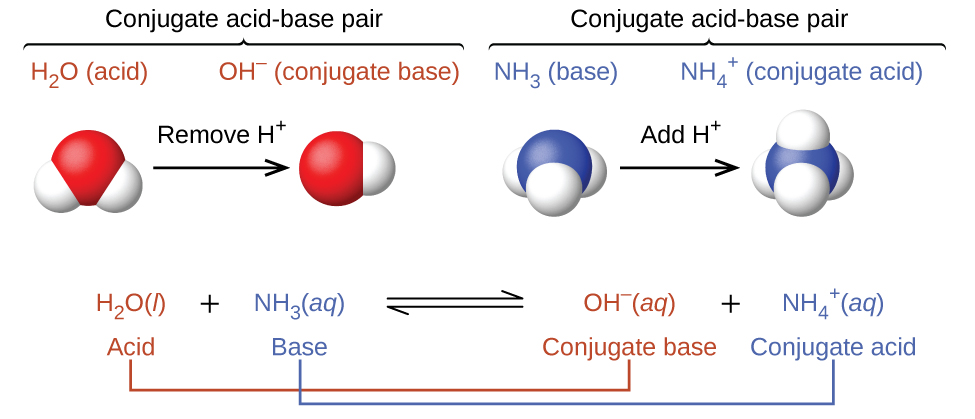
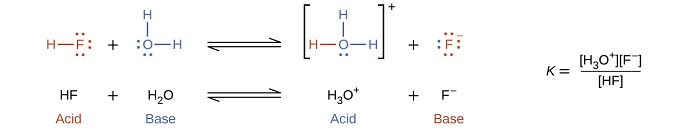
La réaction entre un acide de Brønsted-Lowry et l'eau est appelée ionisation acide. Par exemple, lorsque le fluorure d'hydrogène se dissout dans l'eau et s'ionise, les protons sont transférés des molécules de fluorure d'hydrogène aux molécules d'eau, produisant des ions hydronium et des ions fluorure :
Lorsque nous ajoutons une base à l'eau, une réaction d'ionisation des bases se produit au cours de laquelle les protons sont transférés des molécules d'eau aux molécules de base. Par exemple, l'ajout de pyridine à l'eau produit des ions hydroxyde et des ions pyridinium :
Notez que ces deux réactions d'ionisation sont représentées comme des processus d'équilibre. L'étendue relative de ces réactions d'ionisation des acides et des bases est un sujet important traité dans une section ultérieure de ce chapitre. Dans les paragraphes précédents, nous avons vu que l'eau peut fonctionner soit comme un acide soit comme une base, selon la nature du soluté qui y est dissous. En effet, dans l'eau pure ou dans toute solution aqueuse, l'eau agit à la fois comme un acide et comme une base. Une très petite fraction des molécules d'eau donne des protons à d'autres molécules d'eau pour former des ions hydronium et des ions hydroxyde :
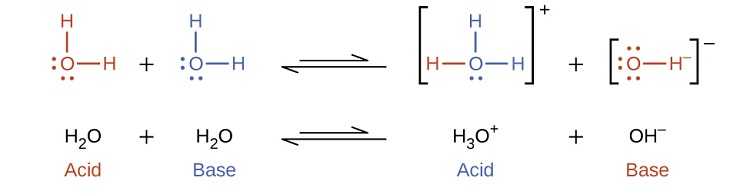
Ce type de réaction, dans lequel une substance s'ionise lorsqu'une molécule de la substance réagit avec une autre molécule de la même substance, est appelé auto-ionisation. L'eau pure subit une auto-ionisation dans une très faible mesure. Environ deux\(10^9\) molécules sur chaque molécule d'un échantillon d'eau pure sont ionisées à 25 °C. La constante d'équilibre pour l'ionisation de l'eau est appelée constante du produit ionique pour l'eau (K w) :
\[\ce{H_2O}_{(l)}+\ce{H_2O}_{(l)} \rightleftharpoons \ce{H_3O^+}_{(aq)}+\ce{OH^-}_{(aq)}\;\;\; K_\ce{w}=\ce{[H_3O^+][OH^- ]} \label{14.14} \]
La légère ionisation de l'eau pure se reflète dans la faible valeur de la constante d'équilibre ; à 25 °C, Kw a une valeur de\(1.0 \times 10^{−14}\). Le processus est endothermique, de sorte que l'étendue de l'ionisation et les concentrations d'ions hydronium et d'ions hydroxyde qui en résultent augmentent avec la température. Par exemple, à 100 °C, la valeur de\(K_\ce{w}\) est environ\(5.1 \times 10^{−13}\) 50 fois plus grande que la valeur à 25 °C.
Quelle est la concentration en ions hydronium et en ions hydroxyde dans l'eau pure à 25 °C ?
Solution
L'auto-ionisation de l'eau produit le même nombre d'ions hydronium et hydroxyde. Donc, dans de l'eau pure,\(\ce{[H_3O^+]} = \ce{[OH^- ]}\). À 25 °C :
\[K_\ce{w}=\ce{[H_3O^+][OH^- ]}=\ce{[H_3O^+]^2}=\ce{[OH^- ]^2}=1.0 \times 10^{−14} \nonumber \]
Donc :
\[\ce{[H_3O^+]}=\ce{[OH^- ]}=\sqrt{1.0 \times 10^{−14}} =1.0 \times 10^{−7}\; M \nonumber \]
La concentration en ions hydronium et la concentration en ions hydroxyde sont les mêmes, et nous trouvons que les deux sont égales\(1.0 \times 10^{−7}\; M\).
Le produit ionique de l'eau à 80 °C est\(2.4 \times 10^{−13}\). Quelles sont les concentrations d'hydronium et d'ions hydroxyde dans l'eau pure à 80 °C ?
- Réponse
-
\(\ce{[H_3O^+]} = \ce{[OH^- ]} = 4.9 \times 10^{−7}\; M\)
Il est important de comprendre que l'équilibre d'auto-ionisation de l'eau est établi dans toutes les solutions aqueuses. L'ajout d'un acide ou d'une base à l'eau ne modifiera pas la position de l'équilibre. L'exemple 14.12 montre les aspects quantitatifs de cette relation entre les concentrations d'hydronium et d'ions hydroxyde.
La proportionnalité inverse de [H 3 O +] et [OH -] Une solution de dioxyde de carbone dans l'eau a une concentration en ions hydronium de\(2.0 \times 10^{−6}\; M\). Quelle est la concentration d'ion hydroxyde à 25 °C ?
Solution
Nous connaissons la valeur de la constante du produit ionique pour l'eau à 25 °C :
\[\ce{2 H_2O}_{(l)} \rightleftharpoons \ce{H_3O^+}_{(aq)} + \ce{OH^-}_{(aq)} \nonumber \]
\[K_\ce{w}=\ce{[H3O+][OH^- ]}=1.0 \times 10^{−14} \nonumber \]
Ainsi, nous pouvons calculer la concentration d'équilibre manquante.
Le réarrangement de l'expression K w donne des résultats qui\([\ce{OH^- }]\) sont directement proportionnels à l'inverse de [H 3 O +] :
\[[\ce{OH^- }]=\dfrac{K_{\ce w}}{[\ce{H_3O^+}]}=\dfrac{1.0 \times 10^{−14}}{2.0 \times 10^{−6}}=5.0 \times 10^{−9} \nonumber \]
La concentration en ions hydroxyde dans l'eau est réduite à\(5.0 \times 10^{−9}\: M\) mesure que la concentration en ions hydrogène augmente à\(2.0 \times 10^{−6}\; M\). Cela est attendu du principe de Le Chatelier : la réaction d'auto-ionisation se déplace vers la gauche pour réduire le stress lié à l'augmentation de la concentration en ions hydronium et\(\ce{[OH^- ]}\) est réduite par rapport à celle de l'eau pure.
La vérification de ces concentrations confirme que notre arithmétique est correcte :
\[\begin{align*} K_\ce{w} &=\ce{[H_3O^+][OH^- ]} \\[4pt] &=(2.0 \times 10^{−6})(5.0 \times 10^{−9})\\[4pt] &=1.0 \times 10^{−14} \end{align*} \nonumber \]
Quelle est la concentration en ions hydronium dans une solution aqueuse dont la concentration en ions hydroxyde est de 0,001 M à 25 °C ?
- Réponse
-
\[\ce{[H3O+]} = 1 \times 10^{−11} M \nonumber \]
Espèces amphiprotiques
Comme l'eau, de nombreuses molécules et ions peuvent gagner ou perdre un proton dans les conditions appropriées. Ces espèces sont dites amphiprotiques. Un autre terme utilisé pour décrire ces espèces est amphotère, terme plus général désignant une espèce qui peut agir soit comme un acide soit comme une base selon n'importe quelle définition (et pas seulement celle de Brønsted-Lowry). Prenons l'exemple de l'ion bicarbonate, qui peut donner ou accepter un proton, comme indiqué ci-dessous :
\[\ce{HCO^-}_{3(aq)} + \ce{H_2O}_{(l)} \rightleftharpoons \ce{CO^{2-}}_{3(aq)} + \ce{H_3O^+}_{(aq)} \label{14.15a} \]
\[ \ce{HCO^-}_{3(aq)} + \ce{H_2O}_{(l)} \rightleftharpoons \ce{H_2CO}_{3(aq)} + \ce{OH^-}_{(aq)} \label{14.15b} \]
Écrivez des équations distinctes représentant la réaction de\(\ce{HSO3-}\)
- sous forme d'acide avec\(\ce{OH^-}\)
- comme base avec HI
Solution
- \(\ce{HSO3-}(aq)+ \ce{OH^-}(aq)\rightleftharpoons \ce{SO3^2-}(aq)+ \ce{H_2O}_{(l)} \)
- \(\ce{HSO3-}(aq)+\ce{HI}(aq)\rightleftharpoons \ce{H2SO3}(aq)+\ce{I-}(aq)\)
Écrivez des équations distinctes représentant la réaction de\(\ce{H2PO4-}\)
- comme base avec HBr
- sous forme d'acide avec\(\ce{OH^-}\)
- Répondez à une
-
\(\ce{H2PO4-}(aq)+\ce{HBr}(aq)\rightleftharpoons \ce{H3PO4}(aq)+\ce{Br-}(aq)\)
- Réponse b
-
\(\ce{H2PO4-}(aq)+\ce{OH^-} (aq)\rightleftharpoons \ce{HPO4^2-}(aq)+ \ce{H_2O}_{(l)} \)
Résumé
Un composé qui peut donner un proton (un ion hydrogène) à un autre composé est appelé acide de Brønsted-Lowry. Le composé qui accepte le proton est appelé base de Brønsted-Lowry. L'espèce qui subsiste après la perte d'un proton par un acide de Brønsted-Lowry est la base conjuguée de l'acide. L'espèce qui se forme lorsqu'une base de Brønsted-Lowry gagne un proton est l'acide conjugué de la base. Ainsi, une réaction acide-base se produit lorsqu'un proton est transféré d'un acide à une base, avec formation de la base conjuguée de l'acide réactif et formation de l'acide conjugué de la base réactive. Les espèces amphiprotiques peuvent agir à la fois comme donneuses et accepteuses de protons. L'eau est l'espèce amphiprotique la plus importante. Il peut former à la fois l'ion hydronium, H 3 O +, et l'ion hydroxyde,\(\ce{OH^-}\) lorsqu'il est soumis à une auto-ionisation :
\[\ce{2 H_2O}_{(l)} \rightleftharpoons \ce{H_3O^+}(aq)+\ce{OH^-} (aq) \nonumber \]
Le produit ionique de l'eau, K w, est la constante d'équilibre de la réaction d'autoionisation :
\[K_\ce{w}=\mathrm{[H_3O^+][OH^- ]=1.0 \times 10^{−14} \; at\; 25°C} \nonumber \]
Équations clés
- \[K_{\ce w} = \ce{[H3O+][OH^- ]} = 1.0 \times 10^{−14}\textrm{ (at 25 °C)} \nonumber \]
Lexique
- ionisation acide
- réaction impliquant le transfert d'un proton d'un acide à l'eau, produisant des ions hydronium et la base conjuguée de l'acide
- amphiprotique
- espèces qui peuvent gagner ou perdre un proton lors d'une réaction
- amphotère
- espèces pouvant agir soit comme un acide soit comme une base
- autoionisation
- réaction entre des espèces identiques produisant des produits ioniques ; pour l'eau, cette réaction implique le transfert de protons pour produire des ions hydronium et hydroxyde
- ionisation de base
- réaction impliquant le transfert d'un proton de l'eau vers une base, produisant des ions hydroxyde et l'acide conjugué de la base
- Acide de Brønsted-Lowry
- donneur de protons
- Base de Brønsted-Lowry
- accepteur de protons
- acide conjugué
- substance formée lorsqu'une base gagne un proton
- base conjuguée
- substance formée lorsqu'un acide perd un proton
- constante du produit ionique pour l'eau (K w)
- constante d'équilibre pour l'auto-ionisation de l'eau


