13.3 : Les équilibres changeants : le principe de Le Chatelier
- Page ID
- 194025
- Décrire les manières dont un système d'équilibre peut être sollicité
- Prédire la réponse d'un équilibre stressé à l'aide du principe de Le Chatelier
Comme nous l'avons vu dans la section précédente, les réactions se produisent dans les deux sens (les réactifs se dirigent vers les produits et les produits vont vers les réactifs). On peut dire qu'une réaction est à l'équilibre si le quotient de réaction (\(Q\)) est égal à la constante d'équilibre (K). Nous abordons ensuite ce qui se passe lorsqu'un système en équilibre est perturbé de telle sorte qu'\(Q\)il n'est plus égal à\(K\). Si un système en équilibre est soumis à une perturbation ou à une contrainte (telle qu'un changement de concentration), la position d'équilibre change. Comme ce stress affecte les concentrations des réactifs et des produits, la valeur de ne\(Q\) sera plus égale à la valeur de\(K\). Pour rétablir l'équilibre, le système se déplacera soit vers les produits (si\(Q < K\)) soit vers les réactifs (si\(Q > K\)) jusqu'à ce qu'il\(Q\) revienne à la même valeur que\(K\).
Ce processus est décrit par le principe de Le Chatelier : lorsqu'un système chimique en équilibre est perturbé, il revient à l'équilibre en neutralisant la perturbation. Comme décrit dans le paragraphe précédent, la perturbation provoque une modification\(Q\) ; la réaction se déplacera pour se rétablir\(Q = K\).
Prédiction de la direction d'une réaction réversible
Le principe du Chatelier peut être utilisé pour prédire les variations des concentrations d'équilibre lorsqu'un système en équilibre est soumis à une contrainte. Toutefois, si nous avons un mélange de réactifs et de produits qui n'ont pas encore atteint l'équilibre, les changements nécessaires pour atteindre l'équilibre peuvent ne pas être aussi évidents. Dans ce cas, nous pouvons comparer les valeurs de Q et de K pour que le système puisse prédire les changements.
Un système chimique en équilibre peut être temporairement mis hors d'équilibre en ajoutant ou en retirant un ou plusieurs réactifs ou produits. Les concentrations des réactifs et des produits subissent ensuite des modifications supplémentaires pour rétablir l'équilibre du système.
La contrainte sur le système de la figure\(\PageIndex{1}\) est la réduction de la concentration d'équilibre de SCN − (l'abaissement de la concentration de l'un des réactifs ferait en sorte que Q soit supérieur à K). En conséquence, le principe de Le Chatelier nous amène à prédire que la concentration de Fe (SCN) 2+ devrait diminuer, augmentant la concentration de SCN − à mi-chemin de sa concentration initiale, et augmentant la concentration de Fe 3 + au-dessus de sa concentration initiale concentration d'équilibre.
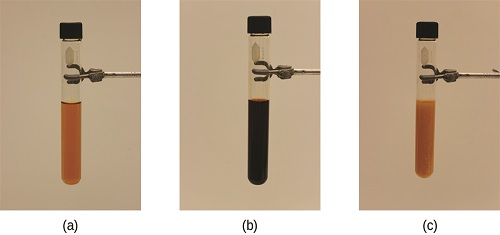
L'effet d'un changement de concentration sur un système à l'équilibre est illustré davantage par l'équilibre de cette réaction chimique :
\[\ce{H}_{2(g)}+\ce{I}_{2(g)} \rightleftharpoons \ce{2HI}_{(g)} \label{13.4.1a} \]
\[K_c=\mathrm{50.0 \; at\; 400°C} \label{13.4.1b} \]
Les valeurs numériques de cet exemple ont été déterminées expérimentalement. Un mélange de gaz à 400 °C avec\(\mathrm{[H_2] = [I_2]} = 0.221\; M\) et\(\ce{[HI]} = 1.563 \;M\) en équilibre ; pour ce mélange,\(Q_c = K_c = 50.0\). S'il\(\ce{H_2}\) est introduit dans le système si rapidement que sa concentration double avant qu'il ne commence à réagir (nouveau\(\ce{[H_2]} = 0.442\; M\)), la réaction se déplace de sorte qu'un nouvel équilibre soit atteint, auquel
- \(\ce{[H_2]} = 0.374\; M\),
- \(\ce{[I_2]} = 0.153\; M\), et
- \(\ce{[HI]} = 1.692\; M\).
Cela donne :
\[Q_c=\mathrm{\dfrac{[HI]^2}{[H_2][I_2]}}=\dfrac{(1.692)^2}{(0.374)(0.153)}=50.0=K_c \label{13.4.2} \]
Nous avons mis l'accent sur ce système en introduisant des\(\ce{H_2}\). Le stress est soulagé lorsque la réaction se déplace vers la droite, consommant une partie (mais pas la totalité) de l'excès\(\ce{H_2}\), réduisant la quantité de produits non combinés\(\ce{I_2}\) et formant des éléments supplémentaires\(\ce{HI}\).
Effet du changement de pression sur l'équilibre
Parfois, nous pouvons modifier la position d'équilibre en modifiant la pression d'un système. Cependant, les variations de pression n'ont un effet mesurable que dans les systèmes dans lesquels des gaz sont impliqués, et uniquement lorsque la réaction chimique entraîne une modification du nombre total de molécules de gaz dans le système. Un moyen facile de reconnaître un tel système est de rechercher différents nombres de moles de gaz du côté réactif et du côté produit de l'équilibre. Lors de l'évaluation de la pression (ainsi que des facteurs connexes tels que le volume), il est important de se rappeler que les constantes d'équilibre sont définies en ce qui concerne la concentration (pour\(K_c\)) ou la pression partielle (pour\(K_P\)). Certaines modifications de la pression totale, comme l'ajout d'un gaz inerte ne faisant pas partie de l'équilibre, modifieront la pression totale mais pas les pressions partielles des gaz dans l'expression de la constante d'équilibre. Ainsi, l'ajout d'un gaz non impliqué dans l'équilibre ne perturbera pas l'équilibre.
Lorsque nous augmentons la pression d'un système gazeux à l'équilibre, soit en diminuant le volume du système, soit en ajoutant plus d'un des composants du mélange d'équilibre, nous introduisons une contrainte en augmentant les pressions partielles d'un ou de plusieurs composants. Conformément au principe du Chatelier, un changement d'équilibre réduisant le nombre total de molécules par unité de volume sera favorisé car cela soulage le stress. La réaction inverse serait favorisée par une diminution de la pression.
Réfléchissez à ce qui se passe lorsque nous augmentons la pression sur un système dans lequel\(\ce{NO}\)\(\ce{O_2}\), et\(\ce{NO_2}\) sont en équilibre :
\[\ce{2NO (g) + O2(g) \rightleftharpoons 2NO2(g)} \label{13.4.3} \]
La formation de quantités supplémentaires de\(\ce{NO2}\) diminue le nombre total de molécules dans le système car à chaque fois, deux molécules\(\ce{NO_2}\) se forment, un total de trois molécules de\(\ce{NO}\) et\(\ce{O_2}\) sont consommées. Cela réduit la pression totale exercée par le système et réduit, mais ne soulage pas complètement, la contrainte liée à l'augmentation de la pression. En revanche, une diminution de la pression sur le système favorise la décomposition\(\ce{NO_2}\) en\(\ce{NO}\) et\(\ce{O_2}\), ce qui tend à rétablir la pression.
Maintenant, considérez cette réaction :
\[\ce{N2 (g) + O2 (g) \rightleftharpoons 2NO (g)} \label{13.4.4} \]
Comme il n'y a aucun changement du nombre total de molécules dans le système pendant la réaction, un changement de pression ne favorise ni la formation ni la décomposition du monoxyde d'azote gazeux.
Effet du changement de température sur l'équilibre
La modification de la concentration ou de la pression perturbe l'équilibre car le quotient de réaction s'éloigne de la valeur d'équilibre. La modification de la température d'un système à l'équilibre a un effet différent : un changement de température modifie en fait la valeur de la constante d'équilibre. Cependant, nous pouvons prédire de manière qualitative l'effet du changement de température en le traitant comme une contrainte sur le système et en appliquant le principe de Le Chatelier.
Lorsque l'hydrogène réagit avec l'iode gazeux, de la chaleur se dégage.
\[\ce{H2(g) + I2(g) \rightleftharpoons 2HI(g) } \;\;\ ΔH=\mathrm{−9.4\;kJ\;(exothermic)} \label{13.4.5} \]
Comme cette réaction est exothermique, on peut l'écrire avec de la chaleur en tant que produit.
\[\ce{H2(g) + I2(g) \rightleftharpoons 2HI(g)} + \text{heat} \label{13.4.6} \]
L'augmentation de la température de la réaction augmente l'énergie interne du système. Ainsi, l'augmentation de la température a pour effet d'augmenter la quantité d'un des produits de cette réaction. La réaction se déplace vers la gauche pour soulager le stress, et il y a une augmentation de la concentration de\(\ce{H2}\)\(\ce{I2}\) et une réduction de la concentration de\(\ce{HI}\). L'abaissement de la température de ce système réduit la quantité d'énergie présente, favorise la production de chaleur et favorise la formation d'iodure d'hydrogène.
Lorsque nous changeons la température d'un système à l'équilibre, la constante d'équilibre de la réaction change. L'abaissement de la température dans le\(\ce{HI}\) système augmente la constante d'équilibre : Au nouvel équilibre, la concentration de\(\ce{HI}\) a augmenté et les concentrations de\(\ce{H2}\) et\(\ce{I2}\) ont diminué. L'élévation de la température fait baisser la valeur de la constante d'équilibre, de 67,5 à 357 °C à 50,0 à 400 °C.
La température affecte l'équilibre entre\(\ce{NO_2}\) et\(\ce{N_2O_4}\) dans cette réaction
\[\ce{N2O4(g) \rightleftharpoons 2NO2(g)}\;\;\; ΔH=\mathrm{57.20\; kJ} \label{13.4.7} \]
La valeur positive de ΔH nous indique que la réaction est endothermique et peut être écrite
\[\text{heat}+\ce{N2O4(g) \rightleftharpoons 2NO2(g)} \label{13.4.8} \]
À des températures plus élevées, le mélange de gaz a une couleur brun foncé, ce qui indique une quantité significative de\(\ce{NO_2}\) molécules brunes. Si, toutefois, nous exerçons une contrainte sur le système en refroidissant le mélange (en retirant de l'énergie), l'équilibre se déplace vers la gauche pour fournir une partie de l'énergie perdue par le refroidissement. La concentration d'incolore\(\ce{N_2O_4}\) augmente et la concentration de brun\(\ce{NO_2}\) diminue, provoquant une décoloration de la couleur brune.
Les catalyseurs n'affectent pas l'équilibre
Comme nous l'avons appris au cours de notre étude de la cinétique, un catalyseur peut accélérer la vitesse d'une réaction. Bien que cette augmentation de la vitesse de réaction puisse permettre à un système d'atteindre l'équilibre plus rapidement (en accélérant les réactions directe et inverse), un catalyseur n'a aucun effet sur la valeur d'une constante d'équilibre ni sur les concentrations d'équilibre.
L'interaction entre les changements de concentration ou de pression, de température et l'absence d'influence d'un catalyseur sur l'équilibre chimique est illustrée dans la synthèse industrielle de l'ammoniac à partir de l'azote et de l'hydrogène selon l'équation
\[\ce{N2(g) + 3H2(g) \rightleftharpoons 2NH3(g)} \label{13.4.9} \]
Une grande quantité d'ammoniac est produite par cette réaction. Chaque année, l'ammoniac figure parmi les 10 principaux produits chimiques fabriqués en masse dans le monde. Environ 2 milliards de livres sont fabriquées aux États-Unis chaque année. L'ammoniac joue un rôle vital dans l'économie mondiale. Il est utilisé dans la production d'engrais et constitue en soi un engrais important pour la croissance du maïs, du coton et d'autres cultures. De grandes quantités d'ammoniac sont converties en acide nitrique, qui joue un rôle important dans la production d'engrais, d'explosifs, de plastiques, de colorants et de fibres, et est également utilisé dans l'industrie sidérurgique.
Haber est né à Breslau, en Prusse (aujourd'hui Wroclaw, Pologne) en décembre 1868. Il a ensuite étudié la chimie et, pendant ses études à l'université de Karlsruhe, il a développé ce que l'on appellera plus tard le procédé Haber : la formation catalytique d'ammoniac à partir d'hydrogène et d'azote atmosphérique à des températures et des pressions élevées.

Pour ce travail, Haber a reçu le prix Nobel de chimie 1918 pour la synthèse de l'ammoniac à partir de ses éléments. Le procédé Haber a été une aubaine pour l'agriculture, car il a permis à la production d'engrais de ne plus dépendre de matières premières extraites telles que le nitrate de sodium.
\[\ce{N2(g) + 3H2(g) \rightleftharpoons 2NH3(g)} \nonumber \]
Actuellement, la production annuelle d'engrais azotés synthétiques dépasse les 100 millions de tonnes et la production d'engrais synthétiques a fait passer le nombre d'humains que les terres arables peuvent nourrir, passant de 1,9 personne par hectare en 1908 à 4,3 en 2008. La disponibilité de l'azote est un important facteur limitant la croissance des plantes. Bien qu'il représente 78 % de l'air, l'azote diatomique (\(\ce{N_2}\)) n'est pas disponible sur le plan nutritionnel en raison de l'incroyable stabilité de la triple liaison azote-azote. Pour que les plantes puissent utiliser l'azote atmosphérique, celui-ci doit être converti en une forme plus biodisponible (cette conversion est appelée fixation de l'azote).
Outre ses travaux dans le domaine de la production d'ammoniac, Haber est également considéré dans l'histoire comme l'un des pères de la guerre chimique. Pendant la Première Guerre mondiale, il a joué un rôle majeur dans le développement de gaz toxiques utilisés pour la guerre de tranchées. À propos de son rôle dans ces développements, Haber a déclaré : « En temps de paix, un scientifique appartient au monde, mais en temps de guerre, il appartient à son pays ». 1 Haber a défendu l'utilisation de la guerre au gaz contre les accusations selon lesquelles elle était inhumaine, affirmant que la mort était la mort, quel que soit le moyen utilisé. Il est un exemple des dilemmes éthiques auxquels sont confrontés les scientifiques en temps de guerre et de la nature à double tranchant de l'épée de la science.
Comme Haber, les produits à base d'ammoniaque peuvent présenter de multiples facettes. Outre leur valeur pour l'agriculture, les composés azotés peuvent également être utilisés à des fins destructrices. Le nitrate d'ammonium a également été utilisé dans des explosifs, y compris des engins explosifs improvisés. Le nitrate d'ammonium était l'un des composants de la bombe utilisée lors de l'attaque du bâtiment fédéral Alfred P. Murrah, dans le centre-ville d'Oklahoma City, le 19 avril 1995.
On sait depuis longtemps que l'azote et l'hydrogène réagissent pour former de l'ammoniac. Cependant, il n'est devenu possible de fabriquer de l'ammoniac en quantités utiles par la réaction de l'azote et de l'hydrogène qu'au début du 20e siècle, après avoir compris les facteurs qui influencent son équilibre.
Pour être pratique, un procédé industriel doit donner un rendement élevé en produit relativement rapidement. L'un des moyens d'augmenter le rendement en ammoniac consiste à augmenter la pression sur le système dans lequel N 2, H 2 et NH 3 sont à l'équilibre ou arrivent à l'équilibre.
\[\ce{N2(g) + 3H2(g) \rightleftharpoons 2NH3(g)} \label{13.4.10} \]
La formation de quantités supplémentaires d'ammoniac réduit la pression totale exercée par le système et réduit quelque peu la contrainte liée à la pression accrue.
Bien que l'augmentation de la pression d'un mélange de N 2, de H 2 et de NH 3 augmente le rendement en ammoniac, à basse température, le taux de formation d'ammoniac est lent. À température ambiante, par exemple, la réaction est si lente que si nous préparions un mélange de N 2 et de H 2, aucune quantité détectable d'ammoniac ne se formerait au cours de notre vie. La formation d'ammoniac à partir de l'hydrogène et de l'azote est un processus exothermique :
\[\ce{N2(g) + 3H2(g) \rightarrow 2NH3(g)} \;\;\; ΔH=\mathrm{−92.2\; kJ} \label{13.4.11} \]
Ainsi, l'augmentation de la température pour augmenter le débit diminue le rendement. Si nous abaissons la température pour modifier l'équilibre et favoriser la formation d'une plus grande quantité d'ammoniac, l'équilibre est atteint plus lentement en raison de la forte diminution de la vitesse de réaction avec la baisse de la température.
Une partie de la vitesse de formation perdue en opérant à des températures plus basses peut être récupérée à l'aide d'un catalyseur. L'effet net du catalyseur sur la réaction est de faire en sorte que l'équilibre soit atteint plus rapidement. Dans la production commerciale d'ammoniac, des conditions d'environ 500 °C, 150 à 900 atm et la présence d'un catalyseur sont utilisées pour obtenir le meilleur compromis entre le débit, le rendement et le coût de l'équipement nécessaire pour produire et contenir des gaz à haute pression à des températures élevées (Figure\(\PageIndex{2}\)).
Résumé
Les systèmes à l'équilibre peuvent être perturbés par des changements de température, de concentration et, dans certains cas, de volume et de pression ; les changements de volume et de pression perturberont l'équilibre si le nombre de moles de gaz est différent du côté réactif et du côté produit de la réaction. La réponse du système à ces perturbations est décrite par le principe de Le Chatelier : le système réagira de manière à neutraliser la perturbation. Les modifications apportées au système n'entraînent pas toutes une perturbation de l'équilibre. L'ajout d'un catalyseur modifie la vitesse des réactions mais ne modifie pas l'équilibre, et un changement de pression ou de volume ne perturbera pas de manière significative les systèmes dépourvus de gaz ou contenant un nombre égal de moles de gaz du côté du réactif et du côté du produit.
| perturbation | Changement observé à mesure que l'équilibre est rétabli | Direction du changement | Effet sur K |
|---|---|---|---|
| réactif ajouté | le réactif ajouté est partiellement consommé | vers les produits | aucune |
| produit ajouté | le produit ajouté est partiellement consommé | vers des réactifs | aucune |
| diminution du volume/augmentation de la pression du gaz | la pression diminue | vers le côté contenant moins de moles de gaz | aucune |
| augmentation du volume/diminution de la pression du gaz | la pression augmente | vers le côté où il y a plus de moles de gaz | aucune |
| augmentation de la température | la chaleur est absorbée | vers des produits pour l'endothermie, vers des réactifs pour l'exothermie | changements |
| diminution de la température | de la chaleur est dégagée | vers des réactifs pour l'endothermie, vers des produits pour l'exothermie | changements |
Notes
- Herrlich, P. « La responsabilité du scientifique : que peut nous apprendre l'histoire sur la manière dont les scientifiques doivent gérer les recherches susceptibles de nuire ? » Rapports EMBO 14 (2013) : 759 à 764.
Lexique
- Le principe du Chatelier
- lorsqu'un système chimique en équilibre est perturbé, il revient à l'équilibre en neutralisant la perturbation
- position d'équilibre
- concentrations ou pressions partielles des composants d'une réaction à l'équilibre (couramment utilisées pour décrire les conditions avant une perturbation)
- stress
- modification des conditions d'une réaction susceptible de modifier l'équilibre


