9.1 : Pression de gaz
- Page ID
- 194068
- Définissez la propriété de pression
- Définir et convertir les unités de mesure de pression
- Décrire le fonctionnement des outils courants pour mesurer la pression du gaz
- Calculer la pression à partir des données du man
L'atmosphère de la Terre exerce une pression, comme tout autre gaz. Bien que nous ne remarquions normalement pas la pression atmosphérique, nous sommes sensibles aux variations de pression, par exemple lorsque vos oreilles « éclatent » lors du décollage et de l'atterrissage en vol, ou lorsque vous plongez sous l'eau. La pression du gaz est provoquée par la force exercée par les molécules de gaz qui entrent en collision avec les surfaces des objets (Figure\(\PageIndex{1}\)). Bien que la force de chaque collision soit très faible, toute surface d'une surface appréciable subit un grand nombre de collisions en peu de temps, ce qui peut entraîner une pression élevée. En fait, la pression d'air normale est suffisamment forte pour écraser un récipient métallique lorsqu'elle n'est pas équilibrée par une pression égale provenant de l'intérieur du récipient.
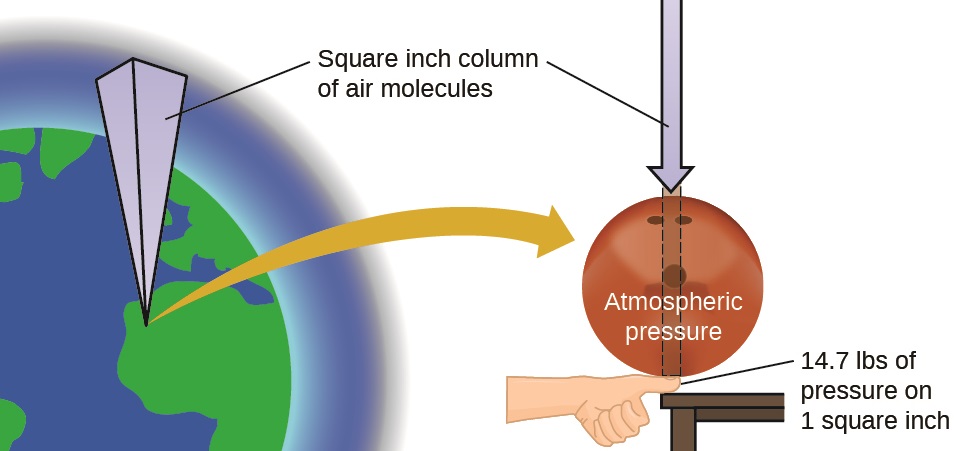
La pression atmosphérique est causée par le poids de la colonne de molécules d'air présentes dans l'atmosphère au-dessus d'un objet, tel que le wagon-citerne. Au niveau de la mer, cette pression est à peu près la même que celle exercée par un éléphant d'Afrique adulte debout sur un paillasson, ou par une boule de bowling typique posée sur votre miniature. Ces quantités peuvent sembler énormes, et elles le sont, mais la vie sur Terre a évolué sous une telle pression atmosphérique. Si vous posez réellement une boule de bowling sur votre miniature, la pression ressentie est deux fois plus forte que la pression habituelle et la sensation est désagréable.

Une illustration spectaculaire de la pression atmosphérique est fournie dans cette brève vidéo, qui montre un wagon-citerne implosant lorsque sa pression interne diminue.
La pression est définie comme la force exercée sur une zone donnée :
\[P=\dfrac{F}{A} \label{9.2.1} \]
Comme la pression est directement proportionnelle à la force et inversement proportionnelle à la surface (Équation \ ref {9.2.1}), la pression peut être augmentée soit en augmentant la quantité de force, soit en diminuant la surface sur laquelle elle est appliquée. En conséquence, la pression peut être diminuée en diminuant la force ou en augmentant la surface.
Appliquons la définition de la pression (équation \ ref {9.2.1}) pour déterminer laquelle serait la plus susceptible de tomber à travers la glace mince de la Figure\(\PageIndex{2}\). ... l'éléphant ou le patineur artistique ?

Un grand éléphant d'Afrique peut peser 7 tonnes, soutenu sur quatre pieds, chacun ayant un diamètre d'environ 1,5 pied (surface au sol de 250 pieds sur 2), de sorte que la pression exercée par chaque pied est d'environ 14 lb/po2 :
\[\mathrm{pressure\: per\: elephant\: foot=14,000\dfrac{lb}{elephant}×\dfrac{1\: elephant}{4\: feet}×\dfrac{1\: foot}{250\:in^2}=14\:lb/in^2} \label{9.2.2} \]
Le patineur artistique pèse environ 120 livres, soutenu par deux lames de patin, chacune ayant une surface d'environ 2 en 2, de sorte que la pression exercée par chaque lame est d'environ 30 lb/po2 :
\[\mathrm{pressure\: per\: skate\: blade=120\dfrac{lb}{skater}×\dfrac{1\: skater}{2\: blades}×\dfrac{1\: blade}{2\:in^2}=30\:lb/in^2} \label{9.2.3} \]
Même si l'éléphant est plus de cent fois plus lourd que le patineur, il exerce moins de la moitié de la pression et serait donc moins susceptible de tomber sur la glace mince. Par contre, si la patineuse retire ses patins et se tient pieds nus (ou avec des chaussures normales) sur la glace, la plus grande surface sur laquelle son poids est appliqué réduit considérablement la pression exercée :
\[\mathrm{pressure\: per\: human\: foot=120\dfrac{lb}{skater}×\dfrac{1\: skater}{2\: feet}×\dfrac{1\: foot}{30\:in^2}=2\:lb/in^2} \label{9.2.4} \]
L'unité de pression SI est le pascal (Pa), avec 1 Pa = 1 N/m 2, où N est le newton, une unité de force définie comme 1 kg m/s 2. Un pascal correspond à une faible pression ; dans de nombreux cas, il est plus pratique d'utiliser des unités de kilopascal (1 kPa = 1 000 Pa) ou de bar (1 bar = 100 000 Pa). Aux États-Unis, la pression est souvent mesurée en livres de force sur une surface d'un pouce carré (livres par pouce carré (psi), par exemple, dans les pneus de voiture. La pression peut également être mesurée à l'aide de l'unité d'atmosphère (atm), qui représentait à l'origine la pression atmosphérique moyenne au niveau de la mer à la latitude approximative de Paris (45°). Le tableau\(\PageIndex{1}\) fournit des informations sur ces unités et quelques autres unités courantes pour les mesures de pression
| Nom d'unité et abréviation | Définition ou relation avec une autre unité | Commentaire |
|---|---|---|
| pascal (Pennsylvanie) | 1 Pa = 1 N/m 2 | unité IUPAC recommandée |
| kilopascal (kPa) | 1 kPa = 1 000 Pa | |
| livres par pouce carré (psi) | la pression atmosphérique au niveau de la mer est de ~14.7 psi | |
| atmosphère (atm) | 1 atm = 101 325 Pa | la pression atmosphérique au niveau de la mer est d'environ 1 atm |
| bar (bar, ou b) | 1 bar = 100 000 Pa (exactement) | couramment utilisé en météorologie |
| millibar (mbar ou mb) | 1 000 mbar = 1 bar | |
| pouces de mercure (po. Hg) | 1 po Hg = 3386 Pa | utilisé par l'industrie aéronautique, également pour certains bulletins météorologiques |
| torr | \(\mathrm{1\: torr=\dfrac{1}{760}\:atm}\) | nommé d'après Evangelista Torricelli, inventrice du baromètre |
| millimètres de mercure (mm Hg) | 1 mm Hg ~1 tore |
Le service météorologique national des États-Unis indique une pression en pouces de mercure et en millibars. Convertissez une pression de 29,2 po. Hg dans :
- torr
- guichet automatique
- kPa
- mbar
Solution
Il s'agit d'un problème de conversion d'unités. Les relations entre les différentes unités de pression sont données dans le tableau 9.2.1.
- \(\mathrm{29.2\cancel{in\: Hg}×\dfrac{25.4\cancel{mm}}{1\cancel{in}} ×\dfrac{1\: torr}{1\cancel{mm\: Hg}} =742\: torr}\)
- \(\mathrm{742\cancel{torr}×\dfrac{1\: atm}{760\cancel{torr}}=0.976\: atm}\)
- \(\mathrm{742\cancel{torr}×\dfrac{101.325\: kPa}{760\cancel{torr}}=98.9\: kPa}\)
- \(\mathrm{98.9\cancel{kPa}×\dfrac{1000\cancel{Pa}}{1\cancel{kPa}} \times \dfrac{1\cancel{bar}}{100,000\cancel{Pa}} \times\dfrac{1000\: mbar}{1\cancel{bar}}=989\: mbar}\)
La pression barométrique typique à Kansas City est de 740 torr. Quelle est cette pression dans les atmosphères, en millimètres de mercure, en kilopascals et en bars ?
- Réponse
-
0,974 atm ; 740 mm de mercure ; 98,7 kPa ; 0,987 bar
Nous pouvons mesurer la pression atmosphérique, la force exercée par l'atmosphère à la surface de la Terre, à l'aide d'un baromètre (Figure\(\PageIndex{3}\)). Un baromètre est un tube de verre fermé à une extrémité, rempli d'un liquide non volatil tel que le mercure, puis inversé et immergé dans un récipient contenant ce liquide. L'atmosphère exerce une pression sur le liquide à l'extérieur du tube, la colonne de liquide exerce une pression à l'intérieur du tube et la pression à la surface du liquide est la même à l'intérieur et à l'extérieur du tube. La hauteur du liquide dans le tube est donc proportionnelle à la pression exercée par l'atmosphère.
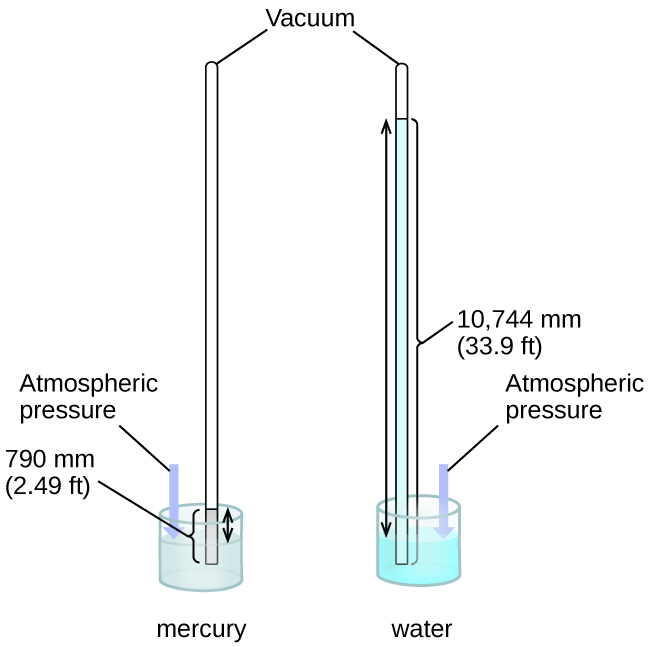
Si le liquide est de l'eau, la pression atmosphérique normale supportera une colonne d'eau de plus de 10 mètres de haut, ce qui est peu pratique pour réaliser (et lire) un baromètre. Comme le mercure (Hg) est environ 13,6 fois plus dense que l'eau, il suffit qu'un baromètre à mercure soit\(\dfrac{1}{13.6}\) aussi haut qu'un baromètre à eau, soit une taille plus adaptée. La pression atmosphérique standard de 1 atm au niveau de la mer (101 325 Pa) correspond à une colonne de mercure d'environ 760 mm (29,92 pouces) de haut. Le torr devait à l'origine être une unité égale à un millimètre de mercure, mais il ne correspond plus exactement. La pression exercée par un fluide en raison de la gravité est connue sous le nom de pression hydrostatique, p :
\[p=hρg \label{9.2.5} \]
où
- \(h\)est la hauteur du fluide,
- \(ρ\)est la densité du fluide, et
- \(g\)est une accélération due à la gravité.
Indiquer le calcul à l'appui de l'affirmation selon laquelle la pression atmosphérique près du niveau de la mer correspond à la pression exercée par une colonne de mercure d'environ 760 mm de haut. La densité du mercure =\(13.6 \,g/cm^3\).
Solution
La pression hydrostatique est donnée par l'équation \ ref {9.2.5}\(h = 760 \,mm\), avec\(ρ = 13.6\, g/cm^3\), et\(g = 9.81 \,m/s^2\). En insérant ces valeurs dans l'équation \ ref {9.2.5} et en effectuant les conversions d'unités nécessaires, nous obtiendrons la valeur que nous recherchons. (Remarque : nous nous attendons à trouver une pression d'environ 101 325 Pa :)
\[\mathrm{101,325\:\mathit{N}/m^2=101,325\:\dfrac{kg·m/s^2}{m^2}=101,325\:\dfrac{kg}{m·s^2}} \nonumber \]
\ [\ begin {align*}
p& \ mathrm {= \ left (760 \ : mm× \ dfrac {1 \ : m} {1000 \ : mm} \ right) × \ left (\ dfrac {13,6 \ : g} {1 \ :cm^3} × \ dfrac {1 \ : kg} {1000 \ : g} × \ dfrac {(100 \ : cm) ^3} {(1 \ : m) ^3} \ droite) × \ gauche (\ dfrac {9,81 \ : m} {1 \ :s^2} \ droite)} \ \ [4 points]
& \ mathrm {=( 0,760 \ : m) (13 600 \ :kg/m^3) (9,81 \ :m/s^2) =1. 01 \ fois 10^5 \ :kg/ms^2 = 1,01 × 10^5 \ mathit {N} /m^2} \\[4pt] & \mathrm{=1.01×10^5\:Pa} \end {align*} \nonumber \]
Calculez la hauteur d'une colonne d'eau à 25 °C qui correspond à la pression atmosphérique normale. La densité de l'eau à cette température est de 1,0 g/cm 3.
- Réponse
-
10,3 m
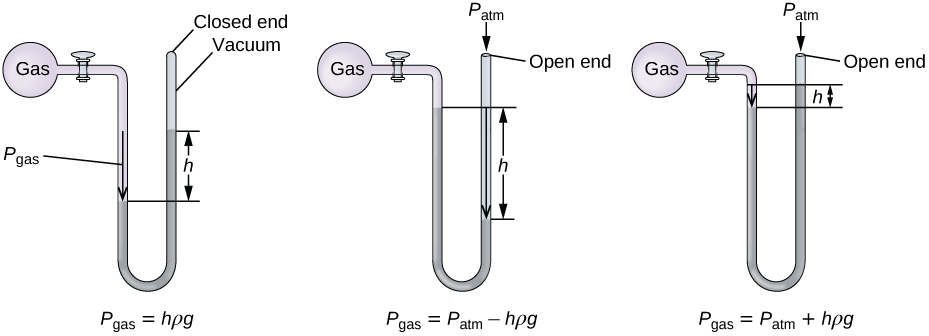
Un manomètre est un appareil similaire à un baromètre qui peut être utilisé pour mesurer la pression d'un gaz emprisonné dans un récipient. Un manomètre à extrémité fermée est un tube en forme de U avec un bras fermé, un bras qui se connecte au gaz à mesurer et un liquide non volatil (généralement du mercure) entre les deux. Comme pour un baromètre, la distance entre les niveaux de liquide dans les deux bras du tube (h sur le schéma) est proportionnelle à la pression du gaz dans le récipient. Un manomètre à extrémité ouverte (Figure\(\PageIndex{3}\)) est identique à un manomètre à extrémité fermée, mais l'un de ses bras est ouvert sur l'atmosphère. Dans ce cas, la distance entre les niveaux de liquide correspond à la différence de pression entre le gaz contenu dans le récipient et l'atmosphère.
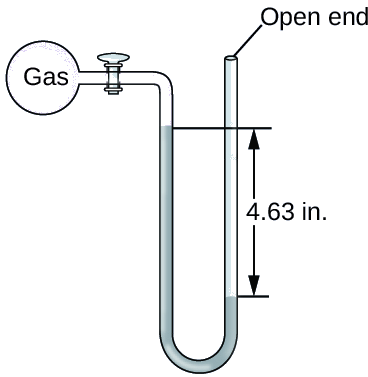
La pression d'un échantillon de gaz est mesurée au niveau de la mer à l'aide d'un manomètre à extrémité ouverte au mercure, comme indiqué ci-dessous. Déterminez la pression du gaz dans :
- mm Hg
- guichet automatique
- kPa
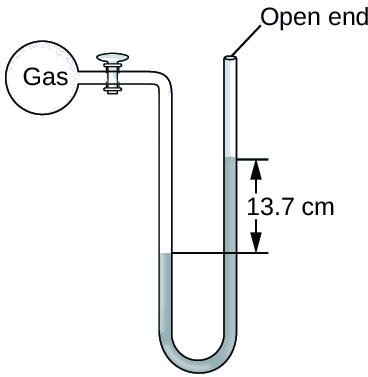
Solution
La pression du gaz est égale à la pression hydrostatique due à une colonne de mercure d'une hauteur de 13,7 cm plus la pression de l'atmosphère au niveau de la mer. (La pression sur la ligne horizontale inférieure est égale des deux côtés du tube. La pression sur la gauche est due au gaz et la pression sur la droite est due à 13,7 cm de mercure plus la pression atmosphérique.)
- En mm Hg, c'est : 137 mm Hg + 760 mm Hg = 897 mm Hg
- \(\mathrm{897\cancel{mm Hg}×\dfrac{1\: atm}{760\cancel{mm Hg}}=1.18\: atm}\)
- \(\mathrm{1.18\cancel{atm}×\dfrac{101.325\: kPa}{1\cancel{atm}}=1.20×10^2\:kPa}\)
La pression d'un échantillon de gaz est mesurée au niveau de la mer à l'aide d'un manomètre à extrémité ouverte au mercure, comme indiqué ci-dessous. Déterminez la pression du gaz dans :
- mm Hg
- guichet automatique
- kPa
Répondez à une
-
642 mm Hg
- Réponse b
-
0,845 atm
- Réponse c
-
85,6 kPa
La pression artérielle est mesurée à l'aide d'un appareil appelé sphygmomanomètre (sphygmos grec = « pouls »). Il se compose d'un brassard gonflable pour limiter la circulation sanguine, d'un manomètre pour mesurer la pression et d'une méthode permettant de déterminer quand la circulation sanguine commence et quand elle est entravée (Figure\(\PageIndex{5}\)). Depuis son invention en 1881, il s'agit d'un dispositif médical essentiel. Il existe de nombreux types de sphygmomanomètres : les sphygmomanomètres manuels qui nécessitent un stéthoscope et sont utilisés par les professionnels de la santé ; les appareils au mercure, utilisés lorsque la précision est la plus élevée ; les appareils mécaniques moins précis ; et les appareils numériques qui peuvent être utilisés avec peu de formation mais qui ont des limites. Lorsque vous utilisez un sphygmomanomètre, le brassard est placé autour de la partie supérieure du bras et gonflé jusqu'à ce que le flux sanguin soit complètement bloqué, puis relâché lentement. Lorsque le cœur bat, le sang introduit dans les artères provoque une augmentation de la pression. Cette augmentation de pression à partir de laquelle le flux sanguin commence est la pression systolique, c'est-à-dire la pression maximale du cycle cardiaque. Lorsque la pression du brassard est égale à la pression systolique artérielle, le sang s'écoule au-delà du brassard, créant des sons audibles qui peuvent être entendus à l'aide d'un stéthoscope. Cela est suivi d'une diminution de la pression lorsque les ventricules du cœur se préparent à un nouveau battement. À mesure que la pression du brassard continue de diminuer, le son n'est plus entendu ; il s'agit de la pression diastolique, la pression la plus basse (phase de repos) du cycle cardiaque. Les unités de pression artérielle d'un sphygmomanomètre sont exprimées en millimètres de mercure (mm Hg).

Météorologie, climatologie et sciences de l'atmosphère
À travers les âges, les gens ont observé les nuages, les vents et les précipitations, en essayant de discerner les tendances et de faire des prédictions : quand il est préférable de planter et de récolter ; s'il est sûr de partir en mer ; et bien plus encore. Nous sommes aujourd'hui confrontés à des défis complexes liés au climat et à l'atmosphère qui auront un impact majeur sur notre civilisation et notre écosystème. Plusieurs disciplines scientifiques utilisent des principes chimiques pour nous aider à mieux comprendre la météo, l'atmosphère et le climat. Il s'agit de la météorologie, de la climatologie et des sciences de l'atmosphère. La météorologie est l'étude de l'atmosphère, des phénomènes atmosphériques et des effets atmosphériques sur le climat de la Terre. Les météorologues cherchent à comprendre et à prévoir les conditions météorologiques à court terme, ce qui peut sauver des vies et profiter à l'économie. Les prévisions météorologiques (Figure\(\PageIndex{5}\)) sont le résultat de milliers de mesures de pression atmosphérique, de température, etc., qui sont compilées, modélisées et analysées dans des centres météorologiques du monde entier.
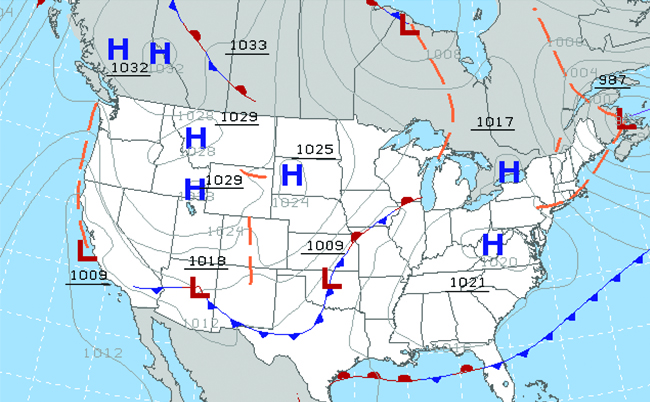
En termes de conditions météorologiques, les systèmes de basse pression se produisent lorsque la pression atmosphérique à la surface de la Terre est inférieure à celle de l'environnement environnant : l'air humide monte et se condense, produisant des nuages. Le mouvement de l'humidité et de l'air sur différents fronts météorologiques est à l'origine de la plupart des événements météorologiques.
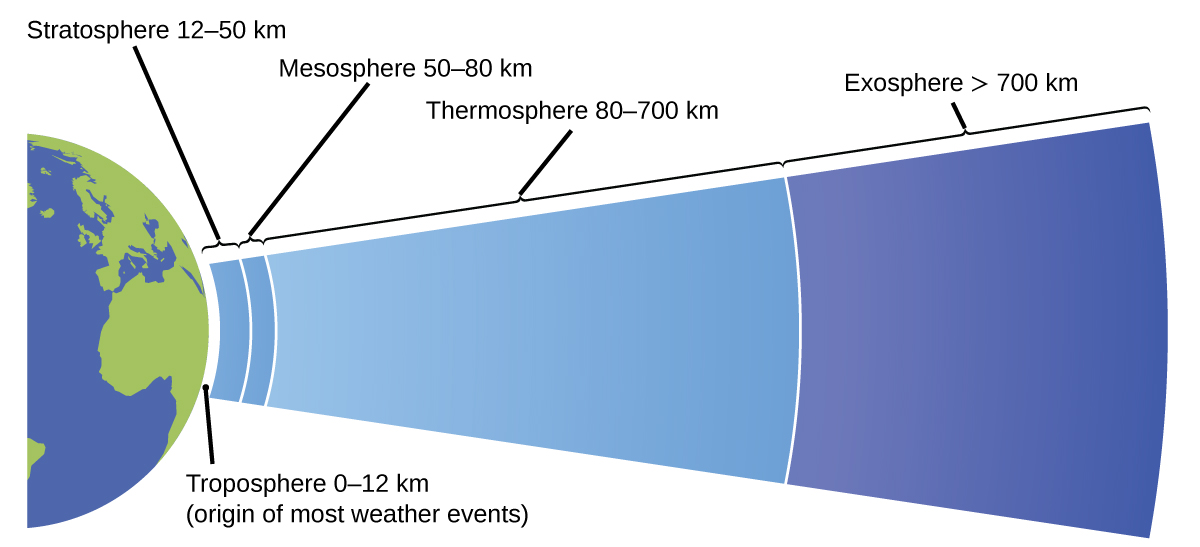
L'atmosphère est la couche gazeuse qui entoure une planète. L'atmosphère de la Terre, d'une épaisseur d'environ 100 à 125 km, est composée d'environ 78,1 % d'azote et 21,0 % d'oxygène, et peut être subdivisée dans les régions illustrées à la figure\(\PageIndex{7}\) : l'exosphère (la plus éloignée de la Terre, > 700 km au-dessus du niveau de la mer), la thermosphère (80 à 700 km), la mésosphère (50 à 80 km), la stratosphère (deuxième niveau le plus bas de notre atmosphère, de 12 à 50 km au-dessus du niveau de la mer) et la troposphère (jusqu'à 12 km au-dessus du niveau de la mer, soit environ 80 % de la masse de l'atmosphère terrestre et la couche d'origine de la plupart des événements météorologiques). À mesure que vous montez dans la troposphère, la densité et la température de l'air diminuent.
La climatologie est l'étude du climat, des conditions météorologiques moyennes sur de longues périodes, à l'aide de données atmosphériques. Cependant, les climatologues étudient les modèles et les effets qui se produisent sur des décennies, des siècles et des millénaires, plutôt que sur des périodes plus courtes de plusieurs heures, jours et semaines, comme les météorologues. La science de l'atmosphère est un domaine encore plus vaste, combinant la météorologie, la climatologie et d'autres disciplines scientifiques qui étudient l'atmosphère.
Résumé
Les gaz exercent une pression, qui est une force par unité de surface. La pression d'un gaz peut être exprimée dans l'unité SI de pascal ou de kilopascal, ainsi que dans de nombreuses autres unités, notamment le torr, l'atmosphère et le bar. La pression atmosphérique est mesurée à l'aide d'un baromètre ; les autres pressions de gaz peuvent être mesurées à l'aide de plusieurs types de manomètres.
Équations clés
- \(P=\dfrac{F}{A}\)
- p = hρg
Lexique
- atmosphère (atm)
- unité de pression ; 1 atm = 101 325 Pa
- bar
- (bar ou b) unité de pression ; 1 bar = 100 000 Pa
- baromètre
- appareil utilisé pour mesurer la pression atmosphérique
- pression hydrostatique
- pression exercée par un fluide sous l'effet de la gravité
- manomètre
- dispositif utilisé pour mesurer la pression d'un gaz emprisonné dans un récipient
- pascal (Pennsylvanie)
- Unité de pression SI ; 1 Pa = 1 N/m 2
- livres par pouce carré (psi)
- unité de pression courante aux États-Unis
- pression
- force exercée par unité de surface
- torr
- unité de pression ;\(\mathrm{1\: torr=\dfrac{1}{760}\,atm}\)


