7.2 : Liaison covalente
- Page ID
- 193988
- Décrire la formation de liaisons covalentes
- Définir l'électronégativité et évaluer la polarité des liaisons covalentes
Dans les composés ioniques, les électrons sont transférés entre les atomes de différents éléments pour former des ions. Mais ce n'est pas la seule façon de former des composés. Les atomes peuvent également créer des liaisons chimiques en partageant des électrons entre eux. Ces liaisons sont appelées liaisons covalentes. Des liaisons covalentes se forment entre deux atomes lorsque les deux ont des tendances similaires à attirer des électrons vers eux-mêmes (c'est-à-dire lorsque les deux atomes ont des énergies d'ionisation et des affinités électroniques identiques ou assez similaires). Par exemple, deux atomes d'hydrogène se lient de manière covalente pour former une molécule H 2 ; chaque atome d'hydrogène de la molécule H 2 possède deux électrons qui la stabilisent, donnant à chaque atome le même nombre d'électrons de valence que le gaz noble He.
Les composés contenant des liaisons covalentes présentent des propriétés physiques différentes de celles des composés ioniques. Comme l'attraction entre les molécules, qui sont électriquement neutres, est plus faible que celle entre les ions chargés électriquement, les composés covalents ont généralement des points de fusion et d'ébullition beaucoup plus bas que les composés ioniques. En fait, de nombreux composés covalents sont des liquides ou des gaz à température ambiante et, à l'état solide, ils sont généralement beaucoup plus mous que les solides ioniques. De plus, alors que les composés ioniques sont de bons conducteurs d'électricité lorsqu'ils sont dissous dans l'eau, la plupart des composés covalents, étant électriquement neutres, sont de mauvais conducteurs d'électricité quel que soit leur état.
Formation de liaisons covalentes
Les atomes non métalliques forment fréquemment des liaisons covalentes avec d'autres atomes non métalliques. Par exemple, la molécule d'hydrogène, H 2, contient une liaison covalente entre ses deux atomes d'hydrogène. La figure\(\PageIndex{1}\) montre pourquoi ce lien se forme. En commençant à l'extrême droite, nous avons deux atomes d'hydrogène distincts avec une énergie potentielle particulière, indiquée par la ligne rouge. Le long de l'axe X se trouve la distance entre les deux atomes. Lorsque les deux atomes se rapprochent l'un de l'autre (se déplaçant vers la gauche le long de l'axe x), leurs orbitales de valence (1 s) commencent à se chevaucher. Les électrons individuels de chaque atome d'hydrogène interagissent ensuite avec les deux noyaux atomiques, occupant l'espace autour des deux atomes. La forte attraction de chaque électron partagé vers les deux noyaux stabilise le système, et l'énergie potentielle diminue à mesure que la distance de liaison diminue. Si les atomes continuent à se rapprocher l'un de l'autre, les charges positives des deux noyaux commencent à se repousser et l'énergie potentielle augmente. La longueur de la liaison est déterminée par la distance à laquelle l'énergie potentielle la plus faible est atteinte.
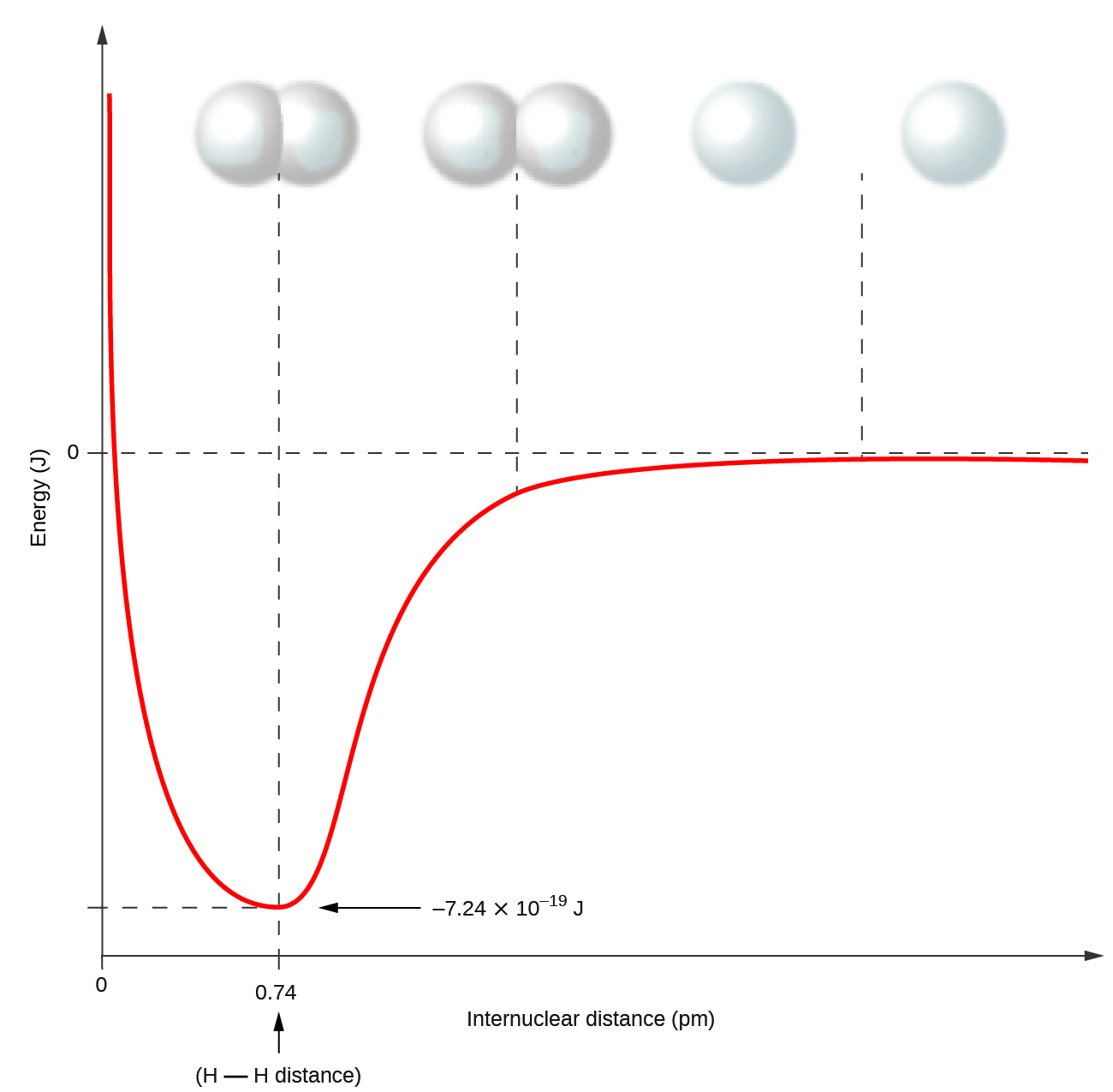
Il est essentiel de se rappeler que de l'énergie doit être ajoutée pour rompre les liaisons chimiques (processus endothermique), tandis que la formation de liaisons chimiques libère de l'énergie (processus exothermique). Dans le cas de H 2, la liaison covalente est très forte ; une grande quantité d'énergie, 436 kJ, doit être ajoutée pour rompre les liaisons dans une mole de molécules d'hydrogène et provoquer la séparation des atomes :
\[\ce{H2}(g)⟶\ce{2H}(g)\hspace{20px}ΔH=\mathrm{436\:kJ} \nonumber \]
Inversement, la même quantité d'énergie est libérée lorsqu'une mole de molécules de H 2 se forme à partir de deux moles d'atomes de H :
\[\ce{2H}(g)⟶\ce{H2}(g)\hspace{20px}ΔH=\mathrm{−436\:kJ} \nonumber \]
Liaisons covalentes pures ou polaires
Si les atomes qui forment une liaison covalente sont identiques, comme dans H 2, Cl 2 et d'autres molécules diatomiques, alors les électrons de la liaison doivent être partagés de manière égale. Nous appelons cela une liaison covalente pure. Les électrons partagés dans des liaisons covalentes pures ont une probabilité égale de se trouver à proximité de chaque noyau. Dans le cas du Cl 2, chaque atome commence par sept électrons de valence, et chaque Cl partage un électron avec l'autre, formant une liaison covalente :
\[\ce{Cl + Cl⟶Cl2} \nonumber \]
Le nombre total d'électrons autour de chaque atome se compose de six électrons non liés et de deux électrons partagés (c'est-à-dire liés) pour huit électrons au total, ce qui correspond au nombre d'électrons de valence dans l'argon, un gaz rare. Comme les atomes de liaison sont identiques, le Cl 2 présente également une liaison covalente pure.
Lorsque les atomes liés par une liaison covalente sont différents, les électrons de liaison sont partagés, mais plus de manière égale. Au lieu de cela, les électrons de liaison sont plus attirés par un atome que par l'autre, ce qui entraîne un déplacement de la densité électronique vers cet atome. Cette distribution inégale des électrons est connue sous le nom de liaison covalente polaire, caractérisée par une charge positive partielle sur un atome et une charge négative partielle sur l'autre. L'atome qui attire le plus fortement les électrons acquiert la charge négative partielle et vice versa. Par exemple, les électrons de la liaison H—Cl d'une molécule de chlorure d'hydrogène passent plus de temps à proximité de l'atome de chlore qu'à proximité de l'atome d'hydrogène. Ainsi, dans une molécule de HCl, l'atome de chlore porte une charge négative partielle et l'atome d'hydrogène possède une charge partiellement positive. La figure\(\PageIndex{2}\) montre la distribution des électrons dans la liaison H—Cl. Notez que la zone ombrée autour de Cl est beaucoup plus grande qu'elle ne l'est autour de H. Comparez cela à la figure\(\PageIndex{1}\), qui montre la distribution uniforme des électrons dans la liaison non polaire H 2.
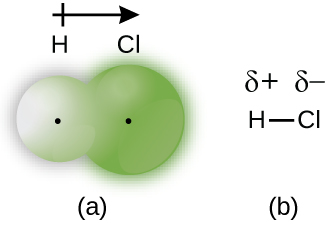
Nous désignons parfois les atomes positifs et négatifs d'une liaison covalente polaire en utilisant la lettre grecque minuscule « delta », δ, avec un signe plus ou moins pour indiquer si l'atome possède une charge positive partielle (δ+) ou une charge partiellement négative (δ—). Ce symbolisme est illustré pour la molécule H—Cl sur la figure\(\PageIndex{2b}\).
Électronégativité
Le fait qu'une liaison soit non polaire ou covalente polaire est déterminé par une propriété des atomes de liaison appelée électronégativité. L'électronégativité est une mesure de la tendance d'un atome à attirer des électrons (ou densité électronique) vers lui-même. Il détermine la façon dont les électrons communs sont répartis entre les deux atomes d'une liaison. Plus un atome attire fortement les électrons dans ses liaisons, plus son électronégativité est importante. Les électrons d'une liaison covalente polaire sont déplacés vers l'atome le plus électronégatif ; ainsi, l'atome le plus électronégatif est celui qui possède la charge négative partielle. Plus la différence d'électronégativité est grande, plus la distribution des électrons est polarisée et plus les charges partielles des atomes sont importantes.
La figure\(\PageIndex{3}\) montre les valeurs d'électronégativité des éléments proposées par l'un des chimistes les plus célèbres du XXe siècle : Linus Pauling. En général, l'électronégativité augmente de gauche à droite au cours d'une période du tableau périodique et diminue vers le bas d'un groupe. Ainsi, les éléments non métalliques, situés en haut à droite, ont tendance à présenter les électronégativités les plus élevées, le fluor étant l'élément le plus électronégatif de tous (EN = 4,0). Les métaux ont tendance à être des éléments moins électronégatifs, et les métaux du groupe 1 ont les plus faibles électronégativités. Notez que les gaz rares sont exclus de cette figure car ces atomes ne partagent généralement pas d'électrons avec d'autres atomes puisqu'ils ont une couche de valence complète. (Bien que des composés de gaz rares tels que le xEO 2 existent, ils ne peuvent se former que dans des conditions extrêmes et ne s'intègrent donc pas parfaitement dans le modèle général de l'électronégativité.)
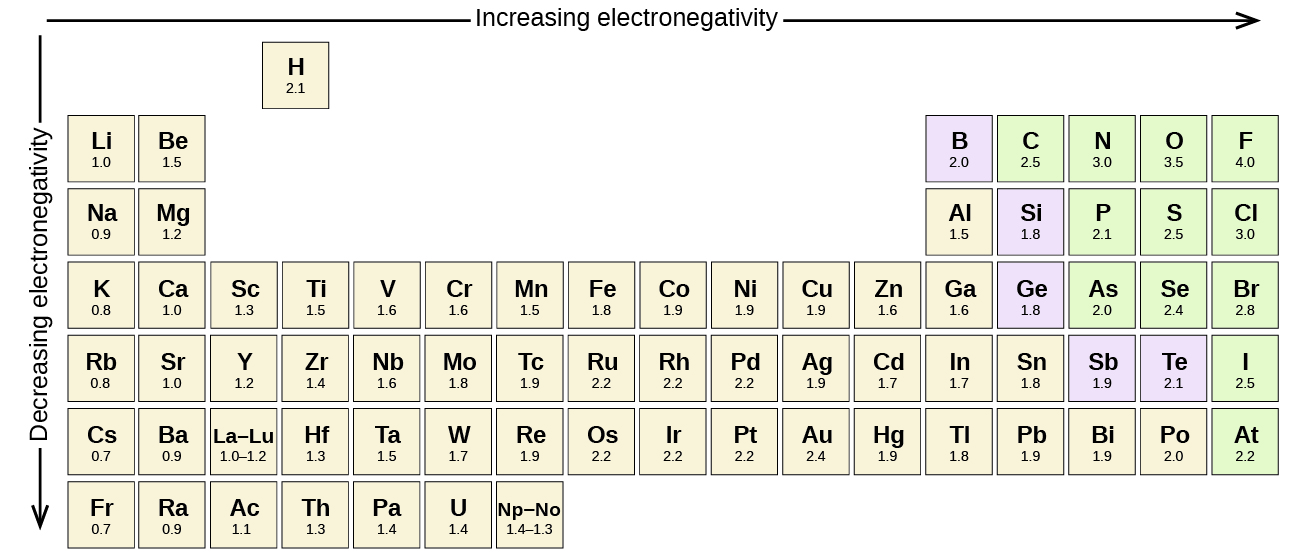
Linus Pauling est le seul à avoir reçu deux prix Nobel non partagés (individuels) : l'un pour la chimie en 1954 pour ses travaux sur la nature des liaisons chimiques et l'autre pour la paix en 1962 pour son opposition aux armes de destruction massive. Il a développé de nombreuses théories et concepts qui sont à la base de notre compréhension actuelle de la chimie, y compris l'électronégativité et les structures de résonance.

Pauling a également contribué à de nombreux autres domaines en plus de la chimie. Ses recherches sur la drépanocytose ont révélé la cause de la maladie, à savoir la présence d'une protéine anormale héréditaire génétiquement dans le sang, et ont ouvert la voie au domaine de la génétique moléculaire. Son travail a également joué un rôle crucial dans la lutte contre les essais d'armes nucléaires ; il a prouvé que les retombées radioactives des essais nucléaires présentaient un risque pour la santé publique.
Électronégativité versus affinité électronique
Il faut veiller à ne pas confondre électronégativité et affinité électronique. L'affinité électronique d'un élément est une quantité physique mesurable, à savoir l'énergie libérée ou absorbée lorsqu'un atome isolé en phase gazeuse acquiert un électron, mesurée en kJ/mol. L'électronégativité, quant à elle, décrit la mesure dans laquelle un atome attire les électrons dans une liaison. C'est une quantité sans dimension qui est calculée et non mesurée. Pauling a obtenu les premières valeurs d'électronégativité en comparant les quantités d'énergie nécessaires pour rompre différents types de liaisons. Il a choisi une échelle relative arbitraire allant de 0 à 4.
Électronégativité et type de liaison
La valeur absolue de la différence d'électronégativité (ΔEN) de deux atomes liés fournit une mesure approximative de la polarité à attendre de la liaison et, par conséquent, du type de liaison. Lorsque la différence est très faible ou nulle, la liaison est covalente et non polaire. Lorsqu'elle est importante, la liaison est polaire covalente ou ionique. Les valeurs absolues des différences d'électronégativité entre les atomes dans les liaisons H—H, H—Cl et Na—Cl sont respectivement de 0 (non polaire), 0,9 (covalent polaire) et 2,1 (ionique). Le degré de partage des électrons entre les atomes varie de complètement égal (liaison covalente pure) à nul (liaison ionique). La figure\(\PageIndex{4}\) montre la relation entre la différence d'électronégativité et le type de liaison.

Une approximation approximative des différences d'électronégativité associées aux liaisons covalentes, covalentes polaires et ioniques est présentée sur la figure\(\PageIndex{4}\). Ce tableau n'est toutefois qu'un guide général, à de nombreuses exceptions près. Par exemple, les atomes H et F du HF ont une différence d'électronégativité de 1,9, et les atomes N et H du NH 3 une différence de 0,9, mais ces deux composés forment des liaisons considérées comme covalentes polaires. De même, les atomes de Na et de Cl dans le NaCl ont une différence d'électronégativité de 2,1, et les atomes de Mn et I dans le MNi 2 ont une différence de 1,0, mais ces deux substances forment des composés ioniques.
Le meilleur guide pour déterminer le caractère covalent ou ionique d'une liaison est de considérer les types d'atomes impliqués et leur position relative dans le tableau périodique. Les liaisons entre deux non-métaux sont généralement covalentes ; la liaison entre un métal et un non-métal est souvent ionique.
Certains composés contiennent à la fois des liaisons covalentes et ioniques. Les atomes des ions polyatomiques, tels que OH —,\(\ce{NO3-}\), et\(\ce{NH4+}\), sont maintenus ensemble par des liaisons covalentes polaires. Cependant, ces ions polyatomiques forment des composés ioniques en se combinant avec des ions de charge opposée. Par exemple, le nitrate de potassium, KNO 3, contient le cation K + et l'\(\ce{NO3-}\)anion polyatomique. Ainsi, la liaison dans le nitrate de potassium est ionique, résultant de l'attraction électrostatique entre les ions K + et\(\ce{NO3-}\), ainsi que de la covalence entre les atomes d'azote et d'oxygène dans\(\ce{NO3-}\).
Les polarités des liaisons jouent un rôle important dans la détermination de la structure des protéines. À l'aide des valeurs d'électronégativité du tableau A2, organisez les liaisons covalentes suivantes, toutes couramment présentes dans les acides aminés, par ordre croissant de polarité. Désignez ensuite les atomes positifs et négatifs à l'aide des symboles δ+ et δ— :
C—H, C—N, C—O, N—H, O—H, —H
Solution
La polarité de ces liaisons augmente à mesure que la valeur absolue de la différence d'électronégativité augmente. L'atome avec la désignation δ— est le plus électronégatif des deux. Le tableau\(\PageIndex{1}\) montre ces liaisons par ordre croissant de polarité.
| Bond | ΔEN | Polarité |
|---|---|---|
| C—H | 0,4 | \(\overset{δ−}{\ce C}−\overset{δ+}{\ce H}\) |
| —H | 0,4 | \(\overset{δ−}{\ce S}−\overset{δ+}{\ce H}\) |
| C-N | 0,5 | \(\overset{δ+}{\ce C}−\overset{δ−}{\ce N}\) |
| N—H | 0,9 | \(\overset{δ−}{\ce N}−\overset{δ+}{\ce H}\) |
| C—O | 1,0 | \(\overset{δ+}{\ce C}−\overset{δ−}{\ce O}\) |
| O—H | 1.4 | \(\overset{δ−}{\ce O}−\overset{δ+}{\ce H}\) |
Les silicones sont des composés polymères contenant, entre autres, les types de liaisons covalentes suivants : Si-O, Si-C, C-H et C-C. À l'aide des valeurs d'électronégativité de la figure\(\PageIndex{3}\), arrangez les liaisons par ordre de polarité croissante et désignez les atomes positifs et négatifs à l'aide des symboles δ+ et δ—.
Réponse
| Bond | Différence d'électronégativité | Polarité |
|---|---|---|
| C-C | 0,0 | non polaire |
| C—H | 0,4 | \(\overset{δ−}{\ce C}−\overset{δ+}{\ce H}\) |
| Si-C | 0,7 | \(\overset{δ+}{\ce{Si}}−\overset{δ−}{\ce C}\) |
| Si-O | 1,7 | \(\overset{δ+}{\ce{Si}}−\overset{δ−}{\ce O}\) |
Résumé
Les liaisons covalentes se forment lorsque les électrons sont partagés entre les atomes et sont attirés par les noyaux des deux atomes. Dans les liaisons covalentes pures, les électrons sont partagés de manière égale. Dans les liaisons covalentes polaires, les électrons sont partagés de manière inégale, car un atome exerce une force d'attraction plus forte sur les électrons que l'autre. La capacité d'un atome à attirer une paire d'électrons dans une liaison chimique est appelée électronégativité. La différence d'électronégativité entre deux atomes détermine la polarité d'une liaison. Dans une molécule diatomique à deux atomes identiques, il n'y a pas de différence d'électronégativité, de sorte que la liaison est non polaire ou purement covalente. Lorsque la différence d'électronégativité est très importante, comme c'est le cas entre les métaux et les non-métaux, la liaison est caractérisée comme ionique.
Lexique
- longueur de liaison
- distance entre les noyaux de deux atomes liés à laquelle l'énergie potentielle la plus faible est atteinte
- liaison covalente
- liaison formée lorsque des électrons sont partagés entre des atomes
- électronégativité
- tendance d'un atome à attirer des électrons dans une liaison avec lui-même
- liaison covalente polaire
- liaison covalente entre des atomes ayant des électronégativités différentes ; une liaison covalente ayant une extrémité positive et une extrémité négative
- liaison covalente pure
- (également, liaison covalente non polaire) liaison covalente entre des atomes d'électronégativité identiques


