7.3 : Symboles et structures de Lewis
- Page ID
- 193992
- Écrivez les symboles de Lewis pour les atomes et les ions neutres
- Dessinez des structures de Lewis représentant la liaison dans des molécules simples
Jusqu'à présent, nous avons discuté des différents types de liaisons qui se forment entre les atomes et/ou les ions. Dans tous les cas, ces liaisons impliquent le partage ou le transfert d'électrons de la couche de valence entre les atomes. Dans cette section, nous explorerons la méthode typique pour représenter les électrons de la couche de valence et les liaisons chimiques, à savoir les symboles de Lewis et les structures de Lewis.
Symboles Lewis
Nous utilisons les symboles de Lewis pour décrire les configurations électroniques de valence des atomes et des ions monatomiques. Un symbole de Lewis consiste en un symbole élémentaire entouré d'un point pour chacun de ses électrons de valence :
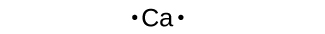
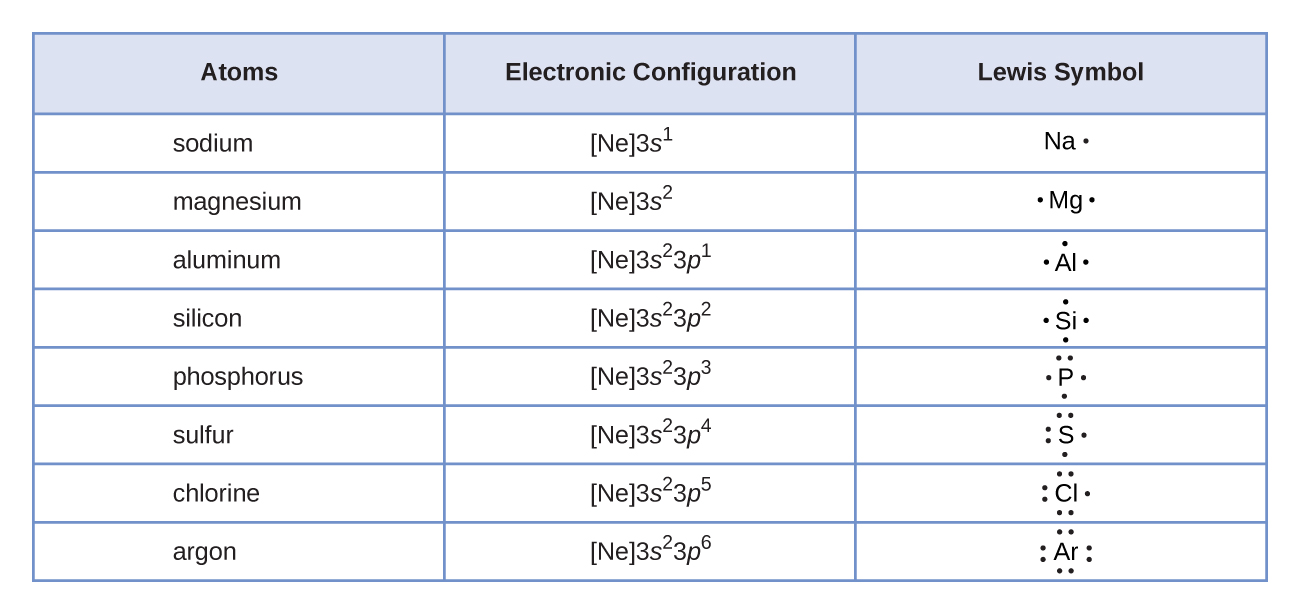
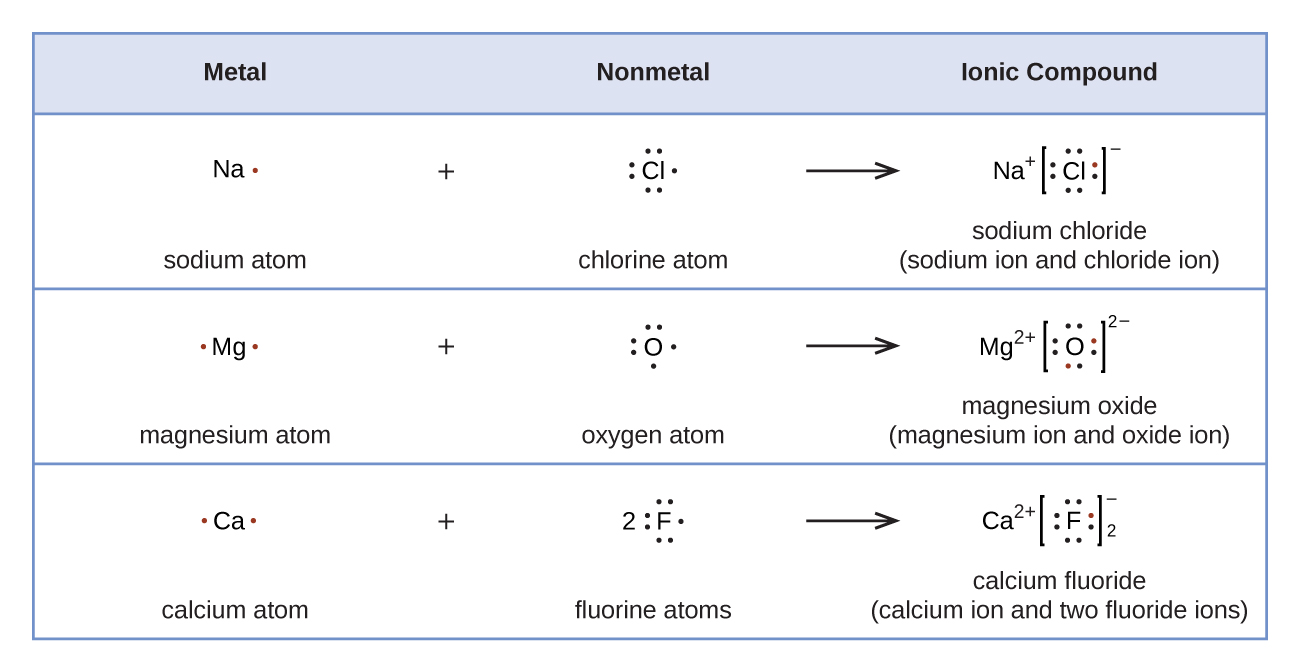
Les symboles de Lewis peuvent être utilisés pour illustrer la formation de cations à partir des atomes, comme indiqué ici pour le sodium et le calcium :

De même, ils peuvent être utilisés pour montrer la formation d'anions à partir d'atomes, comme indiqué ici pour le chlore et le soufre :

Structures Lewis
Nous utilisons également des symboles de Lewis pour indiquer la formation de liaisons covalentes, qui sont illustrées dans les structures de Lewis, les dessins qui décrivent la liaison entre les molécules et les ions polyatomiques. Par exemple, lorsque deux atomes de chlore forment une molécule de chlore, ils partagent une paire d'électrons :
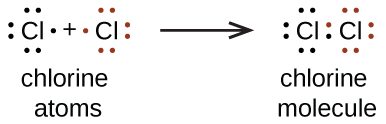
La structure de Lewis indique que chaque atome de Cl possède trois paires d'électrons qui ne sont pas utilisées pour la liaison (appelées paires isolées) et une paire d'électrons partagée (écrite entre les atomes). Un tiret (ou une ligne) est généralement utilisé pour indiquer une paire d'électrons partagée :
![]()
Dans le modèle de Lewis, une seule paire d'électrons partagée constitue une liaison unique. Chaque atome de Cl interagit avec huit électrons de valence au total : les six dans les paires isolées et les deux dans la liaison simple.
La règle de l'octuor
Les autres molécules d'halogène (F 2, Br 2, I 2 et At 2) forment des liaisons similaires à celles de la molécule de chlore : une liaison unique entre les atomes et trois paires isolées d'électrons par atome. Cela permet à chaque atome d'halogène d'avoir une configuration électronique de gaz rare. La tendance des atomes du groupe principal à former suffisamment de liaisons pour obtenir huit électrons de valence est connue sous le nom de règle de l'octet.
Le nombre de liaisons qu'un atome peut former peut souvent être prédit à partir du nombre d'électrons nécessaires pour atteindre un octet (huit électrons de valence) ; cela est particulièrement vrai pour les non-métaux de la deuxième période du tableau périodique (C, N, O et F). Par exemple, chaque atome d'un élément du groupe 14 possède quatre électrons dans sa couche la plus externe et a donc besoin de quatre électrons supplémentaires pour atteindre un octet. Ces quatre électrons peuvent être obtenus en formant quatre liaisons covalentes, comme illustré ici pour le carbone dans le CCl 4 (tétrachlorure de carbone) et le silicium dans le SiH 4 (silane). Comme l'hydrogène n'a besoin que de deux électrons pour remplir sa couche de valence, il fait exception à la règle de l'octet et ne doit former qu'une seule liaison. Les éléments de transition et les éléments de transition internes ne suivent pas non plus la règle de l'octet puisqu'ils ont des électrons d et f impliqués dans leurs couches de valence.
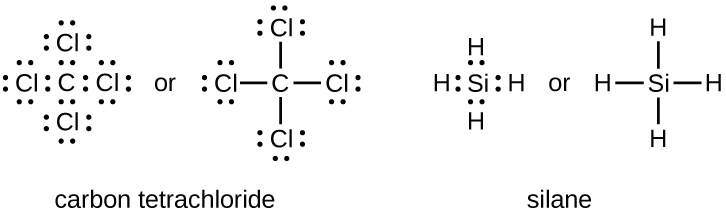
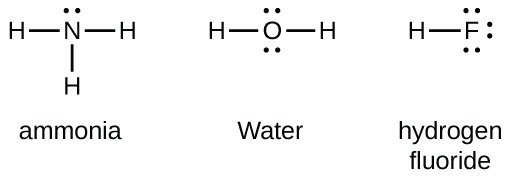
Les éléments du groupe 15 tels que l'azote possèdent cinq électrons de valence dans le symbole atomique de Lewis : une paire isolée et trois électrons non appariés. Pour obtenir un octet, ces atomes forment trois liaisons covalentes, comme dans le NH 3 (ammoniac). L'oxygène et les autres atomes du groupe 16 obtiennent un octet en formant deux liaisons covalentes :
Obligations doubles et triples
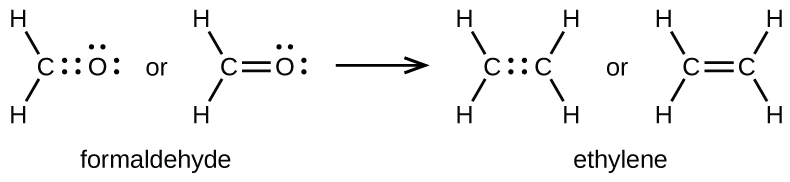
Comme mentionné précédemment, lorsqu'une paire d'atomes partage une paire d'électrons, nous appelons cela une liaison simple. Cependant, une paire d'atomes peut avoir besoin de partager plus d'une paire d'électrons pour obtenir l'octet requis. Une double liaison se forme lorsque deux paires d'électrons sont partagées entre deux atomes, par exemple entre les atomes de carbone et d'oxygène du CH 2 O (formaldéhyde) et entre les deux atomes de carbone du C 2 H 4 (éthylène) :
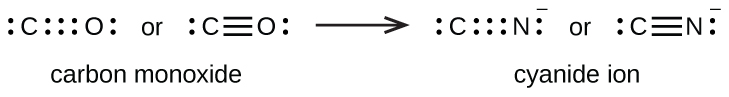
Une triple liaison se forme lorsque trois paires d'électrons sont partagées par une paire d'atomes, comme dans le monoxyde de carbone (CO) et l'ion cyanure (CN —) :
Écrire des structures de Lewis avec la règle des octuors
Pour des molécules et des ions moléculaires très simples, nous pouvons écrire les structures de Lewis en associant simplement les électrons non appariés sur les atomes qui les constituent. Consultez ces exemples :
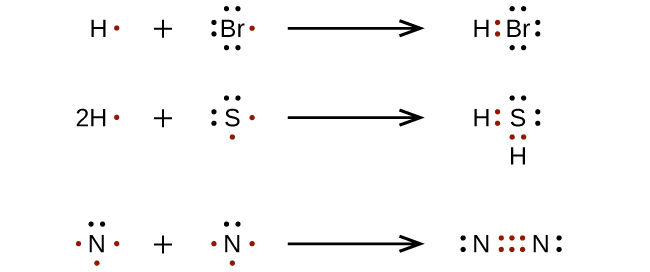
Pour les molécules et les ions moléculaires plus complexes, il est utile de suivre la procédure étape par étape décrite ici :
- Déterminez le nombre total d'électrons de valence (enveloppe externe) parmi tous les atomes. Pour les cations, soustrayez un électron pour chaque charge positive. Pour les anions, ajoutez un électron pour chaque charge négative.
- Dessinez la structure squelettique de la molécule ou de l'ion, en arrangeant les atomes autour d'un atome central. (En général, l'élément le moins électronégatif doit être placé au centre.) Connectez chaque atome à l'atome central par une seule liaison (une paire d'électrons).
- Distribuez les électrons restants sous forme de paires isolées sur les atomes terminaux (sauf l'hydrogène), en complétant un octet autour de chaque atome.
- Placez tous les électrons restants sur l'atome central.
- Réorganisez les électrons des atomes extérieurs pour établir de multiples liaisons avec l'atome central afin d'obtenir des octets dans la mesure du possible.
Déterminons les structures de Lewis de SiH 4\(\ce{CHO2-}\), NO + et OF 2 à titre d'exemples en suivant cette procédure :
- Déterminez le nombre total d'électrons de valence (enveloppe externe) dans la molécule ou l'ion.
- Pour une molécule, on ajoute le nombre d'électrons de valence sur chaque atome de la molécule :
\(\begin{align} &\phantom{+}\ce{SiH4}\\ &\phantom{+}\textrm{Si: 4 valence electrons/atom × 1 atom = 4}\\ &\underline{\textrm{+H: 1 valence electron/atom × 4 atoms = 4}}\\ &\hspace{271px}\textrm{= 8 valence electrons} \end{align}\)
- Pour un ion négatif, par exemple\(\ce{CHO2-}\), nous ajoutons le nombre d'électrons de valence sur les atomes au nombre de charges négatives sur l'ion (un électron est gagné pour chaque charge négative) :
\ (\ ce {CHO2-} \ \
\ textrm {C : 4 électrons de valence/atome × 1 atome} \ hspace {6px} = \ phantom {1} 4 \ \
\ textrm {H : 1 électron/atome de valence × 1 atome} \ hspace {12px} = \ phantom {1} 1 \ \
\ textrm {O : 6 électrons de valence/atome × 2 atomes = 12} \ \
\ underline {+ \ hspace {100px} \ textrm {1 électron supplémentaire} \ hspace {9px} = \ phantom {1} 1} \
\ hspace {264 px} \ textrm {= 18 électrons de valence} \) - Pour un ion positif, tel que le NO +, nous ajoutons le nombre d'électrons de valence sur les atomes de l'ion, puis nous soustrayons le nombre de charges positives sur l'ion (un électron est perdu pour chaque charge positive) du nombre total d'électrons de valence :
\ (\ ce {NO+} \ \
\ textrm {N : 5 électrons de valence/atome × 1 atome} = \ phantom {−} 5 \ \ \ textrm {O : 6 électrons/atome de valence × 1 atome}
\ hspace {5px} = \ phantom {−} 6 \ \ \ underline {\ textrm {+ −1 électron (charge positive)}
\ hspace {44px} = −6 \ \ \ underline {\ textrm {+ −1 électron (charge positive)} \ hspace {44px} = −1 1} \ \
\ hspace {260px} \ textrm {= 10 électrons de valence} \) - L'OF 2 étant une molécule neutre, il suffit d'ajouter le nombre d'électrons de valence :
\ (\ phantom {+} \ ce {OF2} \ \
\ phantom {+} \ textrm {O : 6 électrons de valence/atome × 1 atome} \ hspace {10px} = 6 \ \
\ underline {\ textrm {+ F : 7 électrons de valence par atome × 2 atomes} = 14} \ \
\ hspace {280px} \ textrm {= 20 électrons de valence} \)
- Pour une molécule, on ajoute le nombre d'électrons de valence sur chaque atome de la molécule :
- Dessinez la structure squelettique de la molécule ou de l'ion, en arrangeant les atomes autour d'un atome central et en connectant chaque atome à l'atome central par une seule liaison (une paire d'électrons). (Notez que nous désignons des ions avec des crochets autour de la structure, indiquant la charge en dehors des crochets :)
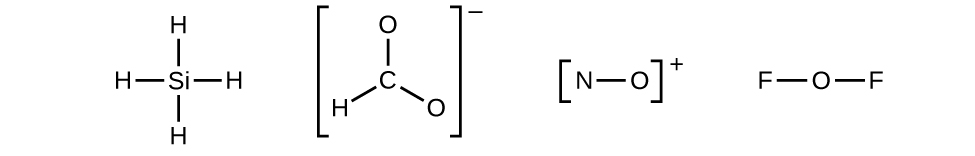
- Lorsque plusieurs arrangements d'atomes sont possibles\(\ce{CHO2-}\), nous devons utiliser des preuves expérimentales pour choisir le bon. En général, les éléments les moins électronégatifs sont plus susceptibles d'être des atomes centraux. Dans\(\ce{CHO2-}\), l'atome de carbone le moins électronégatif occupe la position centrale avec les atomes d'oxygène et d'hydrogène qui l'entourent. D'autres exemples incluent le P dans le POCl 3, le S dans le SO 2 et le Cl dans\(\ce{ClO4-}\). Une exception est que l'hydrogène n'est presque jamais un atome central. En tant qu'élément le plus électronégatif, le fluor ne peut pas non plus être un atome central.
- Distribuez les électrons restants sous forme de paires isolées sur les atomes terminaux (sauf l'hydrogène) pour compléter leurs couches de valence avec un octet d'électrons.
- Il ne reste aucun électron sur le SiH 4, il est donc inchangé :
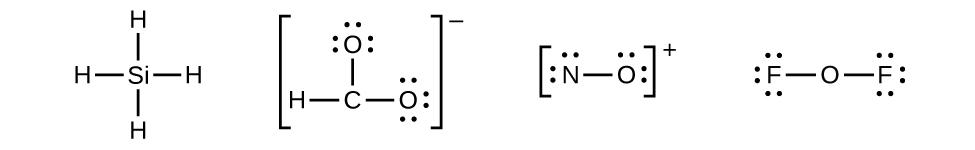
- Placez tous les électrons restants sur l'atome central.
- Pour le SiH 4 et le NO +, il ne reste aucun électron ; nous avons déjà placé tous les électrons déterminés à l'étape 1.\(\ce{CHO2-}\)
- Pour l'OF 2, il nous restait 16 électrons à l'étape 3, et nous en avons placé 12, laissant 4 à placer sur l'atome central :
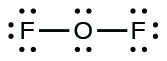
- Réorganisez les électrons des atomes extérieurs pour établir de multiples liaisons avec l'atome central afin d'obtenir des octets dans la mesure du possible.
- SiH 4 : Si possède déjà un octuor, il n'y a donc rien à faire.
- \(\ce{CHO2-}\): We have distributed the valence electrons as lone pairs on the oxygen atoms, but the carbon atom lacks an octet:
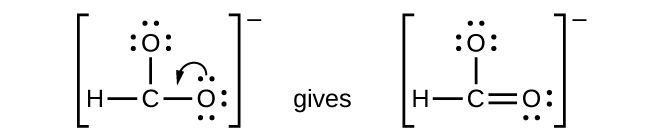
- NO + : Pour cet ion, nous avons ajouté huit électrons extérieurs, mais aucun des deux atomes n'a d'octet. Nous ne pouvons pas ajouter d'autres électrons puisque nous avons déjà utilisé le total que nous avons trouvé à l'étape 1. Nous devons donc déplacer des électrons pour former une liaison multiple :
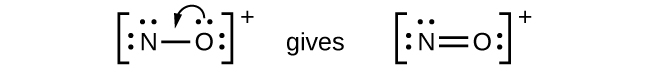
- Cela ne produit toujours pas d'octet, nous devons donc déplacer une autre paire, formant une triple liaison :
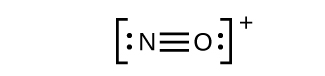
- Dans OF 2, chaque atome possède un octet tel qu'il est dessiné, donc rien ne change.
NASA’s Cassini-Huygens mission detected a large cloud of toxic hydrogen cyanide (HCN) on Titan, one of Saturn’s moons. Titan also contains ethane (H3CCH3), acetylene (HCCH), and ammonia (NH3). What are the Lewis structures of these molecules?
Solution
Calculate the number of valence electrons.
- HCN: (1 × 1) + (4 × 1) + (5 × 1) = 10
- H3CCH3: (1 × 3) + (2 × 4) + (1 × 3) = 14
- HCCH: (1 × 1) + (2 × 4) + (1 × 1) = 10
- NH3: (5 × 1) + (3 × 1) = 8
Draw a skeleton and connect the atoms with single bonds. Remember that H is never a central atom:
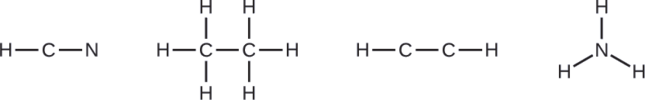
Where needed, distribute electrons to the terminal atoms:
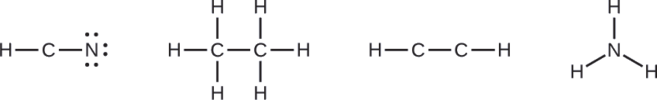
- HCN: six electrons placed on N
- H3CCH3: no electrons remain
- HCCH: no terminal atoms capable of accepting electrons
- NH3: no terminal atoms capable of accepting electrons
Where needed, place remaining electrons on the central atom:
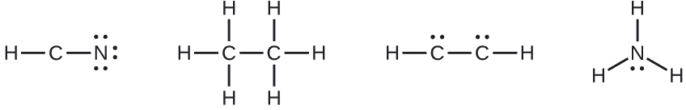
- HCN: no electrons remain
- H3CCH3: no electrons remain
- HCCH: four electrons placed on carbon
- NH3: two electrons placed on nitrogen
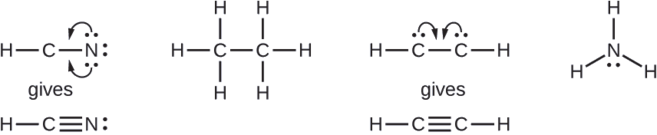
Where needed, rearrange electrons to form multiple bonds in order to obtain an octet on each atom:
- HCN: form two more C–N bonds
- H3CCH3: all atoms have the correct number of electrons
- HCCH: form a triple bond between the two carbon atoms
- NH3: all atoms have the correct number of electrons
Both carbon monoxide, CO, and carbon dioxide, CO2, are products of the combustion of fossil fuels. Both of these gases also cause problems: CO is toxic and CO2 has been implicated in global climate change. What are the Lewis structures of these two molecules?
- Answer
-
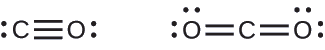
Carbon soot has been known to man since prehistoric times, but it was not until fairly recently that the molecular structure of the main component of soot was discovered. In 1996, the Nobel Prize in Chemistry was awarded to Richard Smalley, Robert Curl, and Harold Kroto for their work in discovering a new form of carbon, the C60 buckminsterfullerene molecule. An entire class of compounds, including spheres and tubes of various shapes, were discovered based on C60. This type of molecule, called a fullerene, consists of a complex network of single- and double-bonded carbon atoms arranged in such a way that each carbon atom obtains a full octet of electrons. Because of their size and shape, fullerenes can encapsulate other molecules, so they have shown potential in various applications from hydrogen storage to targeted drug delivery systems. They also possess unique electronic and optical properties that have been put to good use in solar powered devices and chemical sensors.
Exceptions to the Octet Rule
Many covalent molecules have central atoms that do not have eight electrons in their Lewis structures. These molecules fall into three categories:
- Odd-electron molecules have an odd number of valence electrons, and therefore have an unpaired electron.
- Electron-deficient molecules have a central atom that has fewer electrons than needed for a noble gas configuration.
- Hypervalent molecules have a central atom that has more electrons than needed for a noble gas configuration.
Odd-electron Molecules
We call molecules that contain an odd number of electrons free radicals. Nitric oxide, NO, is an example of an odd-electron molecule; it is produced in internal combustion engines when oxygen and nitrogen react at high temperatures.
To draw the Lewis structure for an odd-electron molecule like NO, we follow the same five steps we would for other molecules, but with a few minor changes:
- Determine the total number of valence (outer shell) electrons. The sum of the valence electrons is 5 (from N) + 6 (from O) = 11. The odd number immediately tells us that we have a free radical, so we know that not every atom can have eight electrons in its valence shell.
- Draw a skeleton structure of the molecule. We can easily draw a skeleton with an N–O single bond: N–O
- Distribute the remaining electrons as lone pairs on the terminal atoms. In this case, there is no central atom, so we distribute the electrons around both atoms. We give eight electrons to the more electronegative atom in these situations; thus oxygen has the filled valence shell:
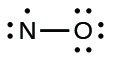
- Placez tous les électrons restants sur l'atome central. Comme il ne reste aucun électron, cette étape ne s'applique pas.
- Réorganisez les électrons pour établir de multiples liaisons avec l'atome central afin d'obtenir des octets dans la mesure du possible. Nous savons qu'une molécule d'électrons impaire ne peut pas avoir d'octet pour chaque atome, mais nous voulons que chaque atome soit le plus proche possible d'un octet. Dans ce cas, l'azote n'est entouré que de cinq électrons. Pour nous rapprocher d'un octet pour l'azote, nous prenons l'une des paires isolées de l'oxygène et nous l'utilisons pour former une double liaison NO. (Nous ne pouvons pas prendre une autre paire d'électrons sur l'oxygène et former une triple liaison car l'azote aurait alors neuf électrons :)
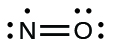
Molécules déficientes en électrons
Nous rencontrerons également quelques molécules contenant des atomes centraux qui n'ont pas de couche de valence pleine. Généralement, il s'agit de molécules dont les atomes centraux appartiennent aux groupes 2 et 13 et dont les atomes extérieurs sont de l'hydrogène ou d'autres atomes ne formant pas de liaisons multiples. Par exemple, dans les structures de Lewis du dihydrure de béryllium, BeH 2, et du trifluorure de bore, BF 3, les atomes de béryllium et de bore ne possèdent chacun que quatre et six électrons, respectivement. Il est possible de dessiner une structure avec une double liaison entre un atome de bore et un atome de fluor dans le BF 3, en respectant la règle des octuors, mais des preuves expérimentales indiquent que les longueurs de liaison sont plus proches de celles attendues pour les liaisons simples B—F. Cela suggère que la meilleure structure de Lewis possède trois liaisons simples B—F et un bore déficient en électrons. La réactivité du composé est également compatible avec un bore déficient en électrons. Cependant, les liaisons B—F sont légèrement plus courtes que ce qui est réellement attendu pour les liaisons simples B—F, ce qui indique qu'on retrouve un certain caractère de double liaison dans la molécule elle-même.
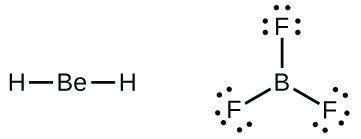
Un atome comme l'atome de bore du BF 3, qui ne possède pas huit électrons, est très réactif. Il se combine facilement avec une molécule contenant un atome avec une seule paire d'électrons. Par exemple, le NH 3 réagit avec le BF 3 parce que la seule paire sur l'azote peut être partagée avec l'atome de bore :
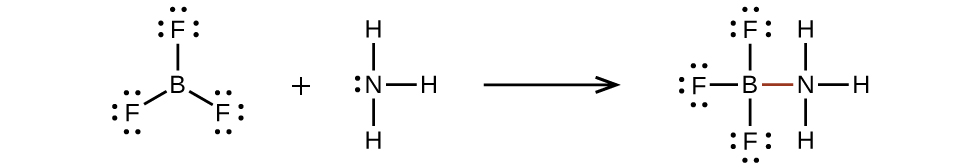
Des molécules hypervalentes
Les éléments de la deuxième période du tableau périodique (n = 2) ne peuvent accueillir que huit électrons dans leurs orbitales de couche de valence car ils n'ont que quatre orbitales de valence (une orbitale 2 s et trois orbitales 2 p). Les éléments de la troisième période et des périodes supérieures (n ≥ 3) ont plus de quatre orbitales de valence et peuvent partager plus de quatre paires d'électrons avec d'autres atomes car ils ont des orbitales d vides dans la même couche. Les molécules formées à partir de ces éléments sont parfois appelées molécules hypervalentes. Le tableau\(\PageIndex{5}\) montre les structures de Lewis pour deux molécules hypervalentes, pCl 5 et SF 6.
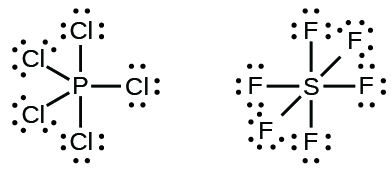
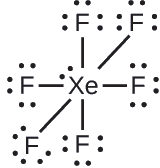
Dans certaines molécules hypervalentes, telles que IF 5 et XeF 4, certains électrons de l'enveloppe externe de l'atome central sont des paires isolées :
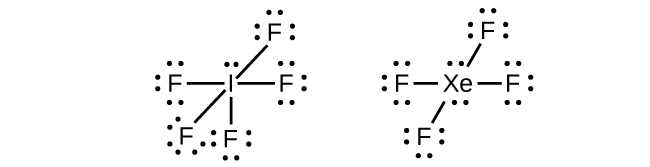
Lorsque nous écrivons les structures de Lewis de ces molécules, nous découvrons qu'il nous reste des électrons après avoir rempli les couches de valence des atomes extérieurs de huit électrons. Ces électrons supplémentaires doivent être affectés à l'atome central.
Le xénon est un gaz noble, mais il forme un certain nombre de composés stables. Nous l'avons examiné\(\ce{XeF4}\) plus tôt. Quelles sont les structures de Lewis de\(\ce{XeF2}\) et\(\ce{XeF6}\) ?
Solution
Nous pouvons dessiner la structure de Lewis de n'importe quelle molécule covalente en suivant les six étapes décrites précédemment. Dans ce cas, nous pouvons condenser les dernières étapes, car elles ne s'appliquent pas toutes.
Étape 1 : Calculez le nombre d'électrons de valence :
\(\ce{XeF6}\): 8 + (6 × 7) = 50
Étape 2 : Dessinez un squelette joignant les atomes par des liaisons simples. Le xénon sera l'atome central car le fluor ne peut pas être un atome central :
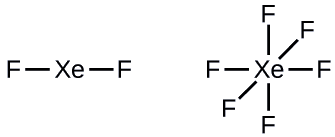
Étape 3 : Distribuez les électrons restants.
XeF 2 : Nous plaçons trois paires isolées d'électrons autour de chaque atome F, ce qui représente 12 électrons et donne à chaque atome F 8 électrons. Il reste donc six électrons (trois paires isolées). Ces paires solitaires doivent être placées sur l'atome Xe. Cela est acceptable car les atomes Xe ont des orbitales de la couche de valence d vide et peuvent contenir plus de huit électrons. La structure de Lewis de XeF 2 montre deux paires de liaisons et trois paires isolées d'électrons autour de l'atome Xe :
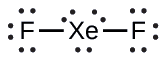
XeF 6 : Nous plaçons trois paires isolées d'électrons autour de chaque atome F, soit 36 électrons. Il reste deux électrons, et cette seule paire est placée sur l'atome Xe :
Les halogènes forment une classe de composés appelés interhalogènes, dans lesquels les atomes d'halogène se lient les uns aux autres par covalence. Écrivez les structures de Lewis pour les interhalogènes\(\ce{BrCl3}\) et\(\ce{ICl4-}\).
- Réponse
-
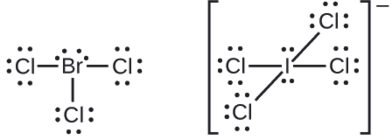
Résumé
Les structures électroniques de valence peuvent être visualisées en dessinant des symboles de Lewis (pour les atomes et les ions monatomiques) et des structures de Lewis (pour les molécules et les ions polyatomiques). Des paires isolées, des électrons non appariés et des liaisons simples, doubles ou triples sont utilisées pour indiquer où se situent les électrons de valence autour de chaque atome dans une structure de Lewis. La plupart des structures, en particulier celles qui contiennent des éléments de deuxième rangée, obéissent à la règle des octets, selon laquelle chaque atome (sauf H) est entouré de huit électrons. Des exceptions à la règle de l'octet se produisent pour les molécules d'électrons impairs (radicaux libres), les molécules déficientes en électrons et les molécules hypervalentes.
Lexique
- double liaison
- liaison covalente dans laquelle deux paires d'électrons sont partagées entre deux atomes
- radical libre
- molécule contenant un nombre impair d'électrons
- molécule hypervalente
- molécule contenant au moins un élément du groupe principal qui possède plus de huit électrons dans sa couche de valence
- Structure de Lewis
- diagramme montrant des paires isolées et des paires d'électrons se liant dans une molécule ou un ion
- Symbole Lewis
- symbole d'un élément ou d'un ion monatomique qui utilise un point pour représenter chaque électron de valence de l'élément ou de l'ion
- une paire
- deux (une paire) d'électrons de valence qui ne sont pas utilisés pour former une liaison covalente
- règle des octuors
- ligne directrice selon laquelle les atomes du groupe principal formeront des structures dans lesquelles huit électrons de valence interagiront avec chaque noyau, en comptant les électrons de liaison comme interagissant avec les deux atomes connectés par la liaison
- liaison unique
- liaison dans laquelle une seule paire d'électrons est partagée entre deux atomes
- triple liaison
- liaison dans laquelle trois paires d'électrons sont partagées entre deux atomes


