2.3 : Structure atomique et symbolisme
- Page ID
- 193944
- Écrire et interpréter des symboles représentant le numéro atomique, le nombre de masse et la charge d'un atome ou d'un ion
- Définissez l'unité de masse atomique et la masse atomique moyenne
- Calculer la masse atomique moyenne et l'abondance isotopique
Le développement de la théorie atomique moderne a révélé beaucoup de choses sur la structure interne des atomes. On a appris qu'un atome contient un très petit noyau composé de protons chargés positivement et de neutrons non chargés, entouré d'un volume d'espace beaucoup plus important contenant des électrons chargés négativement. Le noyau contient la majeure partie de la masse d'un atome, car les protons et les neutrons sont beaucoup plus lourds que les électrons, alors que les électrons occupent la quasi-totalité du volume d'un atome. Le diamètre d'un atome est de l'ordre de 10 -10 m, alors que le diamètre du noyau est d'environ 10 -15 m, soit environ 100 000 fois plus petit. Pour avoir une idée de leur taille relative, considérez ceci : si le noyau avait la taille d'un bleuet, l'atome aurait à peu près la taille d'un stade de football (Figure\(\PageIndex{1}\)).

Les atomes, ainsi que les protons, les neutrons et les électrons qui les composent, sont extrêmement petits. Par exemple, un atome de carbone pèse moins de 2\(\times\) 10 -23 g et un électron a une charge inférieure à 2\(\times\) 10 -19 C (coulomb). Lorsque nous décrivons les propriétés de petits objets tels que les atomes, nous utilisons de petites unités de mesure appropriées, telles que l'unité de masse atomique (amu) et l'unité de charge fondamentale (e). L'amu a été initialement défini sur la base de l'hydrogène, l'élément le plus léger, puis plus tard en termes d'oxygène. Depuis 1961, il est défini en fonction de l'isotope de carbone le plus abondant, dont les atomes se voient attribuer des masses d'exactement 12 amu. (Cet isotope est connu sous le nom de « carbone 12 », comme nous le verrons plus loin dans ce module.) Ainsi, un amu correspond exactement\(1/12\) à la masse d'un atome de carbone 12 : 1 amu = 1,6605\(\times\) 10 −24 g. (Le Dalton (Da) et l'unité de masse atomique unifiée (u) sont des unités alternatives équivalentes à l'amu.) L'unité de charge fondamentale (également appelée charge élémentaire) est égale à l'amplitude de la charge d'un électron (e) avec e = 1,602\(\times\) 10 -19 C.
Un proton a une masse de 1,0073 amu et une charge de 1+. Un neutron est une particule légèrement plus lourde d'une masse de 1,0087 amu et d'une charge nulle ; comme son nom l'indique, elle est neutre. L'électron a une charge de 1− et est une particule beaucoup plus légère avec une masse d'environ 0,00055 amu (il faudrait environ 1800 électrons pour égaler la masse d'un proton). Les propriétés de ces particules fondamentales sont résumées dans le tableau\(\PageIndex{1}\). (Un étudiant attentif remarquera peut-être que la somme des particules subatomiques d'un atome n'est pas égale à la masse réelle de l'atome : la masse totale de six protons, six neutrons et six électrons est de 12,0993 amu, soit légèrement plus que les 12,00 amu d'un atome de carbone 12 réel. Cette masse « manquante » est connue sous le nom de défaut de masse, et vous en apprendrez davantage à ce sujet dans le chapitre sur la chimie nucléaire.)
| Nom | Endroit | Charge (C) | Charge unitaire | Messe (amu) | Masse (g) |
|---|---|---|---|---|---|
| électron | noyau extérieur | \(−1.602 \times 10^{−19}\) | 1− | 0,00055 | \(0.00091 \times 10^{−24}\) |
| proton | noyau | \(1.602 \times 10^{−19}\) | 1+ | 1,00727 | \(1.67262 \times 10^{−24}\) |
| neutron | noyau | 0 | 0 | 1,00866 | \(1.67493 \times10^{−24}\) |
Le nombre de protons dans le noyau d'un atome est son numéro atomique (\(Z\)). C'est la caractéristique déterminante d'un élément : sa valeur détermine l'identité de l'atome. Par exemple, tout atome qui contient six protons est l'élément carbone et porte le numéro atomique 6, quel que soit le nombre de neutrons ou d'électrons qu'il peut contenir. Un atome neutre doit contenir le même nombre de charges positives et négatives, de sorte que le nombre de protons soit égal au nombre d'électrons. Par conséquent, le numéro atomique indique également le nombre d'électrons dans un atome. Le nombre total de protons et de neutrons dans un atome est appelé son nombre de masse (A). Le nombre de neutrons est donc la différence entre le nombre de masse et le numéro atomique : A — Z = nombre de neutrons.
\ [\ begin {align*}
\ ce {atomique \ : numéro \ :( Z) \ : &= \ :numéro \ : de \ : protons \ \
masse \ : numéro \ :( A) \ : &= \ :numéro \ : de \ : protons + nombre \ : de \ : neutrons \ \
A-Z \ : &= \ :numéro \ : de \ : neutrons}
\ end {align*} \ non numéro [\]
Les atomes sont neutres électriquement s'ils contiennent le même nombre de protons chargés positivement et d'électrons chargés négativement. Lorsque le nombre de ces particules subatomiques n'est pas égal, l'atome est chargé électriquement et est appelé ion. La charge d'un atome est définie comme suit :
Charge atomique = nombre de protons − nombre d'électrons
Comme nous le verrons plus en détail plus loin dans ce chapitre, les atomes (et les molécules) se chargent généralement en gagnant ou en perdant des électrons. Un atome qui gagne un ou plusieurs électrons présentera une charge négative et s'appelle un anion. Les atomes chargés positivement appelés cations se forment lorsqu'un atome perd un ou plusieurs électrons. Par exemple, un atome de sodium neutre (Z = 11) possède 11 électrons. Si cet atome perd un électron, il deviendra un cation avec une charge 1+ (11 − 10 = 1+). Un atome d'oxygène neutre (Z = 8) possède huit électrons, et s'il gagne deux électrons, il deviendra un anion avec une charge 2− (8 − 10 = 2−).
L'iode est un oligo-élément essentiel de notre alimentation ; il est nécessaire à la production de l'hormone thyroïdienne. Une alimentation insuffisante en iode peut entraîner le développement d'un goitre, une hypertrophie de la glande thyroïde (Figure\(\PageIndex{2}\)).
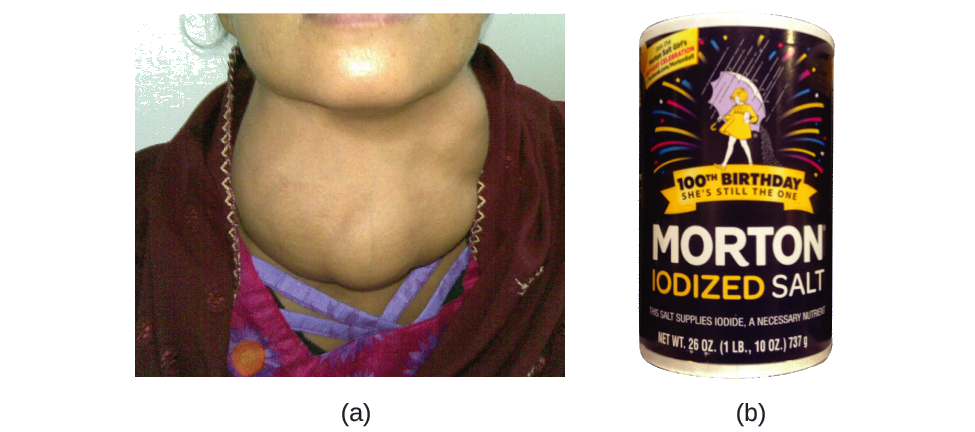
L'ajout de petites quantités d'iode au sel de table (sel iodé) a pratiquement éliminé ce problème de santé aux États-Unis, mais jusqu'à 40 % de la population mondiale est toujours exposée au risque de carence en iode. Les atomes d'iode sont ajoutés sous forme d'anions, et chacun possède une charge 1− et un nombre de masse de 127. Déterminez le nombre de protons, de neutrons et d'électrons dans l'un de ces anions d'iode.
Solution
Le numéro atomique de l'iode (53) indique qu'un atome d'iode neutre contient 53 protons dans son noyau et 53 électrons à l'extérieur de son noyau. Comme la somme des nombres de protons et de neutrons est égale au nombre de masse, 127, le nombre de neutrons est de 74 (127 − 53 = 74). Comme l'iode est ajouté sous forme d'anion 1−, le nombre d'électrons est de 54 [53 — (1—) = 54].
Un ion de platine a un nombre de masse de 195 et contient 74 électrons. Combien de protons et de neutrons contient-il et quelle est sa charge ?
- Réponse
-
78 protons ; 117 neutrons ; la charge est de 4+
Symboles chimiques
Un symbole chimique est une abréviation que nous utilisons pour indiquer un élément ou un atome d'un élément. Par exemple, le symbole du mercure est Hg (Figure\(\PageIndex{3}\)). Nous utilisons le même symbole pour indiquer un atome de mercure (domaine microscopique) ou pour étiqueter un contenant contenant de nombreux atomes de l'élément mercure (domaine macroscopique).

Les symboles de plusieurs éléments communs et de leurs atomes sont répertoriés dans le tableau\(\PageIndex{2}\). Certains symboles sont dérivés du nom commun de l'élément ; d'autres sont des abréviations du nom dans une autre langue. Les symboles comportent une ou deux lettres, par exemple H pour hydrogène et Cl pour chlore. Pour éviter toute confusion avec d'autres notations, seule la première lettre d'un symbole est en majuscule. Par exemple, Co est le symbole de l'élément cobalt, mais CO est la notation du composé monoxyde de carbone, qui contient des atomes des éléments carbone (C) et oxygène (O). Tous les éléments connus et leurs symboles figurent dans le tableau périodique.
| Elément | symbole | Elément | symbole |
|---|---|---|---|
| aluminium | Al | fer | Fe (à partir de ferrum) |
| brome | Bar | plomb | Pb (à partir de plumbum) |
| calcium | Californie | magnésium | Mg |
| carbone | C | mercure | Hg (issu de l'horargyrum) |
| chlore | Cl | nitrogène | N |
| chrome | Cr | oxygène | O |
| cobalt | Co | potassium | K (à partir du kalium) |
| cuivre | Cu (à partir de cuivre) | silicium | Monsieur |
| fluor | F | argent | Ag (de Argentum) |
| or | Au (à partir de Aurum) | sodium | Na (à partir de natrium) |
| hélium | Il | soufre | S |
| hydrogène | H | étain | Sn (à partir de stannum) |
| iode | JE | zinc | Zn |
Traditionnellement, le découvreur (ou les découvreurs) d'un nouvel élément nomme l'élément. Toutefois, jusqu'à ce que le nom soit reconnu par l'Union internationale de chimie pure et appliquée (IUPAC), le nom recommandé pour le nouvel élément est basé sur le ou les mots latins désignant son numéro atomique. Par exemple, l'élément 106 a été appelé unnilhexium (Unh), l'élément 107 a été appelé unnilseptium (Uns) et l'élément 108 a été appelé unniloctium (Uno) pendant plusieurs années. Ces éléments portent désormais le nom de scientifiques ou de lieux ; par exemple, l'élément 106 est désormais connu sous le nom de seaborgium (Sg) en l'honneur de Glenn Seaborg, un lauréat du prix Nobel qui a participé à la découverte de plusieurs éléments lourds.
Isotopes
Le symbole d'un isotope spécifique de n'importe quel élément est écrit en plaçant le nombre de masse en exposant à gauche du symbole de l'élément (Figure\(\PageIndex{4}\)). Le numéro atomique est parfois écrit sous la forme d'un indice précédant le symbole, mais comme ce numéro définit l'identité de l'élément, tout comme son symbole, il est souvent omis. Par exemple, le magnésium existe sous la forme d'un mélange de trois isotopes, chacun ayant un numéro atomique de 12 et un nombre de masse de 24, 25 et 26, respectivement. Ces isotopes peuvent être identifiés comme étant 24 Mg, 25 Mg et 26 Mg. Ces symboles isotopiques sont lus comme « élément, nombre de masse » et peuvent être symbolisés conformément à cette lecture. Par exemple, 24 Mg se lit comme « magnésium 24 » et peut être écrit comme « magnésium-24 » ou « Mg-24 ». 25 mg se lit comme « magnésium 25 » et peut être écrit comme « magnésium-25 » ou « Mg-25 ». Tous les atomes de magnésium ont 12 protons dans leur noyau. Ils ne diffèrent que parce qu'un atome de 24 Mg possède 12 neutrons dans son noyau, un atome de 25 Mg possède 13 neutrons et un atome de 26 Mg contient 14 neutrons.
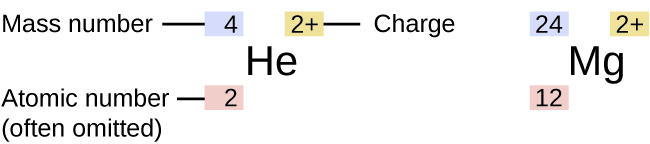
Des informations sur les isotopes naturels des éléments de numéros atomiques 1 à 10 sont données dans le tableau\(\PageIndex{2}\). Notez qu'en plus des noms et des symboles standard, les isotopes de l'hydrogène sont souvent désignés par des noms communs et des symboles d'accompagnement. L'hydrogène-2, symbolisé 2 H, est également appelé deutérium et parfois symbolisé D. L'hydrogène-3, symbolisé 3 H, est également appelé tritium et parfois symbolisé T.
| Elément | symbole | Numéro atomique | Nombre de protons | Nombre de neutrons | Messe (amu) | % d'abondance naturelle |
|---|---|---|---|---|---|---|
| hydrogène | \(\ce{^1_1H}\) (protium) |
1 | 1 | 0 | 1 078 | 99 989 |
| \(\ce{^2_1H}\) (deutérium) |
1 | 1 | 1 | 2.0141 | 0,0115 | |
| \(\ce{^3_1H}\) (tritium) |
1 | 1 | 2 | 3.01605 | — (trace) | |
| hélium | \(\ce{^3_2He}\) | 2 | 2 | 1 | 3.01603 | 0,00013 |
| \(\ce{^4_2He}\) | 2 | 2 | 2 | 4 026 | 100 | |
| lithium | \(\ce{^6_3Li}\) | 3 | 3 | 3 | 6.0151 | 7,59 |
| \(\ce{^7_3Li}\) | 3 | 3 | 4 | 7 0160 | 92,41 | |
| béryllium | \(\ce{^9_4Be}\) | 4 | 4 | 5 | 9 0122 | 100 |
| bore | \(\ce{^{10}_5B}\) | 5 | 5 | 5 | 10.0129 | 19,9 |
| \(\ce{^{11}_5B}\) | 5 | 5 | 6 | 11 093 | 80,1 | |
| carbone | \(\ce{^{12}_6C}\) | 6 | 6 | 6 | 12 000 | 98,89 |
| \(\ce{^{13}_6C}\) | 6 | 6 | 7 | 13 0034 | 1,11 | |
| \(\ce{^{14}_6C}\) | 6 | 6 | 8 | 14 0032 | — (trace) | |
| azote | \(\ce{^{14}_7N}\) | 7 | 7 | 7 | 14 0031 | 99,63 |
| \(\ce{^{15}_7N}\) | 7 | 7 | 8 | 15 001 | 0,37 | |
| oxygène | \(\ce{^{16}_8O}\) | 8 | 8 | 8 | 15 949 | 99 757 |
| \(\ce{^{17}_8O}\) | 8 | 8 | 9 | 16 991 | 0,038 | |
| \(\ce{^{18}_8O}\) | 8 | 8 | 10 | 17 9992 | 0,205 | |
| fluor | \(\ce{^{19}_9F}\) | 9 | 9 | 10 | 18 984 | 100 |
| néon | \(\ce{^{20}_{10}Ne}\) | 10 | 10 | 10 | 19 924 | 90,48 |
| \(\ce{^{21}_{10}Ne}\) | 10 | 10 | 11 | 20 938 | 0,27 | |
| \(\ce{^{22}_{10}Ne}\) | 10 | 10 | 12 | 21 914 | 9,25 |
Masse atomique
Étant donné que chaque proton et chaque neutron contribuent à environ un amu à la masse d'un atome, et que chaque électron contribue beaucoup moins, la masse atomique d'un seul atome est approximativement égale à son nombre de masse (un nombre entier). Cependant, les masses moyennes des atomes de la plupart des éléments ne sont pas des nombres entiers, car la plupart des éléments existent naturellement sous forme de mélanges de deux isotopes ou plus.
La masse d'un élément figurant dans un tableau périodique ou répertorié dans un tableau des masses atomiques est une masse moyenne pondérée de tous les isotopes présents dans un échantillon naturel de cet élément. Ceci est égal à la somme de la masse de chaque isotope individuel multipliée par son abondance fractionnée.
\[\mathrm{average\: mass}=\sum_{i}(\mathrm{fractional\: abundance\times isotopic\: mass})_i \nonumber \]
Par exemple, l'élément bore est composé de deux isotopes : environ 19,9 % de tous les atomes de bore sont du 10 B avec une masse de 10,0129 amu, et les 80,1 % restants sont du 11 B avec une masse de 11,0093 amu. La masse atomique moyenne du bore est calculée comme suit :
\ [\ begin {align*}
\ textrm {masse moyenne du bore} &= \ mathrm {(0,199 \ times10.0129 \ : amu) + (0,801 \ times11.0093 \ : amu)} \ \
&= \ mathrm {1,99 \ : amu+8,82 \ : amu} \ \
&= \ mathrm {10,81 \ : amu} \ {align+8,82 \ : amu}
\ {end *} \ aucun numéro \]
Il est important de comprendre qu'aucun atome de bore ne pèse exactement 10,8 amu ; 10,8 amu est la masse moyenne de tous les atomes de bore, et les atomes de bore individuels pèsent environ 10 amu ou 11 amu.
Une météorite trouvée dans le centre de l'Indiana contient des traces du néon de gaz rare capté par le vent solaire lors de son voyage dans le système solaire. L'analyse d'un échantillon du gaz a montré qu'il était composé de 91,84 % de 20 Ne (masse de 19,9924 amu), de 0,47 % de 21 Ne (masse de 20,9940 amu) et de 7,69 % de 22 Ne (masse de 21,9914 amu). Quelle est la masse moyenne du néon dans le vent solaire ?
Solution 1
\ [\ begin {align*}
\ mathrm {moyenne \ : masse} &= \ mathrm {(0,9184 \ times19,9924 \ : amu) + (0,0047 \ fois/20,9940 \ : amu) + (0,0769 \ times21,9914 \ : amu)} \ \
&= \ mathrm {(18,36+0,099+1,69) \ :amu} \
&= \ mathrm {20.15 \ : amu}
\ end {align*} \ nonumber \]
La masse moyenne d'un atome de néon dans le vent solaire est de 20,15 amu. (La masse moyenne d'un atome de néon terrestre est de 20,1796 amu. Ce résultat montre que nous pouvons trouver de légères différences dans l'abondance naturelle des isotopes, selon leur origine.)
Un échantillon de magnésium contient 78,70 % de 24 atomes de Mg (masse 23,98 amu), 10,13 % d'atomes de Mg (masse 24,99 amu) et 11,17 % d'atomes de Mg (masse 25,98 amu). Calculez la masse moyenne d'un atome de Mg.
- Réponse
-
24.31 amu
Nous pouvons également effectuer des variantes de ce type de calcul, comme indiqué dans l'exemple suivant.
Le chlore naturel se compose de 35 Cl (masse 34,96885 amu) et de 37 Cl (masse 36,96590 amu), avec une masse moyenne de 35,453 amu. Quelle est la composition en pourcentage du Cl en termes de ces deux isotopes ?
Solution
La masse moyenne de chlore est la fraction qui est égale à 35 Cl fois la masse de 35 Cl plus la fraction qui est égale à 37 Cl fois la masse de 37 Cl.
\[\mathrm{average\: mass=(fraction\: of\: ^{35}Cl\times mass\: of\: ^{35}Cl)+(fraction\: of\: ^{37}Cl\times mass\: of\: ^{37}Cl)} \nonumber \]
Si on laisse x représenter la fraction qui est de 35 Cl, alors la fraction qui est de 37 Cl est représentée par 1,00 − x.
(La fraction qui est de 35 Cl + la fraction de 37 Cl doit être égale à 1, de sorte que la fraction de 37 Cl doit être égale à 1,00 − la fraction de 35 Cl.)
En la substituant à l'équation de masse moyenne, nous avons :
\ [\ begin {align*}
\ mathrm {35.453 \ : amu} & =( x \ times 34,96885 \ : \ ce {amu}) + [(1,00-x) \ fois 36,96590 \ : \ ce {amu}] \ \
35,453 &=34,96885x+36,96590-36,96590x \ \
1,99705x &=1,513 \
x&= \ dfrac {1,513} {1,9705} =0,7576
\ end {align*} \ aucun numéro [\]
Ainsi, la résolution donne : x = 0,7576, ce qui signifie que 1,00 − 0,7576 = 0,2424. Le chlore est donc composé de 75,76 % de 35 Cl et de 24,24 % de 37 Cl.
Le cuivre naturel se compose de 63 Cu (masse de 62,9 296 amu) et de 65 Cu (masse de 64,9278 amu), avec une masse moyenne de 63,546 amu. Quelle est la composition en pourcentage du Cu en termes de ces deux isotopes ?
- Réponse
-
69,15 % Cu-63 et 30,85 % Cu-65
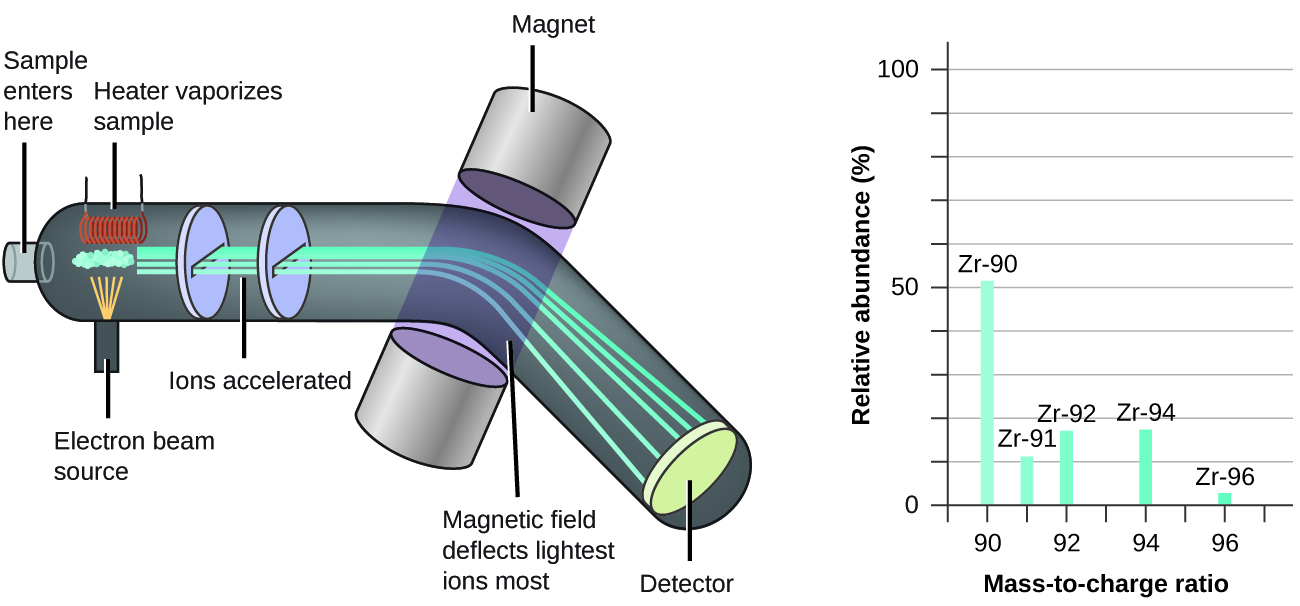
La présence et l'abondance naturelle des isotopes peuvent être déterminées expérimentalement à l'aide d'un instrument appelé spectromètre de masse. La spectrométrie de masse (MS) est largement utilisée en chimie, en criminalistique, en médecine, en sciences de l'environnement et dans de nombreux autres domaines pour analyser et aider à identifier les substances présentes dans un échantillon de matériau. Dans un spectromètre de masse classique (Figure\(\PageIndex{5}\)), l'échantillon est vaporisé et exposé à un faisceau d'électrons à haute énergie qui provoque la charge électrique des atomes (ou molécules) de l'échantillon, généralement en perdant un ou plusieurs électrons. Ces cations traversent ensuite un champ électrique ou magnétique (variable) qui dévie la trajectoire de chaque cation dans une mesure qui dépend à la fois de sa masse et de sa charge (de la même manière que la trajectoire d'un gros roulement à billes en acier passant devant un aimant est moins déviée que celle d'un petit BB en acier). Les ions sont détectés et un graphique du nombre relatif d'ions générés par rapport à leurs rapports masse/charge (spectre de masse) est établi. La hauteur de chaque caractéristique verticale ou pic d'un spectre de masse est proportionnelle à la fraction de cations ayant le rapport masse/charge spécifié. Depuis son utilisation initiale lors du développement de la théorie atomique moderne, la SEP a évolué pour devenir un puissant outil d'analyse chimique dans un large éventail d'applications.
Vidéo\(\PageIndex{1}\) : Regardez cette vidéo de la Royal Society for Chemistry pour une brève description des rudiments de la spectrométrie de masse.
Résumé
Un atome est constitué d'un petit noyau chargé positivement entouré d'électrons. Le noyau contient des protons et des neutrons ; son diamètre est environ 100 000 fois plus petit que celui de l'atome. La masse d'un atome est généralement exprimée en unités de masse atomique (amu), appelées masse atomique. Un amu est défini comme étant exactement\(1/12\) la masse d'un atome de carbone 12 et est égal à 1,6605\(\times\) 10 -24 g.
Les protons sont des particules relativement lourdes avec une charge de 1+ et une masse de 1,0073 amu. Les neutrons sont des particules relativement lourdes sans charge et d'une masse de 1 0087 amu. Les électrons sont des particules légères d'une charge de 1 − et d'une masse de 0,00055 amu. Le nombre de protons dans le noyau est appelé numéro atomique (Z) et est la propriété qui définit l'identité élémentaire d'un atome. La somme des nombres de protons et de neutrons dans le noyau est appelée nombre de masse et, exprimée en amu, est approximativement égale à la masse de l'atome. Un atome est neutre lorsqu'il contient un nombre égal d'électrons et de protons.
Les isotopes d'un élément sont des atomes ayant le même numéro atomique mais des numéros de masse différents ; les isotopes d'un élément ne diffèrent donc les uns des autres que par le nombre de neutrons au sein du noyau. Lorsqu'un élément naturel est composé de plusieurs isotopes, la masse atomique de l'élément représente la moyenne des masses des isotopes impliqués. Un symbole chimique identifie les atomes d'une substance à l'aide de symboles, qui sont des abréviations à une, deux ou trois lettres désignant les atomes.
Équations clés
- \(\mathrm{average\: mass}=\sum_{i}(\mathrm{fractional\: abundance \times isotopic\: mass})_i\)
Lexique
- anion
- atome ou molécule chargé négativement (contient plus d'électrons que de protons)
- masse atomique
- masse moyenne des atomes d'un élément, exprimée en amu
- unité de masse atomique (amu)
- (également unité de masse atomique unifiée, u, ou Dalton, Da) unité de masse égale à\(\dfrac{1}{12}\) la masse d'un atome de 12 C
- numéro atomique (Z)
- nombre de protons dans le noyau d'un atome
- cation
- atome ou molécule chargé positivement (contient moins d'électrons que de protons)
- symbole chimique
- abréviation à une, deux ou trois lettres utilisée pour représenter un élément ou ses atomes
- Dalton (Floride)
- unité alternative équivalente à l'unité de masse atomique
- unité de charge fondamentale
- (également appelée charge élémentaire) est égale à l'amplitude de la charge d'un électron (e) avec e = 1,602\(\times\) 10 −19 C
- ion
- atome ou molécule chargé électriquement (contient un nombre inégal de protons et d'électrons)
- numéro de masse (A)
- somme du nombre de neutrons et de protons dans le noyau d'un atome
- unité de masse atomique unifiée (u)
- unité alternative équivalente à l'unité de masse atomique


