2.4 : Formules chimiques
- Page ID
- 193949
- Symboliser la composition des molécules à l'aide de formules moléculaires et de formules empiriques
- Représenter l'arrangement de liaison des atomes au sein des molécules à l'aide de formules
Une formule moléculaire est une représentation d'une molécule qui utilise des symboles chimiques pour indiquer les types d'atomes suivis d'indices pour indiquer le nombre d'atomes de chaque type dans la molécule. (Un indice n'est utilisé que lorsque plus d'un atome d'un type donné est présent.) Les formules moléculaires sont également utilisées comme abréviations pour les noms des composés.
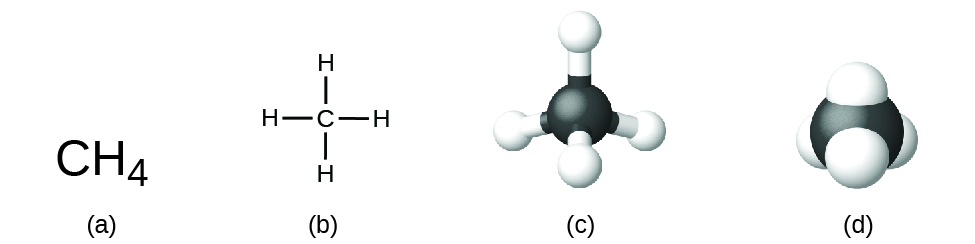
La formule structurale d'un composé fournit les mêmes informations que sa formule moléculaire (le type et le nombre d'atomes dans la molécule) mais montre également comment les atomes sont connectés dans la molécule. La formule structurale du méthane contient des symboles pour un atome C et quatre atomes H, indiquant le nombre d'atomes dans la molécule (Figure\(\PageIndex{1}\)). Les lignes représentent les liaisons qui maintiennent les atomes ensemble. (Une liaison chimique est une attraction entre des atomes ou des ions qui les maintient ensemble dans une molécule ou un cristal.) Nous discuterons des liaisons chimiques et verrons comment prédire la disposition des atomes dans une molécule plus tard. Pour l'instant, sachez simplement que les raies indiquent comment les atomes sont connectés dans une molécule. Un modèle à bille et à bâton montre la disposition géométrique des atomes dont la taille atomique n'est pas à l'échelle, et un modèle de remplissage d'espaces montre les tailles relatives des atomes.
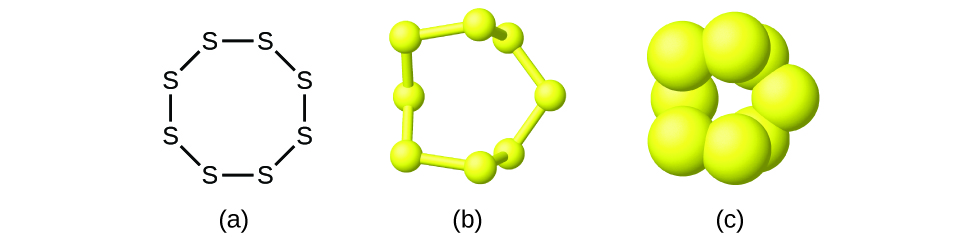
Bien que de nombreux éléments soient constitués d'atomes individuels distincts, certains existent sous forme de molécules composées de deux atomes ou plus de l'élément liés chimiquement entre eux. Par exemple, la plupart des échantillons des éléments hydrogène, oxygène et azote sont composés de molécules contenant deux atomes chacune (appelées molécules diatomiques) et ont donc les formules moléculaires H 2, O 2 et N 2, respectivement. Les autres éléments couramment présents sous forme de molécules diatomiques sont le fluor (F 2), le chlore (Cl 2), le brome (Br 2) et l'iode (I 2). La forme la plus courante de l'élément soufre est composée de molécules composées de huit atomes de soufre ; sa formule moléculaire est S 8 (Figure\(\PageIndex{2}\)).
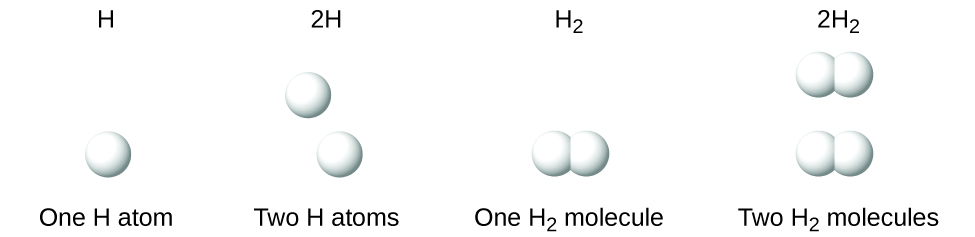
Il est important de noter qu'un indice suivant un symbole et un chiffre devant un symbole ne représentent pas la même chose ; par exemple, H 2 et 2H représentent des espèces nettement différentes. H 2 est une formule moléculaire ; elle représente une molécule diatomique d'hydrogène, composée de deux atomes de l'élément liés chimiquement entre eux. L'expression 2H, en revanche, indique deux atomes d'hydrogène distincts qui ne sont pas combinés en tant qu'unité. L'expression 2H 2 représente deux molécules d'hydrogène diatomique (Figure\(\PageIndex{3}\)).
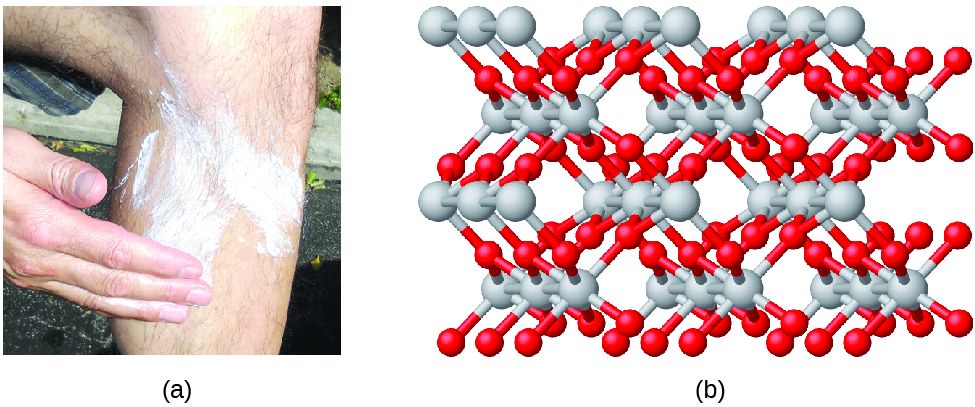
Les composés se forment lorsque deux éléments ou plus se combinent chimiquement, ce qui entraîne la formation de liaisons. Par exemple, l'hydrogène et l'oxygène peuvent réagir pour former de l'eau, et le sodium et le chlore peuvent réagir pour former du sel de table. Nous décrivons parfois la composition de ces composés à l'aide d'une formule empirique, qui indique les types d'atomes présents et le rapport le plus simple entre le nombre entier d'atomes (ou d'ions) dans le composé. Par exemple, le dioxyde de titane (utilisé comme pigment dans la peinture blanche et dans les écrans solaires épais, blancs et bloquants) a une formule empirique de TiO 2. Cela identifie les éléments titane (Ti) et oxygène (O) en tant que constituants du dioxyde de titane et indique la présence de deux fois plus d'atomes de l'élément oxygène que d'atomes de l'élément titane (Figure\(\PageIndex{4}\)).
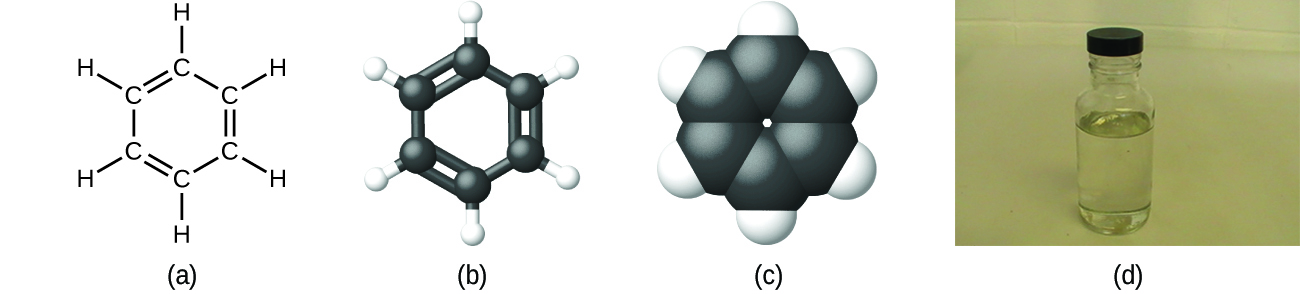
Comme indiqué précédemment, nous pouvons décrire un composé avec une formule moléculaire, dans laquelle les indices indiquent le nombre réel d'atomes de chaque élément d'une molécule du composé. Dans de nombreux cas, la formule moléculaire d'une substance est dérivée de la détermination expérimentale de sa formule empirique et de sa masse moléculaire (la somme des masses atomiques de tous les atomes composant la molécule). Par exemple, on peut déterminer expérimentalement que le benzène contient deux éléments, le carbone (C) et l'hydrogène (H), et que pour chaque atome de carbone du benzène, il y a un atome d'hydrogène. Ainsi, la formule empirique est CH. Une détermination expérimentale de la masse moléculaire révèle qu'une molécule de benzène contient six atomes de carbone et six atomes d'hydrogène, de sorte que la formule moléculaire du benzène est C 6 H 6 (Figure\(\PageIndex{5}\)).
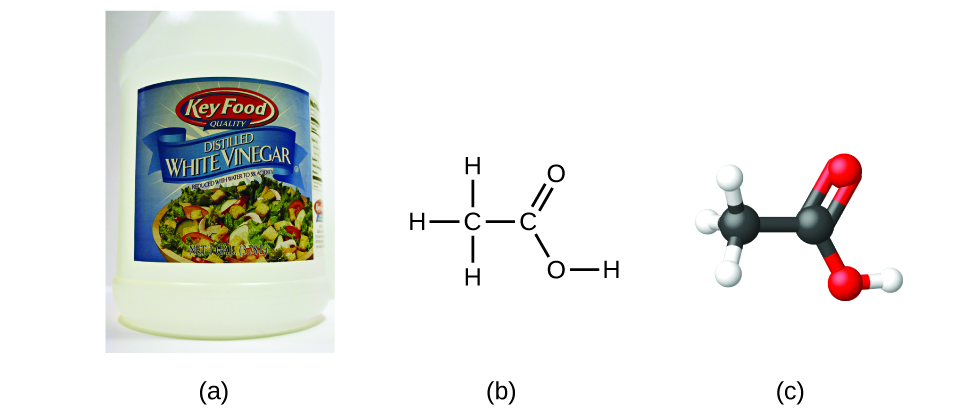
Si nous connaissons la formule d'un composé, nous pouvons facilement déterminer la formule empirique. (Il s'agit en quelque sorte d'un exercice académique ; la chronologie inverse est généralement suivie dans la pratique.) Par exemple, la formule moléculaire de l'acide acétique, le composant qui donne au vinaigre son goût prononcé, est C 2 H 4 O 2. Cette formule indique qu'une molécule d'acide acétique (Figure\(\PageIndex{6}\)) contient deux atomes de carbone, quatre atomes d'hydrogène et deux atomes d'oxygène. Le rapport des atomes est de 2:4:2. En divisant par le plus petit dénominateur commun (2), on obtient le ratio d'atomes le plus simple, 1:2:1, de sorte que la formule empirique est CH 2 O. Notez qu'une formule moléculaire est toujours un multiple entier d'une formule empirique.
Les molécules de glucose (sucre dans le sang) contiennent 6 atomes de carbone, 12 atomes d'hydrogène et 6 atomes d'oxygène. Quelles sont les formules moléculaires et empiriques du glucose ?
Solution
La formule moléculaire est C 6 H 12 O 6 car une molécule contient en fait 6 atomes de C, 12 H et 6 atomes d'O. Le rapport entier le plus simple entre les atomes C, H et O dans le glucose est de 1:2:1, donc la formule empirique est CH 2 O.
Une molécule de métaldéhyde (un pesticide utilisé pour les escargots et les limaces) contient 8 atomes de carbone, 16 atomes d'hydrogène et 4 atomes d'oxygène. Quelles sont les formules moléculaires et empiriques du métaldéhyde ?
- Réponse
-
Formule moléculaire, C 8 H 16 O 4 ; formule empirique, C 2 H 4 O
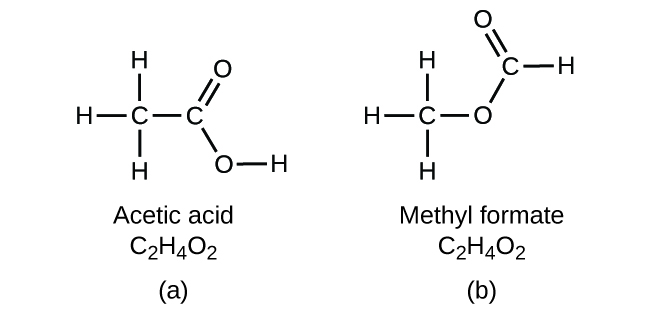
Il est important de savoir qu'il est possible que les mêmes atomes soient organisés de différentes manières : les composés ayant la même formule moléculaire peuvent avoir des liaisons atome-atome différentes et donc des structures différentes. Par exemple, pourrait-il y avoir un autre composé ayant la même formule que l'acide acétique, le C 2 H 4 O 2 ? Et si oui, quelle serait la structure de ses molécules ?
Si vous prédisez qu'un autre composé de formule C 2 H 4 O 2 pourrait exister, alors vous avez démontré de bonnes connaissances chimiques et avez raison. Deux atomes C, quatre atomes H et deux atomes O peuvent également être arrangés pour former du formiate de méthyle, qui est utilisé dans la fabrication, comme insecticide et pour les finitions à séchage rapide. Les molécules de formiate de méthyle possèdent l'un des atomes d'oxygène entre les deux atomes de carbone, ce qui diffère de la disposition des molécules d'acide acétique. L'acide acétique et le formiate de méthyle sont des exemples d'isomères, des composés ayant la même formule chimique mais des structures moléculaires différentes (Figure\(\PageIndex{7}\)). Notez que cette petite différence dans la disposition des atomes a un effet majeur sur leurs propriétés chimiques respectives. Vous ne voudriez certainement pas utiliser une solution de formiate de méthyle pour remplacer une solution d'acide acétique (vinaigre) lorsque vous préparez une vinaigrette.
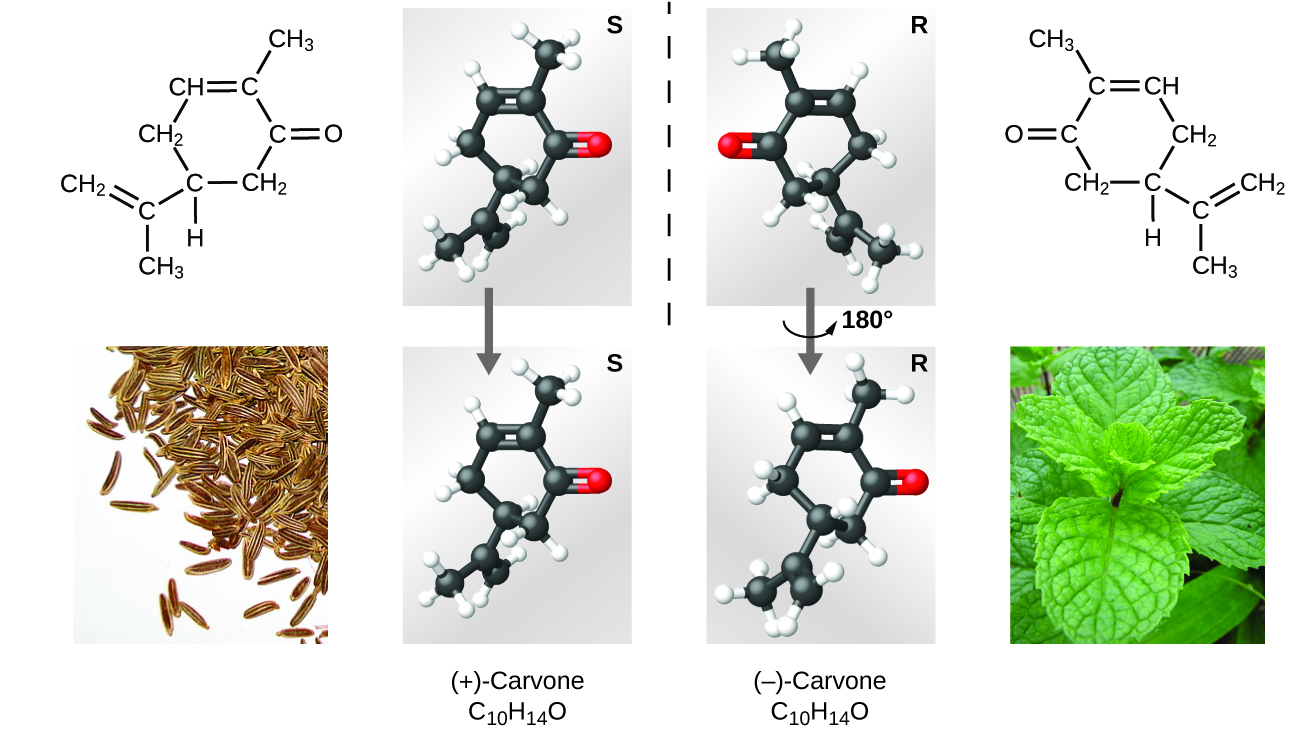
Il existe de nombreux types d'isomères (Figure\(\PageIndex{8}\)). L'acide acétique et le formiate de méthyle sont des isomères structuraux, des composés dans lesquels les molécules diffèrent quant à la façon dont les atomes sont connectés les uns aux autres. Il existe également différents types d'isomères spatiaux, dans lesquels les orientations relatives des atomes dans l'espace peuvent être différentes. Par exemple, le composé carvone (présent dans les graines de carvi, la menthe verte et les écorces de mandarine) est constitué de deux isomères qui sont des images miroir l'un de l'autre. La S - (+) -carvone sent le cumin et la R - (−) -carvone sent la menthe verte.
Résumé
Une formule moléculaire utilise des symboles chimiques et des indices pour indiquer le nombre exact des différents atomes d'une molécule ou d'un composé. Une formule empirique donne le ratio le plus simple des nombres entiers d'atomes dans un composé. Une formule structurale indique l'arrangement de liaison des atomes dans la molécule. Les modèles à bille et en bâton et les modèles de remplissage d'espace montrent la disposition géométrique des atomes dans une molécule. Les isomères sont des composés ayant la même formule moléculaire mais des arrangements atomiques différents.
Lexique
- formule empirique
- formule indiquant la composition d'un composé donnée comme étant le plus simple rapport entre nombres entiers d'atomes
- les isomères
- composés ayant la même formule chimique mais des structures différentes
- formule moléculaire
- formule indiquant la composition d'une molécule d'un composé et donnant le nombre réel d'atomes de chaque élément d'une molécule du composé.
- isomères spatiaux
- composés dans lesquels les orientations relatives des atomes dans l'espace diffèrent
- isomère structurel
- l'une des deux substances qui ont la même formule moléculaire mais des propriétés physiques et chimiques différentes parce que leurs atomes sont liés différemment
- formule structurale
- montre les atomes d'une molécule et la façon dont ils sont connectés


