答:物理和化学基础知识对微生物学很重要
- Page ID
- 200357
像所有其他物质一样,构成微生物的物质受化学和物理定律的支配。 微生物病原体(包括细胞和非细胞)的化学和物理特性决定了它们的栖息地,控制了它们的代谢过程,并决定了它们如何与人体相互作用。 本附录概述了化学和物理学的一些基本原理,这些原理对于理解微生物学至关重要。 本文中的许多章节,尤其是微生物生物化学和微生物代谢,都假设读者已经理解了这里提到的概念。
原子结构
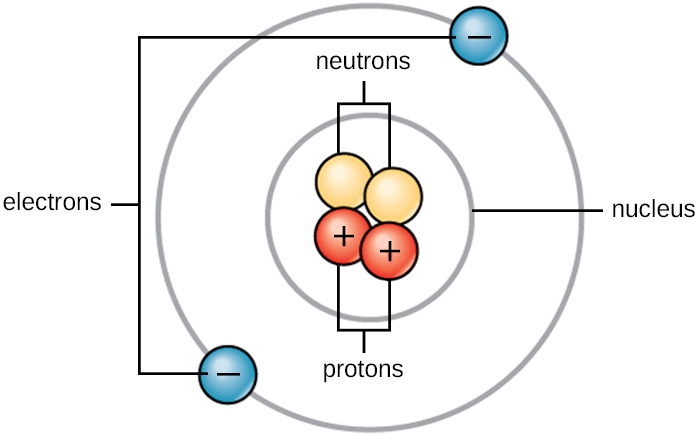
生命是由物质组成的。 物质占据空间并具有质量。 所有物质都是由原子组成的。 所有原子都包含质子、电子和中子(图\(\PageIndex{1}\))。 唯一的例外是氢气(H),它由一个质子和一个电子组成。 质子是一种带正电荷的粒子,位于原子核(原子的核心)中,质量为 1 原子质量单位 (amu),电荷为 +1。 电子是一种带负电荷的粒子,在原子核周围的空间中传播。 电子分布在不同的能级中,称为电子壳。 电子的质量可以忽略不计,电荷为—1。 中子,像质子一样,存在于原子的原子核中。 它们的质量为 1 amu 且无电荷(中性)。 正电荷(质子)和负(电子)电荷在净电荷为零的中性原子中相互平衡。 因为质子和中子的质量各为 1 amu,所以原子的质量等于该原子的质子和中子的数量。 电子的数量不计入总质量,因为电子质量太小了。
化学元素
所有物质都由元素的原子组成。 元素具有独特的物理和化学特性,是无法轻易在物理或化学上转化为其他物质的物质。 每个元素都有一个名称,通常源自拉丁语或英语。 元素还有一个或两个字母的符号代表名称;例如,钠 (Na)、金 (Au) 和银 (Ag) 的缩写分别源自其原始拉丁语名称 n atrium、aurum 和 ar gentum。 英文缩写的例子有碳 (C)、氢 (H)、氧 (O) 和氮 (N)。 共鉴定了118种不同的元素(其中92种是自然存在的),并将其组织成元素周期表。 在天然存在的元素中,在地球上的生物中发现的元素少于30种,其中四种(C、H、O和N)约占生物质量的96%。 1
每个独特的元素都由其原子核中的质子数量来标识。 除质子外,每个元素的原子核还含有相等或更多的中子(氢气除外,它只有一个质子)。 每个元素的质子总数被描述为原子序数,质子和中子的总质量称为原子质量或质量数。 因此,可以通过从质量数中减去原子序数来确定中子的数量。
同位素是相同元素的不同形式,具有相同数量的质子,但中子数量不同。 许多元素有几种同位素,自然界中有一两种常见的同位素。 例如,carbon-12(12 C)是最常见的碳同位素(占地球上发现的所有碳的98.6%),2 包含六个质子和六个中子。 因此,它的质量数为 12(6 个质子 + 6 个中子),原子序数为 6。
自然界中还有另外两种类型的同位素:重同位素和放射性同位素。 重同位素具有一个或多个额外的中子,同时仍能保持稳定的原子核。 重同位素的一个例子是碳13(13 C)(占所有碳的1.1%)。 3 13 C 的质量数为 13(6 个质子 + 7 个中子)。 由于 13 C 的原子序数为 6,它仍然是碳元素;但是,由于原子核中有多余的中子,它的质量比更常见的元素形式 12 C 还要大。 Carbon-14(14 C)(占所有碳的0.0001%)4 就是放射性同位素的一个例子。 14 C 的质量数为 14(6 个质子 + 8 个中子);但是,14 C 中多余的中子会导致原子核不稳定。 这种不稳定性导致了放射性衰变的过程。 放射性衰变涉及一个或多个中子的丢失以及伽玛射线、α粒子或β粒子(取决于同位素)形式的能量释放。
事实证明,碳和其他元素的重同位素和放射性同位素在研究、工业和医学中很有用。
化学键
在描述微生物学中分子内部和分子之间的相互作用时,有三种类型的化学键很重要:(1)共价键,可以是极性或非极性;(2)离子键;(3)氢键。 在描述原子分子间相互作用的物理和化学特性时,也可以讨论其他类型的相互作用,例如伦敦色散力和范德华力,但我们在这里不描述这些力。
化学键由原子的最外层电子壳(称为价电子(VE))决定。 在确定原子将形成的化学键的数量和类型时,VE 的数量很重要。
共价债券
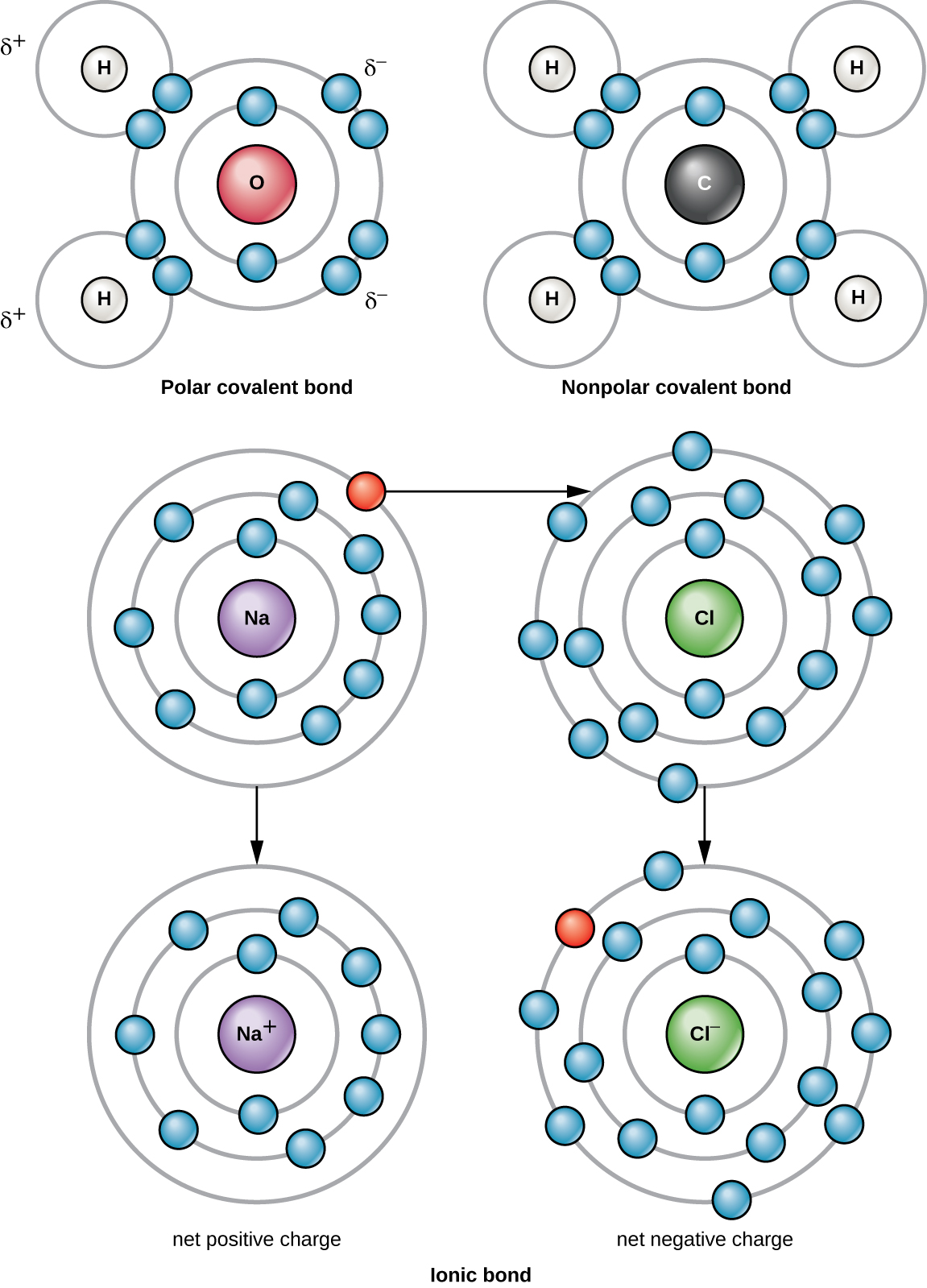
两个或多个原子之间最强的化学键是共价键。 这些键是在两个原子之间共享电子时形成的,它们是活生物体中最常见的化学键形式。 构成我们细胞中生物分子的元素的原子之间形成共价键。 由共价键形成的简单分子的一个例子是水 H 2 O,每个 H 原子有一个 VE,每个 O 原子有 6 个 VE。 由于 VE 配置,每个 H 原子能够额外接受一个 VE,每个 O 原子能够接受另外两个 VE。 共享电子时,结合形成水分子的氢原子和氧原子通过共价键结合在一起(图\(\PageIndex{2}\))。 来自氢原子的电子将其时间分散在氢原子的外部电子壳和氧原子的最外层电子壳之间。 要完全填充氧原子的外壳,需要来自两个氢原子的两个电子,因此下标 “2” 表示 H 2 O 分子中有两个 H 原子。与未填充外壳的情况下存在的所有原子相比,这种共享的能量状态要低。
共价键有两种类型:极性和非极性。 非极性共价键在相同或不同元素的两个原子之间形成,它们平等共享电子(图\(\PageIndex{2}\))。 在极性共价键中,原子共享的电子在靠近一个原子核的时间比离另一个原子核更近的时间长。 由于不同原子核之间的电子分布不均匀,因此会产生略带正电荷(α+)或略为负(β—)的电荷。 水是用极性共价键形成的分子的一个例子(图\(\PageIndex{2}\))。
离子和离子键
当原子不包含相等数量的质子和电子时,它被称为离子。 因为电子的数量不等于质子的数量,所以每个离子都有净电荷。 正离子是通过丢失电子形成的,被称为阳离子。 负离子是通过获得电子形成的,被称为阴离子。
例如,钠原子的最外壳中只有一个电子。 钠原子捐出一个电子所消耗的能量要少于再接受七个电子所需的能量,而这七个电子需要这些电子才能填充其外壳。 如果钠原子失去一个电子,它现在有 11 个质子,只有 10 个电子,剩下的总电荷为 +1。 它现在被称为钠离子(Na +)。
氯原子的外壳中有七个电子。 同样,氯原子获得一个电子比失去七个电子更节能。 因此,它更有可能获得电子以形成具有17个质子和18个电子的离子,从而产生净负(—1)电荷。 它现在被称为氯离子(Cl —)。 电子从一个原子到另一个原子的这种运动被称为电子转移。 由于正电荷和负电荷会吸引,因此这些离子会保持在一起并在离子之间形成离子键或键。 当 Na + 和 Cl — 离子结合产生 NaCl 时,来自钠原子的电子与其他七个来自氯原子的电子停留,钠和氯离子在净电荷为零的离子晶格中相互吸引(图\(\PageIndex{2}\))。
多原子离子由由共价键连接的多个原子组成;但与分子不同,多原子离子具有正电荷或负电荷。 它表现为阳离子或阴离子,因此可以与其他离子形成离子键以形成离子化合物。 多原子离子中的原子可能来自相同的元素或不同的元素。
表中\(\PageIndex{1}\)列出了微生物学中常见的一些阳离子和阴离子。 请注意,此表包括单原子和多原子离子。
| 阳离子 | 阴离子 | ||
|---|---|---|---|
| 钠 | 钠 + | 氯化物 | Cl — |
| 氢气 | H + | 碳酸氢盐 | \(\ce{HCO3-}\) |
| 钾 | K + | 碳酸盐 | \(\ce{CO3^2-}\) |
| 氨 | \(\ce{NH4+}\) | 硫酸氢 | \(\ce{H2SO4^2-}\) |
| 铜 (I) | 铜 + | 硫化氢 | HS — |
| 铜 (II) | Cu 2+ | 氢氧化物 | 哦 — |
| 铁(二) | 铁 2+ | 次氯酸盐 | ClO — |
| 铁(三) | 铁 3+ | 亚硝酸盐 | \(\ce{NO2-}\) |
| 硝酸盐 | \(\ce{NO3-}\) | ||
| 过氧化物 | \(\ce{O2^2-}\) | ||
| 磷酸盐 | \(\ce{PO4^3-}\) | ||
| 焦磷酸盐 | \(\ce{P2O7^4-}\) | ||
| 亚硫酸盐 | \(\ce{SO3^2-}\) | ||
| 硫代硫酸盐 | \(\ce{S2O3^2-}\) | ||
分子式、分子质量和内尔
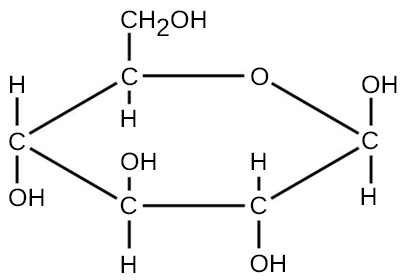
对于由共价键形成的分子,分子式表示构成该分子的元素原子的数量和类型。 例如,以葡萄糖分子为例,其分子式为 C 6 H 12 O 6。 该分子式表示葡萄糖的单分子由六个碳原子、十二个氢原子和六个氧原子组成。
分子的分子质量可以使用分子式和分子中每个元素的原子质量来计算。 将每种类型的原子的数量乘以原子质量;然后将乘积相加得出分子质量。 例如,葡萄糖的分子量 C 6 H 12 O 6(图\(\PageIndex{3}\))计算公式为:
\ [\ begin {array} {l}
\ text {碳质量} & =12\:\ frac {\ mathrm {amu}} {\ mathrm {atom}}\ times 6\ text {amu} =72
\ text {amu}\\ text {\ mathrm {amu}} {\ mathrm {atom}}\ times 12\ text {atoms} =12\ text {amu}\\
\ text {氧气质量} &; =16\:\ frac {\ mathrm {amu}} {\ mathrm {atom}}\ times 6\ text {atoms} =96\ text {amu}\\ text {amu} =96\ text {amu}
\ end {array}\]
通过实验确定构成鼹鼠的实体数量为6.022×10 23,这是一个名为 Avogadro 数 (NA) 或 Avog adro 常数的基本常数。 该常数可以正确报告,明确单位为 “每摩尔”。
能源
热力学是指研究涉及物理物质的能量和能量传递。
参与特定能量传递案例的物质被称为系统,该物质之外的所有事物都称为周围环境。 有两种类型的系统:开放式和封闭式。 在开放系统中,能量可以与周围环境交换。 封闭的系统无法与周围环境交换能量。 生物是开放系统。 当它们使用来自太阳的能量进行光合作用或消耗能量储存分子并通过工作和释放热量向环境释放能量时,它们与周围环境之间会交换能量。 像物理世界中的所有事物一样,能量受物理定律的约束。 一般而言,能量被定义为工作或创造某种变化的能力。 能量以不同的形式存在。 例如,电能、光能和热能都是不同类型的能量。 热力学第一定律,通常被称为能量守恒定律,它指出,宇宙中的总能量是恒定和守恒的。 能量以许多不同的形式存在。 根据热力学第一定律,能量可以从一个地方转移到另一个地方,也可以转化为不同的形式,但不能被创造或摧毁。
所有活生物体面临的挑战是从周围环境中获取能量,这些能量可以转移或转化为可用能量来工作。 微生物已经进化以应对这一挑战。 储存在糖和脂肪等有机分子中的化学能通过一系列细胞化学反应转移并转化为ATP分子内的能量。 ATP 分子中的能量很容易就能起作用。 细胞需要做的工作类型的例子包括构建复杂的分子、运输材料、为纤毛或鞭毛的运动提供动力,以及收缩肌肉纤维以产生运动。
微生物的主要任务是获取、转化和使用能量来工作,可能看起来很简单。 但是,热力学第二定律解释了为什么这些任务比看起来要困难得多。 所有的能量转移和转换从来都不是完全有效的。 在每一次能量传递中,一定数量的能量都会以无法使用的形式流失。 在大多数情况下,这种形式是热能。 从热力学上讲,热能被定义为从一个系统转移到另一个系统的不起作用的能量。 例如,在细胞代谢反应过程中,一些能量作为热能流失。
系统向周围环境损失的能量越多,系统的秩序就越少,随机性就越强。 科学家将衡量系统内随机性或无序性的方法称为熵。 高熵意味着高混乱和低能量。 分子和化学反应也有不同的熵。 例如,当一个地方的高浓度分子扩散和扩散时,熵会增加。 热力学第二定律说,在能量转移或转化中,能量总是会像热量一样流失。 微生物是高度有序的,需要恒定的能量输入才能保持在低熵状态。
化学反应
当两个或多个原子结合在一起形成分子或当键合的原子分解时,就会发生@@ 化学反应。 化学反应中使用的物质被称为反应物(通常位于化学方程式的左侧),反应产生的物质被称为产物(通常位于化学方程式的右侧)。 通常在反应物和产物之间画一个箭头来表示化学反应的方向;这个方向并不总是 “单行道”。
简单化学反应的一个例子是过氧化氢分子的分解,每个过氧化氢分子由两个与两个氧原子(H 2 O 2)结合的氢原子组成。 反应物过氧化氢被分解成水,其中包含一个与两个氢原子(H 2 O)结合的氧原子,以及由两个键合的氧原子(O 2)组成的氧。 在以下方程中,该反应包括两个过氧化氢分子和两个水分子。 这是一个平衡化学方程的示例,其中方程两侧每个元素的原子数是相同的。 根据物质守恒定律,化学反应前后的原子数应相等,这样在正常情况下就不会产生或摧毁任何原子。
\[\ce{2H2O2\:(hydrogen\: peroxide)⟶2H2O\:(water) + O2\:(oxygen)}\]
一些化学反应,例如上面所示的化学反应,可以朝一个方向进行,直到反应物全部用完。 描述这些反应的方程包含一个单向箭头,并且是不可逆的。 可逆反应是指可以朝任一方向发展的反应。 在可逆反应中,反应物被转化为产物,但是当产物的浓度超过一定阈值(特定反应的特征)时,其中一些产物将被转化为反应物;此时,产物和反应物的名称被颠倒了。 浓度的变化一直持续到反应物和产物之间的浓度达到一定的相对平衡为止,这种状态称为化学平衡。 此时,正向和反向反应都在继续发生,但它们的发生速度相同,因此反应物和产物的浓度没有变化。 这些可逆反应的情况通常用化学方程表示,双头箭头指向反应物和产物。 例如,当二氧化碳溶解在水中时,它可以作为溶解在水中的气体,也可以通过与水反应产生碳酸。 在某些微生物的细胞中,碳酸酐酶加速了碳酸的产生速度,如以下方程所示:
\[\ce{CO2 + H2O \stackrel{carbonic}{\stackrel{anhydrase}{\rightleftharpoons}} H2CO3 \rightleftharpoons H+ + HCO3-}\]
水和溶液的特性
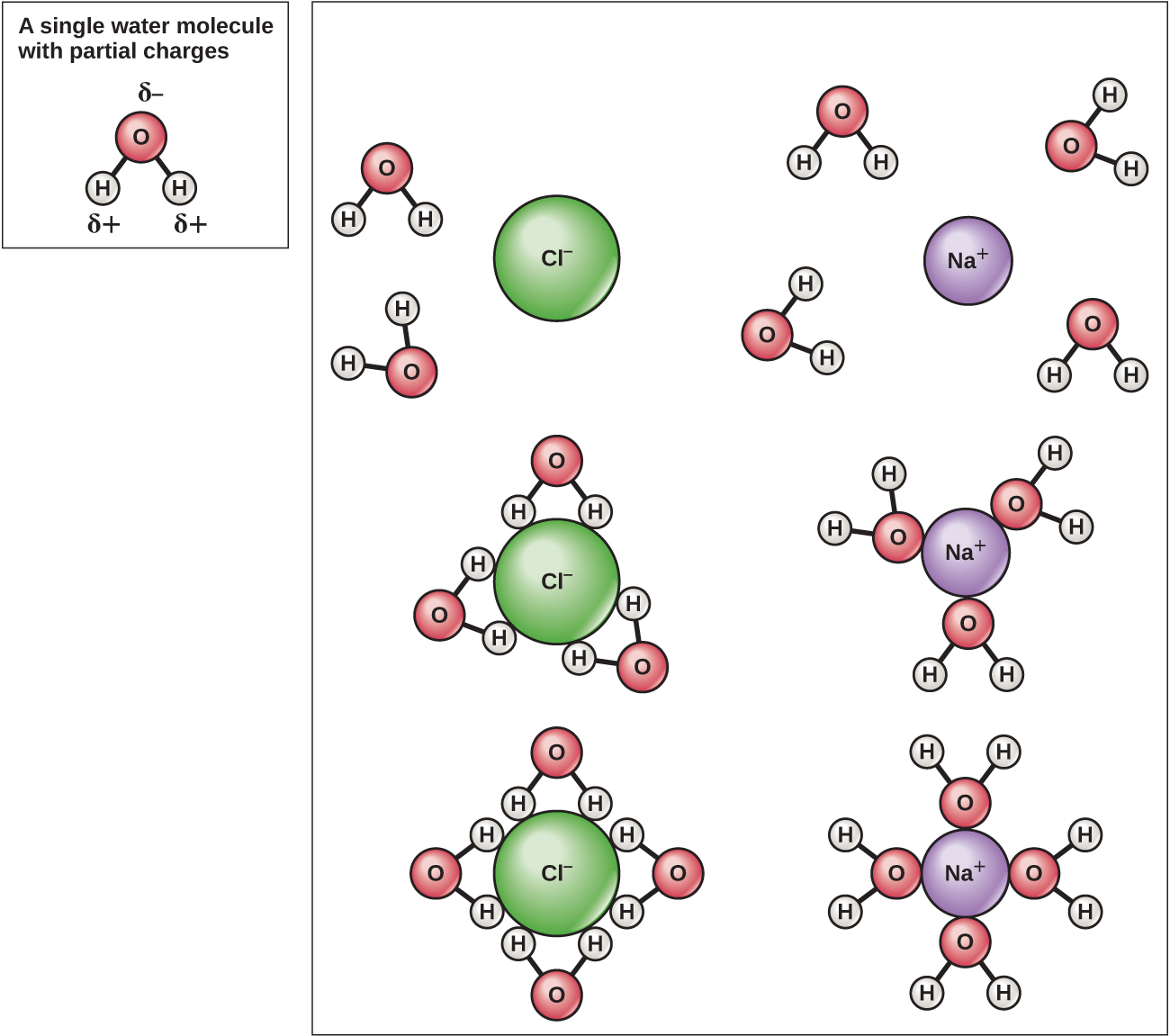
水分子中的氢和氧原子形成极性共价键。 水分子没有总电荷,但是每个氢原子上有一个 +,氧原子上有两个电荷。 每个水分子都会吸引其他水分子,因为分子的不同部分有正负电荷(图\(\PageIndex{4}\))。 水还会吸引其他极性分子(例如糖),形成氢键。 当一种物质容易与水形成氢键时,它可以溶解在水中,被称为亲水性(“爱水”)。 氢键不容易由油和脂肪等非极性物质形成。 这些非极性化合物具有疏水性(“防水”),可远离水并避开水。
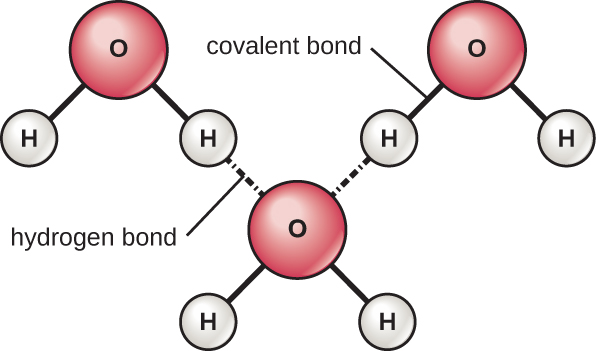
水中的氢键使其吸收和释放热能的速度比许多其他物质更慢。 这意味着水可以缓和生物体内部及其环境中的温度变化。 随着能量输入的继续,氢键形成和断开之间的平衡朝着更少的氢键的方向转变:断开的键多于形成的键。 这个过程导致在称为蒸发的过程中在液体表面(例如水体、植物的叶子或生物体的皮肤)释放单个水分子。
相反,随着分子运动的减少和温度的下降,破坏水分子之间氢键的能量就会减少。 这些键保持完好无损,开始形成坚硬的晶格状结构(例如冰)。 冷冻时,冰的密度低于液态水(分子相距更远)。 这意味着冰漂浮在水体表面。 在湖泊、池塘和海洋中,水面会形成冰,形成隔热屏障,保护地下的动植物免受水中冻结。 如果不发生这种情况,生活在水中的动植物将冻结在冰块中,无法自由移动,从而使在寒冷的温度下生活变得困难或不可能。
由于水是极性的,具有轻微的正负电荷,因此离子化合物和极性分子很容易溶解在其中。 因此,水就是所谓的溶剂,一种能够溶解另一种物质的物质。 带电粒子将与周围的水分子层形成氢键。 这被称为水合球,用于保持离子在水中的分离或分散(图\(\PageIndex{5}\))。 这些水合球也被称为补水壳。 水分子的极性使其成为一种有效的溶剂,在生命系统中的许多作用中起着重要作用。
昆虫漂浮和滑过池塘水的能力源于凝聚力的特性。 在凝聚力中,水分子相互吸引(因为氢键),使分子在液体-空气(气体)界面处保持在一起。 凝聚力会产生表面张力,即物质在张力或应力下承受破裂的能力。
这些凝聚力还与水的粘附特性或水分子与其他分子之间的吸引力有关。 当水 “爬上” 放在一杯水中的吸管时,就会观察到这种情况。 你会注意到吸管两侧的水似乎比中间的水高。 这是因为水分子被吸附在吸管上,因此会粘附在吸管上。
内聚力和粘附力也是细菌菌落和生物膜形成的因素。 凝聚力保持菌落完好无损(帮助它 “粘住” 在表面上),而粘附则使细胞相互粘附。 凝聚力和粘合力对于维持生命很重要。 例如,由于这些力量,自然环境中的水为细菌和古生物细胞粘附和积聚在表面提供了必要的条件。
酸和碱
溶液的 pH 值是氢离子 (H +) 和氢氧化物离子 (OH —) 浓度的度量,分别被描述为酸度或碱度。 酸度和碱度(也称为碱度)可以测量和计算。pH 可以简单地用数学方程表示\(\mathrm{pH=-\log_{10}[H^+]}\)。 在方程的左侧,“p” 表示 “的负对数”,H 表示 [H +]。 在方程的右侧,[H +] 是以摩尔/升为单位的 H + 浓度。 这个简单的方程式中没有表示的是 OH — 的贡献,它也参与酸度或碱度。 计算 pH 值会得出 0 到 14 的数字范围,称为 pH 标度(图\(\PageIndex{6}\))。 介于 0 和 6.9 之间的 pH 值表示酸。 由于 [H +] 浓度高,[OH —] 浓度低,它也被称为低 pH 值。 介于 7.1 和 14 之间的 pH 值表示碱性或碱性。 由于 [H +] 和高 [OH —] 浓度,它也被称为高 pH 值。 pH 值为 7 被描述为中性 pH 值,当 [H +] 等于 [OH —] 时出现。

pH 标度上一个单位的变化表示 [H +] 的变化系数为 10,两个单位的变化表示 [H +] 的变化系数 100。 因此,pH 值的微小变化表示 [H +] 的巨大变化。
脚注
- 1 Schrijver、Karel 和 Iris Schrijver。 与星共存:人体如何与地球、行星和恒星的生命周期相联系。 牛津大学出版社,美国,2015。
- 2 美国国家海洋和大气管理局,“二氧化碳的稳定和放射性碳同位素”。 网页。 已于 2016 年 2 月 19 日访问 [http://www.esrl.noaa.gov/gmd/outreac...hemistry.html]
- 3 同上。
- 4 同上。


