19.1:超敏反应
- Page ID
- 200125
学习目标
- 识别和比较 I 型、II 型、III 型和 IV 型超敏反应的区别特征、机制和主要示例
临床重点:第 1 部分
40 岁的航空公司飞行员克里(Kerry)已经预约了她的初级保健医生,讨论每当她在阳光下度过时光时都会出现的皮疹。 正如她向医生解释的那样,这似乎不像晒伤。 她注意不要在阳光下待太多时间,她会使用防晒霜。 尽管采取了这些预防措施,但皮疹仍然出现,表现为红色凸起的斑块,略带鳞片状。 皮疹每次持续7到10天,而且似乎在很大程度上会自行消失。 最近,皮疹也开始出现在她的脸颊上以及额头两侧的眼睛上方。
练习\(\PageIndex{1}\)
- Kerry 担心是对的吗?还是她应该更加谨慎地暴露在阳光下?
- 凯里的医生应该考虑阳光照射可能带来什么情况吗?
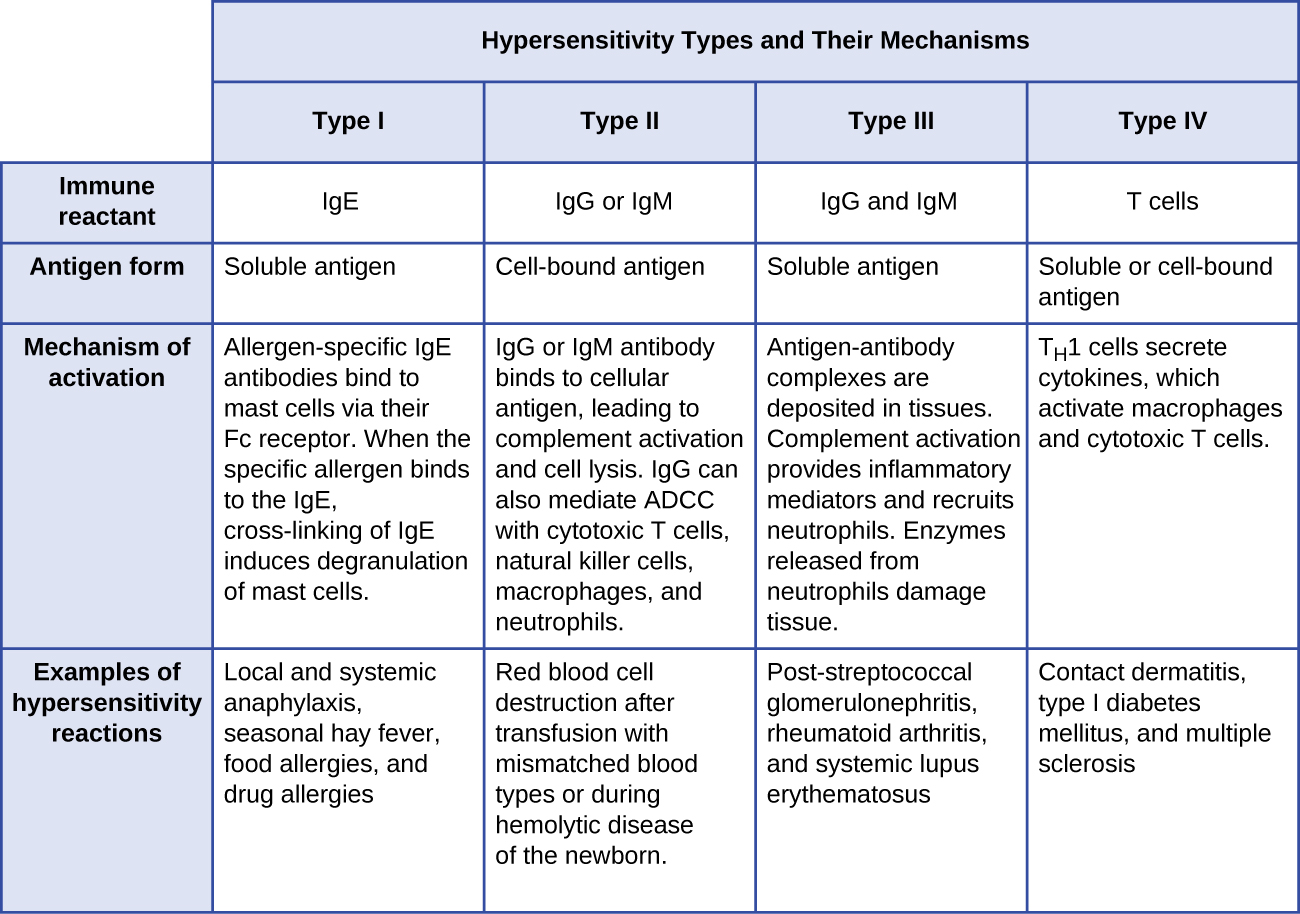
在《适应性特异性宿主防御》中,我们讨论了体液和细胞适应性免疫防御保护我们免受传染病侵害的机制。 但是,同样的保护性免疫防御也可能导致不良反应,称为超敏反应。 超敏反应按其免疫机制分类。
- I 型超敏反应涉及针对可溶性抗原的免疫球蛋白 E (IgE) 抗体,触发肥大细胞脱颗粒。
- II 型超敏反应涉及针对细胞抗原的 IgG 和 IgM 抗体,导致由其他免疫系统效应因子介导的细胞损伤。
- III 型超敏反应涉及 IgG、IgM 和(偶尔)IgA 1 抗体与抗原的相互作用以形成免疫复合物。 免疫复合物在组织中的积累会导致由其他免疫系统效应因子介导的组织损伤。
- IV 型超敏反应是 T 细胞介导的反应,可能涉及活化巨噬细胞和细胞毒性 T 细胞介导的组织损伤。
I 型超敏反应
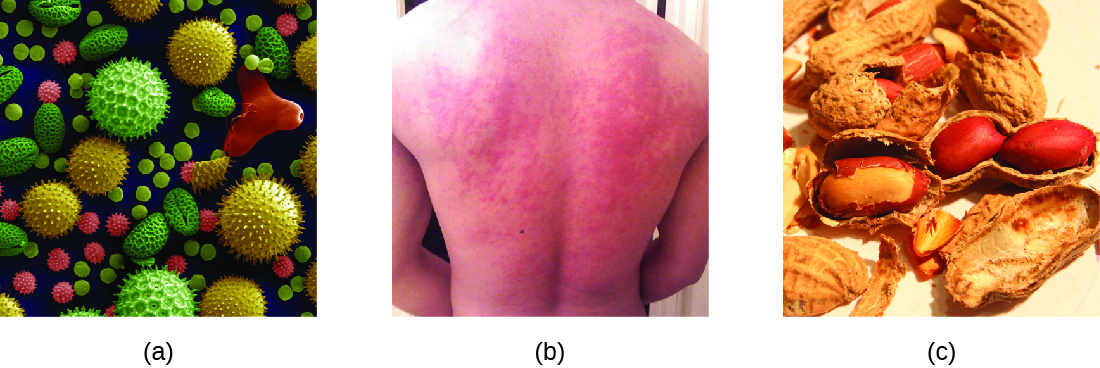
当呈现的个体暴露于过敏原时,它可能导致快速的免疫反应,这种反应几乎立即发生。 这种反应被称为过敏,被归类为I型超敏反应。 过敏原可能是看似无害的物质,例如动物皮屑、霉菌或花粉。 过敏原也可能是被认为天生危险性更高的物质,例如昆虫毒液或治疗药物。 随着个人对花生或贝类等食物过敏,食物不耐受也会产生过敏反应(图\(\PageIndex{1}\))。 无论是哪种过敏原,首次接触都会激活原发性 IgE 抗体反应,使个体在后续接触时对 I 型超敏反应敏感。
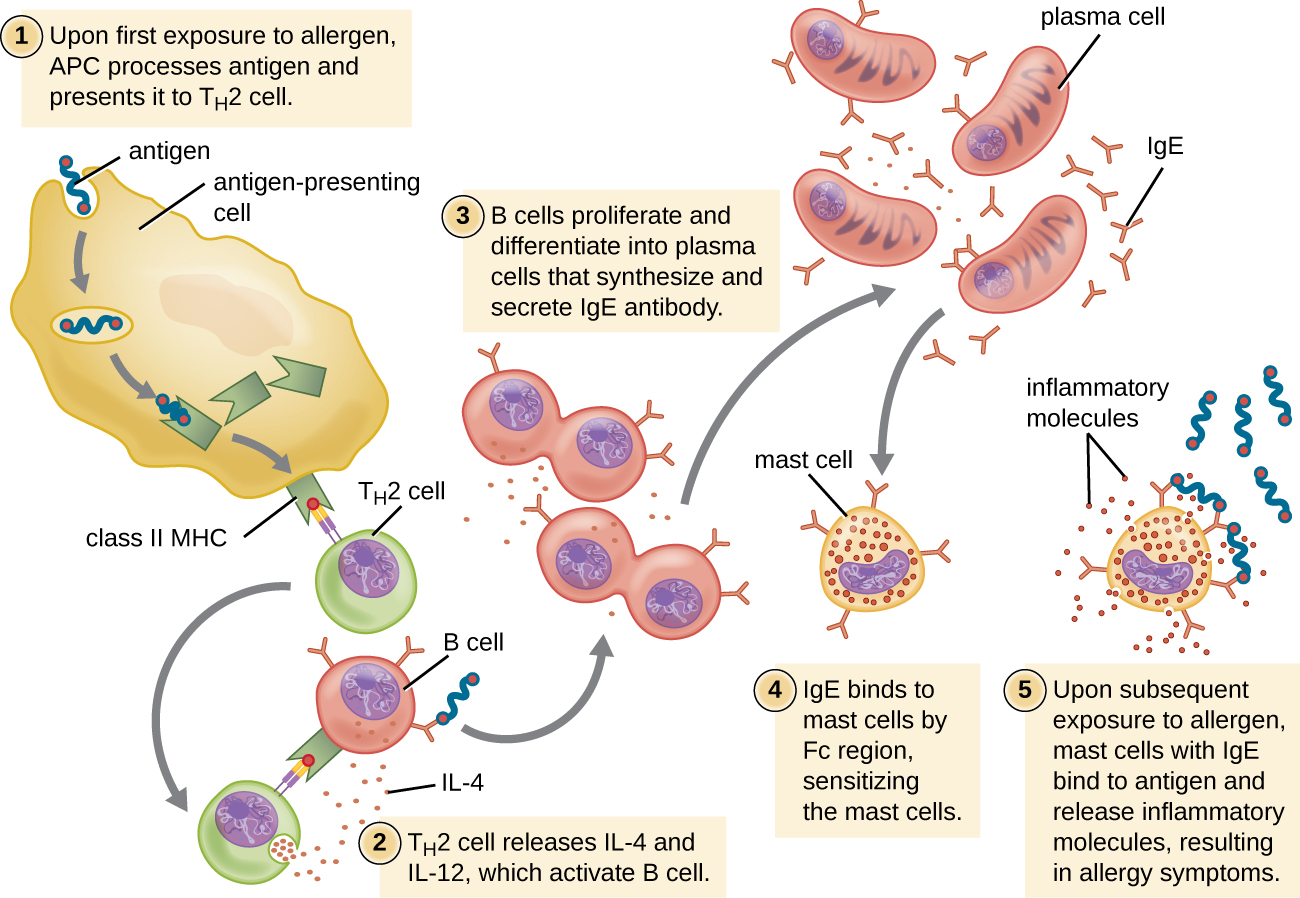
对于易感人群,首次接触过敏原会激活强烈的 T H 2 细胞反应(图\(\PageIndex{2}\))。 来自 T H 2 细胞的细胞因子白介素 (IL) -4 和 IL-13 激活对同一过敏原特异的 B 细胞,从而导致克隆增殖、分化为浆细胞,以及抗体类别从 IgM 的产生转变为 IgE 的产生。 IgE 抗体的片段可结晶 (Fc) 区域与全身肥大细胞表面的特异受体结合。 据估计,每个肥大细胞最多可以结合 500,000 个 IgE 分子,每个 IgE 分子有两个过敏原特异性片段抗原结合(Fab)位点可用于在后续暴露时结合过敏原。 当这种情况发生时,过敏原通常已经不存在,也没有过敏反应,但是肥大细胞已经为随后的暴露做好了准备,个体对过敏原已经过敏。
在随后的暴露中,过敏原会与肥大细胞上的多个 IgE 分子结合,交联 IgE 分子。 几分钟之内,IgE 的这种交联就会激活肥大细胞并触发脱颗粒,在这种反应中,肥大细胞中的颗粒内容物被释放到细胞外环境中。 颗粒中释放的预成分包括组胺、血清素和缓激素(表\(\PageIndex{1}\))。 活化的肥大细胞还会释放新形成的脂质介质(来自膜蛛网膜酸代谢的白三烯和前列腺素)和细胞因子,例如肿瘤坏死因子(表\(\PageIndex{2}\))。
| 颗粒成分 | 活动 |
|---|---|
| 肝素 | 刺激 bradykinin 的产生,这会导致血管通透性增加、血管舒张、细支气管收缩和粘液分泌增加 |
| 组胺 | 导致平滑肌肉收缩,增加血管通透性,增加粘液和泪液的形成 |
| 血清素 | 增加血管通透性,导致血管舒张和平滑肌收缩 |
肥大细胞释放的化学介质共同引起炎症以及与I型超敏反应相关的体征和症状。 组胺刺激鼻道粘液分泌和泪腺形成泪液,促进过敏的流鼻涕和水汪汪的眼睛。 组胺与神经末梢的相互作用会导致瘙痒和打喷嚏。 由多种介质引起的血管舒张可导致荨麻疹、头痛、血管性水肿(肿胀通常影响嘴唇、喉咙和舌头)和低血压(低血压)。 某些化学介质引起的细支气管收缩会导致喘息、呼吸困难(呼吸困难)、咳嗽,在更严重的情况下,还会导致紫绀(皮肤或粘膜呈蓝色)。 呕吐可能是由组胺和血清素刺激小脑呕吐中枢引起的。 组胺还可导致肠道平滑肌松弛和腹泻。
| 化学调解人 | 活动 |
|---|---|
| Le ukot riene | 导致平滑肌肉收缩和粘液分泌,增加血管通透性 |
| 前列腺素 | 导致平滑肌收缩和血管舒张 |
| TNF-α(细胞因子) | 引起炎症并刺激其他细胞类型产生细胞因子 |
I 型超敏反应可以是局部的,也可以是全身性的。 局部的 I 型超敏反应包括花粉症、鼻炎、荨麻疹和哮喘(表\(\PageIndex{3}\))。 全身性 I 型超敏反应被称为过敏反应或过敏性休克。 尽管过敏反应与局部的 I 型超敏反应有许多共同的症状,但舌头和气管肿胀、呼吸道阻塞、血压危险下降和休克的发展会使过敏反应特别严重并危及生命。 实际上,死亡可能在体征和症状出现后的几分钟内发生。
I 型超敏反应的后期反应可能在早期阶段 4-12 小时后出现,由肥大细胞释放的趋化因子招募的嗜酸性粒细胞、中性粒细胞和淋巴细胞介导。 激活这些招募的细胞会导致更多的化学介质释放,这些介质会导致组织损伤以及皮肤肿胀和发红、咳嗽、喘息和鼻腔分泌物的后期症状。
拥有适应不良特征(例如对环境中原本无害成分的强烈I型超敏反应)基因的人的生殖成功率预计会降低。 在这种进化选择性压力下,预计这些特征不会在人群中持续存在。 这表明 I 型超敏反应可能具有适应功能。 有证据表明,在I型超敏反应期间产生的IgE实际上是为了对抗蠕虫感染 2. 蠕虫是为数不多的具有 IgE 靶向蛋白质的生物之一。 此外,有证据表明,年轻时感染蠕虫会降低以后生活中对无害物质产生I型超敏反应的可能性。 因此,过敏可能是哺乳动物谱系中大量选择防御寄生虫或更早出现的不幸后果。
| 常用名 | 原因 | 体征和症状 |
|---|---|---|
| 过敏性哮喘 | 吸入过敏原 | 支气管收缩、呼吸困难、咳嗽、寒战、身体疼痛 |
| 过敏反应 | 对过敏原的全身反应 | 荨麻疹、瘙痒、舌喉肿胀、恶心、呕吐、低血压、休克 |
| 花粉症 | 吸入霉菌或花粉 | 流鼻涕、水汪汪的眼睛、打喷嚏 |
| 麻疹(荨麻疹) | 食物或药物过敏原、昆虫蜇伤 | 凸起、凹凸的皮疹伴有瘙痒;肿块可能会汇聚到较大的凸起区域 |
练习\(\PageIndex{2}\)
- 引起I型超敏反应的细胞有哪些?
- 描述即时和晚期 I 型超敏反应之间的区别。
- 列出过敏反应的体征和症状。
卫生假说
在大多数现代社会中,良好的卫生习惯与定期洗澡有关,而良好的健康与清洁有关。 但是最近的一些研究表明,健康与清洁生活之间的关联可能是错误的。 有些人甚至建议,为了健康起见,应该鼓励孩子在泥土里玩耍,甚至吃泥土 3。 该建议基于所谓的卫生假说,该假设提出,儿童接触来自各种微生物的抗原可以在以后的生活中改善免疫系统的功能。
卫生假说最早是由戴维·斯特拉坎 4 于1989年提出的,他观察到家庭中年龄较大的孩子的数量与花粉症的发病率之间呈反比关系。 尽管在20世纪中叶,儿童花粉症急剧增加,但子女较多的家庭的发病率要低得多。 斯特拉坎提出,大家庭中过敏发病率较低可能与年长的兄弟姐妹感染有关,这表明这些感染使孩子不太容易受到过敏的影响。 斯特拉坎还认为,20世纪家庭规模缩小和更加重视清洁的趋势减少了病原体的接触,从而导致过敏、哮喘和其他免疫疾病的总体发病率上升。
其他研究人员观察到,免疫失调和传染病的发病率呈反比关系,传染病现在在工业化国家很少见,但在工业化程度较低的国家仍然很常见。 5 在发达国家,5 岁以下的儿童不会接触到他们几乎肯定会在一个世纪前遇到的许多微生物、分子和抗原。 人类及其祖先进化的生物缺乏对免疫系统的早期挑战,可能会导致以后的免疫系统功能失效。
II 型(细胞毒性)超敏反应
归类为II型超敏反应或细胞毒性超敏反应的免疫反应由与基底膜上的细胞表面抗原或基质相关抗原结合的IgG和IgM抗体介导。 这些抗体可以激活补体,从而导致靶向细胞的炎症反应和裂解,也可以与细胞毒性 T 细胞一起参与抗体依赖性细胞介导的细胞毒性(ADCC)。
在某些情况下,抗原可能是自身抗原,在这种情况下,该反应也将被描述为自身免疫性疾病。 (自身免疫疾病中描述了自身免疫疾病)。 在其他情况下,抗体可能与天然存在但外源的细胞表面分子结合,例如与红细胞(RBC)中发现的血型相关的抗原。 这会导致红细胞被抗体覆盖、补体级联的激活、补体介导的红细胞裂解,以及对红细胞进行吞噬作用的 opsonization。 涉及红细胞的 II 型超敏反应的两个例子是溶血输血反应 (HTR) 和新生儿溶血病 (HDN)。 表中总结了这些 II 型超敏反应,将对其进行更详细的讨论\(\PageIndex{4}\)。
免疫血液学是研究血液和血液形成组织与免疫反应的关系。 抗体引发的针对血细胞的反应是II型超敏反应,因此属于免疫血液学领域。 对于初次学习免疫血液学的学生来说,由于用于识别不同血型抗原(通常称为血型)的复杂命名系统,理解所涉及的免疫学机制变得更加困难。 第一种血型抗原要么使用字母顺序名称,要么以已知的第一个产生红细胞抗原抗体的人(例如 Kell、Duffy 或 Diego)命名。 但是,在1980年,国际输血学会(ISBT)术语工作组制定了血型术语标准,试图更一致地识别新发现的血型抗原。 现在,新的抗原会被赋予一个编号并分配给血型系统、集合或系列。 但是,即使做出了这样的努力,血型命名法仍然不一致。
| 常用名 | 原因 | 体征和症状 |
|---|---|---|
| 新生儿溶血病(HDN) | 来自母亲的 IgG 穿过胎盘,瞄准胎儿的红细胞进行破坏 | 贫血、水肿、肝脏或脾脏肿大、水肿(体腔积液),严重时导致新生儿死亡 |
| 溶血输血反应 (HTR) | IgG 和 IgM 与输血红细胞上的抗原结合,靶向供体红细胞销毁 | 发热、黄疸、低血压、弥散性血管内凝血,可能导致肾衰竭和死亡 |
ABO 血型不相容
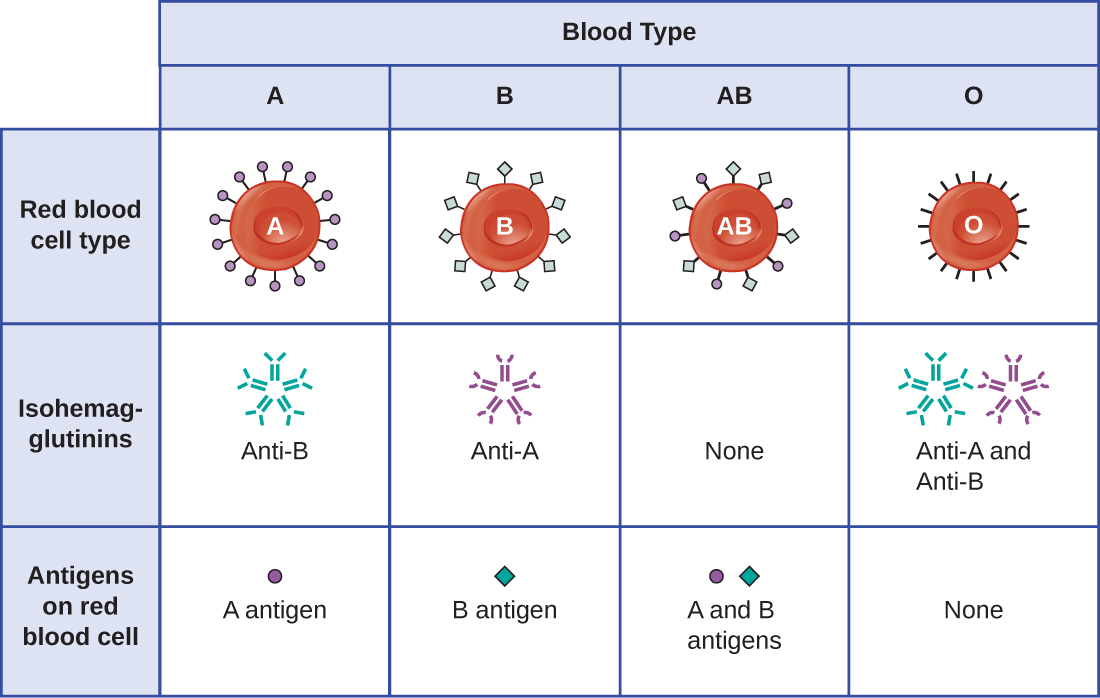
20世纪初,卡尔·兰德施泰纳(Karl Landsteiner)(1868—1943 年)首次描述了人们对不同血型的认识,他认为一个人的血清可能导致另一个人的红细胞结块。 这些研究使兰德施泰纳确定了四种不同的血型。 其他科学家随后进行的研究确定,这四种血型是基于表面糖蛋白 “A” 和 “B” 的存在与否,这为至今仍在使用的ABO血型系统奠定了基础(图\(\PageIndex{3}\))。 这些抗原的功能尚不清楚,但有些与细胞的正常生化功能有关。 此外,ABO 血型是作为等位基因遗传的(每个亲本各一个),它们表现出显性和共显性遗传模式。 A 型和 B 型血型的等位基因相互占主导地位,两者都比 O 型血占主导地位。因此,具有 AA 或 AO 基因型的人有 A 型血并在红细胞表面表达 A 糖蛋白抗原。 BB 或 BO 基因型的人有 B 型血并在红细胞表面表达 B 糖蛋白抗原。 AB基因型的患者有AB型血液,并且在红细胞表面同时表达A和B糖蛋白抗原。 最后,具有 OO 基因型的人有 O 型血,红细胞表面缺乏 A 和 B 糖蛋白。
值得注意的是,所有四种ABO血型的红细胞共享一个共同的蛋白质受体分子,而决定A、B和AB血型的是向蛋白质受体中添加特定的碳水化合物。 A、B 和 AB 血型遗传的基因对向蛋白质受体添加碳水化合物成分的酶进行编码。 O 型血型的人仍然有蛋白质受体,但缺乏会添加碳水化合物的酶,这些碳水化合物会使他们的红细胞变为 A、B 或 AB 型。
血浆中与个人自身红细胞中不存在的血型抗原发生交叉反应的 IgM 抗体称为异血凝素(图\(\PageIndex{3}\))。 Isohemaglutins 在出生后的头几周内产生,并在整个生命中持续存在。 这些抗体是在暴露于食物和微生物中的环境抗原时产生的。 A 型血的人的红细胞表面有 A 抗原,并且会产生类似于 B 抗原碳水化合物成分的环境抗原的抗 B 抗体。 患有 B 型血的人的红细胞表面有 B 抗原,并且会产生针对环境抗原的抗 A 抗体,这些抗原与 A 抗原的碳水化合物成分相似。 O 型血的人的红细胞上同时缺少 A 和 B 抗原,因此会同时产生抗 A 和抗 B 抗体。 相反,AB 血型患者的红细胞上同时有 A 和 B 抗原,因此缺乏抗 A 和抗 B 抗体。
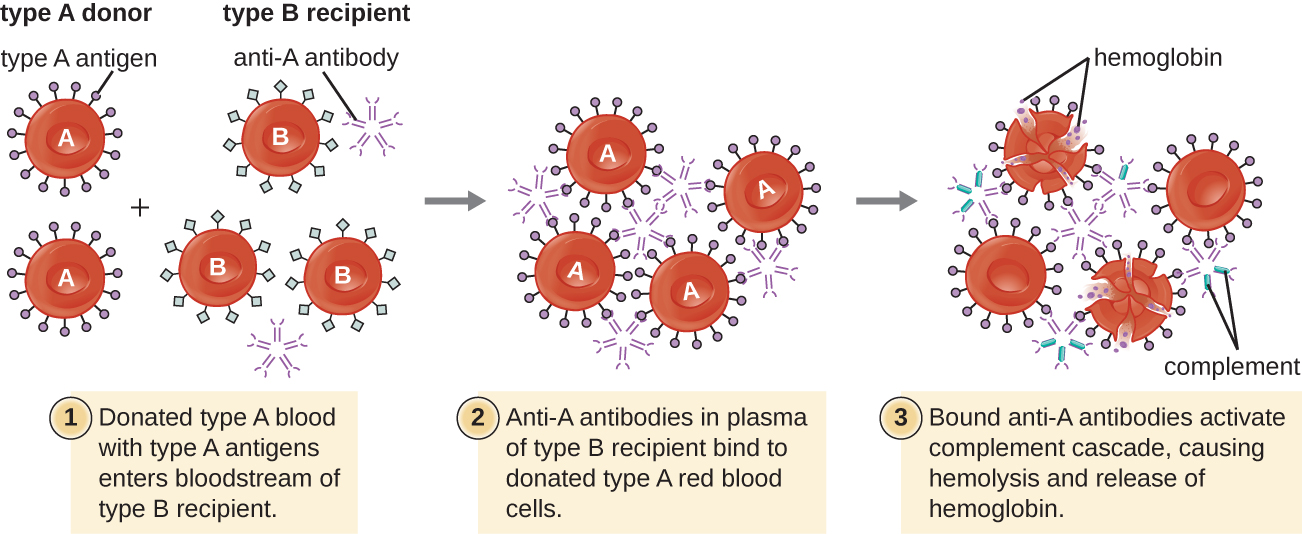
患者可能需要输血,因为他们缺乏足够的红细胞(贫血),或者因为他们因创伤或疾病经历了严重的血容量损失。 尽管输血是为了帮助患者,但患者接受与ABO血型相匹配的输血至关重要。 输血不相容的 ABO 血型可能会导致强烈的、可能致命的 II 型超敏反应细胞毒性反应,称为溶血输血反应(HTR)(图\(\PageIndex{4}\))。
例如,如果 B 型血患者输入 A 型血,他们的抗 A 抗体将与输血的红细胞结合并凝集。 此外,激活经典补体级联将导致强烈的炎症反应,补体膜攻击复合物(MAC)将介导输血红细胞的大量溶血。 受损和破坏的红细胞产生的碎片会阻塞肺泡中的血管和肾脏的肾小球。 在输血不相容后的 1 至 24 小时内,患者会出现发热、寒战、瘙痒(瘙痒)、荨麻疹(荨麻疹)、呼吸困难、血红蛋白尿(尿液中的血红蛋白)和低血压(低血压)。 在最严重的反应中,危险的低血压会导致休克、多器官衰竭和患者死亡。
医院、医疗中心和相关的临床实验室通常使用血液警报系统来最大限度地降低由于文书错误而导致的 HTR 风险。 Hemovigilance 系统是跟踪来自捐赠者来源的输血信息以及为接受者患者随访而获得的血液制品的程序。 许多国家使用的Hemovigilance系统通过强制性报告(例如向美国食品药品监督管理局)来识别HTR及其结果,这些信息对于帮助防止将来发生此类情况非常有价值。 例如,如果发现 HTR 是实验室错误或文书错误造成的,则可以正确找到并贴上当时从捐赠者那里采集的额外血液制品,以避免额外的 HTR。 由于这些措施,在美国,每200万个输血单位中就有一例与HTR相关的死亡。 6
Rh 因子
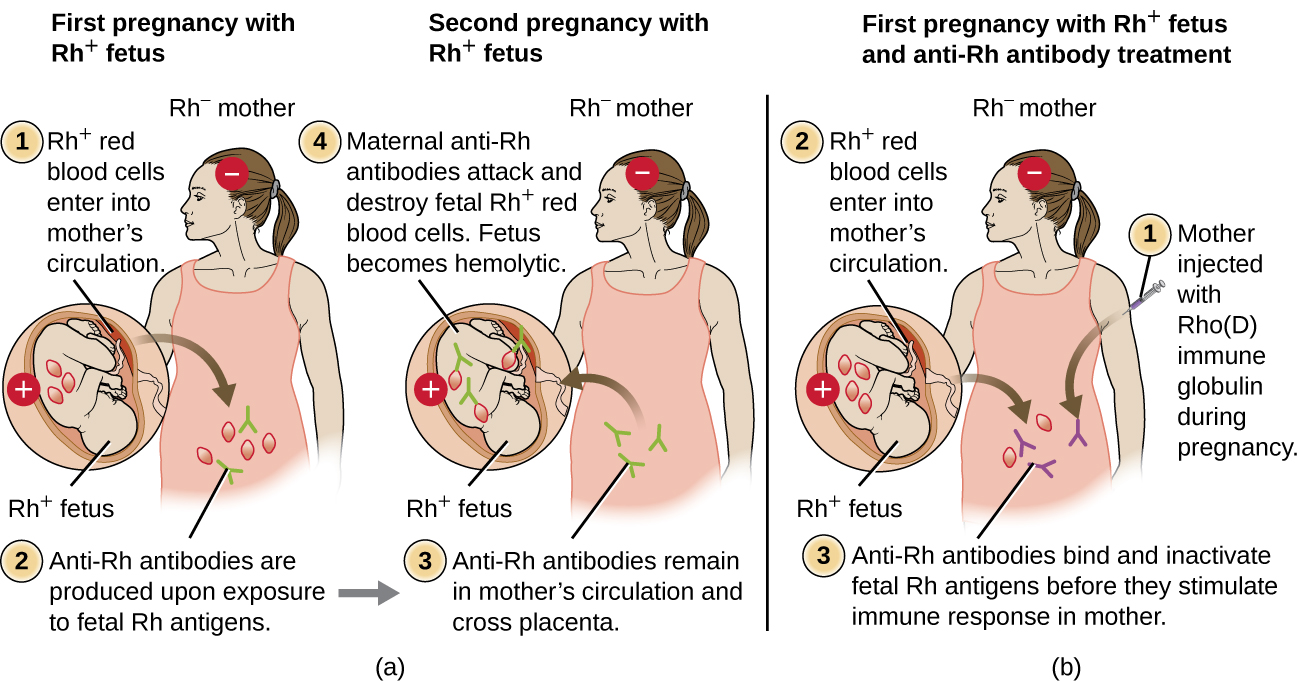
自从描述 ABO 红细胞抗原以来,已经发现了许多不同类型的红细胞抗原。 第二常被描述的红细胞抗原是Rh因子,它以卡尔·兰德施泰纳和亚历山大·韦纳在1940年确定的恒河猴(Macaca mulatta)因子命名。 红细胞抗原的Rh系统是最复杂的免疫原性血型系统,迄今已确定了50多个特异性。 在所有 Rh 抗原中,指定为 Rho(Weiner)或 D(Fisher-Race)的抗原最高。 如果存在 Rho/D 抗原,则细胞被归类为 Rh 阳性 (Rh+);如果没有 Rho/D 抗原,则被归类为 Rh 阴性 (Rh−)。 与区分 ABO 血型并作为 HTR 中 IgM 异血凝素靶标的碳水化合物分子相反,Rh 因子抗原是蛋白质。 正如 B 淋巴细胞和体液免疫中所讨论的那样,蛋白质抗原通过 T 细胞依赖机制激活 B 细胞和抗体产生,而 T H 2 细胞刺激类别从 IgM 向其他抗体类别的转换。 对于 Rh 因子抗原,T H 2 细胞刺激类转换为 IgG,这对 HDN 的机制具有重要影响。
像 ABO 不相容性一样,捐赠者输血时携带错误的 Rh 因子抗原可能会导致 II 型超敏反应 HTR。 但是,与生命早期通过暴露于环境抗原而产生的IgM异血凝素形成鲜明对比的是,抗Rh因子抗体的产生需要Rh−血液中的个体暴露于Rh+阳性红细胞并激活初级抗体反应。 尽管这种初级抗体反应可能导致输血患者的高血压反应,但在初级抗体反应(B 淋巴细胞和体液免疫)的延迟期内,溶血反应将延迟长达 2 周。 但是,如果患者随后输血 Rh+ 红细胞,则血液中已经存在抗 Rh 因子抗体的情况下,HTR 会更快地发生。 此外,快速的二级抗体反应将为HTR提供更多的抗RH因子抗体。
母亲和胎儿之间的 Rh 因子不相容也可能导致 II 型超敏反应溶血反应,称为新生儿溶血病(HDN)(图\(\PageIndex{5}\))。 如果 Rh− 女性将 Rh+ 婴儿带到足月,则母亲的免疫系统可能会暴露于 Rh+ 胎儿红细胞。 这种暴露通常发生在怀孕的最后三个月和分娩过程中。 如果发生这种接触,Rh+ 胎儿红细胞将激活母体内的初级适应性免疫反应,并将产生抗 RH 因子 IgG 抗体。 IgG 抗体是唯一一类能够通过胎盘从母亲传给胎儿的抗体;但是,在大多数情况下,第一个 Rh+ 宝宝不受这些抗体的影响,因为第一次接触通常发生在妊娠很晚的时候,母亲没有时间安装足够的原发抗体婴儿出生前的抗体反应。
但是,如果随后怀有 Rh+ 胎儿,则母亲第二次接触 Rh 因子抗原会产生强烈的二级抗体反应,从而产生大量的抗 Rh 因子 IgG。 这些抗体可以从母体穿过胎盘传给胎儿,从而导致 HDN,这对婴儿来说是一种潜在的致命疾病(图\(\PageIndex{5}\))。
在开发诊断和预防技术之前,Rh因子不相容是HDN的最常见原因,每年导致全球数千名婴儿死亡。 7 出于这个原因,定期筛查准父母的 Rh 因子,并开发了预防由 Rh 不相容引起的 HDN 的治疗方法。 为了预防 Rh 因子介导的 HDN,在妊娠第 28 周和分娩后 72 小时内,通过静脉注射或肌肉注射人类 Rho (D) 免疫球蛋白(例如 RhoGAM)。 在可能导致经胎盘出血的事件(例如,脐带血采样、绒毛膜绒毛取样、腹部创伤、羊膜穿刺术)之后,可以额外给药。 这种治疗是在第一次怀孕 Rh+ 胎儿时开始的。 Rho (D) 免疫球蛋白中的抗Rh抗体将与任何进入母亲血液的胎儿红细胞的Rh因子结合,从而阻止这些Rh+细胞激活母亲的一级抗体反应。 如果没有原发性抗 RH 因子抗体反应,下次使用 Rh+ 的妊娠患有 HDN 的风险将降至最低。 但是,母亲在怀孕期间需要接受Rho(D)免疫球蛋白的治疗,以防止可能威胁后续妊娠的原发性抗RH抗体反应。
使用这个互动式血型游戏来增强你的血型知识。
练习\(\PageIndex{3}\)
- 在 II 型超敏反应中含有不相容抗原的细胞会怎样?
- 描述新生儿的溶血性疾病并解释如何预防。
临床重点:第 2 部分
克里的初级保健医生不确定为什么凯里在阳光下待了一段时间后似乎会出现皮疹,因此她下令进行尿液分析和基本血液检查。 结果显示,凯瑞患有蛋白尿(尿液中蛋白质水平异常)、血红蛋白尿(尿液中血红蛋白过多)和血细胞比容(红细胞计数)低。 这些测试表明 Kerry 患有轻度溶血性贫血。 医生怀疑问题可能是自身免疫性的,因此她将凯里转介给风湿病学家进行进一步的检查和诊断。
练习\(\PageIndex{4}\)
风湿病学家专门研究肌肉骨骼疾病,例如关节炎、骨质疏松症和关节疼痛。 为什么克里的医生会将她转介给这种特殊类型的专科医生,尽管她没有出现任何症状?
III 型超敏反应
III 型超敏反应是免疫复合物反应,尼古拉斯·莫里斯·阿尔萨斯(1862-1945)于 1903 年首次表现出来。 为了产生用于实验程序的抗体,Arthus通过向兔子注射来自马的血清来对兔子进行免疫接种。 但是,在用马血清反复给兔子接种疫苗时,阿尔萨斯注意到注射部位出现了以前未报告且出乎意料的局部皮下出血,伴有水肿。 这种反应在注射后的 3 到 10 小时内发生。 这种对非自身血清蛋白的局部反应被称为 Arthus 反应。 当可溶性抗原与 IgG 结合的比例导致称为免疫复合物的抗原抗体聚集体的积累时,就会发生 Arthus 反应。
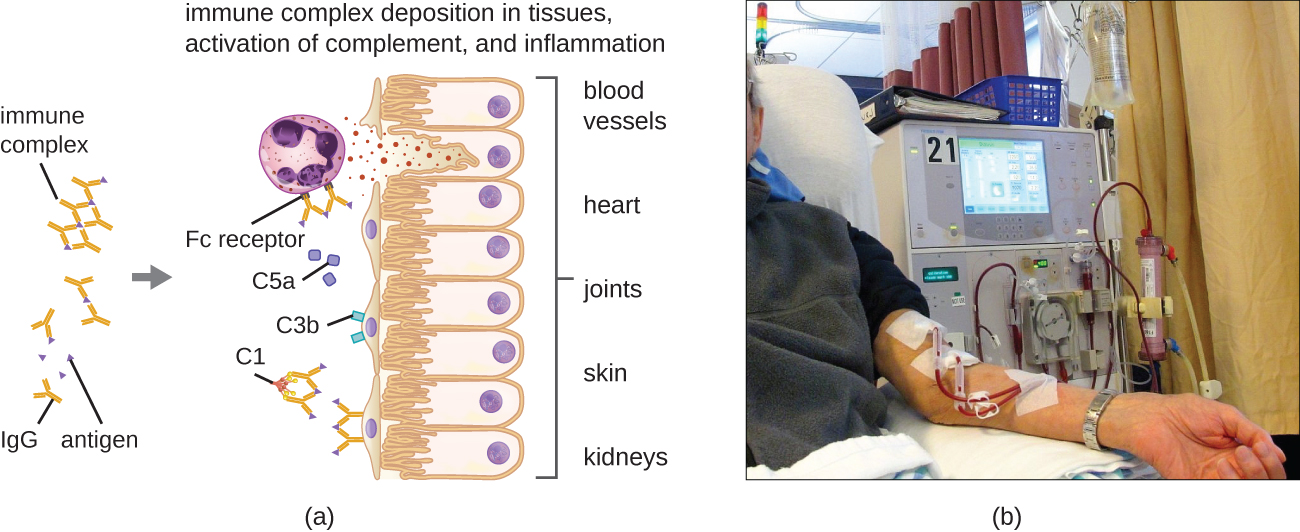
III 型超敏反应的一个独特特征是抗体过多(主要是 IgG),再加上抗原浓度相对较低,导致形成小型免疫复合物,这些复合物沉积在小血管内腔内壁的上皮细胞表面或表面组织(图\(\PageIndex{6}\))。 这种免疫复合物的积累会导致一系列炎症事件,包括:
- IgG 与局部肥大细胞上的抗体受体结合,导致肥大细胞脱粒
- 通过产生促炎 C3a 和 C5a 来补充活化(参见化学防御)
- 通过趋化招募中性粒细胞和巨噬细胞,提高血管通透性
由于这些免疫复合物的大小不是最佳大小并且会沉积在细胞表面,因此中性粒细胞和巨噬细胞无法像通常那样吞噬它们,而中性粒细胞和巨噬细胞反过来又被描述为 “沮丧”。 尽管没有发生吞噬作用,但中性粒细胞脱颗粒会导致溶酶体酶的释放,从而导致免疫复合物的细胞外破坏,在此过程中破坏局部细胞。 还会激活凝血通路,导致血栓(血块)阻塞血管并导致缺血,从而导致血管坏死和局部出血。
当免疫复合物沉积在人体各个部位时,就会发生系统性 III 型超敏反应(血清病),从而导致更广泛的全身性炎症反应。 这些免疫复合物涉及非自身蛋白,例如动物体内产生的用于人工被动免疫的抗体(见疫苗)、某些药物或在慢性感染(例如亚急性细菌性心内膜炎、慢性病毒)期间随着时间的推移持续释放的微生物抗原肝炎)。 血清病的机制与局部III型超敏反应中描述的机制相似,但涉及肥大细胞、补体、中性粒细胞和巨噬细胞的广泛激活,这会导致肾脏、关节和血管等区域的组织破坏。 由于组织破坏,血清病的症状包括寒战、发热、皮疹、血管炎和关节炎。 肾小球肾炎或肝炎的发展也是可能的。
当自身抗体与自身抗原形成免疫复合物时,系统性红斑狼疮(SLE)和类风湿关节炎等自身免疫性疾病也可能涉及破坏性的 III 型超敏反应。 这些疾病在自身免疫性疾病中进行了讨论。
练习\(\PageIndex{5}\)
- 为什么抗体过量在 III 型超敏反应中很重要?
- 描述阿尔萨斯反应和血清病之间的区别。
白喉抗毒素
抗菌血清现在的使用比过去少得多,取而代之的是类毒素疫苗。 但是,在马身上产生的白喉抗毒素就是这种治疗方法的一个例子,世界某些地区仍在使用这种疗法。 尽管没有获得美国食品药品管理局的许可在美国使用,但白喉抗毒素可用于治疗白喉病例,白喉病例是由白喉棒状杆菌引起的。 8 但是,这种治疗并非没有风险。 当患者对非自身马蛋白产生免疫反应时,就会发生血清病。 当马蛋白和循环抗体以一定比例存在时,两者之间就会形成免疫复合物。 这些免疫复合物会沉积在器官中,造成关节炎、肾炎、皮疹和发烧等损害。 血清病通常是短暂的,没有永久性损害,除非患者长期暴露于抗原,这会对关节和肾脏等身体部位造成不可逆转的损害。 随着时间的推移,巨噬细胞等吞噬细胞能够清除马血清抗原,从而改善患者的病情,并随着免疫反应的消散而减少症状。
临床重点:第 3 部分
凯瑞没有去找风湿病学家。 她在离开初级保健医生办公室时出现了癫痫发作。 她很快被送往急诊室,在那里她的初级保健医生讲述了她的病史和最近的检测结果。 急诊科医生召集风湿病学家去医院的工作人员进行咨询。 根据症状和测试结果,风湿病学家怀疑克里患有狼疮,并下令进行两次血液检查:抗核抗体测试(ANA)以寻找与DNA结合的抗体,另一项是寻找与称为史密斯抗原(Sm)的自身抗原结合的抗体的测试。
练习\(\PageIndex{6}\)
根据下令进行的血液检查,风湿病学家怀疑哪种反应导致了克里的癫痫发作?
IV 型超敏反应
IV 型超敏反应不像其他三种超敏反应那样由抗体介导。 相反,IV 型超敏反应受到 T 细胞的调节,涉及效应细胞的作用。 这些类型的超敏反应可以根据T细胞亚型、抗原类型和由此产生的效应机制分为三个亚类(表\(\PageIndex{5}\))。
在第一个 IV 型亚类中,CD4 T H 1 介导的反应被描述为迟发型超敏反应(DTH)。 致敏步骤包括将抗原引入皮肤,并通过局部抗原呈递细胞(APC)进行吞噬。 APC 激活辅助性 T 细胞,刺激克隆增殖并分化为记忆 T H 1 细胞。 在随后暴露于抗原后,这些致敏的记忆 T H 1 细胞会释放激活巨噬细胞的细胞因子,而活化的巨噬细胞是造成大部分组织损伤的原因。 在结核菌素、Mantoux 皮肤试验和接触性皮炎(例如发生在乳胶过敏反应中)中观察到这种 T H 1 介导的超敏反应的例子。
在第二个 IV 型亚类中,CD4 T H 2 介导的反应会导致慢性哮喘或慢性过敏性鼻炎。 在这些情况下,首先吸入可溶性抗原,随着细胞因子和炎症介质的释放,导致嗜酸性粒细胞的招募和激活。
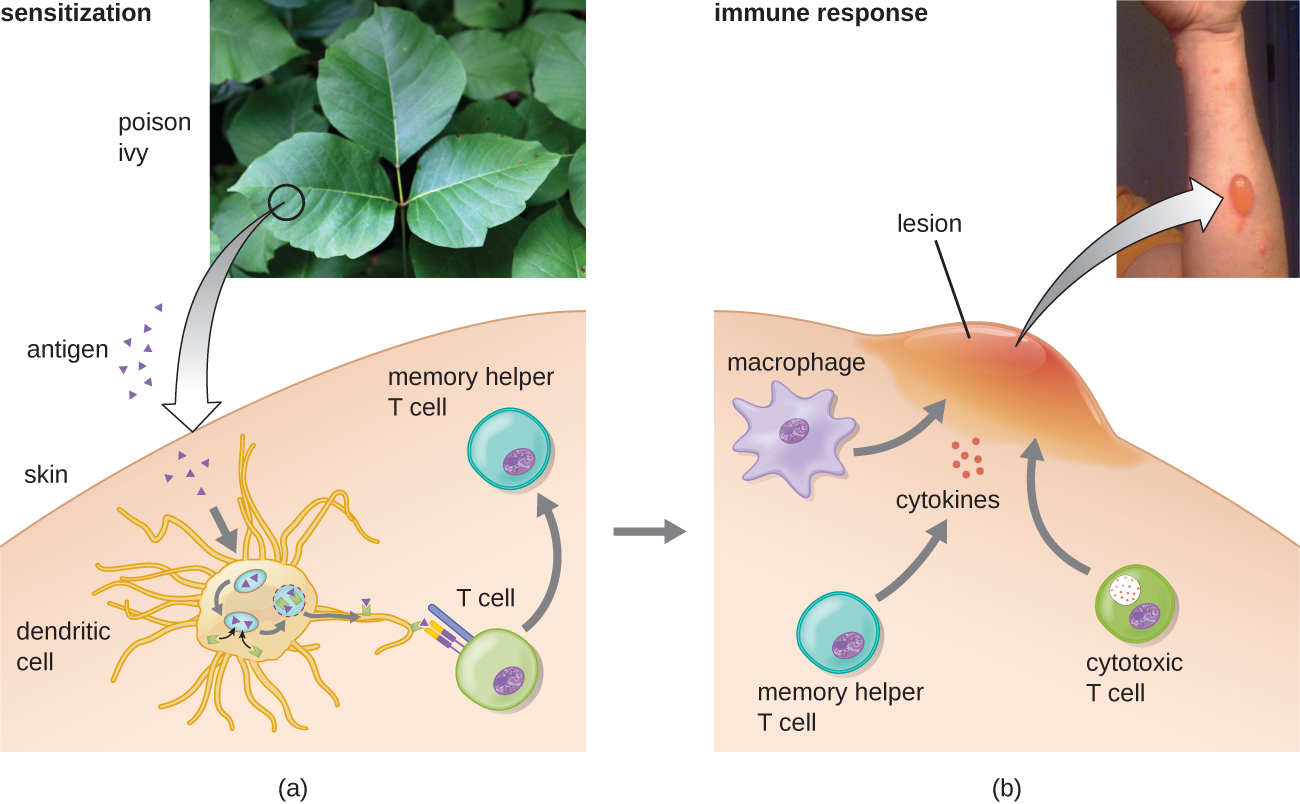
在第三个 IV 型亚类中,CD8 细胞毒性 T 淋巴细胞 (CTL) 介导的反应与组织移植排斥反应和接触性皮炎有关(图\(\PageIndex{7}\))。 对于这种形式的细胞介导的超敏反应,APC 处理抗原并将其与 MHC I 一起呈现给天真的 CD8 T 细胞。 当这些幼稚的 CD8 T 细胞被激活时,它们会增殖并分化为 CTL。 活化的 T H 1 细胞还可以增强 CTL 的活化。 然后,活化的 CTL 在与 MHC I 呈现相同抗原的细胞中靶向并诱导颗粒酶介导的凋亡。这些靶细胞可能是吸收了外来抗原的 “自身” 细胞(例如毒藤引起的接触性皮炎),也可能是移植的显示异物的组织细胞来自捐赠者的抗原。
| 子类别 | 抗原 | 效应器机制 | 示例 |
|---|---|---|---|
| 1 | 可溶性抗原 | 活化的巨噬细胞会损伤组织并促进炎症反应 | 接触性皮炎(例如接触乳胶)和迟发型超敏反应(例如结核菌素反应) |
| 2 | 可溶性抗原 | 嗜酸性粒细胞的招募和激活释放细胞因子和促炎化学物质 | 慢性哮喘和慢性过敏性鼻炎 |
| 3 | 细胞相关抗原 | CTL 介导的细胞毒性 | 接触性皮炎(例如,接触毒藤)和组织移植排斥反应 |
练习\(\PageIndex{7}\)
- 描述 IV 型超敏反应的三种亚型。
- 解释 T 细胞如何在 IV 型超敏反应中造成组织损伤。
使用延迟超敏反应检测结核病
奥地利儿科医生克莱曼斯·冯·皮尔奎特(1874—1929)首次描述了过敏机制,包括三型血清病。 9 他的兴趣促使他开发了一种使用结核菌素抗原的肺结核(TB)检测方法,该检测基于罗伯特·科赫早些时候进行的结核病病原体鉴定。 皮尔奎特的方法包括划痕,这会导致同时进行多次穿刺,使用带有一系列针头的设备在很小的区域内多次折断皮肤。 Pirquet 使用的设备类似于 tine testdevice,如图所示,有四根针头\(\PageIndex{8}\)。
阵列中所有针头的尖端都涂有结核菌素,结核菌素是一种结核细菌的蛋白质提取物,可以有效地将结核菌素引入皮肤。 一到三天后,可以检查该区域是否存在延迟的超敏反应,其症状包括肿胀和发红。
你可以想象,划痕并不是一种愉快的经历,10 而且无数次的皮肤穿刺使患者面临皮肤细菌感染的风险。 Mantoux 修改了 Pirquet 的测试,使用单次皮下注射纯化的结核菌素材料。 检测结果呈阳性(表现为注射部位延迟的局部肿胀)并不一定意味着患者目前感染了活动性结核病。 由于 IV 型(延迟型)超敏反应是由记忆 T 细胞的重新激活所介导的,因此此类细胞可能是最近(由于当前活跃感染)或几年前(如果患者患有结核病并已自发清除,或者已进入潜伏期)产生。 但是,如果患者出现症状或X光片上的发现表明存在感染,则该测试可用于确认感染。

超敏反应肺炎
某些由超敏反应引起的疾病并非完全由一种类型引起。 例如,超敏性肺炎(HP)通常是一种职业或环境疾病,发生在肺部因对吸入的灰尘、内孢子、鸟羽、鸟粪、霉菌或化学物质的过敏反应而发炎时。 惠普有许多不同的名称,与各种形式的曝光有关(图\(\PageIndex{9}\))。 与鸟粪相关的生命值有时被称为鸽友的肺或家禽工人的肺,这两者在鸟类育种者和管理者中都很常见。 奶酪处理者病、农民肺病、桑拿服用者病和热水浴缸肺是与在各种环境中暴露于霉菌有关的惠普的其他名称。
与 HP 相关的病理可能是由于 III 型(由免疫复合物介导)和 IV 型(由 T H 1 细胞和巨噬细胞介导)的超敏反应所致。 反复接触过敏原会导致肺泡炎,这是由于肺泡壁中形成免疫复合物并伴有液体积聚,以及由于 T H 1 介导的巨噬细胞激活导致肺泡瘤和其他病变的形成。 肺泡炎伴有液体和肉芽肿的形成,会导致肺泡中的氧气灌注不足,这反过来又可能导致咳嗽、呼吸困难、发冷、发热、出汗、肌痛、头痛和恶心等症状。 症状可能在接触后最快 2 小时内出现,如果不及时治疗,可能会持续数周。

练习\(\PageIndex{8}\)
解释为什么超敏性肺炎被视为职业病。
图\(\PageIndex{10}\)总结了本节中讨论的每种超敏反应的机制和影响。
超敏反应的诊断
I 型超敏反应的诊断是一个复杂的过程,除了有据可查的患者病史外,还需要进行多项诊断测试。 血清 IgE 水平可以测量,但仅有 IgE 升高并不能证实过敏性疾病。 作为鉴定导致I型反应过敏的抗原过程的一部分,可以通过刺穿皮肤试验(PPST)或皮内测试进行测试。 PPST 是在患者背部或手臂的一系列表面皮肤刺中引入过敏原进行的(图\(\PageIndex{11}\))。 根据美国过敏联合委员会和欧洲过敏与免疫学学会的数据,PPST被认为是诊断过敏的最方便、最便宜的方法。 第二种测试是皮内测试,需要用一根小针头注射到真皮中。 这种针头也被称为结核菌素针头,附着在含有少量过敏原的注射器上。 PPST 和皮内测试都要观察 15-20 分钟,以确定对过敏原有小麦耀斑反应。 在几分钟内测量任何小麦(凸起、发痒的肿块)和耀斑(发红)都表明存在I型超敏反应,而wheal-flare反应越大,患者对过敏原的敏感性就越高。
由于其非特异性炎症,III 型超敏反应经常会被误诊。 症状很容易看到,但它们可能与许多其他疾病中的任何一种有关。 详实、全面的患者病史对于正确和准确的诊断至关重要。 用于确定超敏性肺炎(由 III 型超敏反应引起)诊断的测试包括支气管肺泡灌洗(BAL)、肺功能检查和高分辨率计算机断层扫描(HRCT)。
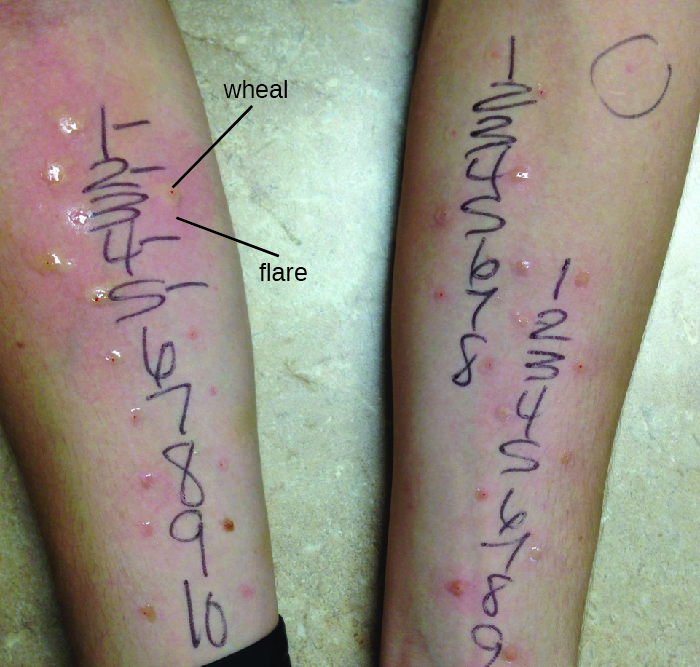
练习\(\PageIndex{9}\)
- 描述刺穿皮肤试验。
- 解释为什么 III 型超敏反应可能难以诊断
超敏反应的治疗
过敏反应可以通过多种方式治疗。 过敏反应的预防可以通过脱敏(低敏化)疗法来实现,该疗法可以通过反复注射过敏原来减少超敏反应。 在规定的间隔(例如,每周)向患者注射极稀释浓度的已知过敏原(根据过敏原测试确定)。 疫苗输送的过敏原量在一段积聚期内缓慢增加,直到确定有效剂量并在治疗期间保持该剂量,该剂量可能持续数年。 通常鼓励患者在注射后在医生办公室待30分钟,以防所施用的过敏原引起严重的全身反应。 进行脱敏治疗的医生办公室必须做好准备,在发生此类事件时提供复苏和药物治疗。
脱敏疗法用于昆虫刺过敏和环境过敏。 过敏注射会产生不同的白介素和 IgG 抗体反应,而不是 IgE。 当产生过量的过敏原特异性 IgG 抗体并将其与过敏原结合时,它们可以充当阻断抗体,在过敏原与肥大细胞结合 IgE 之前将其中和。 有使用口服疗法对食物过敏进行脱敏的早期研究很有希望。 11 12 这些研究涉及随着时间的推移给有过敏症的孩子喂少量的过敏原(例如花生粉)或相关蛋白质。 许多受试者在治疗后表现出对食物过敏原反应的严重程度降低。
还有一些旨在治疗严重过敏反应的疗法。 紧急全身性过敏反应最初是通过注射肾上腺素来治疗的,肾上腺素可以抵消血压的下降。 已知有严重过敏症的人通常会携带自动注射器,该注射器可在接触过敏原(例如,昆虫刺痛或意外摄入引起严重反应的食物)时使用。 通过自行注射肾上腺素注射(有时两次),患者可以将反应停止足够长的时间以寻求医疗救助。 后续治疗通常包括在反应后的几天内给予患者抗组胺药和慢效皮质类固醇,以防止潜在的晚期反应。 但是,抗组胺药和皮质类固醇治疗的效果尚未得到充分研究,是基于理论考虑而使用的。
较轻的过敏反应的治疗通常涉及抗组胺药和其他抗炎药物。 有多种抗组胺药可供选择,有处方药和非处方药两种强度。 还有抗白三烯和抗前列腺素药物可以在联合(且更有效的)治疗方案中与抗组胺药物一起使用。
III 型超敏反应的治疗方法包括防止进一步接触抗原和使用抗炎药。 如果防止暴露于抗原,某些情况是可以解决的。 抗炎皮质类固醇吸入器也可用于减少炎症,使肺部病变愈合。 全身性皮质类固醇治疗,口服或静脉注射,对于影响身体系统的III型超敏反应也很常见。 超敏性肺炎的治疗包括避免过敏原,以及可能添加泼尼松等处方类固醇以减轻炎症。
IV 型超敏反应的治疗包括抗组胺药、抗炎药、镇痛药,并在可能的情况下消除对抗原的进一步暴露。
练习\(\PageIndex{10}\)
- 描述脱敏疗法。
- 解释肾上腺素在治疗超敏反应中的作用。
关键概念和摘要
- 过敏是对过敏原的适应性免疫反应,有时危及生命。
- I 型超敏反应要求肥大细胞通过 IgE 过敏,包括初始 IgE 抗体反应和 IgE 附着在肥大细胞上。 第二次接触过敏原时,肥大细胞上IgE分子的交联会触发脱颗粒以及预成型和新形成的炎症化学介质的释放。 I 型超敏反应可能是局部性的,相对较轻(荨麻疹和花粉症),也可能是全系统危险的(全身性过敏反应)。
- II 型超敏反应是由抗体与细胞上的抗原结合并引发细胞毒性反应引起的。 例子包括新生儿的溶血输血反应和溶血性疾病。
- III 型超敏反应是由组织中免疫复合物的形成和积累引起的,刺激了破坏性的炎症反应。
- IV 型超敏反应不是由抗体介导的,而是由辅助性的 T 细胞激活巨噬细胞、嗜酸性粒细胞和细胞毒性 T 细胞介导的。
脚注
- 1 D.S. Strayer 等人(编辑)。 鲁宾的病理学:医学的临床病理学基础。第 7 版 2 宾夕法尼亚州费城:Lippincott、Williams & Wilkins,2014 年。
- 2 C.M. Fitzsimmons 等人 “蠕虫过敏原、寄生虫特异性IgE及其在人体免疫中的保护作用。” 《免疫学前沿》 5 (2015): 47。
- 3 S.T. Weiss。 “吃泥土——卫生假说和过敏性疾病。” 《新英格兰医学杂志》 347 第 12 期 (2002): 930—931。
- 4 D.P. Strachan “花粉症、卫生和家庭规模”。 英国医学杂志 299 第 6710 号 (1989): 1259。
- 5 H. Okada 等人。 “自身免疫和过敏性疾病的'卫生假设':更新。” 临床和实验免疫学 160 第 1 期 (2010): 1—9。
- 6 E.C. Vamvakas,马萨诸塞州 Blajchman。 “与输血相关的死亡率:同种异体输血的持续风险及其预防策略。” B@@ lood 113 no.15 (2009): 3406—3417。
- 7 G. Reali。 “抗-D免疫预防四十年。” 输血 5 号 1 (2007): 3—6。
- 8 疾病控制与预防中心。 “白喉抗毒素。” http://www.cdc.gov/diphtheria/dat.html。 已于 2016 年 3 月 25 日访问。
- 9 B. Huber “100 Jahre Allergie:Clemens von Pirquet—sein Allergiebegriff 和 das ihm zugrunde liegende Krankheitsverständnis。” Wiener Klinische Wochenschrift 118 编号 19—20 (2006): 573—579。
- 10 C.A. Stewart。 “Pirquet 测试:划痕和穿刺应用方法的比较。” 儿科和青少年医学档案 35 第 3 期(1928):388—391。
- 11 C.L. Schneider 等人。 “奥马珠单抗促进高危花生过敏患者快速口服脱敏的试点研究。” 《过敏与临床免疫学杂志》 132 第 6 期 (2013): 1368—1374。
- 12 P. Varshney 等人。 “花生口服免疫疗法的随机对照研究:过敏反应的临床脱敏和调节。” 《过敏与临床免疫学杂志》 127 第 3 期 (2011): 654—660。


