11.7:基因调控——操纵子理论
- Page ID
- 200129
学习目标
- 比较诱导操作子和可抑制操作子
- 描述为什么调节操作子很重要
多细胞生物体中的每个有核细胞都包含相同 DNA 的拷贝。 同样,从同一个起始菌落接种的两个纯细菌培养物中的所有细胞都含有相同的DNA,但自发突变引起的变化除外。 如果多细胞生物体中的每个细胞都有相同的DNA,那么生物体不同部位的细胞如何表现出不同的特征呢? 同样,暴露于不同环境条件的两个纯培养物中的相同细菌细胞怎么会表现出不同的表型? 在这两种情况下,每个遗传上相同的细胞都不会开启或表达相同的基因组。 在给定时间,细胞中只有一部分蛋白质被表达。
基因组DNA既包含结构基因,前者对充当细胞结构或酶的产物进行编码,也包含调控基因,后者编码调节基因表达的产物。 基因的表达是一个高度调节的过程。 尽管调节多细胞生物中的基因表达允许细胞分化,但在原核生物等单细胞生物中,它主要确保细胞的资源不会被浪费在制造细胞当时不需要的蛋白质上。
阐明控制基因表达的机制对于理解人类健康非常重要。 人类这个过程中的故障会导致癌症和其他疾病的发展。 了解病原体的基因表达与其人类宿主的基因表达之间的相互作用对于理解特定的传染病很重要。 基因调控涉及给定细胞内来自细胞环境的信号、细胞内的信号分子和细胞 DNA 之间的复杂相互作用网络。 视情况而定,这些相互作用会导致某些基因的表达而其他基因被抑制。
原核生物和真核生物在调节基因表达的机制上有一些相似之处;但是,由于转录和翻译过程之间的时间和空间分离,真核生物中的基因表达更加复杂。 因此,尽管大多数基因表达的调控是通过原核生物的转录控制进行的,但真核生物中基因表达的调节发生在转录水平和转录后(生成初级转录本之后)。
原核基因调控
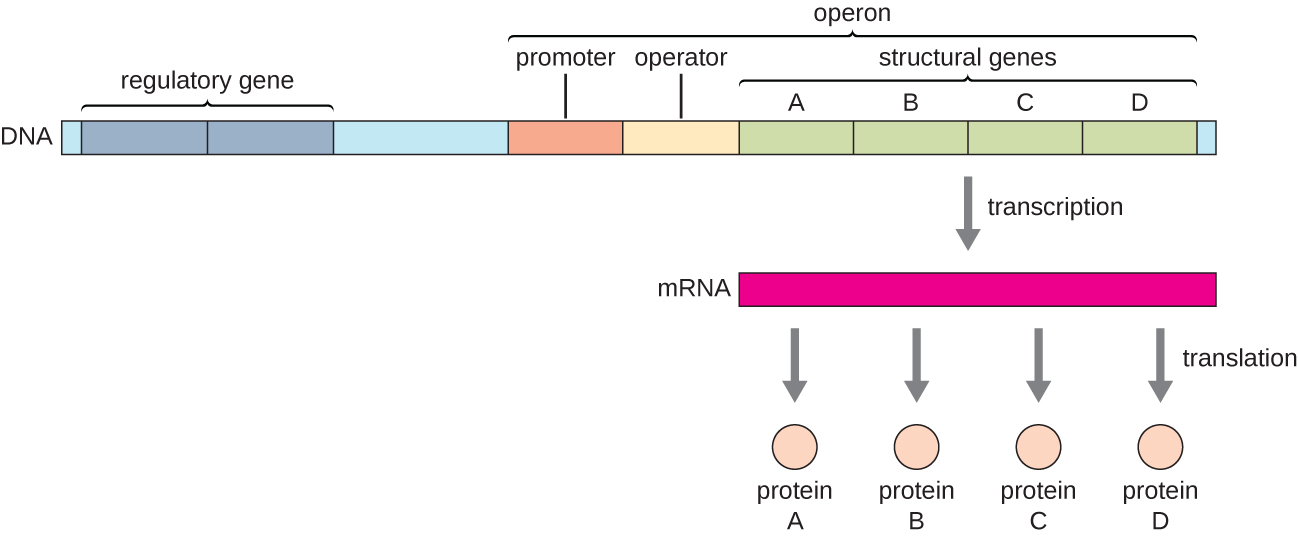
在细菌和古细菌中,具有相关功能的结构蛋白通常在基因组中一起编码成一个称为操纵子的区块,并在单个启动子的控制下一起转录,从而形成多环共转录本(图\(\PageIndex{1}\))。 通过这种方式,可以同时控制所有编码催化单一生化途径中许多步骤的酶的结构基因的转录,因为它们要么同时需要,要么根本不需要。 例如,在大肠杆菌中,编码使用乳糖作为能量源所需的酶的所有结构基因在乳糖(或 lac)操纵子中彼此相邻,受单一启动子(l ac启动子)的控制。 法国科学家弗朗索瓦·雅各布(1920-2013 年)和巴斯德研究所的雅克·莫诺德通过对大肠杆菌的 l ac operon 的研究,率先展示了细菌基因组织成操纵子的过程。 由于这项工作,他们于1965年获得了诺贝尔生理学或医学奖。 尽管真核生物基因没有组织成操纵子,但原核操作子是学习基因调控的绝佳模型。 真核生物中有一些基因簇的功能与操纵子相似。 许多原理可以应用于真核生物系统,有助于我们理解真核生物中基因表达的变化,这些变化可能导致癌症等病理变化。
每个操纵子都包含影响其自身转录的 DNA 序列;这些序列位于一个称为调控区的区域。 调控区域包括启动子和启动子周围的区域,转录因子(由调控基因编码的蛋白质)可以与之结合。 转录因子影响RNA聚合酶与启动子的结合,并允许其进展转录结构基因。 抑制因子是一种转录因子,它通过与调节区域内称为操作员的DNA序列结合来抑制基因的转录,该序列位于启动子的RNA聚合酶结合位点和第一个启动子的转录起始位点之间结构基因。 抑制剂结合物理阻断 RNA 聚合酶转录结构基因。 相反,激活剂是一种转录因子,它通过促进RNA聚合酶与启动子的结合来增加基因的转录,以应对外部刺激。 诱导剂是第三种调节分子,是一种通过与抑制剂或激活剂相互作用来激活或抑制转录的小分子。
在原核生物中,有一些操纵子的例子是相当持续地需要其基因产物,因此其表达不受管制。 这些操纵子是组成表达的,这意味着它们会被持续转录和翻译,为细胞提供恒定中间水平的蛋白质产物。 此类基因编码参与细胞维持所需的内务功能的酶,包括DNA复制、修复和表达,以及参与核心代谢的酶。 相比之下,还有其他原核操作子只有在需要时才表达,并受抑制剂、激活剂和诱导剂的调节。
练习\(\PageIndex{1}\)
- 操纵子的DNA序列中有哪些部分?
- 有哪些类型的调节分子?
通过镇压进行监管
原核操作子通常通过抑制剂与操作区结合来控制,从而阻止结构基因的转录。 此类操作子被归类为可抑制操作子或诱导操作子。 可抑制的操纵子,例如色氨酸(trp)操纵子,通常含有编码生物合成途径所需酶的基因。 只要细胞继续需要该途径的产物,如色氨酸,就会继续表达可抑制的操纵子。 但是,当生物合成途径的产物开始在细胞中积聚,从而消除了细胞继续产生更多产物的需要时,操纵子的表达就会受到抑制。 相反,诱导操纵子,例如大肠杆菌的 lac operon,通常含有编码与乳糖等特定底物代谢有关的途径中的酶的基因。 这些酶只有在该底物可用时才需要,因此操纵子的表达通常只有在底物存在的情况下才会诱导。
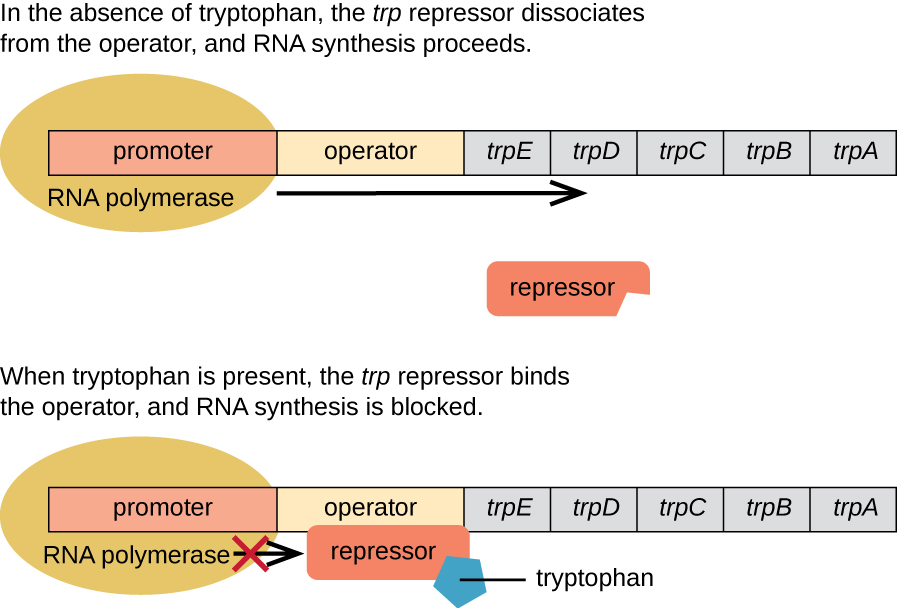
trp Operon:一个可抑制的操作子
大@@ 肠杆菌可以使用由 tr p 操纵子中彼此相邻的五个结构基因编码的酶来合成色氨酸(图\(\PageIndex{2}\))。 当环境色氨酸含量低时,操纵子处于开启状态。 这意味着开始转录,表达基因,合成色氨酸。 但是,如果环境中存在色氨酸,则会关闭 trp 操作元。 不发生转录,色氨酸也未合成。
当细胞中不存在色氨酸时,抑制剂本身不会与操作员结合;因此,操纵子处于活跃状态,色氨酸被合成。 但是,当色氨酸积聚在细胞中时,两个色氨酸分子会与 t rp 抑制剂分子结合,后者会改变其形状,使其能够与 trp 操作员结合。 这种活性形式的 trp 抑制剂与操作员的结合会阻止 RNA 聚合酶转录结构基因,从而阻止操纵子的表达。 因此,操纵子控制的生物合成途径的实际产物调节操纵子的表达。
观看此视频,了解有关 trp 操作员的更多信息。
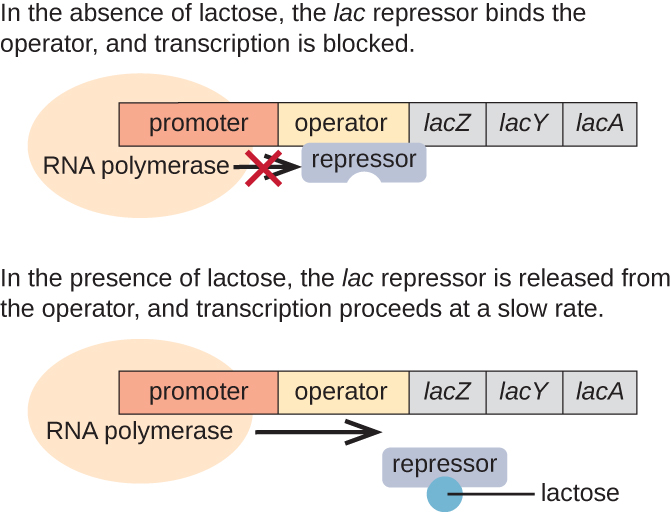
Lac Operon:诱导操作元
lac operon 是诱导操纵子的一个例子,它在没有葡萄糖的情况下也会被激活(图\(\PageIndex{3}\))。 lac operon 编码从环境中获取和处理二糖乳糖所必需的三个结构基因,将其分解为简单的糖葡萄糖和半乳糖。 为了表达 la c operon,必须存在乳糖。 这对细胞来说是有道理的,因为如果没有乳糖,制造用于处理乳糖的酶会浪费能量。
在没有乳糖的情况下,l ac 抑制剂与l ac 操作子的操作区结合,从物理上阻止RNA聚合酶转录结构基因。 但是,当存在乳糖时,细胞内的乳糖会转化为异乳糖。 Allolactose 是一种诱导分子,与抑制剂结合并改变其形状,使其无法再与操作员 DNA 结合。 在存在乳糖的情况下去除抑制因子可以让 RNA 聚合酶穿过操作区并开始转录 lac 结构基因。
lac Operon:由分解代谢物激活蛋白激活蛋白激活
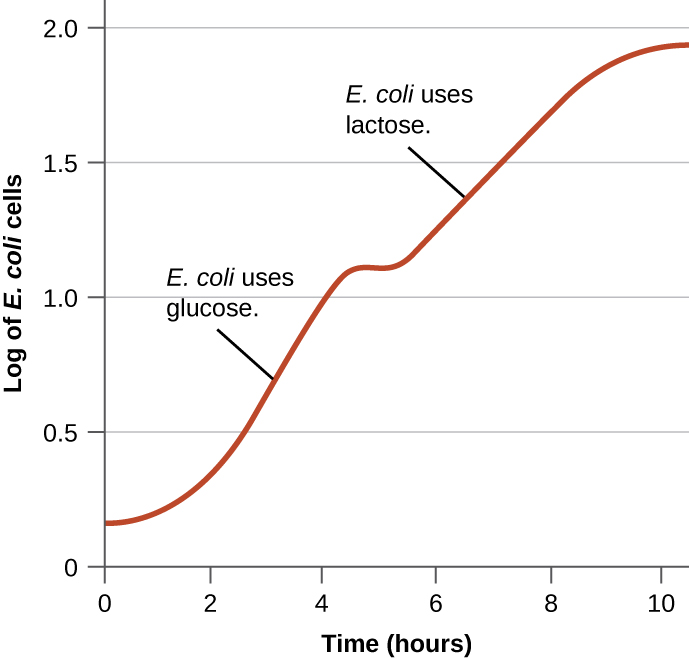
细菌通常能够使用各种基质作为碳源。 但是,由于葡萄糖通常比其他底物更可取,因此细菌具有确保只有在葡萄糖耗尽时才使用替代底物的机制。 此外,细菌具有确保编码使用替代底物的酶的基因仅在替代底物可用时才表达的机制。 20 世纪 40 年代,雅克·莫诺德通过研究在两种不同底物存在下同时培养的大肠杆菌的生长情况,率先证明对某些底物比其他底物更偏爱。 此类研究生成了双氧增长曲线,如图所示\(\PageIndex{4}\)。 尽管首先使用首选底物葡萄糖,但大肠杆菌生长迅速,乳糖代谢酶不存在。 但是,一旦葡萄糖水平耗尽,生长速度就会减慢,从而诱导第二种底物乳糖代谢所需的酶的表达。 注意乳糖的生长速度是如何变慢的,正如生长曲线的陡度较低所表明的那样。
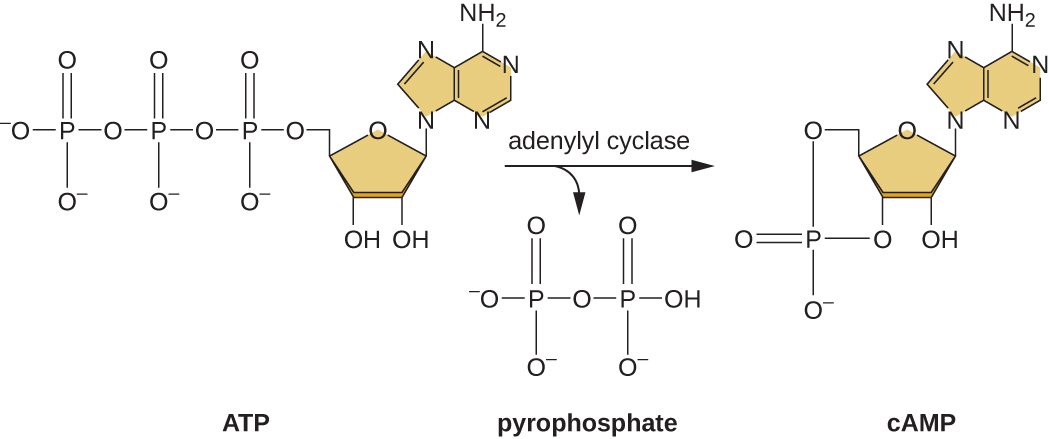
从葡萄糖的使用转向乳糖等另一种底物的能力是一种叫做Enzyme IIA(EIIA)的酶活性的结果。 当葡萄糖水平下降时,细胞分解代谢产生的ATP就会减少(参见碳水化合物的分解代谢),EIIA会被磷酸化。 磷酸化的 EIIA 激活腺苷环化酶,这种酶可将部分剩余的 ATP 转化为环状AMP(cAMP),环状AMP是AMP的环衍生物,也是参与大肠杆菌葡萄糖和能量代谢的重要信号分子。 结果,细胞中的cAMP水平开始升高(图\(\PageIndex{5}\))。
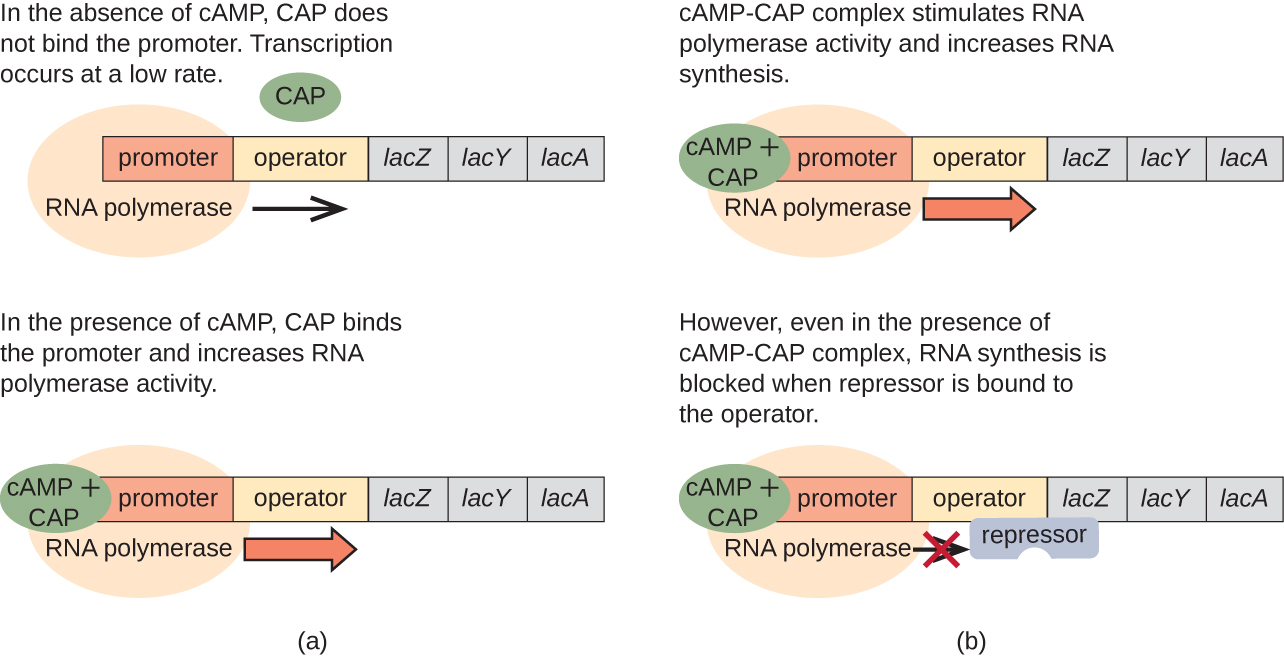
lac operon 在从使用葡萄糖到使用乳糖的转变中也起着作用。 当葡萄糖稀缺时,腺苷环化酶活性增加引起的积累 cAMP 会与分解代谢物激活蛋白 (CAP) 结合,也称为 cAMP 受体蛋白 (CRP)。 该复合物与 lac 操作子的启动子区域结合(图\(\PageIndex{6}\))。 在这些操作子的调节区域中,CAP 结合位点位于启动子中 RNA 聚合酶结合位点的上游。 Cap-camp 复合物与该位点的结合提高了 RNA 聚合酶与启动子区域的结合能力,从而启动结构基因的转录。 因此,对于 la c operon 而言,要进行转录,必须存在乳糖(去除 lac 抑制蛋白),并且必须耗尽葡萄糖水平(允许活化蛋白结合)。 当葡萄糖水平较高时,分解代谢物会抑制编码用于替代底物代谢的酶的操纵子。 由于这些条件下的 cAMP 水平较低,因此 Cap-camp 复合物的数量不足以激活这些操作子的转录。 \(\PageIndex{1}\)有关lac操作员法规的摘要,请参见表。
| 葡萄糖 | CAP 绑定 | 乳糖 | 抑制器绑定 | 转录 |
|---|---|---|---|---|
| + | — | — | + | 不是 |
| + | — | + | — | 一些 |
| — | + | — | + | 不是 |
| — | + | + | — | 是的 |
在此处观看有关 lac operon 工作原理的动画教程。
练习\(\PageIndex{2}\)
- 什么会影响 trp 操作员抑制器与操作员的绑定?
- 乳胶抑制蛋白的行为如何以及何时发生变化?
- 除了可以抑制之外,lac operon 还能如何监管?
原核生物的全球反应
在原核生物中,还有几个更高水平的基因调控能够同时控制许多相关操纵子的转录,以响应环境信号。 一组同时控制的操作子称为调节器。
Alarmones
当感知即将来临的压力时,原核生物会改变各种操作子的表达,以协调作出反应。 他们通过产生 alarmones 来做到这一点,alarmones 是小的细胞内核苷酸衍生物。 Alarmones 改变了哪些基因的表达,刺激了特定应激反应基因的表达。 在致病细菌中,使用alarmones来改变基因表达以应对压力似乎很重要。 在感染过程中遇到宿主防御机制和其他恶劣条件时,许多编码毒力基因的操纵子会因alarmone信号传导而上调。 了解这些反应是能够充分了解许多病原体的感染过程以及开发对抗这种过程的疗法的关键。
替代 α 因子
由于细菌 RNA 聚合酶的 α 亚单位对应转录哪些启动子具有特异性,因此改变所用的 α 因子是细菌在给定时间快速全局改变转录的调控子的另一种方式。 μ因子识别细菌启动子中的序列,因此不同的α因子将分别识别略有不同的启动子序列。 这样,当细胞感知到特定的环境条件时,它可能会通过改变其所表达的α因子,降解旧因子并产生新的操纵子来转录编码基因的操纵子,这些基因的产物在新的环境条件下将有用。 例如,在 Bacillus 和 Clostridium 属的孢子化细菌(包括许多病原体)中,一组 α 因子控制着孢子形成所需的许多基因的表达,以响应孢子刺激信号。
练习\(\PageIndex{3}\)
- 一组可以作为一个群体进行监管的操作子叫什么名字?
- 哪种刺激会触发不同的 α 因子的转录?
细菌的其他调节方法:衰减和核糖开关
尽管大多数基因表达在原核生物的转录启动水平上受到调节,但也有同时控制转录完成和翻译的机制。 自从它们被发现以来,这些机制已被证明可以控制许多原核操作子的转录和翻译的完成。 由于这些机制将转录和翻译的调控直接联系起来,因此它们是原核生物所特有的,因为这些过程在真核生物中是物理上分离的。
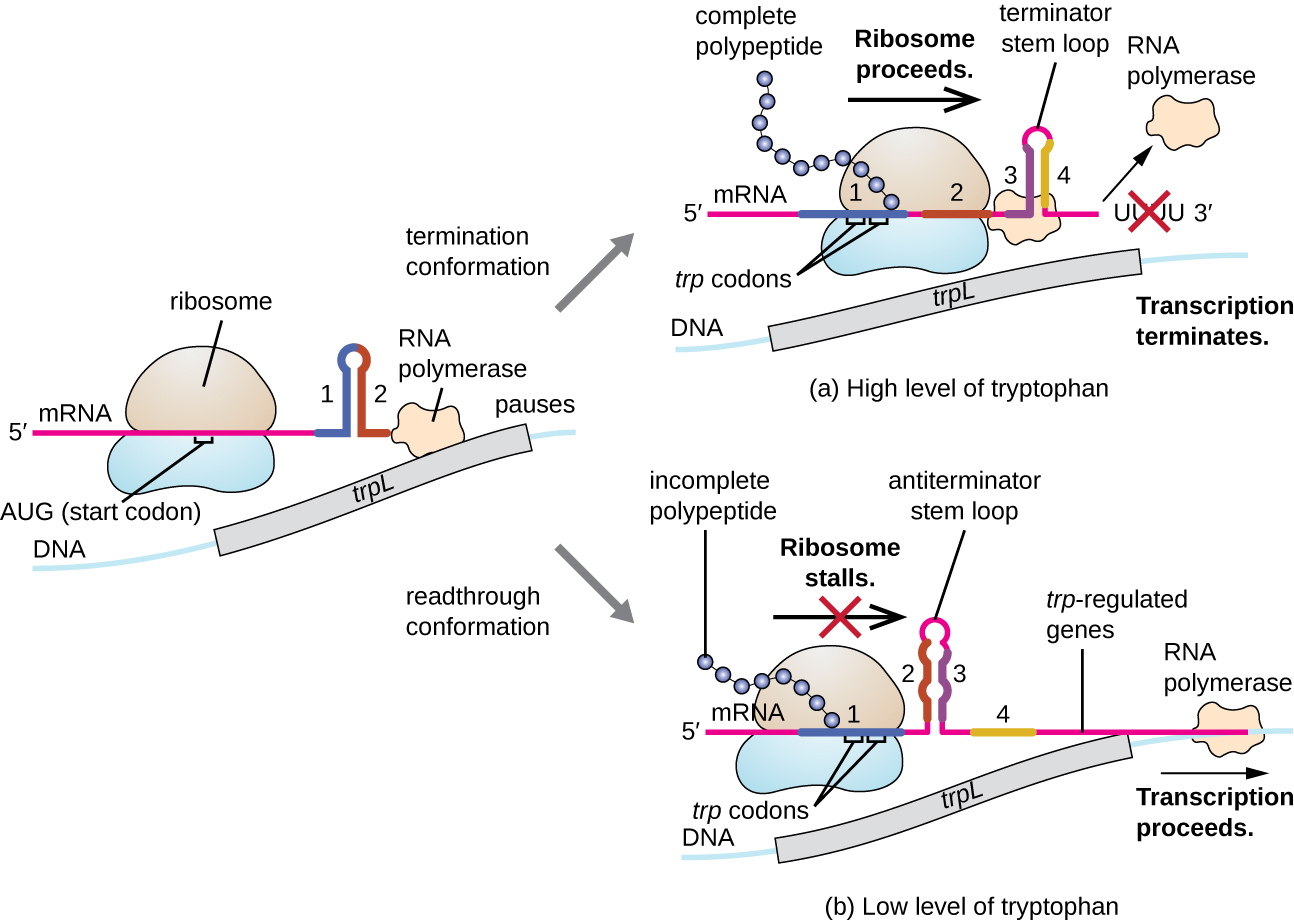
其中一个调节系统是衰减,即在被转录的mRNA的5'末端形成的次要干环结构决定是否会发生转录以完成该mRNA的合成,以及该mRNA是否会用于翻译。 除了已经讨论过的转录抑制机制外,衰减还控制着大肠杆菌中 trp 操纵子的表达(图\(\PageIndex{7}\))。 trp 操纵子调控区在操作员和第一个结构基因之间包含一个名为 trpL 的先导序列,该序列有四段 RNA,它们可以在不同的组合中相互碱基配对。 当终止体茎环形成时,转录终止,从mRNA中释放出RNA聚合酶。 但是,当抗终止剂茎环形成时,这会阻止终止剂茎环的形成,因此 RNA 聚合酶可以转录结构基因。
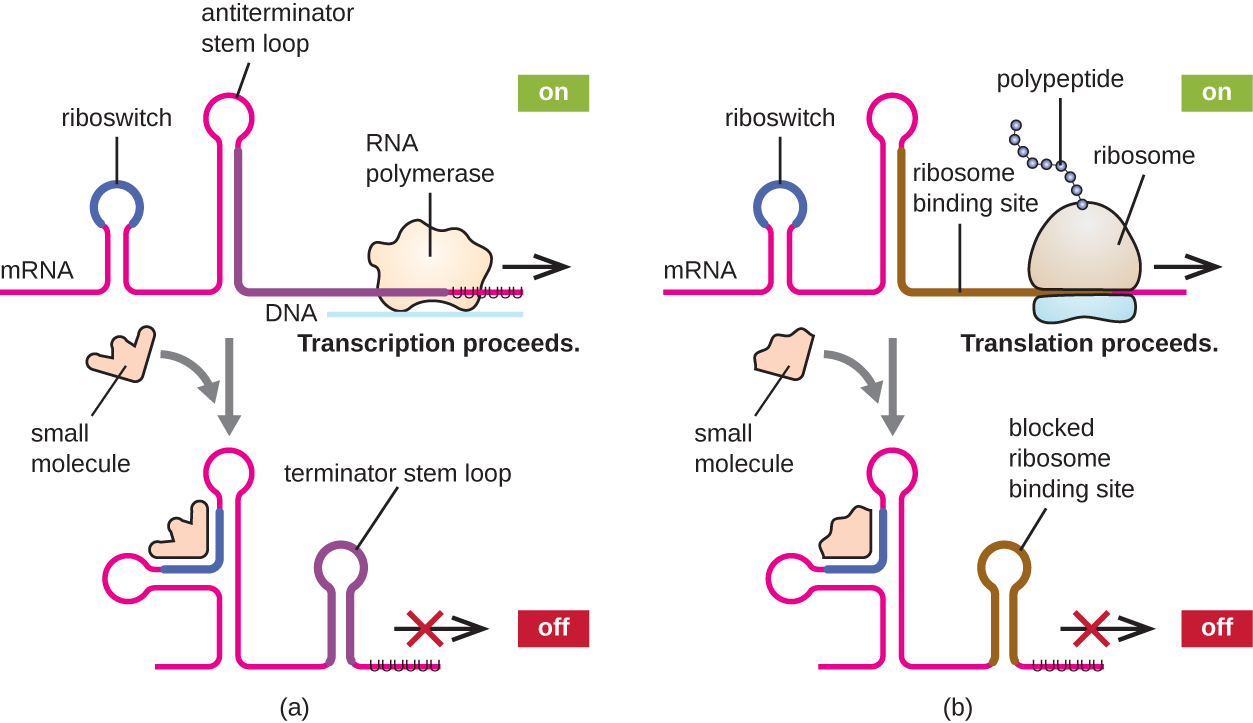
同时调节原核生物转录和翻译的一个相关机制是使用 riboswitch,这是在一些原核生物 mRNA 分子的 5' 末端发现的一小块非编码 RNA 区域(图\(\PageIndex{8}\))。 riboswitch 可以与一个小的细胞内分子结合,以稳定 mRNA 分子的某些二级结构。 小分子的结合决定了哪种茎环结构的形成,从而影响mRNA合成和蛋白质合成的完成。
影响原核生物和真核生物基因表达的其他因素
尽管我们对转录控制的讨论重点以原核操作子为例,但真核生物转录控制在许多方面是相似的。 与原核生物一样,真核生物的转录可以通过结合转录因子(包括抑制因子和激活剂)来控制。 有趣的是,通过增强剂和启动子之间促进的DNA循环,蛋白质与DNA区域(称为增强剂)的结合,可以影响真核生物的转录,这些区域距离基因很远(图\(\PageIndex{9}\))。 总体而言,调节转录是控制原核生物和真核生物中基因表达的高效方法。 但是,在没有转录因子与调节区域结合的情况下,可以通过其他方式控制真核生物中的基因表达,以应对环境和细胞压力。
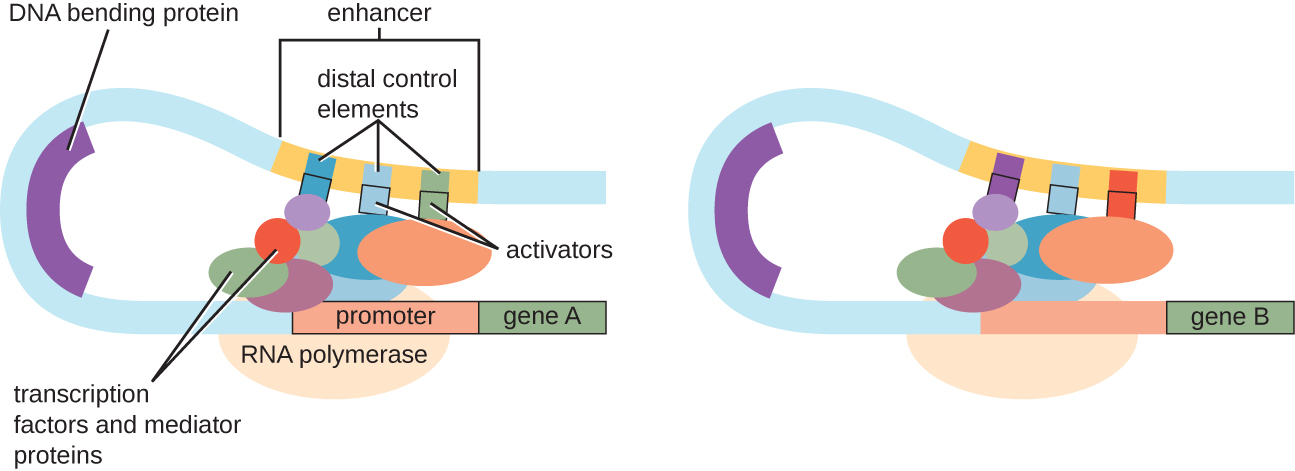
脱氧核糖核酸水平控制
在真核生物中,可以对DNA分子或相关的组蛋白进行化学修饰,从而影响转录;这称为表观遗传调节。 事实证明,DNA中某些胞嘧啶核苷酸因环境因素的甲基化会影响此类DNA进行转录的使用,而DNA甲基化通常与基因表达水平的降低有关。 此外,为了应对环境因素,用于封装 DNA 的组蛋白还可以通过多种方式进行化学修饰,包括乙酰化和去乙酰化,从而影响 DNA 的封装状态,从而影响松散伤口的 DNA 用于转录的可用性。 这些化学修饰有时可以通过多轮细胞分裂来维持,这使得至少其中一些表观遗传学变化是可以遗传的。
该视频描述了表观遗传调控如何控制基因表达。
练习\(\PageIndex{}\)
- 当衰减运行时,什么会停止或允许转录继续进行?
- 什么决定了 riboswitch 的状态?
- 描述增强剂的功能。
- 描述真核生物中表观遗传调控的两种机制。
临床重点:分辨率
尽管马克在坏死性筋膜炎的发作中幸存下来,但他现在必须接受皮肤移植手术,然后接受长期的物理治疗。 根据他失去的肌肉量,他的腿不太可能恢复到全力,但他的物理治疗师乐观地认为他会恢复腿部的使用能力。
实验室测试显示,Mark感染的病原体是A组链球菌(A组链球菌)菌株。 根据法律要求,马克的病例已报告给州卫生部门,并最终报告给疾病控制与预防中心(CDC)。 在疾病预防控制中心,对从Mark分离出来的A组链球菌菌株进行了更彻底的甲氧西林耐药性分析。
甲氧西林耐药性是基因编码的,通过水平基因转移,在A组链球菌中变得越来越常见。 在坏死性筋膜炎中,由于各种遗传编码细菌毒素的作用,流向感染区域的血液通常受到限制。 这就是为什么切口测试通常很少甚至没有出血的原因。 不幸的是,这些细菌毒素限制了静脉注射抗生素清除皮肤和下层组织感染的有效性,这意味着仅靠抗生素耐药性并不能解释马克治疗的无效性。 尽管如此,静脉注射抗生素治疗是必要的,以帮助最大限度地减少败血症的可能结果,败血症是坏死性筋膜炎的常见结果。 通过CDC对从Mark分离出来的菌株进行基因组分析,几个重要的毒力基因被证明是在预言上编码的,这表明转导对于这些基因从一个细菌细胞到另一个细菌细胞的水平基因转移很重要。
关键概念和摘要
- 基因表达是一个严格监管的过程。
- 在转录时,原核生物中的基因表达在很大程度上受到调节。 真核生物中的基因表达还受到转录后调节。
- 具有相关功能的原核结构基因通常被组织成操纵子,全部由单个启动子的转录控制。 操纵子的调控区域包括启动子本身和启动子周围的区域,转录因子可以与之结合以影响转录。
- 尽管有些操纵子是本质表达的,但大多数操作子通过使用转录因子(抑制因子和激活剂)受到调节。 抑制剂与操作员结合,即启动子中的RNA聚合酶结合位点和第一结构基因之间的调节区域内的DNA序列,从而物理阻断这些操作子的转录。 激活剂在操纵子的调节区域内结合,帮助RNA聚合酶与启动子结合,从而增强该操纵子的转录。 诱导剂通过与抑制剂或激活剂相互作用来影响转录。
- t rp 操作数是可抑制操作子的典型示例。 当色氨酸积聚时,色氨酸与抑制剂结合,然后抑制剂与操作员结合,防止进一步转录。
- lac operon 是一个典型的例子,一个诱导操作子。 当细胞中存在乳糖时,它会转化为全乳糖。 Allolactose 充当诱导剂,与抑制剂结合并防止抑制剂与操作员结合。 这允许转录结构基因。
- lac operon 也需要激活。 当葡萄糖水平耗尽时,一些细胞 ATP 会转化为 cAMP,后者与分解代谢物激活蛋白 (CAP) 结合。 Camp-cap 复合物激活 lac 操作子的转录。 当葡萄糖水平较高时,它的存在会阻止 lac 操纵子和其他操纵子通过抑制分解代谢物进行转录。
- 被称为 alarmones 的小细胞内分子是为了应对各种环境压力而产生的,它使细菌能够控制一组操纵子(称为调节子)的转录。
- 细菌有能力根据环境条件改变它们使用的RNA聚合酶的α因子,从而在全球范围内快速改变转录的调控子。
- 原核生物具有调节机制,包括衰减和使用核糖开关,可以同时控制转录的完成和该转录的翻译。 这些机制通过在目前正在合成的 mRNA 分子的 5' 末端形成茎环而起作用。
- 原核生物和真核生物的基因表达还有其他调控点。 在真核生物中,通过对DNA或组蛋白进行化学修饰进行表观遗传调控和调节RNA处理是两种方法。


