8.1: 能量、物质和酶
- Page ID
- 200197
学习目标
- 定义和描述新陈代谢
- 比较和对比 autotrophs 和 heterotrophs
- 描述氧化还原反应在新陈代谢中的重要性
- 描述为什么 ATP、FAD、NAD + 和 NADP + 在细胞中很重要
- 识别酶的结构和结构成分
- 描述竞争性酶抑制剂和非竞争性酶抑制剂之间的区别
临床重点:第 1 部分
汉娜是一个来自华盛顿州的15个月大的女孩。 她正在冈比亚度过夏天,她的父母正在冈比亚为一家非政府组织工作。 抵达冈比亚大约三周后,汉娜的胃口开始减弱,她的父母注意到她看上去异常呆滞、疲劳和困惑。 当她在户外时,尤其是在白天,她似乎也很烦躁。 当她开始呕吐时,她的父母认为她感染了 24 小时的病毒,但是当她的症状持续存在时,他们带她去了诊所。 当地医生注意到汉娜的反应似乎异常缓慢,当他用灯光检查她的眼睛时,她似乎对光线异常敏感。 她的脖子似乎也很僵硬。
练习\(\PageIndex{1}\)
汉娜出现症状的可能原因有哪些?
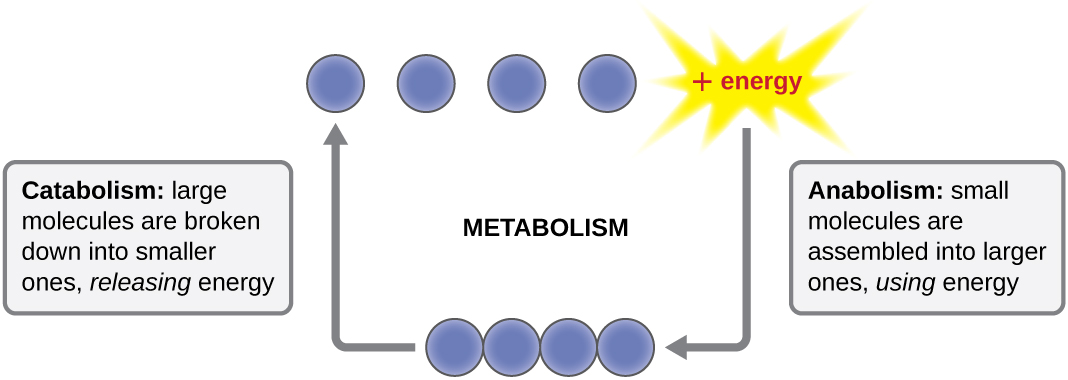
用来描述细胞内部所有化学反应的术语是新陈代谢(图\(\PageIndex{1}\))。 细胞过程,例如复杂分子的生成或分解,是通过一系列称为代谢途径的逐步、相互关联的化学反应发生的。 自发和释放能量的反应是外激反应,而内能反应需要能量才能进行。 合成代谢一词是指那些参与生物合成的内能代谢途径,这些途径将简单的分子组成部分转化为更复杂的分子,并由细胞能量的使用提供动力。 相反,分解代谢一词是指将复杂分子分解成更简单分子的外激素途径。 储存在复杂分子键中的分子能量以分解代谢途径释放,其收集方式可以用来产生高能分子,用于驱动合成代谢途径。 因此,在能量和分子方面,细胞不断平衡分解代谢和合成代谢。
按碳和能量来源分类
可以根据生物用于新陈代谢的碳来源及其能量来源来识别生物。 前缀 auto-(“self”)和 hetero-(“其他”)指的是各种生物可以使用的碳源的来源。 将无机二氧化碳(CO 2)转化为有机碳化合物的生物是自养体。 植物和蓝藻是自养的众所周知的例子。 相反,异养生物依赖更复杂的有机碳化合物作为营养素;这些化合物最初是由自养提供给他们的。 许多生物,从人类到许多原核生物,包括经过充分研究的大肠杆菌,都是异养的。
生物也可以通过它们使用的能量来识别。 所有能量都来自电子的转移,但是不同类型的生物的电子来源不同。 前缀照片-(“光”)和化疗-(“化学”)是指各种生物使用的能源。 那些从光中获得电子转移能量的是光养体,而化学养生通过破坏化学键获得电子转移能量。 有两种类型的 chemotrophs:organotrophs 和 lithotrophs。 Organotrophs,包括人类、真菌和许多原核生物,是从有机化合物中获取能量的化学养体。 Lithotrophs(“litho” 的意思是 “岩石”)是从无机化合物中获取能量的化学养分,包括硫化氢(H 2 S)和还原铁。 Lithotrophy 是微生物世界所独有的。
可以将用于获取碳和能量的策略结合起来,根据营养类型对生物进行分类。 大多数生物都是化学异养生物,因为它们使用有机分子作为电子和碳源。 下表\(\PageIndex{1}\)汇总了这种分类和其他分类。
| 分类 | 能量来源 | 碳源 | 示例 | |
|---|---|---|---|---|
| Chemotrophs | Chemautotrophs | 化学 | 无机 | 氢氧化菌、硫氧化菌、铁氧化菌、氮气和一氧化碳氧化细菌 |
| Chemohetrophs | 化学 | 有机化合物 | 所有动物,大多数真菌、原生动物和细菌 | |
| Photrophs | Photoautotrop | 光 | 无机 | 所有植物、藻类、蓝细菌以及绿色和紫色的硫磺细菌 |
| Photoretrophs | 光 | 有机化合物 | 绿色和紫色的非硫细菌、日光细菌 | |
练习\(\PageIndex{2}\)
- 解释分解代谢和合成代谢之间的区别。
- 解释自养和异养之间的区别。
新陈代谢的氧化和降低
电子在分子之间的转移很重要,因为存储在原子中并用于燃料电池功能的大部分能量都是高能电子的形式。 电子形式的能量转移使电池能够逐步转移和使用能量;也就是说,在小封装中,而不是一次破坏性的爆发。 从供体分子中去除电子并使其氧化的反应是氧化反应;那些向受体分子添加电子并使其减少的反应是还原反应。 因为电子可以从一个分子移动到另一个分子,所以氧化和还原是串联发生的。 这两对反应称为氧化还原反应或氧化还原反应。
能量载体:NAD +、NADP +、FAD 和 ATP
营养素中化学键分解所释放的能量可以通过减少电子载流子储存,也可以储存在三磷酸腺苷(ATP)的键中。 在生命系统中,一小类化合物充当移动电子载体,这些分子在路径中与化合物结合并在化合物之间穿梭高能电子。 我们将考虑的主要电子载体来自B族维生素组,是核苷酸的衍生物;它们是烟酰胺腺嘌呤二核苷酸、尼古丁腺嘌呤磷酸二核苷酸和黄素腺嘌呤二核苷酸。 这些化合物很容易还原或氧化。 烟酰胺腺嘌呤二核苷酸(NAD + /NADH)是分解代谢中最常用的移动电子载体。 NAD + 是分子的氧化形式;NADH 是分子的还原形式。 尼古丁腺嘌呤磷酸二核苷酸(NADP +)是含有额外磷酸基团的 NAD + 变体的氧化形式,是另一种重要的电子载体;还原后会形成 NADPH。 黄素腺嘌呤二核苷酸的氧化形式为 FAD,其还原形式为 FADH 2。 NAD + /NADH 和 FAD/FADH 2 在化学异养分解代谢过程中广泛用于从糖中提取能量,而 NADP + /NADPH 在合成代谢反应和光合作用中起着重要作用。 总的来说,FADH 2、NADH 和 NADPH 通常被称为功率降低,因为它们能够为各种化学反应提供电子。
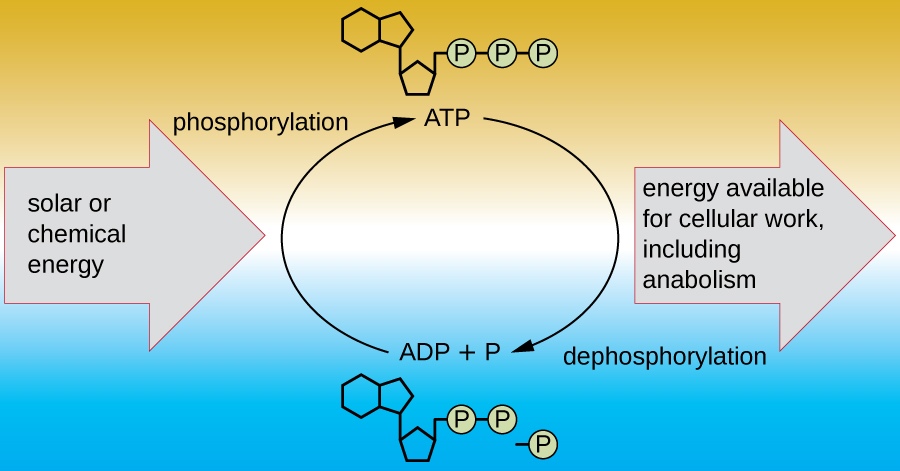
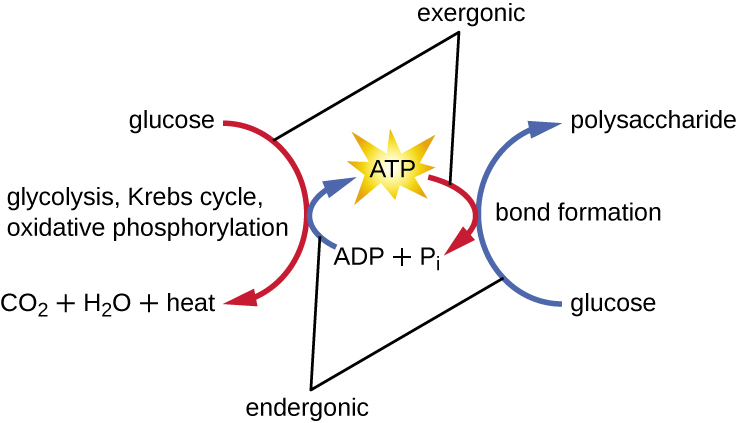
活细胞必须能够处理分解代谢过程中释放的能量,使细胞能够安全地储存能量并仅在需要时释放能量以供使用。 活细胞通过使用化合物三磷酸腺苷(ATP)来实现这一目标。 ATP 通常被称为细胞的 “能量货币”,与货币一样,这种多功能化合物可以用来满足细胞的任何能量需求。 ATP 的核心是腺苷一磷酸分子(AMP),它由与核糖分子和单磷酸基团结合的腺嘌呤分子组成。 核糖是一种存在于 RNA 中的五碳糖,而 AMP 是 RNA 中的核苷酸之一。 在该核心分子中添加第二个磷酸基团会形成二磷酸腺苷(ADP);添加第三个磷酸基团会形成 ATP(图\(\PageIndex{2}\))。 在分子中添加磷酸基团,这种过程称为磷酸化,需要能量。 磷酸盐基团带负电荷,因此当它们串联排列时,它们会相互排斥,就像在ADP和ATP中一样。 这种排斥使得 ADP 和 ATP 分子本质上是不稳定的。 因此,磷酸基团之间的键(一个在ADP中,两个在ATP中)被称为高能磷酸盐键。 当这些高能键被破坏,通过称为脱磷酸化的过程从 ATP 中释放出一个磷酸盐(称为无机磷酸盐 [P i])或两个连接的磷酸盐基团(称为焦磷酸盐 [PP i])时,就会释放能量来驱动内能反应(图\(\PageIndex{3}\))。
练习\(\PageIndex{3}\)
电子载体的作用是什么?
酶的结构和功能
一种有助于加速化学反应的物质是催化剂。 在化学反应过程中不使用或更换催化剂,因此可以重复使用。 无机分子可以作为各种化学反应的催化剂,而称为酶的蛋白质则是细胞内生化反应的催化剂。 因此,酶在控制细胞新陈代谢方面起着重要作用。
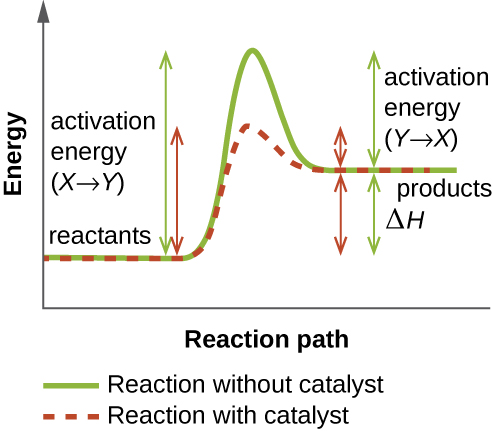
酶的作用是降低细胞内化学反应的活化能。 活化能是形成或破坏化学键并将反应物转化为产物所需的能量(图\(\PageIndex{4}\))。 酶通过与反应物分子结合并以加快反应速度的方式保持活化能来降低活化能。
酶结合的化学反应物称为底物,底物在酶内结合的位置称为酶的活性位点。 活性位点附近氨基酸的特性在活性位点内形成了一个非常特殊的化学环境,该环境诱导了与特定底物(或底物)结合(尽管是短暂的)的适宜性。 由于酶与其底物之间的这种拼图游戏般的匹配,酶以其特异性而闻名。 实际上,当一种酶与其底物结合时,酶的结构会略有变化,以找到过渡状态(底物和产物之间的结构中间体)和活性位点之间的最佳契合,就像橡胶手套模塑成插入其中的手一样。 这种在衬底存在下的活性位点修饰以及过渡态的同时形成,称为诱导拟合(图\(\PageIndex{5}\))。 总的来说,每种底物都有一种特别匹配的酶,因此每种化学反应都有一种特别匹配的酶;但是,也有一定的灵活性。 有些酶能够作用于几种不同的结构相关的底物。
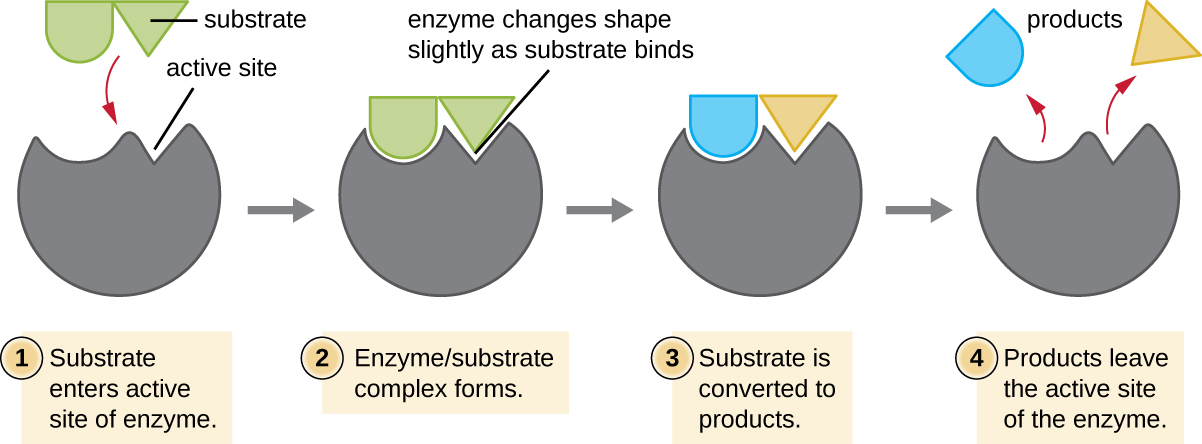
酶受当地环境条件的影响,例如pH、底物浓度和温度。 尽管提高环境温度通常会提高反应速率,无论是酶催化还是其他方式,但将温度提高或降低到最佳范围之外会影响活性位点内的化学键,使其不太适合结合底物。 高温最终会导致酶像其他生物分子一样变性,失去其三维结构和功能。 酶也适合在一定的 pH 值范围内发挥最佳作用,而且,与温度一样,极端的环境 pH 值(酸性或碱性)会导致酶变性。 活性位点氨基酸侧链具有自身的酸性或碱性特性,最适合催化,因此对pH值的变化很敏感。
影响酶活性的另一个因素是底物浓度:在底物浓度较高时,酶活性会增加,直到达到饱和点,酶无法结合其他底物。 总体而言,酶经过优化,可以在产生它们的生物生存的环境条件下发挥最佳作用。 例如,虽然栖息在温泉中的微生物含有在高温下效果最好的酶,但人类病原体的酶在 37°C 下效果最好。同样,虽然大多数生物产生的酶在中性 pH 值下效果最好,但在酸性环境中生长的微生物会使酶优化到低 pH 值条件,允许他们在这些条件下生长。
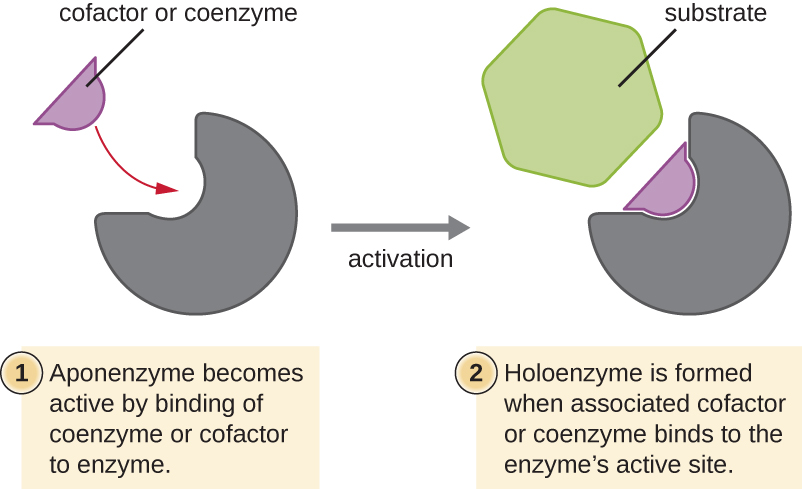
除非与其他特定的非蛋白质辅助分子结合,要么暂时通过离子键或氢键,要么通过更强的共价键永久结合,许多酶都无法发挥最佳作用,甚至根本无法发挥作用。 与这些分子结合可促进其各自酶的最佳构象和功能。 两种类型的辅助分子是辅因子和辅酶。 辅助因子是无机离子,例如铁(Fe 2+)和镁(Mg 2+),它们有助于稳定酶的构象和功能。 需要金属离子作为辅助因子的酶的一个例子是构建 DNA 分子的酶,即 DNA 聚合酶,它需要结合的锌离子(Zn 2+)才能起作用。
辅酶是酶作用所需的有机辅助分子。 与酶一样,它们不被食用,因此可以重复使用。 辅酶最常见的来源是膳食中的维生素。 有些维生素是辅酶的前体,而另一些则直接起到辅酶的作用。
一些辅助因子和辅酶,例如辅酶A(CoA),通常与酶的活性位点结合,有助于底物向产物的过渡(图\(\PageIndex{6}\))。 在这种情况下,缺乏必要辅因子或辅酶的酶被称为 apoenze 并且处于非活性状态。 相反,具有必需的相关辅因子或辅酶的酶被称为全酶并且具有活性。 NADH 和 ATP 也是常用辅酶的例子,它们分别提供高能电子或磷酸基团,它们与酶结合,从而激活它们。
练习\(\PageIndex{4}\)
酶在化学反应中起什么作用?
酶抑制剂
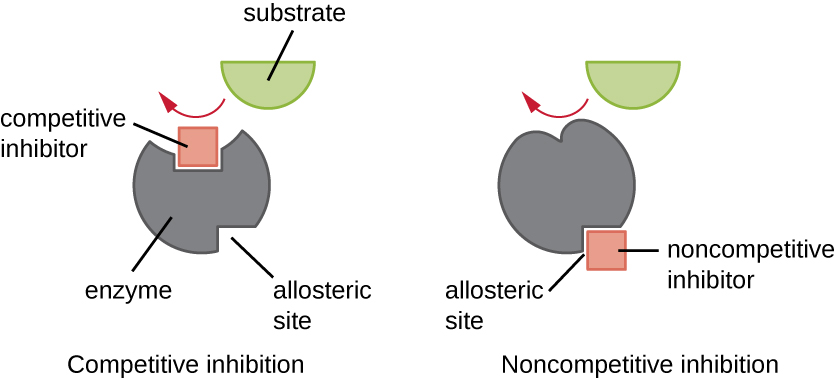
酶可以通过促进或减少其活性的方式进行调节。 有许多不同种类的分子可以抑制或促进酶的功能,并且存在不同的机制(图\(\PageIndex{7}\))。 竞争抑制剂是一种与底物足够相似的分子,只要阻断底物结合,它就可以与底物竞争与活性位点结合。 为了使竞争性抑制剂有效,抑制剂浓度必须大致等于底物浓度。 磺胺类药物为竞争提供了一个很好的例子。 它们之所以用于治疗细菌感染,是因为它们与细菌叶酸合成途径中酶的活性位点结合。 如果有足够的剂量,磺胺类药物会阻止叶酸的合成,细菌无法生长,因为它们无法合成 DNA、RNA 和蛋白质。 人类不受影响,因为我们从饮食中获取叶酸。
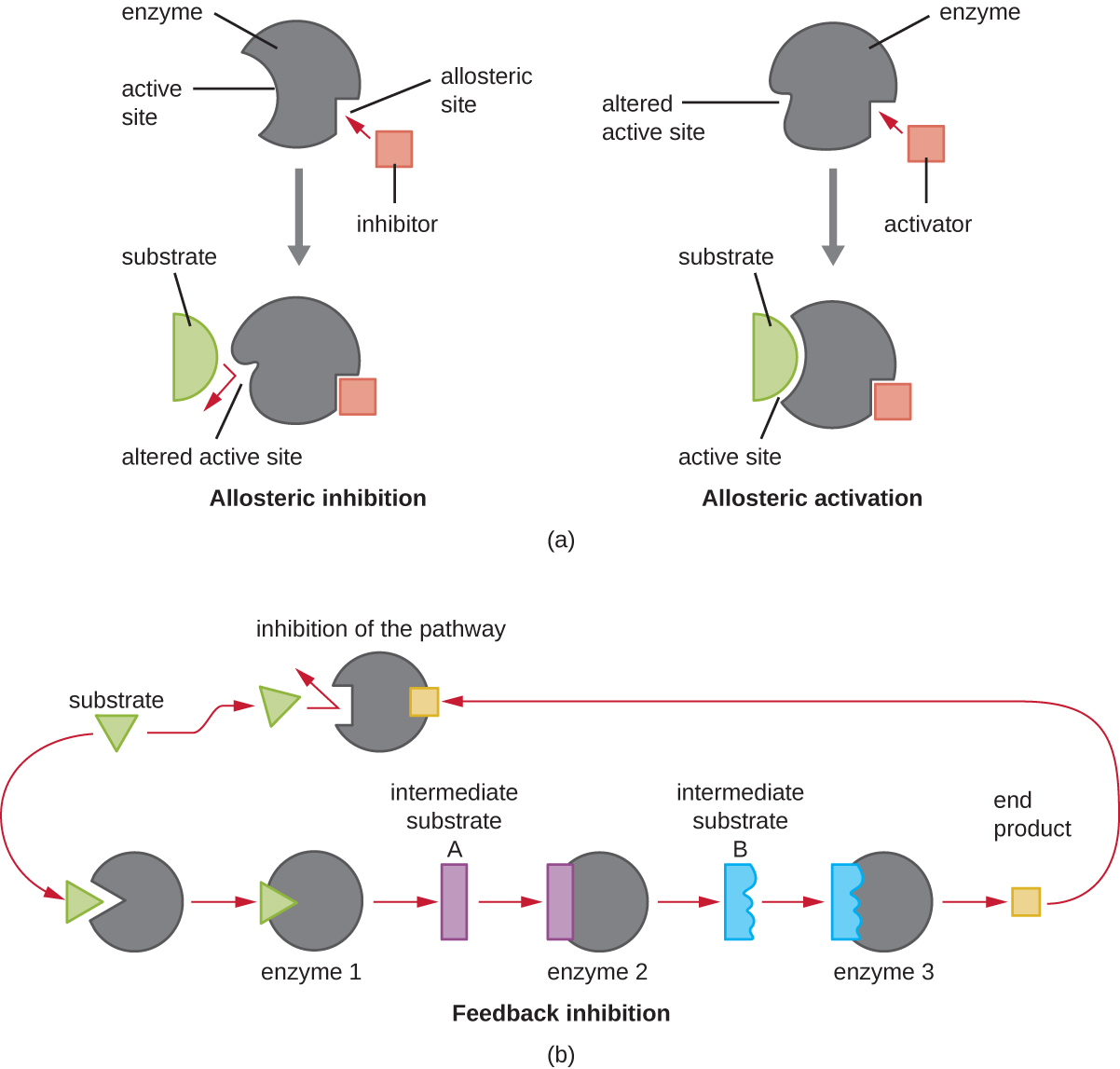
另一方面,非竞争性(变构)抑制剂在变构位点(活性位点以外的位置)与酶结合,并且仍然设法通过诱导构象变化来阻断底物与活性位点的结合,从而降低酶对其底物的亲和力(图\(\PageIndex{8}\))。 由于每种酶只需要一个抑制剂分子即可有效抑制,因此非竞争性抑制所需的抑制剂浓度通常远低于底物浓度。
除了变构抑制剂外,还有变构激活剂会与酶上远离活性位点的位置结合,从而诱发构象变化,从而增加该酶活性位点对其底物的亲和力。
变构控制是调节参与分解代谢和合成代谢的代谢途径的重要机制。 以一种最有效和最优雅的方式,细胞也进化为使用自身代谢反应的产物来抑制酶活性的反馈抑制。 反馈抑制涉及使用途径产物来调节其自身的进一步产生。 细胞通过在合成代谢或分解代谢反应期间减缓产量来对特定产物的丰度做出反应(图\(\PageIndex{8}\))。
练习\(\PageIndex{5}\)
解释竞争抑制剂和非竞争抑制剂之间的区别。
关键概念和摘要
- 新陈代谢包括分解复杂分子的化学反应(分解代谢)和生成复杂分子的化学反应(合成代谢)。
- 生物可以根据其碳来源进行分类。 Autotrophs 将无机二氧化碳转化为有机碳;h etrotrophs 使用固定的有机碳化合物。
- 也可以根据生物的能量来源对生物进行分类。 Photrophs 从光中获取能量。 Chemotrophs 从化合物中获取能量。 Organotrophs 使用有机分子,而 l ithotrophs 使用无机化学物质。
- 细胞电子载体接受食物中的高能电子,然后在随后的氧化还原反应中充当电子供体。 F@@ AD/FADH 2、NAD + /NADH 和 NADP + /NADPH 是重要的电子载体。
- 三磷酸腺苷(ATP)是细胞的能量货币,安全地将化学能储存在其两个高能磷酸盐键中,供以后用于驱动需要能量的过程。
- 酶是生物催化剂,它通过降低反应进行所需的活化能来提高细胞内部的化学反应速度。
- 在自然界中,exergonic 反应不需要活化能以外的能量即可进行,它们会释放能量。 它们可能在没有酶的情况下生长,但速度很慢。 相反,内能反应需要活化能以外的能量才能发生。 在细胞中,内激素反应与外激素反应相结合,使这种组合具有活力有益。
- 底物与酶的活性位点结合。 这个过程通常会改变活性位点和底物的结构,有利于过渡态的形成;这被称为诱导拟合。
- 辅助因子是稳定酶构象和功能的无机离子。 辅@@ 酶是正常酶功能所需的有机分子,通常来自维生素。 缺少辅因子或辅酶的酶是原酶;具有结合辅因子或辅酶的酶是全酶。
- 竞争性抑制剂通过与酶的活性位点结合来调节酶,从而阻止底物结合。 非竞争性(变构)抑制剂与变构位点结合,诱导酶的构象变化,从而阻止其发挥作用。 当代谢途径的产物在代谢途径的早期以非竞争性方式与酶结合,最终阻止该产物的合成时,就会发生@@ 反馈抑制。


