2.3: 显微镜仪器
- Page ID
- 200297
学习目标
- 识别和描述明场显微镜的各个部分
- 计算复合显微镜的总放大倍率
- 描述各种类型的光学显微镜、电子显微镜和扫描探针显微镜的区别特征和典型用途
早期的显微镜先驱者为进入微生物的隐形世界打开了一扇窗户。 但是在随后的几个世纪中,显微镜继续进步。 1830 年,约瑟夫·杰克逊·李斯特创造了一款本质上是现代的光学显微镜。 20 世纪,人们开发了利用不可见光的显微镜,例如使用紫外光源的荧光显微镜和使用短波长电子束的电子显微镜。 这些进步使放大倍率、分辨率和对比度有了重大改进。 相比之下,van Leeuwenhoek及其同时代人的相对基本的显微镜的威力远不及当今使用的最基本的显微镜。 在本节中,我们将概述现代显微镜技术的广泛范围以及每种显微镜的常见应用。
光学显微镜
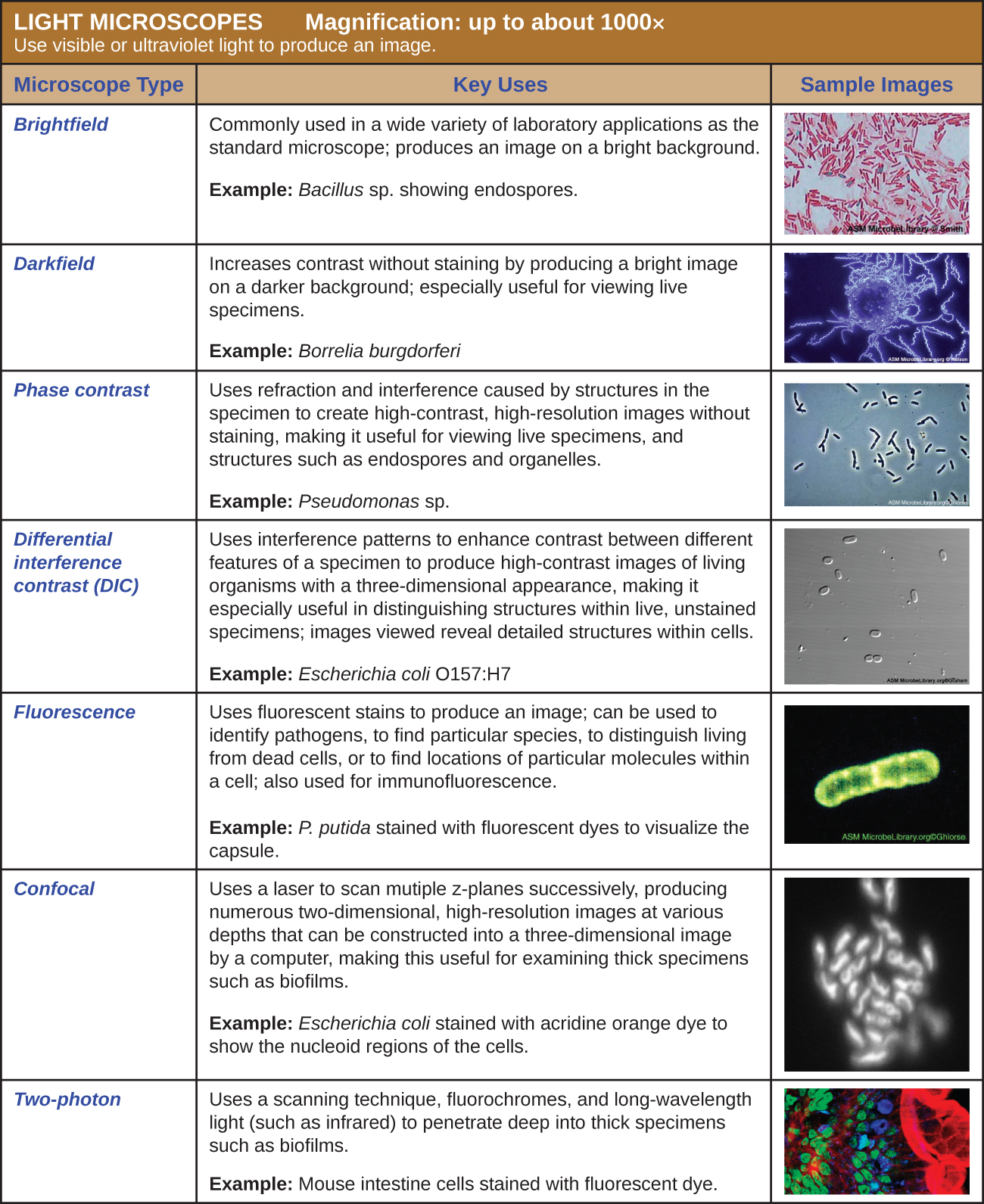
许多类型的显微镜都属于光学显微镜类别,光学显微镜使用光来可视化图像。 光学显微镜的示例包括明场显微镜、暗场显微镜、相位对比显微镜、差分干涉对比显微镜、荧光显微镜、共焦扫描激光显微镜和双光子显微镜。 这些不同类型的光学显微镜可用于在诊断和研究中相互补充。
布莱特菲尔德显微镜
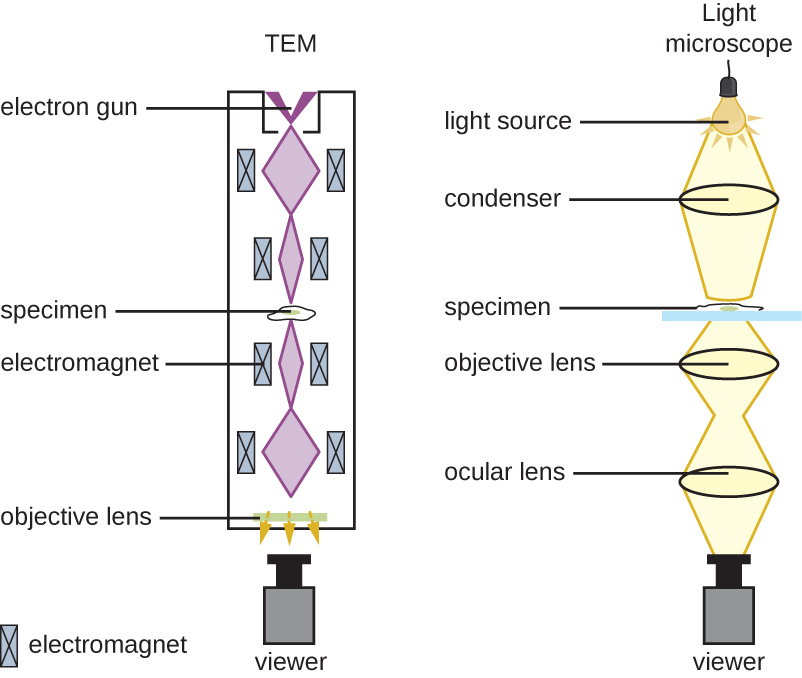
明场显微镜,也许是最常用的显微镜类型,它是一种带有两个或更多镜头的复合显微镜,可以在明亮的背景上产生深色图像。 有些明场显微镜是单目显微镜(只有一个目镜),但大多数较新的明场显微镜都是双目显微镜(有两个目镜),如图所示\(\PageIndex{1}\);无论哪种情况,每个目镜都包含一个称为眼镜的镜头。 眼镜通常将图像放大 10 倍(10 倍)。 人体管的另一端是旋转物镜转换器上的一组物镜。 这些物镜的放大倍率通常在4到100度之间,每个镜头的放大倍率在镜头的金属外壳上指定。 眼镜和物镜协同工作以创建放大后的图像。 总放大倍率是眼部放大倍率乘以物镜放大倍率的乘积:
\[\text{ocular magnification} \times \text{objective magnification} \nonumber\]
例如,如果选择了物\(40 \times\)镜而目镜是\(10\times\),则总放大倍率为
\[(40×)(10×)=400× \nonumber\]
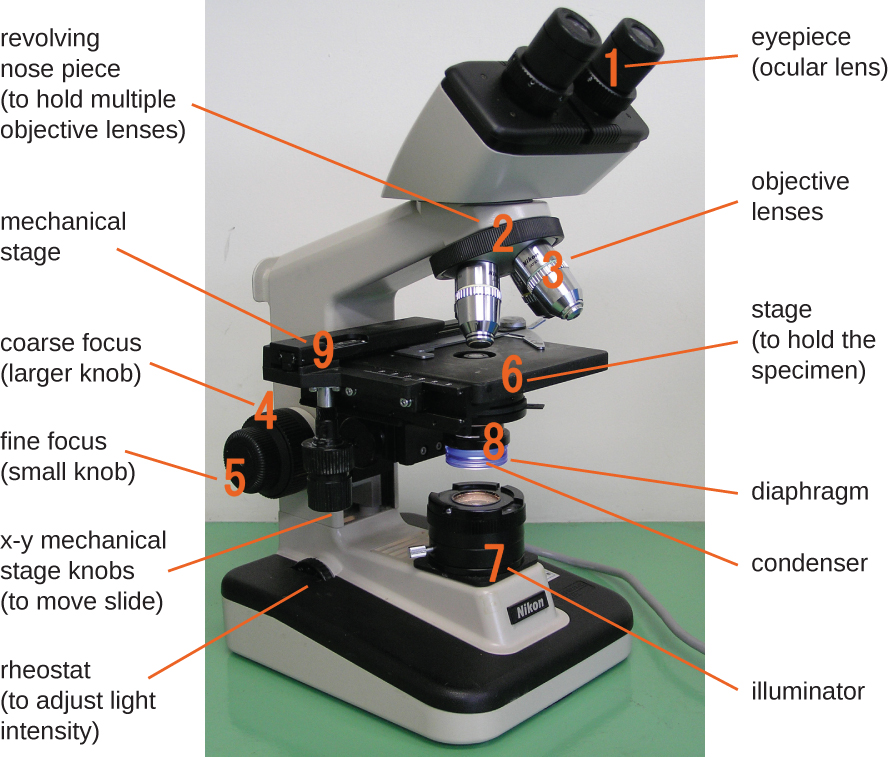
典型明场显微镜的组件。
正在查看的物品称为标本。 将标本放在玻璃载玻片上,然后将其夹在显微镜的载物台(平台)上。 滑块固定好后,使用 x-y 机械载物台旋钮将载玻片上的标本置于灯光之上。 这些旋钮可在舞台表面移动滑轨,但不会升高或降低舞台。 一旦标本以光线为中心,就可以升高或降低舞台位置以聚焦图像。 粗调焦旋钮用于使用 4和 10物镜进行大规模移动;精细聚焦旋钮用于小规模移动,尤其是 40 或 100 物镜。
当图像被放大时,它们会变得更暗,因为每个单位图像面积的光线较少。 因此,显微镜生成的高放大图像需要强光照明。 在明场显微镜中,这种光是由照明器提供的,照明器通常是舞台下方的高强度灯泡。 来自照明器的光线通过聚光透镜(位于舞台下方)向上传递,聚光镜将所有光线聚焦在标本上,以最大限度地提高照明。 使用附带的聚光器对焦旋钮可以优化聚光器的位置;一旦确定了最佳距离,就不应移动聚光镜来调整亮度。 如果需要低于最大光照水平,则可以通过打开或关闭冷凝器和试样之间的隔膜来轻松调整照射样本的光量。 在某些情况下,还可以使用变阻器调整亮度,变阻器是一种控制照明器强度的调光开关。
明场显微镜通过将来自照明器的光引向标本来生成图像;这种光被不同的结构以差分方式透射、吸收、反射或折射。 不同的颜色在与部分标本中的发色团(吸收和反射特定波长光的颜料)相互作用时会有不同的表现。 通常,发色团是使用染色剂人工添加到标本中,这有助于提高对比度和分辨率。 通常,标本中的结构在不同程度上会显得比明亮的背景更暗,从而在放大倍率高达约1000°时产生最清晰的图像。 进一步放大将创建更大的图像,但不会提高分辨率。 这使我们能够看到像细菌一样小的物体,在大约 400 度左右可见,但看不到病毒等较小的物体。
在非常高的放大倍率下,当光线穿过样本和镜头之间的少量空气时,分辨率可能会受到影响。 这是因为空气和玻璃的折射率差异很大;空气在光线被镜头聚焦之前就散射出来。 为了解决这个问题,可以使用一滴油填充试样和油浸透镜之间的空间,油浸透镜是一种设计用于浸没油的特殊镜头。 由于油的折射率与玻璃的折射率非常相似,因此它增加了离开样本的光线照射透镜的最大角度。 这增加了收集的光线,从而提高了图像的分辨率(图\(\PageIndex{2}\))。 各种油可用于不同类型的光。
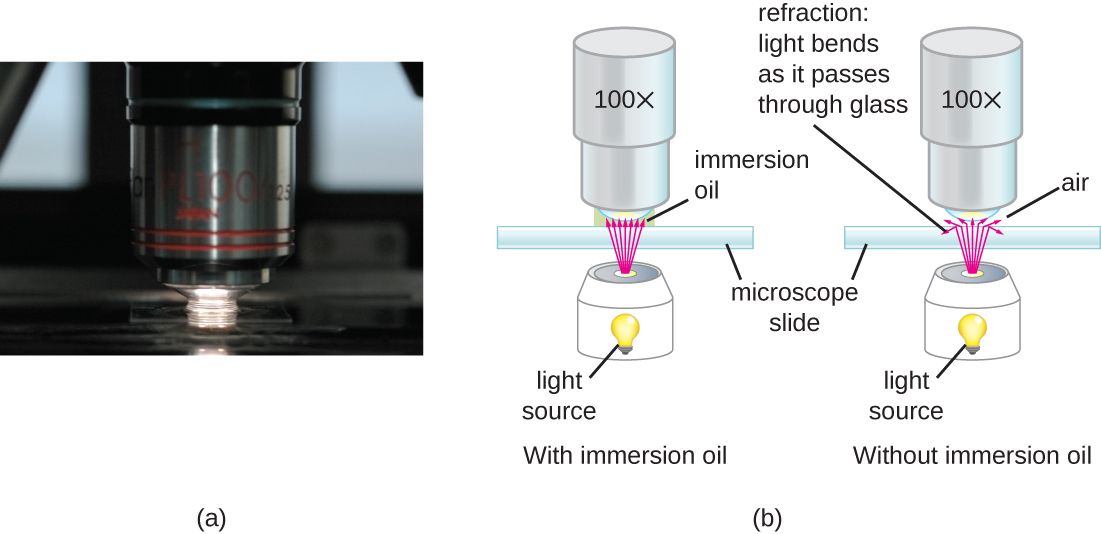
如果没有进行适当的清洁和维护,即使是功能非常强大的显微镜也无法提供高分辨率的图像。 由于镜头经过精心设计和制造,可以高精度地折射光线,因此即使是稍微脏污或刮擦的镜头也会以意想不到的方式折射光线,从而降低标本的图像。 此外,显微镜是相当精密的仪器,必须格外小心,以免损坏零件和表面。 除其他外,对显微镜的正确保养包括以下内容:
- 用镜头纸清洁镜头
- 不允许镜片接触幻灯片(例如,通过快速改变对焦)
- 保护灯泡(如果有)免受破损
- 不要将目标推入幻灯片
- 使用 40 度或以上的物镜时不要使用粗调焦旋钮
- 仅使用带有特殊油品物镜的浸没油,通常是 100物镜
- 使用显微镜后清洁浸入式镜头上的油
- 清洗意外从其他镜头转移过来的油脂
- 遮住显微镜或在不使用时将其放在柜子里
暗场显微镜
暗场显微镜是一种明场显微镜,对聚光镜进行了微小但重要的修改。 在照明器和聚光镜之间放置一个不透明的小圆盘(直径约为 1 cm)。 这种不透明的光圈被称为圆盘,它在照明器通过聚光器到达物镜的途中阻挡了来自照明器的大部分光线,从而产生一个聚焦在标本上的空心光锥。 到达物镜的唯一光是被样本中的结构折射或反射的光。 生成的图像通常在深色背景上显示明亮的物体(图\(\PageIndex{3}\))
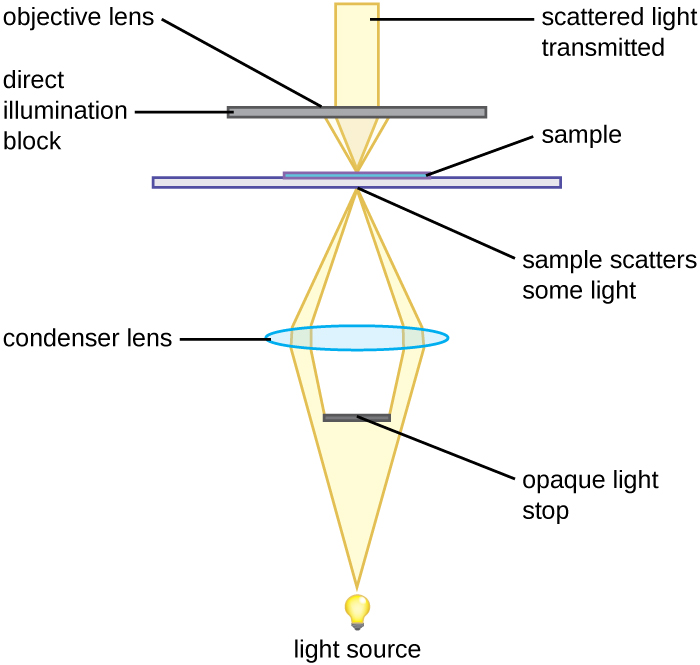
插入明场显微镜中的不透明光标用于生成暗场图像。 光阻阻挡光线直接从照明器传播到物镜,只允许从样本反射或折射的光线到达眼睛。
暗场显微镜通常可以在不使用污渍的情况下创建高对比度、高分辨率的标本图像,这对于查看可能被污渍杀死或以其他方式破坏的活标本特别有用。 例如,最好使用暗场显微镜观察像梅毒的病原体梅毒螺旋体这样的细螺旋体(图\(\PageIndex{4}\))。
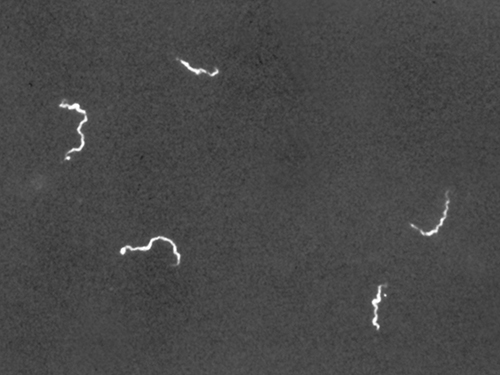
使用暗场显微镜使我们能够查看活的、未染色的 spirochete Pallidum 螺旋体样本。 与摄影底片类似,螺旋体在深色背景下显得明亮。 (来源:美国疾病控制与预防中心/C.W. Hubbard)
练习\(\PageIndex{1}\)
确定明场显微镜和暗场显微镜之间的主要区别。
临床重点:第 2 部分
像辛迪这样的伤口感染可能是由许多不同类型的细菌引起的,其中一些细菌可以迅速传播,并出现严重的并发症。 确定具体原因对于选择能够杀死或阻止细菌生长的药物非常重要。
在就辛迪的病例打电话给当地医生后,营地护士将伤口样本送到最近的医学实验室。 不幸的是,由于营地位于偏远地区,最近的实验室很小,设备很差。 更现代化的实验室可能会使用其他方法来培养、培育和鉴定细菌,但是在这种情况下,技术人员决定用标本做一个湿式支架,然后在明场显微镜下观察。 在湿式支架中,向载玻片中添加一小滴水,然后在试样放置在物镜下方之前,在试样上方放置一张盖板以将其保持在原位。
在明场显微镜下,技术人员几乎看不见细菌细胞,因为它们在明亮的背景下几乎是透明的。 为了增加对比度,技术人员在照明器上方插入了一个不透明的光标。 由此产生的暗场图像清楚地表明,细菌细胞是球形的,像葡萄一样成簇分组。
- 为什么识别标本中细胞的形状和生长模式很重要?
- 还有哪些其他类型的显微镜可以有效地用于查看该标本?
相位对比显微镜
相位对比显微镜利用样品中的结构引起的折射和干扰来创建高对比度、高分辨率的图像,而不会染色。 它是最古老和最简单的显微镜类型,它通过改变穿过标本的光线的波长来创建图像。 为了创建改变的波长路径,在聚光器中使用环形光标。 环形光圈产生一个空心的光锥,在到达物镜之前聚焦在标本上。 物镜包含一个含有相环的相板。 结果,直接从照明器传播的光线穿过相环,而样本折射或反射的光则穿过板。 这会导致穿过环的波长与穿过环的波长相差约为一半的波长。 由于波浪有峰值和低谷,因此它们可以加在一起(如果相位同相),也可以相互抵消(如果相位不一致)。 当波长异相时,波槽将抵消波峰,这称为破坏性干扰。 然后,在只有未折射光线的明亮背景下,折射光线的结构会显得很暗。 更一般地说,折射率等特征不同的结构在暗度方面会有所不同(图\(\PageIndex{5}\))。
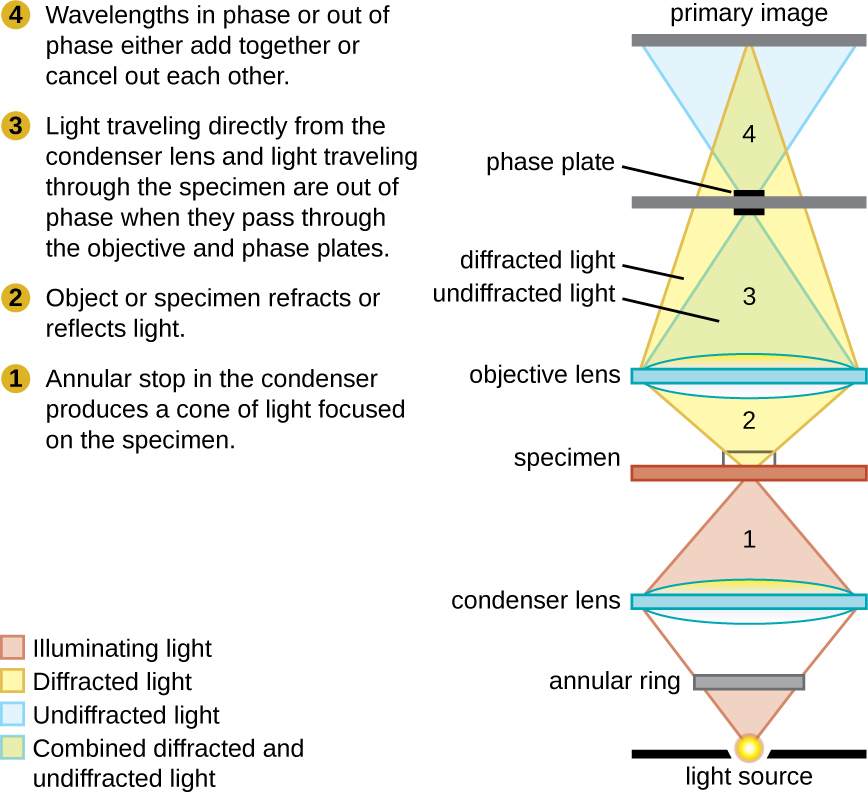
这张相位对比显微镜的示意图说明了穿过物体的光与背景之间的相位差。 这些差异是通过将光线穿过相板的不同部分而产生的。 光线叠加在图像平面中,由于它们的干扰而产生对比度。
由于相位对比度显微镜无需染色即可增加对比度,因此通常使用相位对比显微镜来观察活体标本。 某些结构,例如真核细胞中的细胞器和原核细胞中的内孢子,通过相位对比显微镜可以很好地可视化(图\(\PageIndex{6}\))。
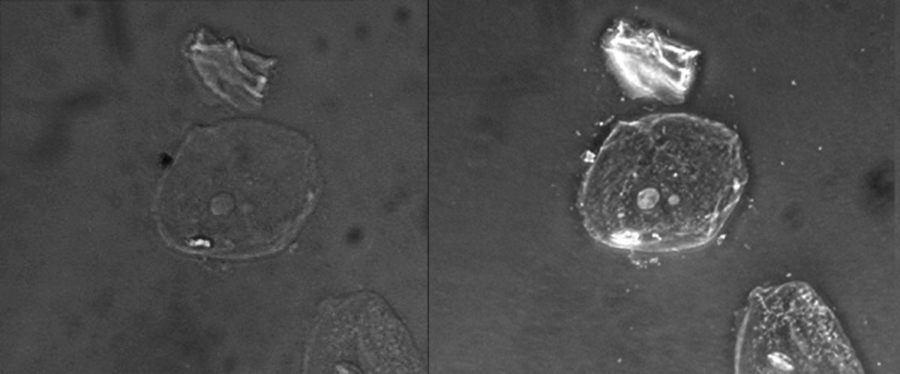
此图将同一未染色的简单鳞状上皮细胞的明场图像(左)与相位对比图像(右)进行了比较。 细胞位于每张照片的中间和右下角(细胞上方的不规则项目是脱细胞碎片)。 请注意,明场图像中未染色的单元格在背景下几乎不可见,而相位对比图像中的单元格似乎在背景下发光,显示的细节要多得多。 (来源:“显然是开菲尔” /维基共享资源)
差分干涉对比显微镜
差分干涉对比 (DIC) 显微镜(也称为诺玛斯基光学)与相位对比显微镜相似,因为它们使用干涉模式来增强样品不同特征之间的对比度。 在 DIC 显微镜中,会产生两束光束,波动方向(偏振)不同。 一旦光束穿过无样本空间或无标本空间,它们就会重新组合,样本的影响会导致光束组合产生的干扰模式出现差异。 这就产生了具有三维外观的活生物体的高对比度图像。 这些显微镜在区分活的、未染色的标本中的结构方面特别有用。 (图\(\PageIndex{7}\))。

在改良后的莱昂尼安琼脂上生长的 Fonsecaea pedrosoi 的 DIC 图像。 这种真菌会导致色母菌病,这是一种常见于热带和亚热带气候的慢性皮肤感染。
练习\(\PageIndex{2}\)
相位对比和 DIC 显微镜有哪些优点?
荧光显微镜
荧光显微镜使用称为荧光色素的荧光发色团,它能够吸收来自光源的能量,然后将这种能量作为可见光发射。 Fluorochromes 包括天然荧光物质(例如叶绿素)以及添加到样本中以形成对比度的荧光污渍。 诸如德州红和FITC之类的染料就是荧光染料的例子。 其他例子包括核酸染料 4',6'-diamidino-2-phenylindole(DAPI)和 acridine orange。
显微镜向标本传输激发光,通常是一种波长较短的 EMR 形式,例如紫外线或蓝光;发色团吸收激发光并发射波长较长的可见光。 然后激发光被过滤掉(部分原因是紫外线对眼睛有害),这样只有可见光才能通过眼镜。 这会在深色背景下生成色彩鲜艳的标本图像。
荧光显微镜在临床微生物学中特别有用。 它们可以用来识别病原体,在环境中寻找特定的物种,或者寻找细胞内特定分子和结构的位置。 还开发了使用荧光显微镜根据活细胞和死细胞是否吸收特定的荧光色素来区分活细胞和死细胞的方法。 有时,在同一个标本上使用多种荧光色素来显示不同的结构或特征。
荧光显微镜最重要的应用之一是一种称为免疫荧光的技术,该技术用于通过观察抗体是否与某些致病微生物结合来识别它们。 (抗体是免疫系统产生的蛋白质分子,附着在特定的病原体上以杀死或抑制它们。) 该技术有两种方法:直接免疫荧光测定(DFA)和间接免疫荧光测定(IFA)。 在 DFA 中,特异性抗体(例如,靶向狂犬病病毒的抗体)用荧光色素染色。 如果标本含有靶向病原体,则可以在荧光显微镜下观察到与病原体结合的抗体。 这被称为初级抗体染色,因为染色的抗体直接附着在病原体上。
在IFA中,二级抗体用荧光色素而不是初级抗体染色。 二级抗体不直接附着在病原体上,但它们确实与初级抗体结合。 当未染色的一级抗体与病原体结合时,可以观察到荧光二级抗体与初级抗体结合。 因此,二级抗体间接附在病原体上。 由于多个二级抗体通常可以附着在一级抗体上,因此 IFA 增加了附着在样本上的荧光抗体的数量,从而更容易可视化样本中的特征(图\(\PageIndex{8}\))。
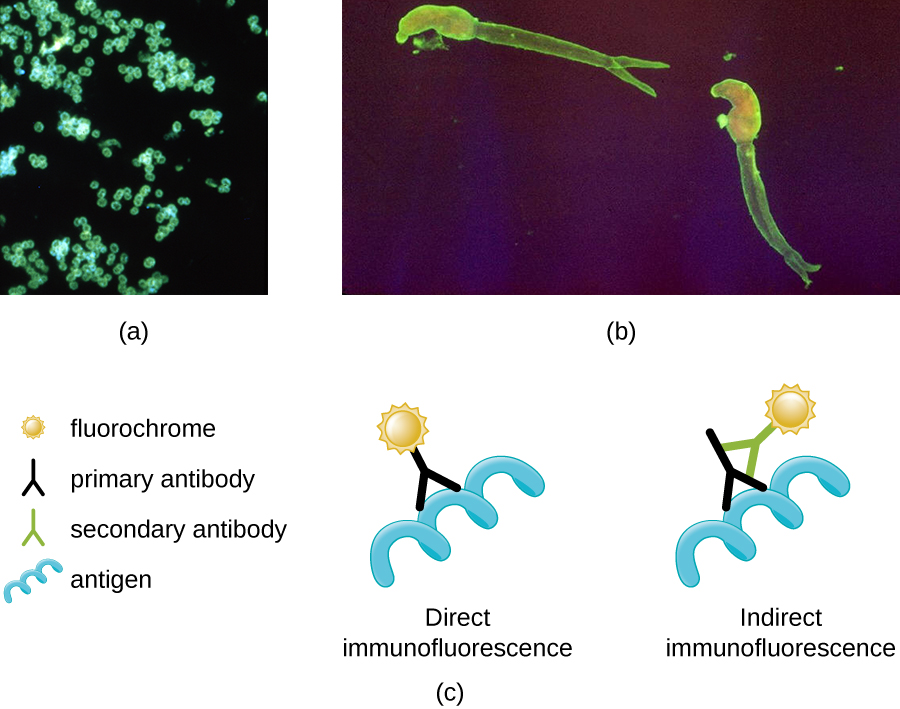
练习\(\PageIndex{3}\)
为什么必须使用荧光色素在荧光显微镜下检查标本?
共焦显微镜
其他形式的光学显微镜产生的图像最大程度地聚焦在距离观察者单个距离(深度或 z 平面)处,而共焦显微镜则使用激光连续扫描多个 z 平面。 这会生成大量不同深度的二维、高分辨率图像,这些图像可以由计算机构造成三维图像。 与荧光显微镜一样,荧光染色通常用于提高对比度和分辨率。 狭窄的光圈可消除任何非来自 z 平面的光,进一步增强了图像的清晰度。 因此,共聚焦显微镜对于检查诸如生物膜之类的厚标本非常有用,这些标本可以活着且不固定(图\(\PageIndex{9}\))。
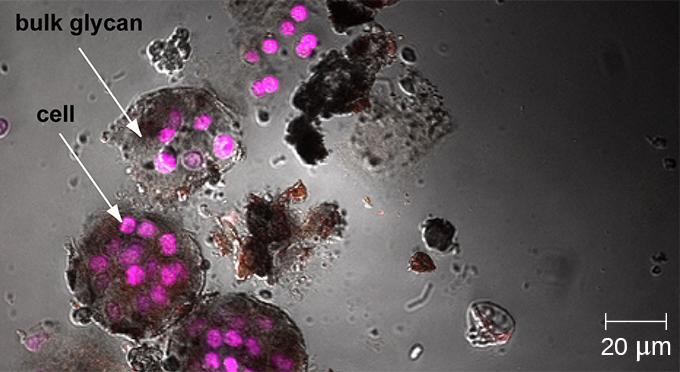
双光子显微镜
虽然最初的荧光显微镜和共焦显微镜可以更好地显示样本中的独特特征,但仍然存在一些问题,阻碍了最佳可视化。 在观察厚样本时,荧光显微镜的有效灵敏度通常受到失焦耀斑的限制,这会导致分辨率差。 在共焦显微镜中,通过使用共焦针孔来抑制具有薄(<1 μm)、无模糊光学切片的失焦背景荧光,这种限制在共聚焦显微镜中得到了极大的降低。 但是,即使是共焦显微镜也缺乏观察厚组织样本所需的分辨率。 双光子显微镜的开发解决了这些问题,该显微镜使用扫描技术、荧光色素和长波长光(例如红外光)对标本进行可视化。 与长波长光相关的低能量意味着两个光子必须同时撞击一个位置才能激发荧光色素。 激发光的低能量对细胞的伤害较小,激发光的长波长更容易穿透到厚样本的深处。 这使得双光子显微镜可用于检查完整组织中的活细胞,包括脑切片、胚胎、整个器官,甚至整个动物。
目前,双光子显微镜的使用仅限于先进的临床和研究实验室,因为这些仪器的成本很高。 单光子显微镜的成本通常在30万至500,000美元之间,用于激发标本上使用的染料的激光也非常昂贵。 但是,随着技术的进步,双光子显微镜在临床环境中可能变得更容易获得。
练习\(\PageIndex{4}\)
哪些类型的样本最好使用共焦显微镜或双光子显微镜检查?
电子显微镜
光学显微镜生成的图像的最大理论分辨率最终受到可见光波长的限制。 大多数光学显微镜只能放大1000倍,少数可以放大到1500倍,但这还没有接近电子显微镜(EM)的放大功率,电子显微镜使用短波长电子束而不是光来提高放大倍率和分辨率。
像电磁辐射一样,电子可以表现为波浪,但是波长为0.005 nm,它们可以产生比可见光更好的分辨率。 EM 可以生成可放大至 100,000的清晰图像。 因此,EM 可以分辨亚细胞结构和某些分子结构(例如 DNA 的单链);但是,由于制备标本需要的方法,电子显微镜不能用于活物质。
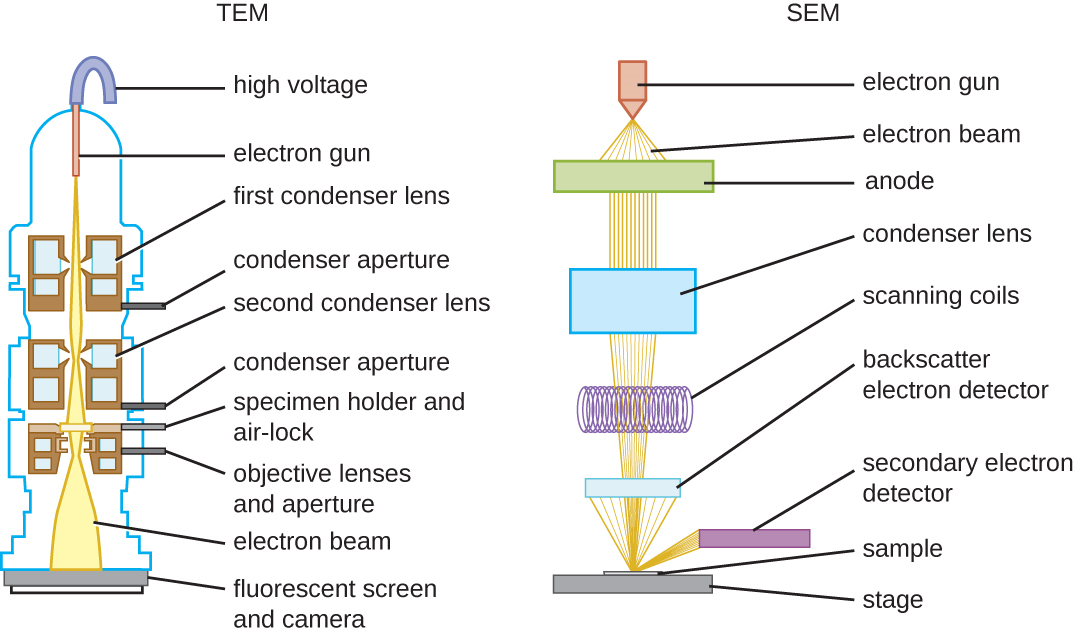
EM 有两种基本类型:透射电子显微镜 (TEM) 和扫描电子显微镜 (SEM)(图\(\PageIndex{10}\))。 就其功能而言,透射电镜与明场光学显微镜有些相似。 但是,它使用来自样本上方的电子束,该电子束使用磁透镜(而不是玻璃透镜)聚焦,然后通过样本投射到探测器上。 电子穿过样本,然后探测器捕获图像(图\(\PageIndex{11}\))。
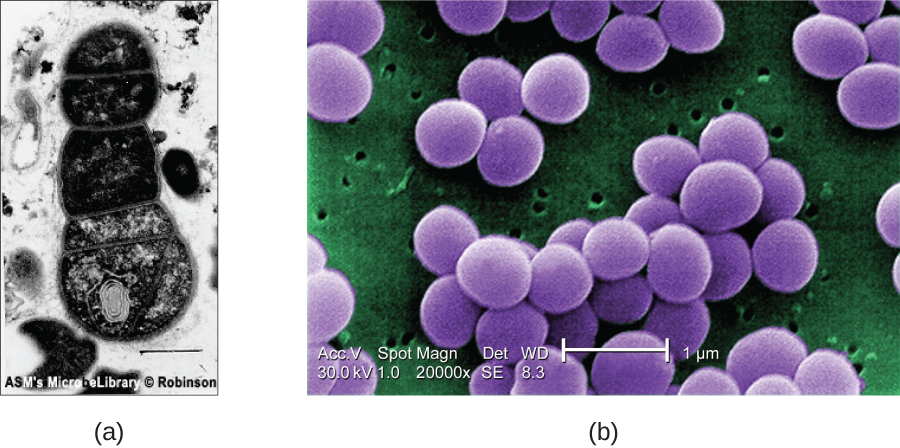
电子要通过透射电镜中的样本,样本必须非常薄(20—100 nm 厚)。 图像之所以产生,是因为标本各个部分的不透明度不同。 这种不透明度可以通过用电子密集的重金属等材料对样本进行染色来增强。 透射电镜要求光束和试样处于真空状态,并且样品必须非常薄且脱水。 下一节将详细讨论准备样本以便在 EM 下观测所需的具体步骤。
SEM 形成标本表面的图像,通常来自被电子束从标本上击落的电子。 这可以创建在显示器上显示的具有三维外观的高度详细的图像(图\(\PageIndex{12}\))。 通常,标本经过干燥并使用固定剂制备,这些固定剂可以减少诸如萎缩之类的伪影,这些伪影可以通过干燥产生,然后再用一层薄薄的金属(例如金)进行溅射涂层。 尽管透射电子显微镜需要非常薄的截面并允许人们看到细胞器和膜内部等内部结构,但扫描电子显微镜可用于观察较大物体(例如花粉颗粒)的表面以及非常小的样品的表面(图\(\PageIndex{13}\))。 有些 EM 可以将图像放大到 2,000,000。 1
练习\(\PageIndex{5}\)
- 与光学显微镜相比,电子显微镜在检查微生物标本方面有哪些优缺点?
- 使用透射电镜检查哪种样本最好? SEM?
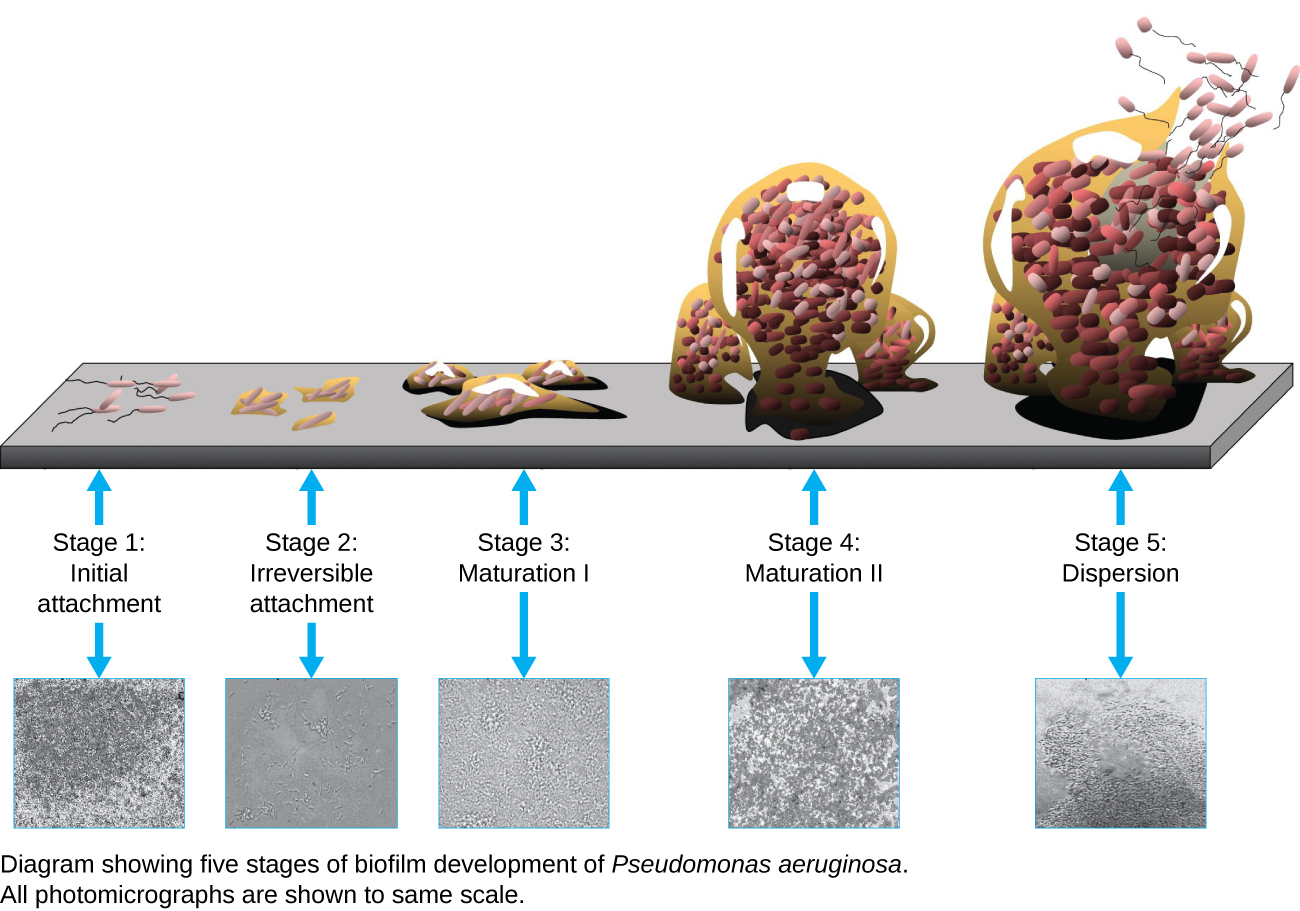
生物膜是由一种或多种微生物物种组成的复杂群落,由于产生附着在表面或表面之间的界面(例如空气和水之间)的外聚物质(EPS),通常以粘稠涂层的形式形成。 在自然界中,生物膜非常丰富,经常占据生态系统中复杂的利基市场(图\(\PageIndex{14}\))。 在医学中,生物膜可以覆盖医疗器械并存在于体内。 由于生物膜具有独特的特征,例如对免疫系统和抗微生物药物的耐药性增加,因此微生物学家和临床医生都特别感兴趣。
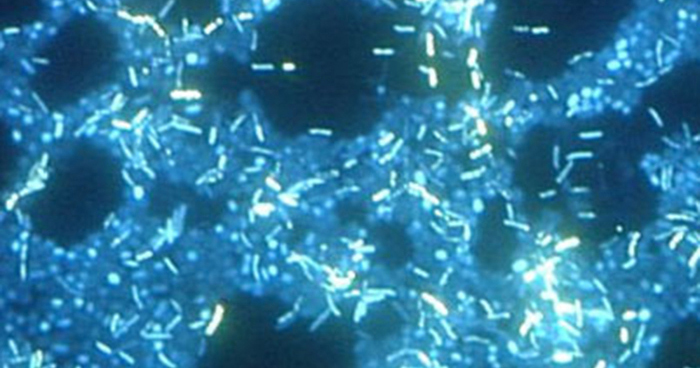
由于生物膜很厚,因此使用光学显微镜无法很好地观察到它们;切片生物膜以产生更薄的标本可能会杀死或干扰微生物群落。 共聚焦显微镜可提供更清晰的生物膜图像,因为它可以一次聚焦在一个 z 平面上,生成厚标本的三维图像。 荧光染料可以帮助识别基质中的细胞。 此外,可以使用免疫荧光和荧光原位杂交(FISH)等技术,其中使用荧光探针与DNA结合。
电子显微镜可用于观察生物膜,但只能在样本脱水后才能观察,这会产生不想要的伪影并使标本变形。 除了这些方法外,还可以使用荧光涂层珠子运动的视频,跟踪水流穿过生物膜的形状(例如锥体和蘑菇)(图\(\PageIndex{15}\))。
扫描探针显微镜
扫描探针显微镜不使用光或电子,而是使用非常锋利的探针,这些探针会穿过标本表面并与之直接相互作用。 这样产生的信息可以组合成放大倍数高达 100,000,000的图像。 如此大的放大倍率可用于观察表面上的单个原子。 迄今为止,这些技术主要用于研究,而不是用于诊断。
扫描探针显微镜有两种类型:扫描隧道显微镜(STM)和原子力显微镜(AFM)。 STM 使用刚好穿过试样上方的探头,因为恒定的电压偏置会在探头和样品之间产生电流。 这种电流是通过探针和样本之间电子的量子隧道产生的,电流的强度取决于探针和样本之间的距离。 探头在表面上方水平移动,然后测量电流强度。 扫描隧道显微镜可以有效地绘制表面结构图,分辨率可以检测到单个原子。
与 STM 类似,原子力显微镜有一个细探头,该探针正好穿过标本上方。 但是,原子力显微镜不是测量试样上方恒定高度的电流变化,而是建立恒定电流并测量探针尖端穿过试样时高度的变化。 当探针尖端穿过标本时,原子之间的力(范德华力、毛细管力、化学键合、静电力等)使其上下移动。 探针尖端的偏转是使用胡克弹性定律确定和测量的,这些信息用于构造具有原子级分辨率的样品表面的图像(图\(\PageIndex{16}\))。

练习\(\PageIndex{6}\)
- 哪个放大倍率更高,是光学显微镜还是扫描探针显微镜?
- 列举扫描探针显微镜的一个优势和一个局限性。


关键概念和摘要
- 许多类型的显微镜使用各种技术来生成显微照片。 大多数适用于特定类型的样本或应用。
- 光学显微镜使用镜头将光聚焦在标本上以生成图像。 常用的光学显微镜包括明场、暗场、相位对比度、差分干涉对比度、荧光、共焦和双光子显微镜。
- 电子显微镜使用磁体将电子聚焦在样本上,产生的放大倍率比光学显微镜大得多。 透射电子显微镜 (TEM) 和扫描电子显微镜 (SEM) 是两种常见形式。
- 扫描探针显微镜通过测量与标本相互作用的尖锐探针的反馈,生成放大倍率更高的图像。 探针显微镜包括扫描隧道显微镜 (STM) 和原子力显微镜 (AFM)。
脚注
- 1 “JEM-ARM200F 透射电子显微镜”,JEOL USA Inc,www.jeolusa.com/Products/Tran... 规格。 已于 2015 年 8 月 28 日访问。
词汇表
- 原子力显微镜
- 一种扫描探针显微镜,它使用穿过试样正上方的细探针来测量原子和探针之间的力
- 双眼
- 有两个目镜
- 明场显微镜
- 带有两个镜头的复合光学显微镜;它在明亮的背景上产生深色图像
- 粗调焦旋钮
- 显微镜上的旋钮,可产生相对较大的动作来调整对焦
- 发色团
- 吸收和反射特定波长的光的颜料(赋予它们一种颜色)
- 聚光镜
- 显微镜上的镜头,用于将来自光源的光聚焦到标本上
- 共焦显微镜
- 一种使用荧光染料和激发激光创建三维图像的扫描激光显微镜
- 暗场显微镜
- 在深色背景上产生明亮图像的复合光学显微镜;通常是经过改良的明场显微镜
- 隔膜
- 显微镜的一个组件;通常由舞台下方的圆盘组成,上面有各种大小的孔;可以调整以允许或多或少来自光源的光到达标本
- 差分干涉对比显微镜
- 使用偏振光增加对比度的显微镜
- 电子显微镜
- 一种使用短波长电子束而不是光来提高放大倍率和分辨率的显微镜
- 精细聚焦旋钮
- 显微镜上的旋钮,可产生相对较小的动作来调整对焦
- 荧光显微镜
- 使用天然荧光色素或荧光染色来增加对比度的显微镜
- 氟铬
- 发荧光(吸收然后发光)的发色团
- 书稿彩饰师
- 显微镜上的光源
- 免疫荧光
- 一种使用荧光显微镜和抗体特异性荧光色素来确定样本中是否存在特定病原体的技术
- 单眼
- 只有一个目镜
- 物镜镜头
- 在光学显微镜上,离标本最近的镜头,通常位于炮塔的末端
- 眼镜
- 在显微镜上,离眼睛最近的镜头(也称为目镜)
- 浸油镜头
- 显微镜上的特殊物镜,旨在与浸油一起使用,以提高分辨率
- 相位对比显微镜
- 使用环形挡块和环形板来增加对比度的光学显微镜
- 变阻器
- 调光开关,用于控制光学显微镜上照明器的强度
- 扫描电子显微镜 (SEM)
- 一种电子显微镜,它可以将电子从样本中反射出来,形成表面图像
- 扫描探针显微镜
- 一种显微镜,它使用探针以恒定距离穿过样品表面,同时测量对间隙大小敏感的电流
- 扫描隧道显微镜
- 显微镜使用的探针正好穿过样品上方,因为恒定的电压偏置在探针和样本之间产生电流的可能性
- 舞台
- 放置载玻片的显微镜平台
- 总放大倍率
- 在光学显微镜中,是一个通过将眼镜的放大倍率乘以物镜的放大倍数计算得出的值
- 透射电子显微镜 (TEM)
- 一种电子显微镜,它使用以磁铁聚焦的电子束,穿过薄的样本
- 双光子显微镜
- 使用长波长或红外光对样本中的荧光荧光进行荧光的显微镜
- x-y 机械舞台旋钮
- 显微镜上的旋钮用于调整标本在舞台表面的位置,通常将其居中位于光线正上方


