35.2: 神经元如何交流
- Page ID
- 202757
培养技能
- 描述静息膜电位的基础
- 解释动作电位的各个阶段以及动作电位是如何传播的
- 解释化学突触和电突触之间的相似之处和区别
- 描述长期增强和长期抑郁症
神经系统执行的所有功能——从简单的运动反射到更高级的功能,例如记忆或决策——都需要神经元相互交流。 人类使用文字和肢体语言进行交流,而神经元则使用电信号和化学信号。 就像委员会中的人一样,一个神经元在 “决定” 将信息发送给其他神经元之前,通常会接收和合成来自多个其他神经元的信息。
神经元内的神经冲动传播
为了使神经系统发挥作用,神经元必须能够发送和接收信号。 这些信号之所以成为可能,是因为每个神经元都有带电的细胞膜(内部和外部之间的电压差),并且该膜的电荷会随着其他神经元释放的神经递质分子和环境刺激而发生变化。 要了解神经元是如何交流的,首先必须了解基线或 “静止” 膜电荷的基础。
神经元带电膜
围绕神经元的脂质双层膜不被带电分子或离子渗透。 要进入或离开神经元,离子必须通过横跨膜的称为离子通道的特殊蛋白质。 离子通道具有不同的配置:打开、关闭和非活动,如图所示\(\PageIndex{1}\)。 需要激活一些离子通道才能打开并允许离子进入或离开细胞。 这些离子通道对环境很敏感,可以相应地改变其形状。 因电压变化而改变其结构的离子通道称为电压门控离子通道。 电压门控离子通道调节电池内外不同离子的相对浓度。 细胞内部和外部之间的总电荷差称为膜电位。
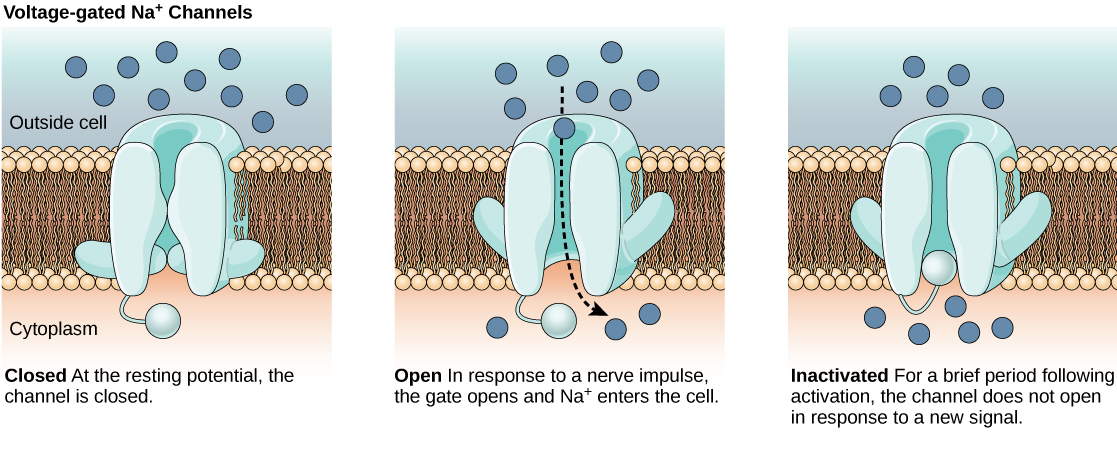
链接到学习
该视频讨论了静息膜电位的基础。
静息膜电位
静止的神经元带负电荷:细胞内部的负电荷比外部高约70毫伏(−70 mV,请注意,这个数字因神经元类型和物种而异)。 这种电压被称为静息膜电位;它是由细胞内外离子浓度的差异引起的。 如果膜对所有离子具有同等的渗透性,则每种类型的离子都会流过膜,系统将达到平衡。 由于离子不能随意穿过膜,因此细胞内外的几种离子浓度不同,如下表所示。 细胞内外带正电荷的钾离子(K +)数量的差异在静息膜电位中占主导地位(图\(\PageIndex{2}\))。 当膜处于静止状态时,由于浓度梯度的净移动,K + 离子会积聚在细胞内。 负静息膜电位是通过增加细胞外(细胞外液中)相对于细胞内部(细胞质中)阳离子的浓度来产生和维持的。 细胞内的负电荷是由细胞膜比钠离子运动更容易渗透而产生的。 在神经元中,钾离子在细胞内保持高浓度,而钠离子在细胞外保持高浓度。 该细胞具有钾和钠泄漏通道,允许两种阳离子沿其浓度梯度向下扩散。 但是,神经元的钾泄漏通道比钠泄漏通道多得多。 因此,钾从细胞中扩散的速度比钠泄漏的速度快得多。 由于离开细胞的阳离子多于进入细胞的阳离子,这会导致细胞内部相对于细胞外部产生负电荷。 一旦建立,钠钾泵的作用有助于维持静息潜力。 回想一下,钠钾泵将两个 K + 离子带入细胞,同时每消耗 ATP 去除三个 Na + 离子。 由于从细胞排出的阳离子多于吸收的阳离子,细胞内部相对于细胞外液体保持负电荷。 应该注意的是,钙离子(Cl —)往往会积聚在细胞外,因为它们会被细胞质内带负电荷的蛋白质排斥。
| 离子 | 细胞外浓度 (mM) | 细胞内浓度 (mM) | 外部/内部比例 |
|---|---|---|---|
| Na + | 145 | 12 | 12 |
| K + | 4 | 155 | 0.026 |
| Cl − | 120 | 4 | 30 |
| 有机阴离子 (A−) | — | 100 |
行动潜力
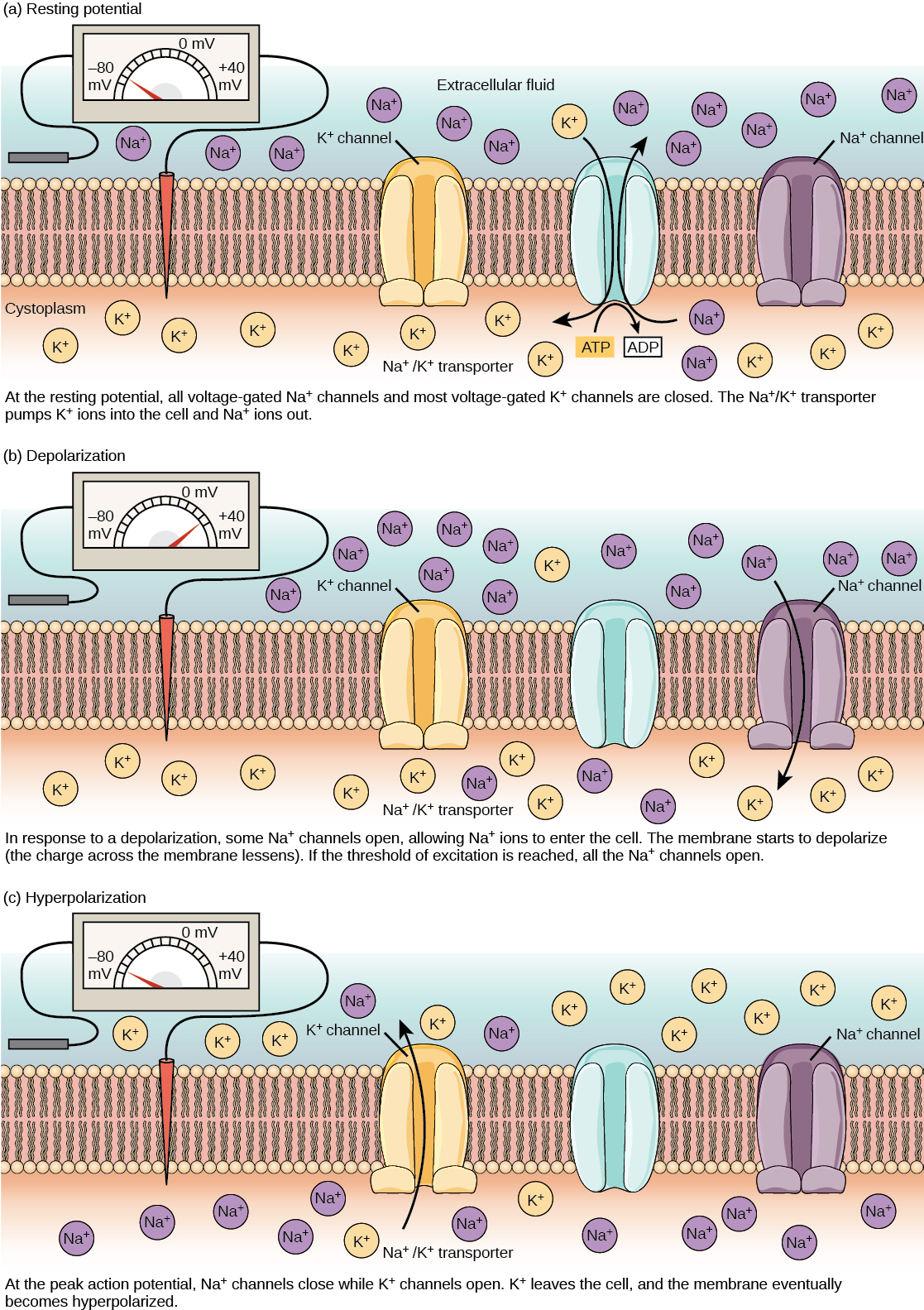
神经元可以接收来自其他神经元的输入,如果该输入足够强,则将信号发送到下游神经元。 神经元之间的信号传输通常由一种称为神经递质的化学物质携带。 神经元内(从树突到轴突末端)信号的传递是通过短暂反转静息膜电位(称为动作电位)来传递的。 当神经递质分子与位于神经元树突上的受体结合时,离子通道就会打开。 在兴奋性突触处,这种开口允许正离子进入神经元并导致膜去极化,从而减少神经元内部和外部之间的电压差。 来自感觉细胞或其他神经元的刺激会使目标神经元去极化至其阈值电位 (-55 mV)。 轴突小丘中的钠离子通道打开,允许正离子进入细胞(图\(\PageIndex{3}\)和图\(\PageIndex{4}\))。 一旦钠通道打开,神经元就会完全去极化至大约 +40 mV 的膜电位。 动作电位被视为 “要么全有要么全无” 的事件,因为一旦达到阈值电位,神经元总是会完全去极化。 去极化完成后,电池现在必须将其膜电压 “重置” 回静止电位。 为此,Na + 通道关闭且无法打开。 这开始了神经元的难治期,在此期间,由于其钠通道无法打开,它无法产生另一个动作电位。 同时,电压门控 K + 通道打开,允许 K + 离开电池。 当 K + 离子离开细胞时,膜电位再次变为负值。 K + 从细胞中扩散出来实际上会使细胞超极化,因为膜电位变得比细胞的正常静息电位更为负。 此时,钠通道将恢复到静止状态,这意味着如果膜电位再次超过阈值电位,它们已经准备好再次打开。 最终,多余的 K + 离子通过钾泄漏通道从细胞中扩散出来,使细胞摆脱超极化状态,恢复其静息膜电位。
艺术连接
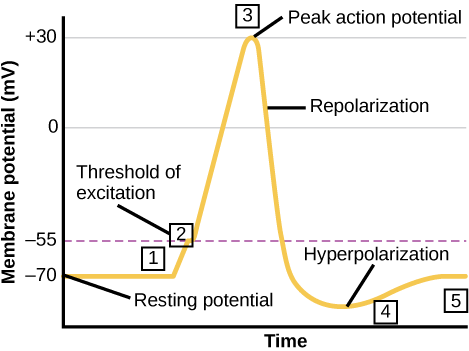
钾通道阻滞剂,例如胺碘酮和普鲁卡因胺,用于治疗心脏异常的电活动,称为心律失常,会阻碍 K + 通过电压门控 K + 通道的运动。 你预计钾通道会影响作用电位的哪一部分?
链接到学习
该视频概述了行动潜力。
髓磷脂和动作电位的传播
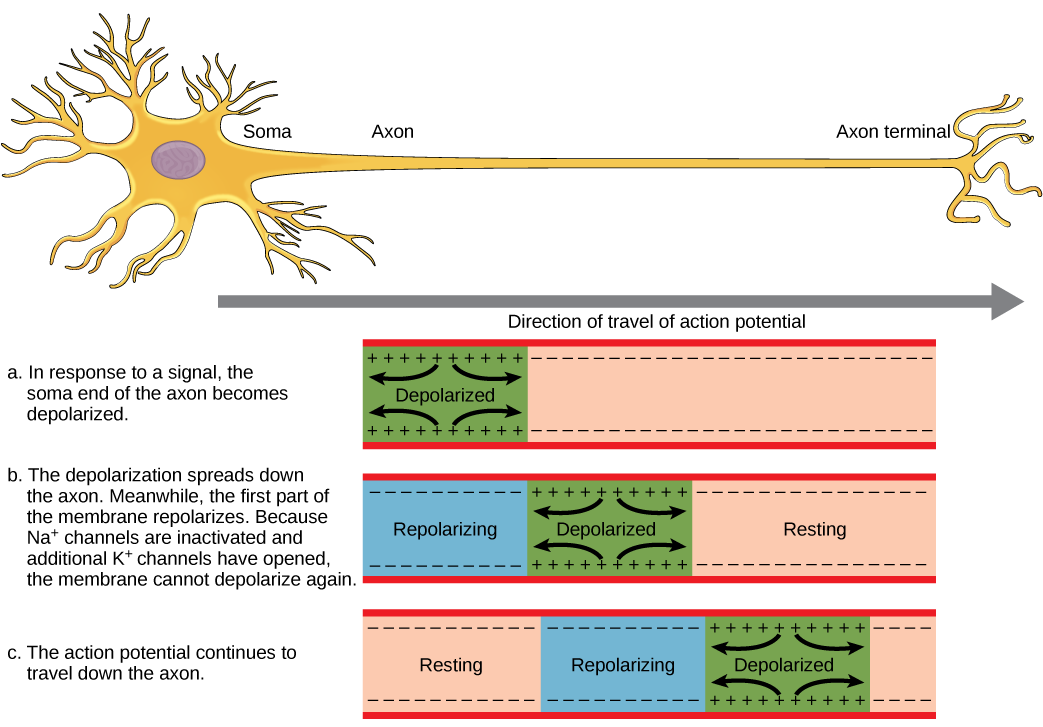
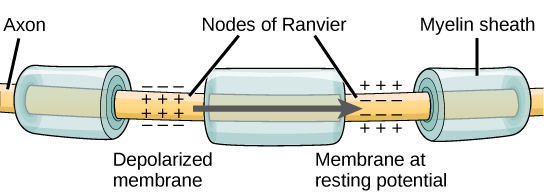
要使动作电位向另一个神经元传递信息,它必须沿轴突传播并到达轴突末端,在那里它可以启动神经递质释放。 动作电位沿轴突的传导速度受轴突的直径和轴突对电流泄漏的抵抗力的影响。 髓磷脂充当绝缘体,防止电流离开轴颈;这提高了作用电位传导的速度。 在多发性硬化症等脱髓鞘疾病中,动作电位传导会减慢,因为电流从先前绝缘的轴突区域泄漏。 如图所示,Ranvier 的节点\(\PageIndex{5}\)是髓鞘沿轴突的间隙。 这些未髓鞘化的空间长约一微米,包含电压门控 Na + 和 K + 通道。 离子流经这些通道,尤其是 Na + 通道,沿轴突一遍又一遍地再生动作电位。 这种动作电位从一个节点到另一个节点的 “跳跃” 称为盐传导。 如果轴突上不存在 Ranvier 节点,则动作电位的传播速度将非常缓慢,因为 Na + 和 K + 通道必须在轴突沿线的每个点而不是在特定点持续再生动作电位。 Ranvier的节点还可以为神经元节省能量,因为通道只需要存在于节点上,而不必出现在整个轴突上。
突触传输
突触或 “间隙” 是信息从一个神经元传输到另一个神经元的地方。 突触通常在轴突末端和树突状刺之间形成,但这并非普遍如此。 还有轴突到轴突的突触、树突到树突以及轴突到细胞的身体突触。 传递信号的神经元称为突触前神经元,接收信号的神经元称为突触后神经元。 请注意,这些名称与特定的突触有关,大多数神经元既是突触前的,也是突触后的。 有两种类型的突触:化学突触和电突触。
化学突触
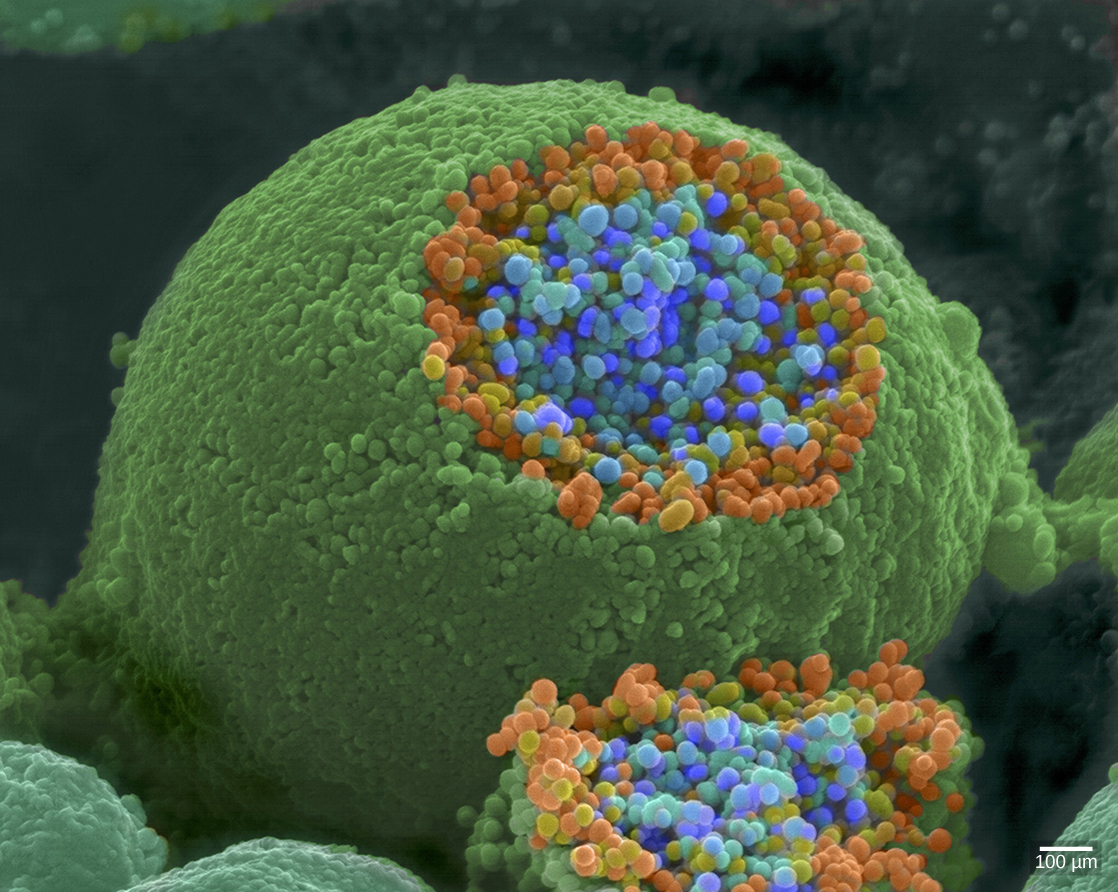
当动作电位到达轴突末端时,它会使膜去极化并打开电压门控的 Na + 通道。 Na + 离子进入细胞,进一步去极化突触前膜。 这种去极化会导致电压门控 Ca 2+ 通道打开。 进入细胞的钙离子会引发信号级联,导致含有神经递质分子的膜结合小囊泡(称为突触囊泡)与突触前膜融合。 突触囊泡如图所示\(\PageIndex{6}\),这是一张来自扫描电子显微镜的图像。
囊泡与突触前膜融合会导致神经递质释放到突触裂缝中,突触裂缝是突触前膜和突触后膜之间的细胞外空间,如图所示\(\PageIndex{7}\)。 神经递质通过突触裂缝扩散,与突触后膜上的受体蛋白结合。
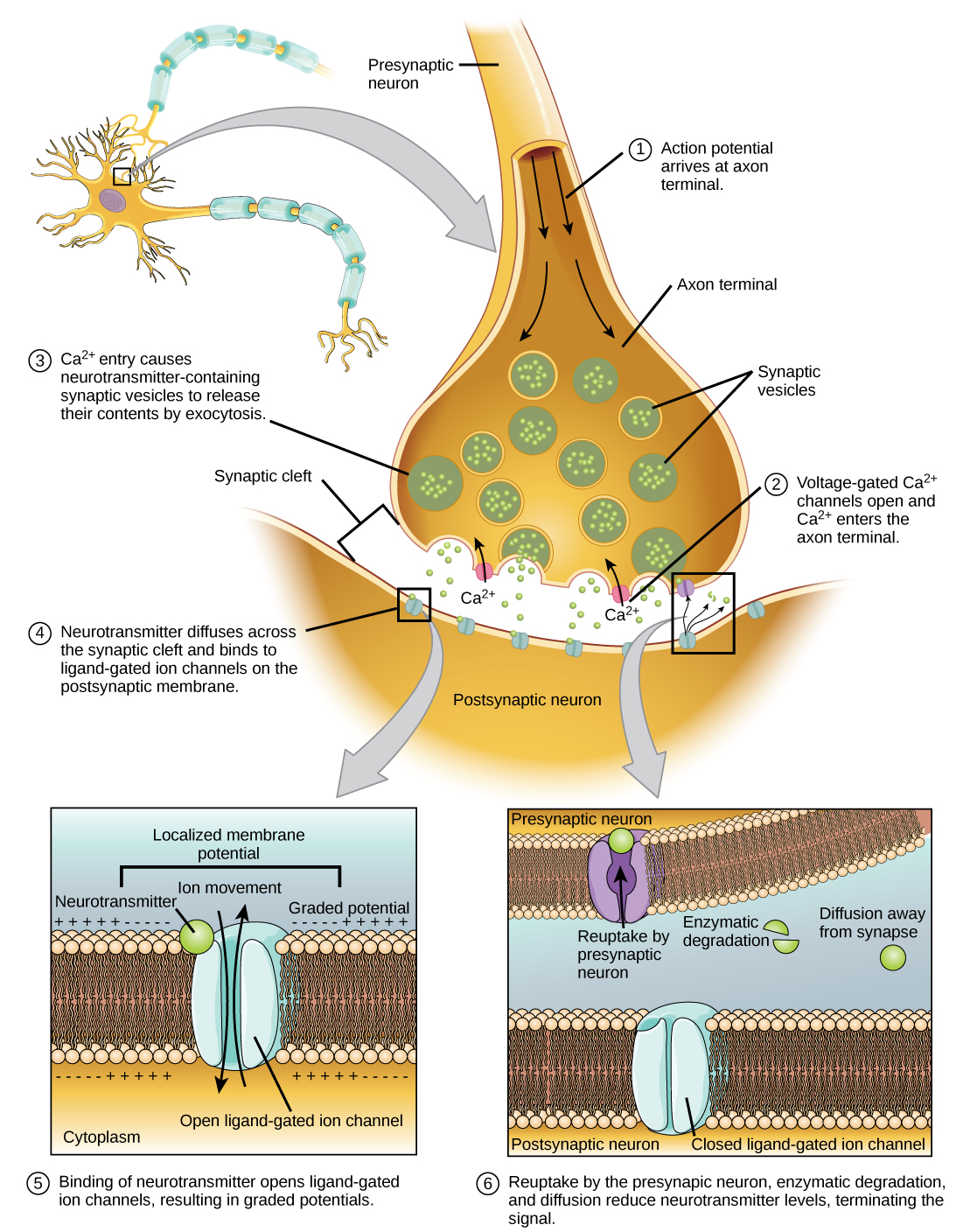
特定神经递质的结合会导致突触后膜上的特定离子通道(在本例中为配体门控通道)打开。 神经递质可以对突触后膜产生兴奋或抑制作用,如下表所示。 例如,当突触前神经元在神经和肌肉之间的突触(称为神经肌肉交界处)处释放乙酰胆碱时,它会导致突触后的 Na + 通道打开。 Na + 进入突触后细胞,导致突触后膜去极化。 这种去极化被称为兴奋性突触后电位(EPSP),它使突触后神经元更有可能产生动作电位。 抑制性突触处释放神经递质会导致抑制性突触后电位(IPSP),即突触前膜的超极化。 例如,当神经递质 GABA(γ-氨基丁酸)从突触前神经元中释放出来时,它会结合并打开 Cl - 通道。 Cl - 离子进入细胞并使膜超极化,使神经元不太可能产生动作电位。
一旦发生神经传递,就必须从突触裂缝中移除神经递质,这样突触后膜才能 “重置” 并准备好接收另一个信号。 这可以通过三种方式实现:神经递质可以从突触裂缝扩散,可以被突触裂缝中的酶降解,或者可以被突触前神经元回收(有时称为再摄取)。 有几种药物在神经传递的这一步起作用。 例如,一些给阿尔茨海默病患者的药物通过抑制乙酰胆碱酯酶(一种降解乙酰胆碱的酶)起作用。 这种对酶的抑制本质上会增加释放乙酰胆碱的突触处的神经传递。 乙酰胆碱一旦释放,就会停留在裂缝中,可以持续结合和解除与突触后受体的结合。
| 神经递质 | 示例 | 地点 |
|---|---|---|
| 乙酰胆碱 | — | CNS 和/或 PNS |
| 生物胺 | 多巴胺、血清素、去甲肾上腺素 | CNS 和/或 PNS |
| 氨基酸 | 甘氨酸、谷氨酸、天冬氨酸、伽玛氨基丁酸 | 中枢神经系统 |
| 神经肽 | 物质 P,内啡肽 | CNS 和/或 PNS |
电气突触
虽然电突触的数量少于化学突触,但它们存在于所有神经系统中,起着重要而独特的作用。 电突触中的神经传递模式与化学突触中的神经传递模式大不相同。 在电突触中,突触前膜和突触后膜非常接近,实际上是通过形成间隙连接的通道蛋白在物理上连接的。 间隙连接允许电流直接从一个像元传递到下一个单元。 除了携带这种电流的离子外,其他分子,例如ATP,也可以在较大的间隙连接孔中扩散。
化学突触和电突触之间存在关键区别。 由于化学突触依赖于神经递质分子从突触囊泡中释放出来传递信号,因此从轴突电位到达突触前末端到神经递质导致突触后离子通道打开之间大约有一毫秒的延迟。 此外,此信号是单向的。 相比之下,电突触中的信号实际上是即时的(这对于参与按键反射的突触很重要),有些电突触是双向的。 电突触也更可靠,因为它们不太可能被阻塞,而且它们对于同步一组神经元的电活动很重要。 例如,人们认为丘脑中的电突触可以调节慢波睡眠,而这些突触的中断会导致癫痫发作。
信号求和
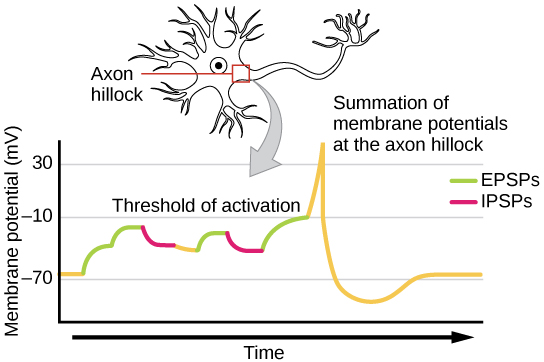
有时候,单个 EPSP 的强度足以在突触后神经元中诱发动作电位,但通常,多个突触前输入必须在大约同一时间创建 EPSP,突触后神经元才能充分去极化以激发动作电位。 这个过程称为求和,发生在轴突小丘上,如图所示\(\PageIndex{8}\)。 此外,一个神经元通常有来自许多突触前神经元的输入,有些是兴奋性的,有些是抑制性的,因此 IPSP 可以抵消 EPSP,反之亦然。 突触后膜电压的净变化决定了突触后细胞是否已达到激发动作电位所需的激发阈值。 突触求和和与激励阈值共同起到过滤器的作用,因此系统中的随机 “噪声” 不会作为重要信息传输。
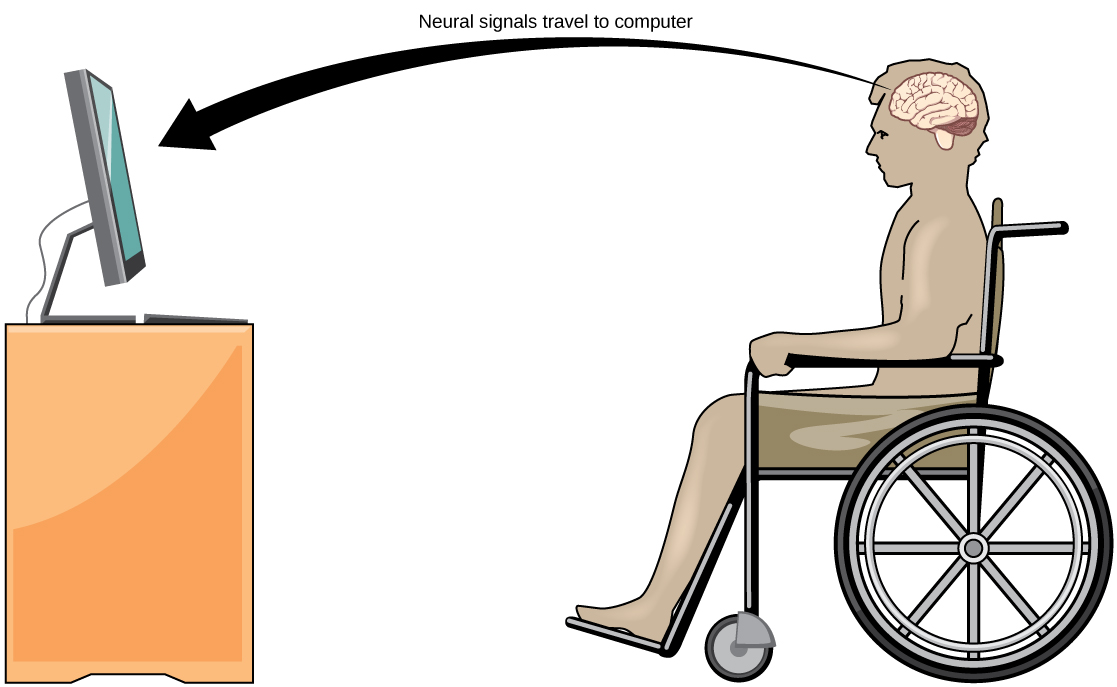
日常连接:脑机接口
肌萎缩性侧索硬化症(ALS,也称为卢·格里格氏病)是一种神经系统疾病,其特征是控制自愿运动的运动神经元退化。 这种疾病始于肌肉减弱和缺乏协调能力,最终破坏控制言语、呼吸和吞咽的神经元;最后,这种疾病可能导致瘫痪。 那时,患者需要机器的帮助才能呼吸和沟通。 已经开发出几种特殊技术,允许 “封锁” 患者与世界其他地区进行交流。 例如,一种技术允许患者通过抽动脸颊来打出句子。 然后,计算机可以大声朗读这些句子。
帮助瘫痪患者(包括肌萎缩性侧索硬化症患者)进行沟通并保持一定程度的自给自足的一项相对较新的研究被称为脑机接口(BCI)技术,如图所示\(\PageIndex{9}\)。 这项技术听起来像是科幻小说中的东西:它允许瘫痪的患者仅凭自己的思想来控制计算机。 BCI 有几种形式。 有些表格使用贴在头骨上的电极的脑电图记录。 这些记录包含来自大量神经元的信息,这些信息可以由计算机解码。 其他形式的 BCI 需要在运动皮层的手臂和手部区域植入比邮票小的电极阵列。 这种形式的 BCI 虽然更具侵入性,但非常强大,因为每个电极都可以记录来自一个或多个神经元的实际动作电位。 然后,这些信号被发送到计算机,该计算机经过训练,可以解码信号并将其馈送到工具,例如计算机屏幕上的光标。 这意味着肌萎缩性侧索硬化症患者可以通过考虑移动他或她的手或手臂来使用电子邮件、阅读互联网和与他人交流(尽管瘫痪的患者无法进行这种身体运动)。 最近的进展使一名15年前中风的瘫痪的闭锁患者能够控制机械臂,甚至可以使用BCI技术给自己喂咖啡。
尽管BCI技术取得了惊人的进步,但它也有局限性。 该技术可能需要患者长时间的训练和长时间的集中精力;还可能需要进行脑部手术才能植入设备。
链接到学习
观看这段视频,其中一位瘫痪的女性使用大脑控制的机械臂将饮料带到嘴里,以及脑机接口技术在运行中的其他图像。
Synaptic 可塑性
突触不是静态结构。 它们可以被削弱或加强。 它们可以被打破,也可以产生新的突触。 Synaptic 可塑性允许这些变化,而这些变化是神经系统正常运转所必需的。 实际上,突触可塑性是学习和记忆的基础。 特别是两个过程,长期增强(LTP)和长期抑郁(LTD),是突触可塑性的重要形式,发生在海马体的突触中,海马体是参与存储记忆的大脑区域。
长期增强 (LTP)
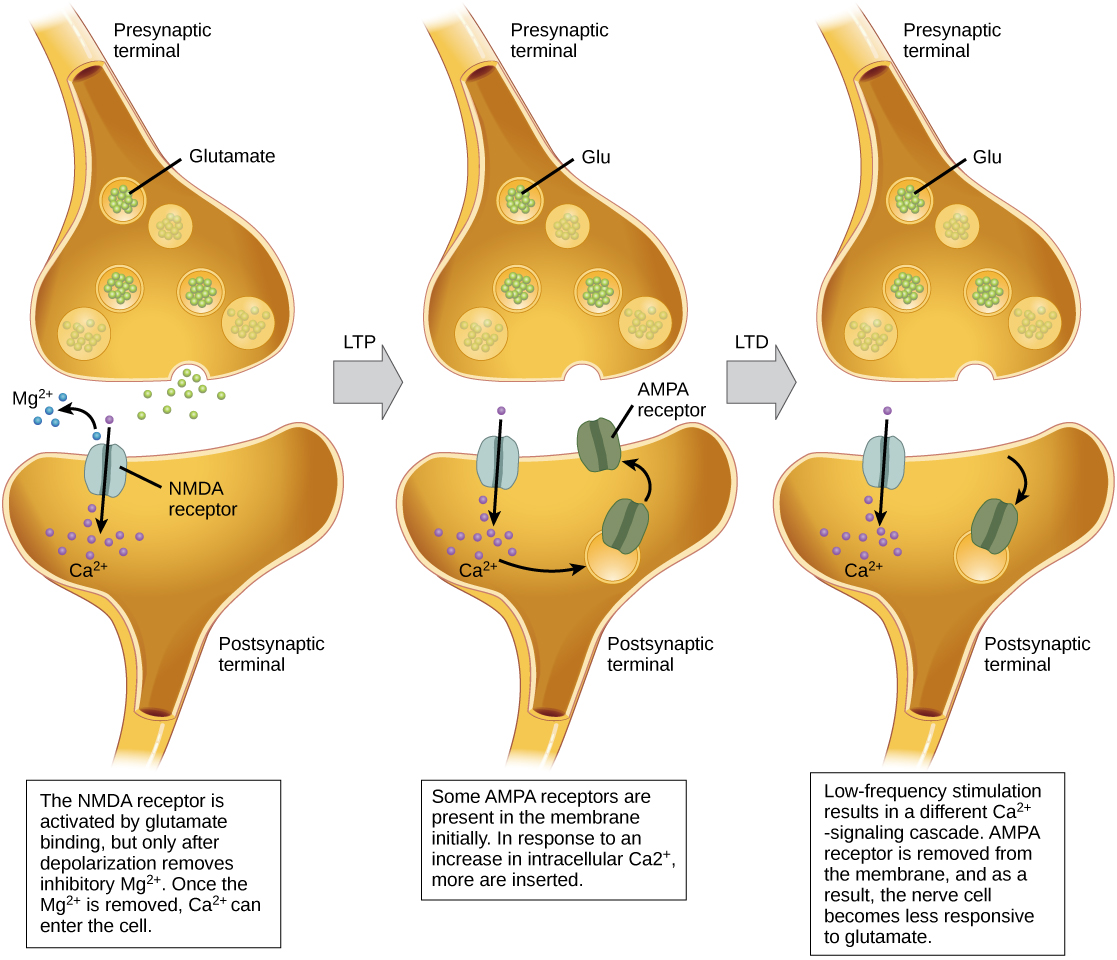
长期增强(LTP)是持续增强突触连接。 LTP 基于 Hebbian 原理:一起发射的细胞连接在一起。 LTP 的突触强化背后有各种机制,但尚不完全理解。 一种已知机制涉及一种突触后谷氨酸受体,称为NMDA(N-甲基-D-天冬氨酸)受体,如图所示\(\PageIndex{10}\)。 这些受体通常被镁离子阻断;但是,当突触后神经元被快速连续的多个突触前输入(来自一个神经元或多个神经元)去极化时,镁离子被迫排出,允许钙离子进入突触后细胞。 接下来,进入细胞的 Ca 2+ 离子会启动信号级联,导致另一种类型的谷氨酸受体,即 AMPA(α-氨基-3-羟基-5-甲基-4-异恶唑丙酸)受体插入突触后膜,因为活化的 AMPA 受体允许正离子进入细胞。 因此,下次谷氨酸从突触前膜释放时,它将对突触后细胞产生更大的兴奋作用(EPSP),因为谷氨酸与这些 AMPA 受体的结合将允许更多的正离子进入细胞。 插入额外的 AMPA 受体可增强突触,这意味着突触后神经元更有可能在突触前神经递质释放时发射。 一些滥用药物会采用 LTP 途径,这种突触强化会导致成瘾。
长期抑郁症(LTD)
长期抑郁症(LTD)本质上与LTP相反:它是突触连接的长期减弱。 一种已知的导致 LTD 的机制还涉及 AMPA 受体。 在这种情况下,通过 NMDA 受体进入的钙会启动不同的信号级联,从而从突触后膜中去除 AMPA 受体,如图所示\(\PageIndex{10}\)。 膜中AMPA受体的减少使突触后神经元对突触前神经元释放的谷氨酸反应降低。 尽管看起来违反直觉,但LTD对于学习和记忆可能与LTP一样重要。 相比之下,未使用的突触的减弱和修剪会导致不重要的连接丢失,并使经历过 LTP 的突触变得更强大。
摘要
神经元之所以有带电膜,是因为细胞内外的离子浓度不同。 电压门控离子通道控制离子进出神经元的移动。 当神经元膜去极化到至少达到激发阈值时,就会激发动作电位。 然后,动作电位沿着髓鞘化的轴突传播到轴突末端。 在化学突触中,动作电位会导致神经递质分子释放到突触裂缝中。 通过与突触后受体结合,神经递质可分别通过突触后膜去极化或超极化来引起兴奋性或抑制性突触后电位。 在电突触中,动作电位通过间隙连接直接传递给突触后细胞,间隙连接是连接突触前和突触后膜的大通道蛋白。 突触不是静态结构,可以得到加强和削弱。 突触可塑性的两种机制是长期增强和长期抑郁。
艺术联系
图\(\PageIndex{3}\):钾通道阻滞剂,例如胺碘酮和普鲁卡因胺,用于治疗心脏异常的电活动,称为心律失常,会阻碍 K + 通过电压门控 K + 通道的运动。 你预计钾通道会影响作用电位的哪一部分?
- 回答
-
钾通道阻滞剂减缓复极化阶段,但对去极化没有影响。
词汇表
- 动作潜力
- 神经元(或肌肉)膜电位的自我传播瞬间变化
- 去极化
- 膜电位变为较小的负值
- 兴奋性突触后电位 (EPSP)
- 突触前细胞释放的神经递质分子引起的突触后膜去极化
- 超极化
- 膜电位变为更负的值
- 抑制性突触后电位 (IPSP)
- 突触前细胞释放的神经递质分子引起的突触后膜超极化
- 长期抑郁症(LTD)
- 突触前和突触后细胞之间的突触偶联持续减少
- 长期增强 (LTP)
- 突触前和突触后细胞之间的突触偶联持续增加
- 膜电位
- 电池内部和外部之间的电位差
- 耐火期
- 动作电位之后的一段时间,更难或不可能发射动作电位;由钠通道失活和膜中额外钾通道的激活引起
- 盐流传导
- 沿轴突的动作电位从 Ranvier 的一个节点 “跳跃” 到下一个节点
- 合计
- 多次突触前输入的过程,大约在同一时间产生 epsP,使突触后神经元充分去极化以激发动作电位
- 突触裂缝
- 突触前膜和突触后膜之间的空间
- 突触囊泡
- 含有神经递质的球形结构
- 激励阈值
- 触发动作电位所需的去极化水平


