17.1: रेडियोधर्मी आइसोटोप
- Page ID
- 170488
याद रखें कि एक परमाणु एक तत्व का सबसे छोटा घटक है जो उस तत्व के सभी रासायनिक गुणों को बरकरार रखता है (पदार्थ देखें)। जैसा कि पहले चर्चा की गई थी, परमाणुओं में नाभिक में अनचार्ज्ड न्यूट्रॉन और सकारात्मक रूप से चार्ज किए गए प्रोटॉन होते हैं। नकारात्मक रूप से चार्ज किए गए इलेक्ट्रॉन नाभिक को घेर लेते हैं। एक परमाणु का परमाणु द्रव्यमान प्रोटॉन और न्यूट्रॉन की संख्या से निर्धारित होता है क्योंकि इलेक्ट्रॉनों का द्रव्यमान नगण्य होता है। प्रत्येक प्रोटॉन या न्यूट्रॉन का वजन 1 परमाणु द्रव्यमान इकाई (AMU) होता है। तत्वों की आवधिक तालिका में प्रदर्शित परमाणु द्रव्यमान मान पूर्ण संख्या नहीं हैं क्योंकि वे उस तत्व (आकृति\(\PageIndex{a}\)) के परमाणुओं के लिए औसत परमाणु द्रव्यमान का प्रतिनिधित्व करते हैं। एक ही तत्व के परमाणुओं में समान द्रव्यमान होना जरूरी नहीं है क्योंकि वे न्यूट्रॉन संख्या में भिन्न हो सकते हैं।
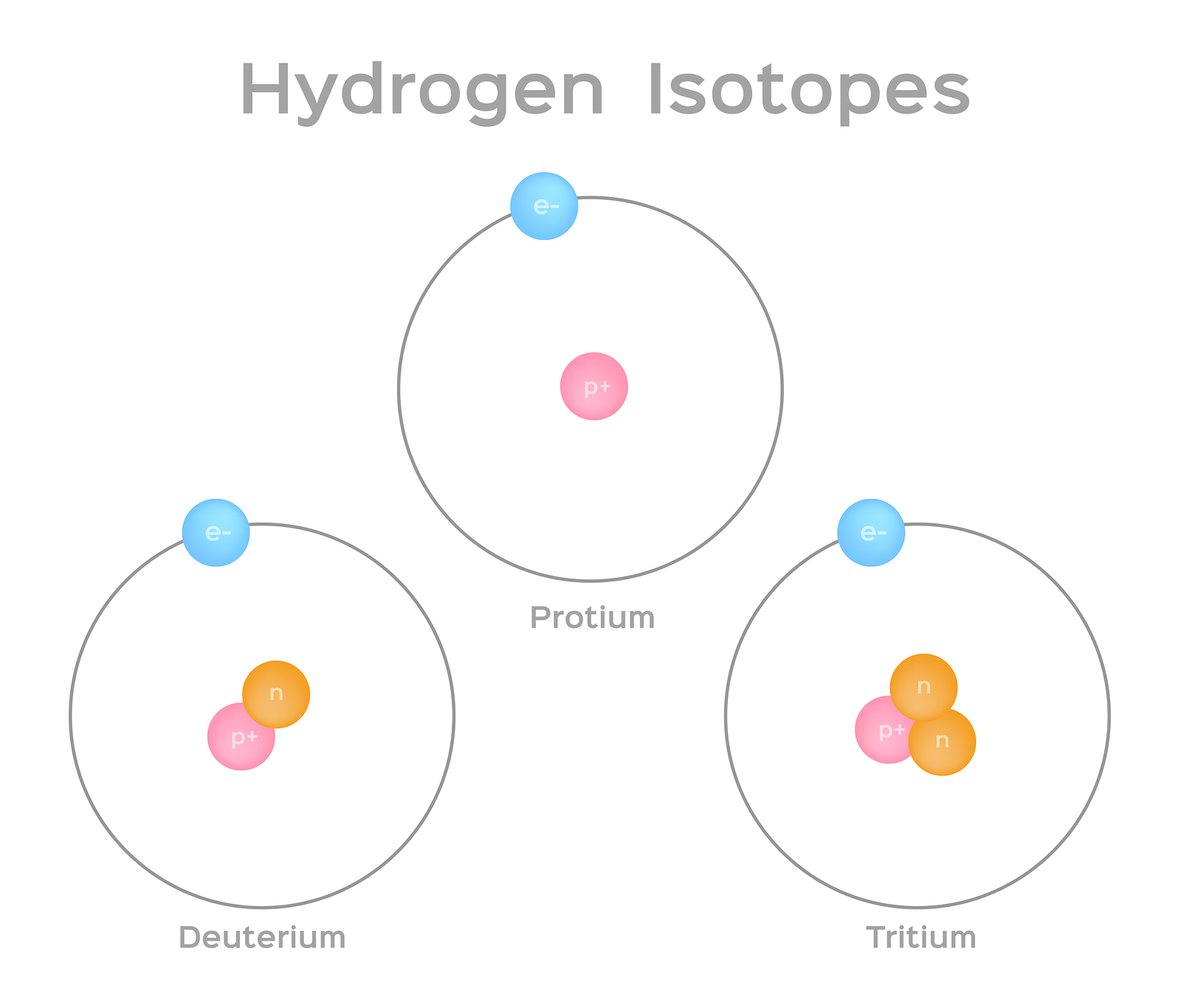
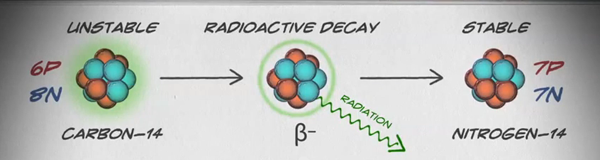
आइसोटोप एक ही तत्व के विभिन्न रूप हैं जिनमें प्रोटॉन की संख्या समान होती है, लेकिन न्यूट्रॉन की एक अलग संख्या होती है। कार्बन, पोटेशियम और यूरेनियम जैसे कुछ तत्वों में प्राकृतिक रूप से आइसोटोप होते हैं। कार्बन का सबसे आम आइसोटोप कार्बन -12 में छह प्रोटॉन और छह न्यूट्रॉन होते हैं। इसलिए, इसका द्रव्यमान 12 (छह प्रोटॉन और छह न्यूट्रॉन) और परमाणु संख्या 6 (जो इसे कार्बन बनाता है) है। कार्बन -14 में छह प्रोटॉन और आठ न्यूट्रॉन होते हैं। इसलिए, इसका द्रव्यमान 14 (छह प्रोटॉन और आठ न्यूट्रॉन) और परमाणु संख्या 6 है, जिसका अर्थ है कि यह अभी भी तत्व कार्बन है। कार्बन के ये दो वैकल्पिक रूप आइसोटोप हैं। कुछ आइसोटोप अस्थिर होते हैं और अधिक स्थिर तत्व बनाने के लिए कणों और ऊर्जा के रूप में विकिरण का उत्सर्जन करते हैं। विकिरण के कुछ रूप खतरनाक होते हैं। इन्हें रेडियोधर्मी आइसोटोप या रेडियोआइसोटोप (आंकड़ा\(\PageIndex{b}\)) कहा जाता है। रेडियोधर्मी क्षय के दौरान, एक प्रकार का परमाणु इस तरह से दूसरे प्रकार के परमाणु में बदल सकता है (आकृति\(\PageIndex{c}\))।
हाफ लाइफ
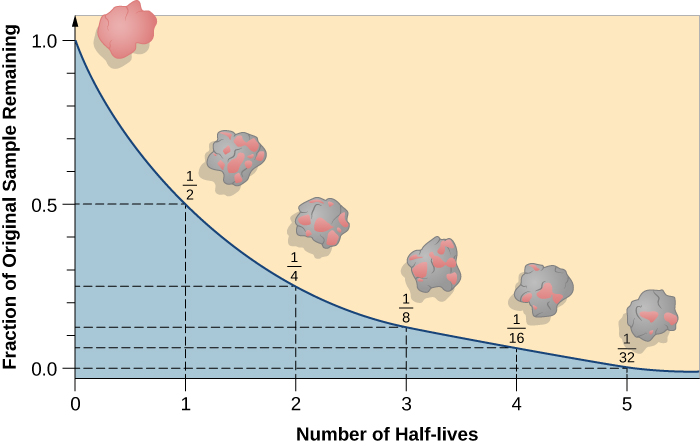
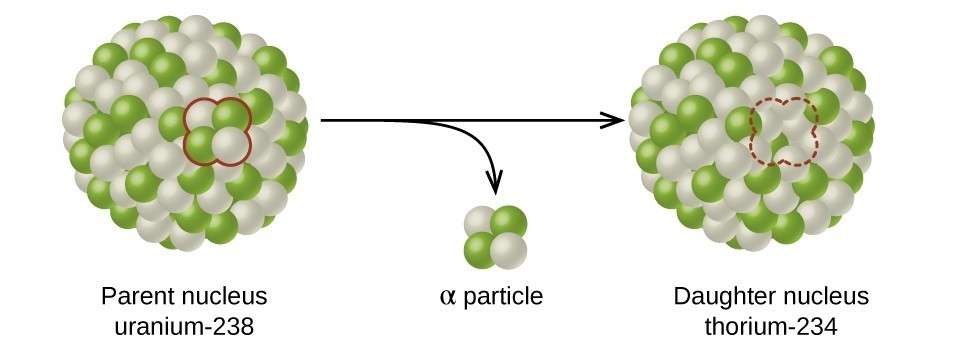
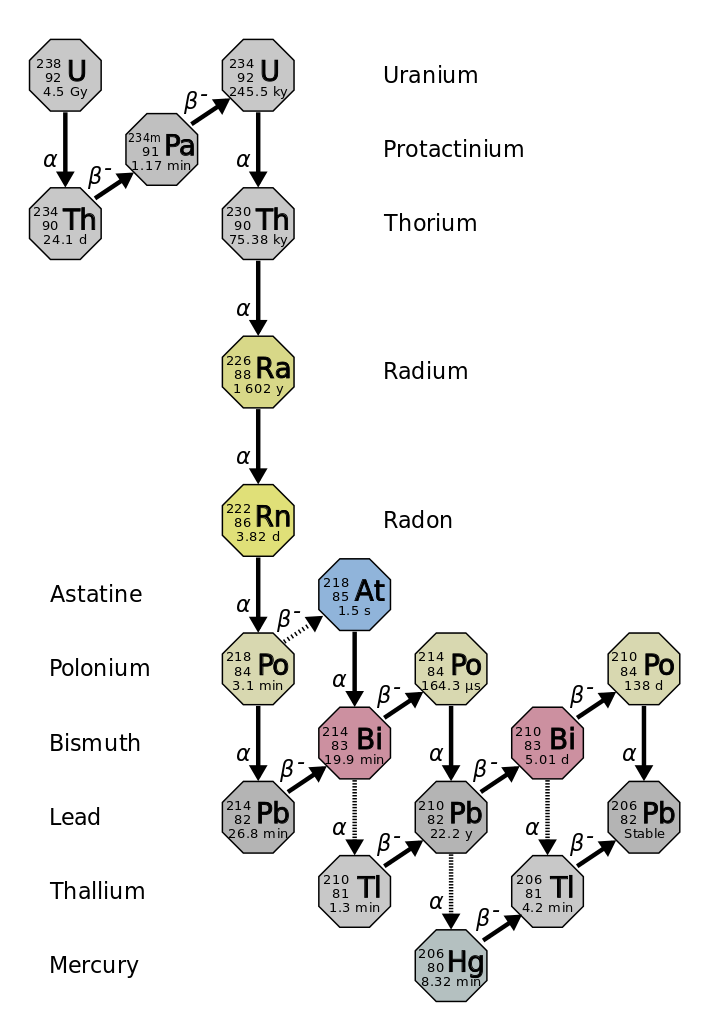
आधा जीवन वह समय है जो मूल रेडियोधर्मी आइसोटोप के आधे हिस्से को क्षय (आंकड़ा\(\PageIndex{d}\)) तक ले जाता है। उदाहरण के लिए, यूरेनियम -238 का आधा जीवन लगभग 4.5 बिलियन वर्ष है। 4.5 बिलियन वर्षों के बाद, यूरेनियम -238 की मूल मात्रा का केवल आधा (50%) ही रहेगा। बाकी थोरियम -234 (जो रेडियोधर्मी भी है और जल्दी से रेडियोधर्मी आइसोटोप की एक श्रृंखला तक पहुंच जाता है, जब तक कि यह अंततः लीड-206 नहीं बन जाता, जो स्थिर है; आंकड़ा\(\PageIndex{e-f}\))। दो आधे जीवन (9 बिलियन वर्ष) के बाद, 50% में से केवल आधा ही रहेगा (मूल का 25%)। तीन आधे जीवन के बाद, मूल यूरेनियम -238 का केवल 12.5% ही रहेगा।
इवोल्यूशन इन एक्शन: कार्बन डेटिंग
कार्बन-14 (14 C) एक प्राकृतिक रूप से पाया जाने वाला रेडियोआइसोटोप है जो वायुमंडल में ब्रह्मांडीय किरणों द्वारा बनाया जाता है। यह एक सतत प्रक्रिया है, इसलिए अधिक 14 C हमेशा बनाए जा रहे हैं। जैसे ही एक जीवित जीव विकसित होता है, उसके शरीर में 14 C का सापेक्ष स्तर वायुमंडल में 14C की सांद्रता के बराबर होता है। जब एक जीव मर जाता है, तो वह 14 डिग्री सेल्सियस का सेवन नहीं करता है, इसलिए अनुपात में गिरावट आएगी। बीटा क्षय नामक प्रक्रिया द्वारा 14 C घटकर 14 N हो जाता है; यह इस धीमी प्रक्रिया (आंकड़ा\(\PageIndex{c}\)) में ऊर्जा को छोड़ देता है। लगभग 5,730 वर्षों के बाद, 14 C की शुरुआती सांद्रता का केवल आधा हिस्सा 14 N में परिवर्तित हो गया होगा, एक आइसोटोप की मूल सांद्रता के आधे हिस्से को उसके अधिक स्थिर रूप में सड़ने में लगने वाले समय को इसका आधा जीवन कहा जाता है।
क्योंकि 14 C का आधा जीवन लंबा होता है, इसका उपयोग पूर्व में जीवित वस्तुओं, जैसे कि जीवाश्म की उम्र के लिए किया जाता है। किसी वस्तु में पाए जाने वाले 14 C सांद्रता के अनुपात का उपयोग करके वायुमंडल में पाए जाने वाले 14 C की मात्रा का उपयोग करके, आइसोटोप की मात्रा जो अभी तक क्षीण नहीं हुई है, निर्धारित की जा सकती है। इस राशि के आधार पर, जीवाश्म की आयु की गणना लगभग 50,000 वर्ष (\(\PageIndex{g}\)नीचे चित्र) की जा सकती है। लंबे समय तक आधे जीवन वाले आइसोटोप, जैसे पोटेशियम -40, का उपयोग पुराने जीवाश्मों की उम्र की गणना करने के लिए किया जाता है। कार्बन डेटिंग के उपयोग के माध्यम से, वैज्ञानिक पिछले 50,000 वर्षों के भीतर रहने वाले जीवों की पारिस्थितिकी और जैव-भूगोल का पुनर्निर्माण कर सकते हैं।
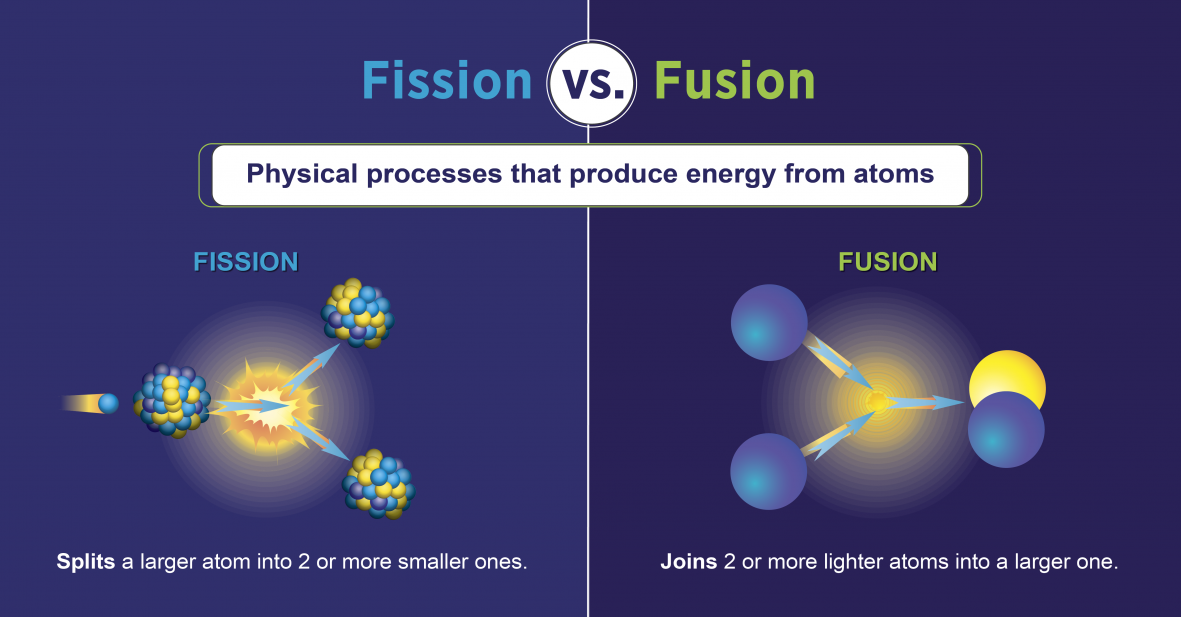
परमाणु विखंडन प्रतिक्रियाएँ
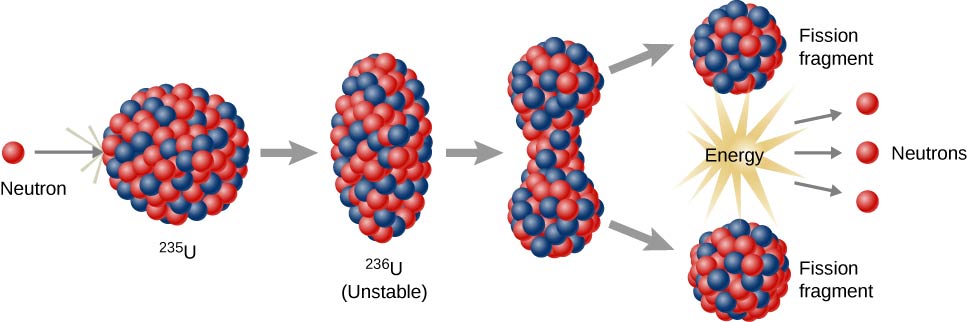
परमाणु विखंडन प्रतिक्रियाएं वे हैं जिनमें परमाणु (आकृति\(\PageIndex{h}\)) के नाभिक को विभाजित करना शामिल है। उन्हें न्यूट्रॉन के साथ रेडियोधर्मी तत्वों को नष्ट करके प्रेरित किया जा सकता है। प्राकृतिक रेडियोधर्मी क्षय की तरह, प्रेरित परमाणु विखंडन प्रतिक्रियाएं ऊर्जा छोड़ती हैं। जब परमाणु विखंडन का उपयोग बिजली उत्पन्न करने के लिए किया जा सकता है तो ऊष्मा ऊर्जा का उत्सर्जन होता है। यह परमाणु ऊर्जा का आधार है। वर्तमान में, यूरेनियम -235 (235 यू; 235 के परमाणु द्रव्यमान वाला यूरेनियम का एक आइसोटोप) वर्तमान में परमाणु विखंडन प्रतिक्रियाओं (आंकड़ा\(\PageIndex{h}\)) के लिए ईंधन के रूप में उपयोग किया जाता है।