7.2: मैटर
- Page ID
- 170050
पदार्थ पारिस्थितिक तंत्र में पाया जाने वाला “सामान” है। तकनीकी रूप से, पदार्थ को किसी ऐसी चीज के रूप में परिभाषित किया जाता है जिसमें अंतरिक्ष होता है या द्रव्यमान होता है। द्रव्यमान त्वरण के प्रति प्रतिरोध है। अधिक सरलता से कहें, तो द्रव्यमान वजन के समान है, लेकिन गुरुत्वाकर्षण के कारण वजन में तेजी आती है। पदार्थ जैव-रासायनिक चक्रों के माध्यम से जैविक और अजैविक पारिस्थितिकी तंत्र घटकों के बीच चलता है। इन चक्रों को पूरी तरह से समझने के लिए, कणों की पृष्ठभूमि की आवश्यकता होती है जिसमें पदार्थ, परमाणु शामिल होते हैं।
परमाणु और अणु
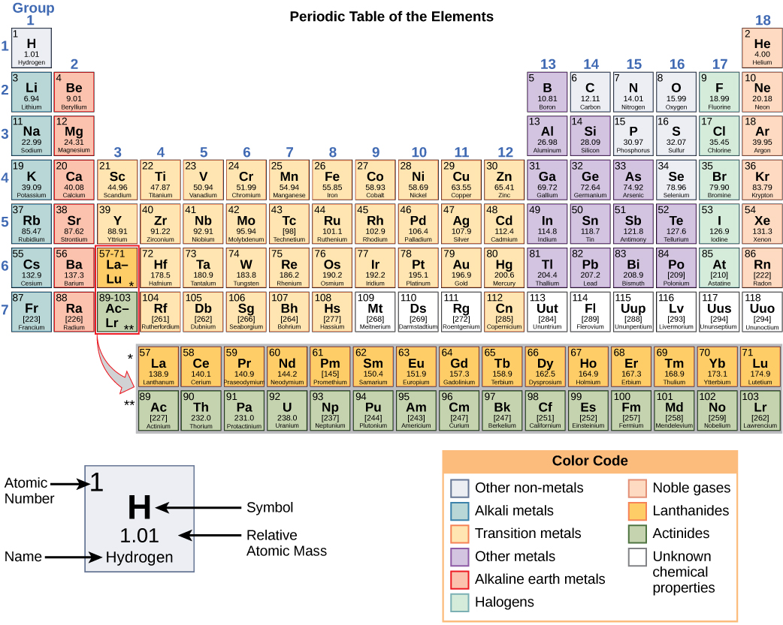
तत्व ऐसे पदार्थ होते हैं जिन्हें रासायनिक रूप से अन्य पदार्थों (आकृति\(\PageIndex{a}\)) में नहीं तोड़ा जा सकता है या परिवर्तित नहीं किया जा सकता है। कुल 118 तत्वों को परिभाषित किया गया है; हालाँकि, केवल 92 प्राकृतिक रूप से होते हैं और जीवों में 30 से कम पाए जाते हैं। शेष 26 तत्व अस्थिर हैं और इसलिए बहुत लंबे समय तक मौजूद नहीं हैं या सैद्धांतिक हैं और अभी तक उनका पता नहीं चल पाया है। प्रत्येक तत्व को उसके रासायनिक प्रतीक (जैसे H, N, O, C, और Na) द्वारा निर्दिष्ट किया जाता है, और इसमें अद्वितीय गुण होते हैं। ये अद्वितीय गुण तत्वों को विशिष्ट तरीकों से एक दूसरे के साथ संयोजित करने और बंधने की अनुमति देते हैं।
एक परमाणु एक तत्व का सबसे छोटा घटक होता है जो उस तत्व के सभी रासायनिक गुणों को बरकरार रखता है। उदाहरण के लिए, एक हाइड्रोजन परमाणु में तत्व हाइड्रोजन के सभी गुण होते हैं, जैसे कि यह कमरे के तापमान पर गैस के रूप में मौजूद होता है और यह पानी के अणु को बनाने के लिए ऑक्सीजन के साथ बंध जाता है। हाइड्रोजन के गुणों को बनाए रखते हुए हाइड्रोजन के परमाणुओं को किसी भी छोटी चीज में नहीं तोड़ा जा सकता है। यदि हाइड्रोजन परमाणु को छोटे कणों में तोड़ा जाता, तो उसमें हाइड्रोजन के गुण नहीं रह जाते। सबसे बुनियादी स्तर पर, सभी जीव तत्वों के संयोजन से बने होते हैं। इनमें परमाणु होते हैं जो एक साथ मिलकर अणु बनाते हैं। अणु कोशिकाओं, जीवन की संरचनात्मक और कार्यात्मक इकाइयों को बनाने के लिए परस्पर क्रिया कर सकते हैं। जानवरों जैसे बहुकोशिकीय जीवों में, ये कोशिकाएँ ऊतक बनाने के लिए मिलती हैं, जो अंगों का निर्माण करती हैं। ये संयोजन तब तक जारी रहते हैं जब तक कि पूरे बहुकोशिकीय जीव नहीं बन जाते।
परमाणु आपस में मिलकर अणु बनते हैं। अणु एक साथ बंधे दो या दो से अधिक परमाणुओं से बने रसायन होते हैं। कुछ अणु बहुत सरल होते हैं, जैसे O 2, जिसमें सिर्फ दो ऑक्सीजन परमाणु होते हैं। जीवों द्वारा उपयोग किए जाने वाले कुछ अणु, जैसे कि डीएनए, कई लाखों परमाणुओं से बने होते हैं। सभी परमाणुओं में प्रोटॉन, इलेक्ट्रॉन और न्यूट्रॉन (आकृति\(\PageIndex{b}\)) होते हैं। एकमात्र अपवाद हाइड्रोजन (एच) है, जो आमतौर पर केवल एक प्रोटॉन और एक इलेक्ट्रॉन से बना होता है। प्रोटॉन एक सकारात्मक रूप से चार्ज किया जाने वाला कण होता है जो परमाणु के नाभिक (परमाणु के मूल) में रहता है और इसका द्रव्यमान 1 का द्रव्यमान और +1 का चार्ज होता है। एक इलेक्ट्रॉन एक नकारात्मक रूप से चार्ज किया जाने वाला कण है जो नाभिक के चारों ओर के अंतरिक्ष में यात्रा करता है। दूसरे शब्दों में, यह नाभिक के बाहर रहता है। इसका एक नगण्य द्रव्यमान है और इसका शुल्क —1 है। प्रोटॉन की तरह न्यूट्रॉन, एक परमाणु के नाभिक में रहते हैं। उनका द्रव्यमान 1 है और कोई शुल्क नहीं है। सकारात्मक (प्रोटॉन) और नकारात्मक (इलेक्ट्रॉन) शुल्क एक दूसरे को एक तटस्थ परमाणु में संतुलित करते हैं, जिसमें शुद्ध शून्य चार्ज होता है।
प्रत्येक तत्व में अलग-अलग संख्या में प्रोटॉन और न्यूट्रॉन होते हैं, जो इसे अपना परमाणु संख्या और द्रव्यमान संख्या देते हैं। किसी तत्व की परमाणु संख्या उस तत्व में मौजूद प्रोटॉन की संख्या के बराबर होती है। द्रव्यमान संख्या प्रोटॉन की संख्या और उस तत्व के न्यूट्रॉन की संख्या है। इसलिए, द्रव्यमान संख्या से परमाणु संख्या घटाकर न्यूट्रॉन की संख्या निर्धारित करना संभव है।
केमिकल बॉन्ड्स
तत्व एक दूसरे के साथ कैसे बातचीत करते हैं, यह इलेक्ट्रॉनों की संख्या और उनकी व्यवस्था कैसे की जाती है, इस पर निर्भर करता है। जब एक परमाणु में समान संख्या में प्रोटॉन और इलेक्ट्रॉन नहीं होते हैं तो उसे आयन कहा जाता है। क्योंकि इलेक्ट्रॉनों की संख्या प्रोटॉन की संख्या के बराबर नहीं होती है, प्रत्येक आयन का शुद्ध चार्ज होता है। उदाहरण के लिए, यदि सोडियम एक इलेक्ट्रॉन खो देता है, तो इसमें अब 11 प्रोटॉन और केवल 10 इलेक्ट्रॉन होते हैं, जो इसे +1 के समग्र चार्ज के साथ छोड़ देते हैं। सकारात्मक आयन इलेक्ट्रॉनों को खोने से बनते हैं और उन्हें केशन कहा जाता है। नकारात्मक आयन इलेक्ट्रॉन प्राप्त करके बनते हैं और उन्हें आयन कहा जाता है। एलिमेंटल आयनिक नामों को -ide में अंत में बदल दिया जाता है। उदाहरण के तौर पर, जब क्लोरीन आयन बन जाता है तो इसे क्लोराइड कहा जाता है।
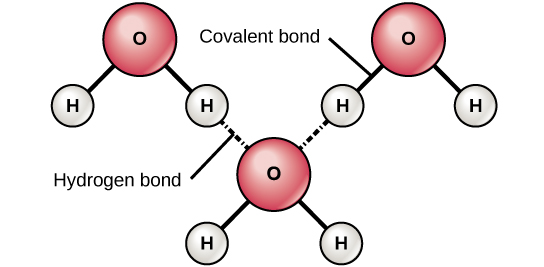
आयनिक और सहसंयोजक बांड दो परमाणुओं के बीच बनने वाले मजबूत बंधन हैं। ये बंधन अपेक्षाकृत स्थिर अवस्था में परमाणुओं को एक साथ रखते हैं। आयनिक बॉन्ड दो विपरीत रूप से चार्ज किए गए आयनों (एक आयन और एक कटियन) के बीच बनते हैं। क्योंकि सकारात्मक और नकारात्मक शुल्क आकर्षित होते हैं, इन आयनों को एक साथ रखा जाता है जैसे दो विपरीत रूप से चार्ज किए गए मैग्नेट एक साथ चिपक जाते हैं। सहसंयोजक बांड तब बनते हैं जब इलेक्ट्रॉनों को दो परमाणुओं के बीच साझा किया जाता है। प्रत्येक परमाणु अपने एक इलेक्ट्रॉन को साझा करता है, जो फिर दोनों परमाणुओं के नाभिक की परिक्रमा करता है, दोनों परमाणुओं को एक साथ पकड़ता है। सहसंयोजक बंधन जीवों में रासायनिक बंधन का सबसे मजबूत और सबसे सामान्य रूप है। अधिकांश आयनिक बॉन्ड के विपरीत, सहसंयोजक बांड पानी में अलग नहीं होते हैं। हाइड्रोजन बांड तब बनते हैं जब अणुओं में इलेक्ट्रॉनों का असमान वितरण होता है और इस प्रकार आंशिक रूप से सकारात्मक और आंशिक रूप से नकारात्मक अंत होते हैं। इस प्रकार वे एक-दूसरे (आकृति\(\PageIndex{c}\)) के प्रति आकर्षित होते हैं। तकनीकी रूप से, हाइड्रोजन बांड केवल हाइड्रोजन और ऑक्सीजन (O), नाइट्रोजन (N), या फ्लोरीन (F) के बीच होते हैं। कभी-कभी हाइड्रोजन बांड अलग-अलग हिस्सों या बड़े अणुओं को जोड़ते हैं, जैसा कि डीएनए और प्रोटीन में होता है। आयनिक और सहसंयोजक बॉन्ड की तुलना में हाइड्रोजन बांड कमजोर होते हैं और आसानी से टूट सकते हैं। (ध्यान दें कि हाइड्रोजन बांड सबसे मजबूत अंतर-आणविक शक्तियों में से हैं, जो अणुओं के बीच होते हैं, हालांकि।)
जैविक मैक्रोमोलेक्यूल्स
जीवों में बड़े, जैविक अणु होते हैं जिन्हें जैविक मैक्रोमोलेक्यूल कहा जाता है। कार्बनिक अणु वे होते हैं जिनमें कार्बन सहसंयोजक रूप से हाइड्रोजन से बंधे होते हैं। (इसके विपरीत, अकार्बनिक अणुओं में हाइड्रोजन से बंधे कार्बन की कमी होती है और ये अक्सर जैविक अणुओं की तुलना में सरल होते हैं।) इसके अलावा, इनमें ऑक्सीजन, नाइट्रोजन, फॉस्फोरस, सल्फर और अतिरिक्त तत्व हो सकते हैं। जैविक मैक्रोमोलेक्यूल्स के चार प्रमुख वर्ग हैं: कार्बोहाइड्रेट, लिपिड, प्रोटीन और न्यूक्लिक एसिड। प्रत्येक सेल का एक महत्वपूर्ण घटक है और कई प्रकार के कार्य करता है।
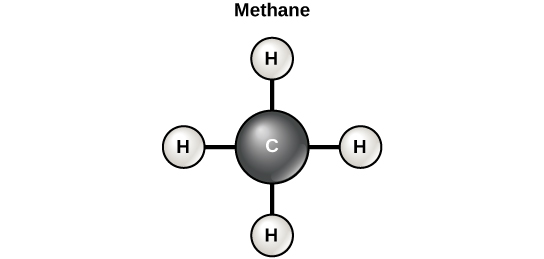
अक्सर कहा जाता है कि जीवन “कार्बन-आधारित” है। इसका अर्थ है कि कार्बन परमाणु, जो अन्य कार्बन परमाणुओं या अन्य तत्वों से बंधे होते हैं, जीवित चीजों में विशिष्ट रूप से पाए जाने वाले कई अणुओं के मूलभूत घटकों का निर्माण करते हैं। अन्य तत्व जैविक अणुओं में महत्वपूर्ण भूमिका निभाते हैं, लेकिन कार्बन निश्चित रूप से जीवित चीजों में अणुओं के लिए “नींव” तत्व के रूप में योग्य है। यह कार्बन परमाणुओं के बंधन गुण हैं जो इसकी महत्वपूर्ण भूमिका के लिए जिम्मेदार हैं। कार्बन अन्य परमाणुओं या अणुओं के साथ चार सहसंयोजक बंधन बना सकता है। सबसे सरल जैविक कार्बन अणु मीथेन (CH 4) है, जिसमें चार हाइड्रोजन परमाणु एक कार्बन परमाणु (आकृति\(\PageIndex{d}\)) से जुड़ते हैं।
कार्बोहाइड्रेट में वे शामिल हैं जिन्हें आमतौर पर साधारण शर्करा के रूप में जाना जाता है, जैसे ग्लूकोज, और स्टार्च जैसे जटिल कार्बोहाइड्रेट। जबकि ऊर्जा के लिए कई प्रकार के कार्बोहाइड्रेट का उपयोग किया जाता है, कुछ का उपयोग पौधों और जानवरों सहित अधिकांश जीवों द्वारा संरचना के लिए किया जाता है। उदाहरण के लिए, सेलूलोज़ एक जटिल कार्बोहाइड्रेट है जो पौधों की कोशिकाओं (सेल की दीवारों) की बाहरी परत में कठोरता और ताकत जोड़ता है।
लिपिड्स में यौगिकों का एक विविध समूह शामिल होता है जो एक सामान्य विशेषता द्वारा एकजुट होते हैं: लिपिड पानी में अघुलनशील होते हैं। लिपिड्स एक सेल में कई अलग-अलग कार्य करते हैं। कोशिकाएं वसा नामक लिपिड के रूप में लंबे समय तक उपयोग के लिए ऊर्जा का भंडारण करती हैं। लिपिड पौधों और जानवरों के लिए पर्यावरण से इन्सुलेशन भी प्रदान करते हैं। उदाहरण के लिए, वे जलीय पक्षियों और स्तनधारियों को उनकी जलरोधी प्रकृति के कारण सूखा रखने में मदद करते हैं। लिपिड कई हार्मोनों के निर्माण खंड भी होते हैं और कोशिकाओं को घेरने वाली झिल्लियों का एक महत्वपूर्ण घटक होते हैं और उनकी कई आंतरिक संरचनाएं बनाते हैं।
प्रोटीन जीवित प्रणालियों में सबसे प्रचुर मात्रा में जैविक अणुओं में से एक है और इसमें सभी मैक्रोमोलेक्यूल्स के कार्यों की सबसे विविध श्रेणी होती है। वे सभी अमीनो एसिड के पॉलिमर हैं। प्रोटीन के कार्य बहुत ही विविध होते हैं क्योंकि 20 अलग-अलग रासायनिक रूप से अलग-अलग अमीनो एसिड होते हैं जो लंबी श्रृंखलाएं बनाते हैं, और अमीनो एसिड किसी भी क्रम में हो सकते हैं। प्रोटीन जीवों में सुगम रासायनिक प्रतिक्रियाओं में कार्य कर सकते हैं, जैसे कि प्रकाश संश्लेषण, संदेश को हार्मोन के रूप में प्रेषित करना, जिससे मांसपेशियां सिकुड़ जाती हैं, और बहुत कुछ।
न्यूक्लिक एसिड बहुत बड़े अणु होते हैं जो जीवन की निरंतरता के लिए महत्वपूर्ण होते हैं। इनमें एक कोशिका का आनुवंशिक खाका होता है और इस प्रकार इसकी कार्यक्षमता के लिए निर्देश दिए जाते हैं। न्यूक्लिक एसिड के दो मुख्य प्रकार डीऑक्सीराइबोन्यूक्लिक एसिड (डीएनए) और राइबोन्यूक्लिक एसिड (आरएनए) हैं। डीएनए सभी जीवों में पाया जाने वाला आनुवंशिक पदार्थ है, जिसमें एकल कोशिका वाले बैक्टीरिया से लेकर बहुकोशिकीय स्तनधारियों तक शामिल हैं। अन्य प्रकार का न्यूक्लिक एसिड, आरएनए, ज्यादातर प्रोटीन संश्लेषण में शामिल होता है। डीएनए और आरएनए छोटे बिल्डिंग ब्लॉकों से बने होते हैं जिन्हें न्यूक्लियोटाइड कहा जाता है। डीएनए में एक सुंदर डबल-हेलिकल संरचना (चित्र\(\PageIndex{e}\)) है।


