14.2: السوائل والكثافة والضغط (الجزء الأول)
- Page ID
- 200168
- اذكر المراحل المختلفة للمادة
- وصف خصائص مراحل المادة على المستوى الجزيئي أو الذري
- التمييز بين المواد القابلة للضغط وغير القابلة للضغط
- تعريف الكثافة ووحدات SI ذات الصلة
- قارن وقارن بين كثافات المواد المختلفة
- تحديد الضغط ووحدات SI ذات الصلة
- شرح العلاقة بين الضغط والقوة
- احسب القوة بمعلومية الضغط والمساحة
توجد المادة الأكثر شيوعًا في صورة صلبة أو سائلة أو غازية؛ وتُعرف هذه الحالات بالمراحل الثلاث الشائعة للمادة. سننظر في كل مرحلة من هذه المراحل بالتفصيل في هذا القسم.
خصائص المواد الصلبة
المواد الصلبة صلبة ولها أشكال محددة وأحجام محددة. تكون الذرات أو الجزيئات في مادة صلبة قريبة من بعضها البعض، وهناك قوة كبيرة بين هذه الجزيئات. سوف تتخذ المواد الصلبة شكلاً تحدده طبيعة هذه القوى بين الجزيئات. على الرغم من أن المواد الصلبة الحقيقية ليست غير قابلة للضغط، إلا أنها تتطلب قوة كبيرة لتغيير شكل المادة الصلبة. في بعض الحالات، يمكن أن تتسبب القوة بين الجزيئات في تنظيم الجزيئات في شبكة كما هو موضح في الشكل\(\PageIndex{1}\). يتم تمثيل بنية هذه الشبكة ثلاثية الأبعاد كجزيئات متصلة بروابط صلبة (على غرار الينابيع الصلبة)، والتي تسمح بحرية محدودة للحركة. حتى القوة الكبيرة تنتج فقط عمليات نزوح صغيرة في ذرات أو جزيئات الشبكة، وتحافظ المادة الصلبة على شكلها. تقاوم المواد الصلبة أيضًا قوى القص. (قوى القص هي قوى يتم تطبيقها بشكل عرضي على السطح، كما هو موضح في التوازن الثابت والمرونة.)
خصائص السوائل
تعتبر السوائل والغازات سوائل لأنها تخضع لقوى القص، بينما تقاومها المواد الصلبة. مثل المواد الصلبة، ترتبط الجزيئات الموجودة في السائل بالجزيئات المجاورة، ولكنها تمتلك عددًا أقل بكثير من هذه الروابط. لا يتم تثبيت الجزيئات الموجودة في السائل في مكانها ويمكن أن تتحرك فيما يتعلق ببعضها البعض. المسافة بين الجزيئات تشبه المسافات في المادة الصلبة، وبالتالي فإن السوائل لها أحجام محددة، لكن شكل السائل يتغير، اعتمادًا على شكل الحاوية. لا ترتبط الغازات بالذرات المجاورة ويمكن أن يكون لها فواصل كبيرة بين الجزيئات. لا تحتوي الغازات على أشكال محددة ولا أحجام محددة، حيث تتحرك جزيئاتها لملء الحاوية التي يتم الاحتفاظ بها (الشكل\(\PageIndex{1}\)).
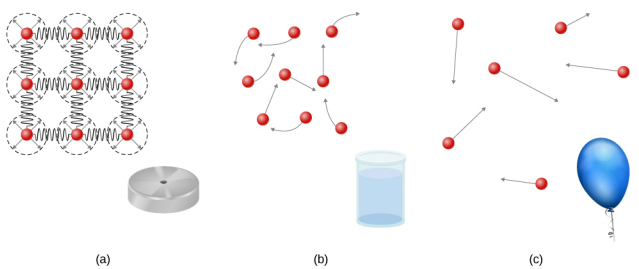
تتشوه السوائل بسهولة عند الإجهاد ولا تعود إلى شكلها الأصلي بمجرد إزالة القوة. يحدث هذا لأن الذرات أو الجزيئات في السائل حرة في الانزلاق وتغيير الجيران. أي أن السوائل تتدفق (لذا فهي نوع من السوائل)، مع تماسك الجزيئات معًا عن طريق الجذب المتبادل. عندما يتم وضع السائل في حاوية بدون غطاء، فإنه يبقى في الحاوية. نظرًا لأن الذرات معبأة بشكل وثيق، فإن السوائل، مثل المواد الصلبة، تقاوم الضغط؛ قوة كبيرة للغاية ضرورية لتغيير حجم السائل.
في المقابل، يتم فصل الذرات في الغازات بمسافات كبيرة، وبالتالي تكون القوى بين الذرات في الغاز ضعيفة جدًا، إلا عندما تصطدم الذرات ببعضها البعض. هذا يجعل الغازات سهلة الضغط نسبيًا ويسمح لها بالتدفق (مما يجعلها سائلة). عند وضعها في حاوية مفتوحة، ستهرب الغازات، على عكس السوائل.
في هذا الفصل، نشير عمومًا إلى كل من الغازات والسوائل على أنها مجرد سوائل، ونميز بينها فقط عندما تتصرف بشكل مختلف. توجد مرحلة أخرى من المادة، وهي البلازما، التي توجد في درجات حرارة عالية جدًا. في درجات الحرارة المرتفعة، قد تنفصل الجزيئات إلى ذرات، وتتفكك الذرات إلى إلكترونات (بشحنات سالبة) وبروتونات (بشحنات موجبة)، لتشكل بلازما. لن تتم مناقشة البلازما بعمق في هذا الفصل لأن البلازما لها خصائص مختلفة جدًا عن المراحل الثلاث الشائعة الأخرى للمادة، والتي تمت مناقشتها في هذا الفصل، بسبب القوى الكهربائية القوية بين الشحنات.
الكثافة
لنفترض أن كتلة من النحاس وكتلة من الخشب لهما نفس الكتلة تمامًا. إذا تم إسقاط كلتا الكتلتين في خزان ماء، فلماذا يطفو الخشب ويغرق النحاس (الشكل\(\PageIndex{2}\))؟ يحدث هذا لأن النحاس يحتوي على كثافة أكبر من الماء، في حين أن الخشب له كثافة أقل من الماء.

الكثافة هي خاصية مهمة للمواد. إنه أمر بالغ الأهمية، على سبيل المثال، في تحديد ما إذا كان الجسم يغرق أو يطفو في السائل.
يُعرّف متوسط كثافة المادة أو الجسم بأنه كتلته لكل وحدة حجم،
\[\rho = \frac{m}{V} \label{14.1}\]
حيث الحرف اليوناني\(\rho\) (rho) هو رمز الكثافة، m هو الكتلة، و V هو الحجم.
وحدة الكثافة SI هي كجم/م 3. يسرد الجدول 14.1 بعض القيم التمثيلية. وحدة كثافة cgs هي الجرام لكل سنتيمتر مكعب، g/cm 3، حيث
\[1\; g/cm^{3} = 1000\; kg/m^{3} \ldotp\]
تم تصميم النظام المتري في الأصل بحيث تكون كثافة الماء 1 جم/سم 3، أي ما يعادل 103 كجم/م 3. وهكذا، تم تصميم وحدة الكتلة الأساسية، الكيلوغرام، لأول مرة لتكون كتلة 1000 مل من الماء، والتي يبلغ حجمها 1000 سم 3.
الجدول 14.1 - كثافات بعض المواد الشائعة
| المواد الصلبة | (0.0 درجة مئوية) | السوائل | (0.0 درجة مئوية) | الغازات | (0.0 درجة مئوية، 101.3 كيلو باسكال) |
|---|---|---|---|---|---|
| مادة | \(\rho\)(كجم/م 3) | مادة | \(\rho\)(كجم/م 3) | مادة | \(\rho\)(كجم/م 3) |
| ألمنيوم | 2.70 × 10 3 | بنزين | 8.79 × 10 × 2 | الهواء | 1.29 × 10 0 |
| عظم | 1.90 × 10 3 | الدم | 1.05 × 10 3 | ثنائي أكسيد الكربون | 1.98 × 10 0 |
| نحاس | 8.44 × 10 3 | كحول إيثيلي | 8.06 × 10 × 2 | أحادي أكسيد الكربون | 1.25 × 10 0 |
| الخرسانة | 2.40 × 10 3 | بنزين | 6.80 × 10 × 2 | هيليوم | 1.80 × 10 -1 |
| نحاس | 8.92 × 10 3 | الجلسرين | 1.26 × 10 3 | هيدروجين | 9.00 × 10 -2 |
| كورك | 2.40 × 10 2 | الزئبق | 1.36 × 10 4 | الميثان | 7.20 × 10 -2 |
| القشرة الأرضية | 3.30 × 10 3 | زيت الزيتون | 9.20 × 10 × 2 | نيتروجين | 1.25 × 10 0 |
| زجاج | 2.60 × 10 3 | أكسيد النيتروز | 1.98 × 10 0 | ||
| الغرانيت | 2.70 × 10 3 | أكسجين | 1.43 × 10 0 | ||
| الحديد | 7.86 × 10 3 | ||||
| الرصاص | 1.13 × 10 4 | ||||
| أوك | 7.10 × 10 × 2 | ||||
| صنوبر | 3.73 × 10 × 2 | ||||
| بلاتين | 2.14 × 10 4 | ||||
| بوليسترين | 1.00 × 10 × 2 | ||||
| التنغستن | 1.93 × 10 4 | ||||
| يورانيوم | 1.87 × 10 3 |
كما ترى من خلال فحص الجدول 14.1، قد تساعد كثافة الكائن في تحديد تكوينه. تبلغ كثافة الذهب، على سبيل المثال، حوالي 2.5 مرة من كثافة الحديد، أي حوالي 2.5 مرة من كثافة الألومنيوم. تكشف الكثافة أيضًا شيئًا عن مرحلة المادة وبنيتها التحتية. لاحظ أن كثافة السوائل والمواد الصلبة قابلة للمقارنة تقريبًا، بما يتفق مع حقيقة أن ذراتها على اتصال وثيق. كثافة الغازات أقل بكثير من كثافة السوائل والمواد الصلبة، لأن الذرات في الغازات مفصولة بكميات كبيرة من المساحة الفارغة. يتم عرض الغازات لدرجة حرارة قياسية تبلغ 0.0 درجة مئوية وضغط قياسي يبلغ 101.3 كيلو باسكال، وهناك اعتماد قوي للكثافات على درجة الحرارة والضغط. تُعطى كثافات المواد الصلبة والسوائل المعروضة لدرجة الحرارة القياسية البالغة 0.0 درجة مئوية وتعتمد كثافة المواد الصلبة والسوائل على درجة الحرارة. عادة ما تزداد كثافة المواد الصلبة والسوائل مع انخفاض درجة الحرارة.
يوضح الجدول 14.2 كثافة الماء في المراحل المختلفة ودرجة الحرارة. تزداد كثافة الماء مع انخفاض درجة الحرارة، لتصل إلى حد أقصى عند 4.0 درجة مئوية، ثم تنخفض مع انخفاض درجة الحرارة إلى أقل من 4.0 درجة مئوية، وهذا السلوك لكثافة الماء يفسر سبب تشكل الجليد في الجزء العلوي من جسم مائي.
الجدول 14.2 - كثافات المياه
| مادة | \(\rho\)(كجم/م 3) |
|---|---|
| الثلج (0 درجة مئوية) | \ (\ rho\) (كجم/م 3)» النمط = «محاذاة النص: المركز؛» class= «lt-phys-4055">9.17 × 10 2 |
| الماء (0 درجة مئوية) | \ (\ rho\) (كجم/م 3)» النمط = «محاذاة النص: المركز؛» class= «lt-phys-4055">9.998 × 10 2 |
| الماء (4 درجة مئوية) | \ (\ rho\) (كجم/م 3)» النمط = «محاذاة النص: المركز؛» class= «lt-phys-4055">1.000 × 10 3 |
| الماء (20 درجة مئوية) | \ (\ rho\) (كجم/م 3)» النمط = «محاذاة النص: المركز؛» class= «lt-phys-4055">9.982 × 10 2 |
| الماء (100 درجة مئوية) | \ (\ rho\) (كجم/م 3)» النمط = «محاذاة النص: المركز؛» class= «lt-phys-4055">9.584 × 10 2 |
| البخار (100 درجة مئوية، 101.3 كيلو باسكال) | \ (\ rho\) (كجم/م 3)» النمط = «محاذاة النص: المركز؛» class= «lt-phys-4055">1.670 × 10 2 |
| مياه البحر (0 درجة مئوية) | \ (\ rho\) (كجم/م 3)» النمط = «محاذاة النص: المركز؛» class= «lt-phys-4055">1.030 × 10 3 |
لا تكون كثافة المادة ثابتة بالضرورة طوال حجم المادة. إذا كانت الكثافة ثابتة في جميع أنحاء المادة، يُقال إن المادة مادة متجانسة. شريط الحديد الصلب هو مثال على مادة متجانسة. الكثافة ثابتة طوال الوقت، وكثافة أي عينة من المادة هي نفس متوسط الكثافة. إذا لم تكن كثافة المادة ثابتة، يُقال إن المادة مادة غير متجانسة. قطعة من الجبن السويسري هي مثال على مادة غير متجانسة تحتوي على كل من الجبن الصلب والفراغات المملوءة بالغاز. تسمى الكثافة في موقع معين داخل مادة غير متجانسة الكثافة المحلية، ويتم إعطاؤها كدالة للموقع،\(\rho\) =\(\rho\) (x، y، z) (الشكل\(\PageIndex{3}\)).
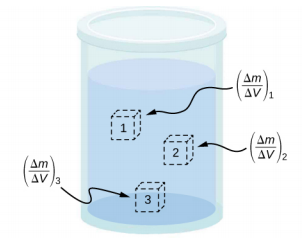
يمكن الحصول على الكثافة المحلية من خلال عملية تحديد، استنادًا إلى متوسط الكثافة في حجم صغير حول النقطة المعنية، مع الأخذ في الاعتبار الحد الذي يقترب فيه حجم الحجم من الصفر،
\[\rho = \lim_{\Delta V \rightarrow 0} \frac{\Delta m}{\Delta V} \label{14.2}\]
أين\(\rho\) الكثافة، m هي الكتلة، و V هو الحجم.
نظرًا لأن الغازات حرة في التمدد والانكماش، فإن كثافة الغازات تختلف اختلافًا كبيرًا مع درجة الحرارة، في حين أن كثافة السوائل تختلف قليلاً مع درجة الحرارة. لذلك، غالبًا ما يتم التعامل مع كثافة السوائل على أنها ثابتة، حيث تساوي الكثافة متوسط الكثافة.
الكثافة هي خاصية الأبعاد؛ لذلك، عند مقارنة كثافة مادتين، يجب أخذ الوحدات في الاعتبار. لهذا السبب، غالبًا ما يتم استخدام كمية أكثر ملاءمة وبدون أبعاد تسمى الجاذبية النوعية لمقارنة الكثافات. تُعرّف الجاذبية النوعية بأنها نسبة كثافة المادة إلى كثافة الماء عند 4.0 درجة مئوية وجو واحد من الضغط، وهو 1000 كجم/م 3:
\[Specific\; gravity = \frac{Density\; of\; material}{Density\; of\; water} \ldotp\]
تستخدم المقارنة الماء لأن كثافة الماء تبلغ 1 جم/سم 3، والتي كانت تستخدم في الأصل لتحديد الكيلوغرام. توفر الجاذبية النوعية، التي لا تحتوي على أبعاد، مقارنة جاهزة بين المواد دون الحاجة إلى القلق بشأن وحدة الكثافة. على سبيل المثال، تبلغ كثافة الألومنيوم 2.7 بوصة جم/سم 3 (2700 بالكيلو جرام/م 3)، ولكن جاذبيته النوعية هي 2.7، بغض النظر عن وحدة الكثافة. الجاذبية النوعية هي كمية مفيدة بشكل خاص فيما يتعلق بالطفو، والتي سنناقشها لاحقًا في هذا الفصل.
الضغط
لا شك أنك سمعت كلمة «ضغط» المستخدمة فيما يتعلق بالدم (ارتفاع ضغط الدم أو انخفاضه) وفيما يتعلق بالطقس (أنظمة الطقس ذات الضغط العالي والمنخفض). هذان مثالان فقط من العديد من الأمثلة على الضغط في السوائل. (تذكر أننا قدمنا فكرة الضغط في التوازن الثابت والمرونة، في سياق الإجهاد الكلي والإجهاد.)
يُعرّف الضغط (p) بأنه القوة العادية F لكل وحدة مساحة A التي يتم تطبيق القوة عليها، أو
\[p = \frac{F}{A} \ldotp \label{14.3}\]
لتحديد الضغط عند نقطة معينة، يُعرّف الضغط بأنه القوة dF التي يمارسها السائل فوق عنصر متناهي الصغر من المنطقة dA التي تحتوي على النقطة، مما ينتج عنه p =\(\frac{dF}{dA}\).
يمكن أن يكون لقوة معينة تأثير مختلف بشكل كبير، اعتمادًا على المنطقة التي تمارس عليها القوة. على سبيل المثال، تؤثر القوة المُطبّقة على مساحة ١ مم ٢ ضغطًا يساوي ١٠٠ مرة نفس القوة المُطبقة على مساحة ١ سم ٢. هذا هو السبب في أن الإبرة الحادة قادرة على اختراق الجلد عند ممارسة قوة صغيرة، ولكن تطبيق نفس القوة بإصبع لا يثقب الجلد (الشكل\(\PageIndex{4}\)).
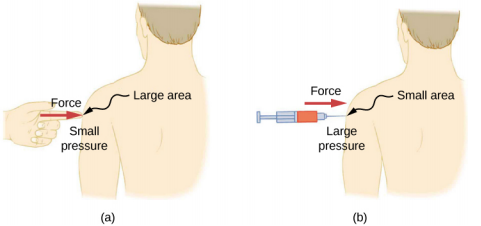
لاحظ أنه على الرغم من أن القوة متجه، إلا أن الضغط هو مقياس قياسي. الضغط هو كمية قياسية لأنه يُعرّف بأنه يتناسب مع حجم القوة المؤثرة عموديًا على مساحة السطح. وحدة SI للضغط هي الباسكال (Pa)، التي سميت على اسم عالم الرياضيات والفيزيائي الفرنسي بليز باسكال (1623-1662)، حيث
\[1\; Pa = 1\; N/m^{2} \ldotp\]
يتم استخدام العديد من الوحدات الأخرى للضغط، والتي نناقشها لاحقًا في الفصل.


