ج: أساسيات الفيزياء والكيمياء المهمة لعلم الأحياء الدقيقة
- Page ID
- 195149
مثل جميع المواد الأخرى، تخضع المادة التي تشمل الكائنات الحية الدقيقة لقوانين الكيمياء والفيزياء. تحدد الخصائص الكيميائية والفيزيائية لمسببات الأمراض الميكروبية - الخلوية والخلوية على حد سواء - موطنها، وتتحكم في عمليات التمثيل الغذائي، وتحدد كيفية تفاعلها مع جسم الإنسان. يقدم هذا الملحق مراجعة لبعض المبادئ الأساسية للكيمياء والفيزياء الضرورية لفهم علم الأحياء الدقيقة. تفترض العديد من فصول هذا النص - وخاصة الكيمياء الحيوية الميكروبية والأيض الميكروبي - أن القارئ لديه بالفعل فهم للمفاهيم التي تمت مراجعتها هنا.
البنية الذرية
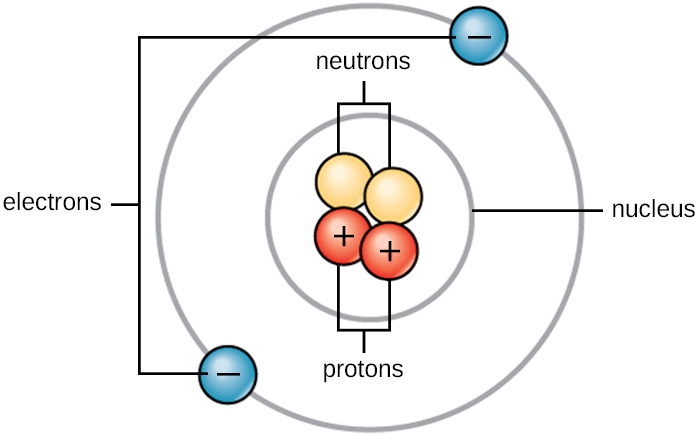
الحياة تتكون من مادة. المادة تحتل الفضاء ولها كتلة. تتكون جميع المواد من ذرات. تحتوي جميع الذرات على البروتونات والإلكترونات والنيوترونات (الشكل\(\PageIndex{1}\)). الاستثناء الوحيد هو الهيدروجين (H)، وهو مصنوع من بروتون واحد وإلكترون واحد. البروتون هو جسيم ذو شحنة موجبة يتواجد في النواة (جوهر الذرة) للذرة وكتلته وحدة كتلة ذرية واحدة (amu) وشحنة +1. الإلكترون هو جسيم سالب الشحنة ينتقل في الفضاء المحيط بالنواة. يتم توزيع الإلكترونات في مستويات طاقة مختلفة تسمى قذائف الإلكترون. الإلكترونات لها كتلة ضئيلة وشحنة قدرها —1. توجد النيوترونات، مثل البروتونات، في نواة الذرة. تبلغ كتلتها 1 مللي أمبير وبدون شحنة (محايدة). تعمل الشحنات الموجبة (البروتون) والسالبة (الإلكترون) على موازنة بعضها البعض في ذرة محايدة ذات شحنة صافية صفرية. نظرًا لأن كتلة كل من البروتونات والنيوترونات تبلغ 1 amu، فإن كتلة الذرة تساوي عدد البروتونات والنيوترونات في تلك الذرة. لا يؤثر عدد الإلكترونات في الكتلة الكلية لأن كتلة الإلكترون صغيرة جدًا.
عناصر كيميائية
تتكون جميع المواد من ذرات العناصر. تتميز العناصر بخصائص فيزيائية وكيميائية فريدة وهي مواد لا يمكن تحويلها بسهولة ماديًا أو كيميائيًا إلى مواد أخرى. تم إعطاء كل عنصر اسمًا، عادةً ما يكون مشتقًا من اللاتينية أو الإنجليزية. تحتوي العناصر أيضًا على رموز من حرف واحد أو حرفين تمثل الاسم؛ على سبيل المثال، يحتوي الصوديوم (Na) والذهب (Au) والفضة (Ag) على اختصارات مشتقة من أسمائهم اللاتينية الأصلية natrium و aurum و argentum على التوالي. ومن الأمثلة على الاختصارات الإنجليزية الكربون (C) والهيدروجين (H) والأكسجين (O) والنيتروجين (N). تم تحديد ما مجموعه 118 عنصرًا مختلفًا (92 منها تحدث بشكل طبيعي) وتنظيمها في الجدول الدوري للعناصر. من بين العناصر التي تحدث بشكل طبيعي، يوجد أقل من 30 عنصرًا في الكائنات الحية على الأرض، وتشكل أربعة منها (C و H و O و N) حوالي 96٪ من كتلة الكائن الحي. 1
يتم تحديد كل عنصر فريد من خلال عدد البروتونات في نواة الذرة. بالإضافة إلى البروتونات، تحتوي النواة الذرية لكل عنصر على عدد مساوٍ أو أكبر من النيوترونات (باستثناء الهيدروجين، الذي يحتوي على بروتون واحد فقط). يوصف العدد الإجمالي للبروتونات لكل عنصر بالرقم الذري، والكتلة المجمعة للبروتونات والنيوترونات تسمى الكتلة الذرية أو رقم الكتلة. لذلك، من الممكن تحديد عدد النيوترونات بطرح العدد الذري من العدد الكتلي.
النظائر هي أشكال مختلفة من نفس العنصر لها نفس عدد البروتونات، ولكن عددًا مختلفًا من النيوترونات. تحتوي العديد من العناصر على العديد من النظائر مع نظير واحد أو اثنين من النظائر الشائعة في الطبيعة. على سبيل المثال، يحتوي الكربون 12 (12 درجة مئوية)، وهو النظير الأكثر شيوعًا للكربون (98.6٪ من جميع درجات الحرارة الموجودة على الأرض)، 2 على ستة بروتونات وستة نيوترونات. لذلك، يبلغ عدد كتلته 12 (6 بروتونات + 6 نيوترونات) وعدد ذري قدره 6.
هناك نوعان إضافيان من النظائر في الطبيعة: النظائر الثقيلة والنظائر المشعة. تحتوي النظائر الثقيلة على نيوترونات إضافية واحدة أو أكثر مع الحفاظ على نواة ذرية مستقرة. مثال على النظائر الثقيلة هو الكربون 13 (13 درجة مئوية) (1.1٪ من كل الكربون). 3 13 C له عدد كتلته 13 (6 بروتونات + 7 نيوترونات). نظرًا لأن العدد الذري لـ 13 C هو 6، فإنه لا يزال عنصر الكربون؛ ومع ذلك، فإن كتلته أكبر من الشكل الأكثر شيوعًا للعنصر، 12 C، بسبب النيوترون الإضافي في النواة. يعتبر الكربون 14 (14 درجة مئوية) (0.0001٪ من إجمالي الكربون) 4 مثالاً على النظائر المشعة. 14 C له عدد كتلته 14 (6 بروتونات + 8 نيوترونات)؛ ومع ذلك، فإن النيوترونات الزائدة في 14 C تؤدي إلى نواة غير مستقرة. يؤدي عدم الاستقرار هذا إلى عملية التحلل الإشعاعي. يتضمن التحلل الإشعاعي فقدان واحد أو أكثر من النيوترونات وإطلاق الطاقة في شكل أشعة جاما أو جسيمات ألفا أو جسيمات بيتا (اعتمادًا على النظير).
أثبتت النظائر الثقيلة والنظائر المشعة للكربون والعناصر الأخرى أنها مفيدة في البحث والصناعة والطب.
روابط كيميائية
هناك ثلاثة أنواع من الروابط الكيميائية المهمة عند وصف تفاعل الذرات داخل الجزيئات وفيما بينها في علم الأحياء الدقيقة: (1) الروابط التساهمية، والتي يمكن أن تكون إما قطبية أو غير قطبية، (2) الروابط الأيونية، و (3) الروابط الهيدروجينية. هناك أنواع أخرى من التفاعلات مثل قوى التشتت في لندن وقوى فان دير فال التي يمكن مناقشتها أيضًا عند وصف الخصائص الفيزيائية والكيميائية للتفاعلات بين الجزيئات للذرات، لكننا لن ندرج أوصافًا لهذه القوى هنا.
يتم تحديد الترابط الكيميائي من خلال الغلاف الخارجي للإلكترونات، والذي يُطلق عليه اسم إلكترونات التكافؤ (VE)، للذرة. يعد عدد VE مهمًا عند تحديد عدد ونوع الروابط الكيميائية التي ستشكلها الذرة.
السندات التساهمية
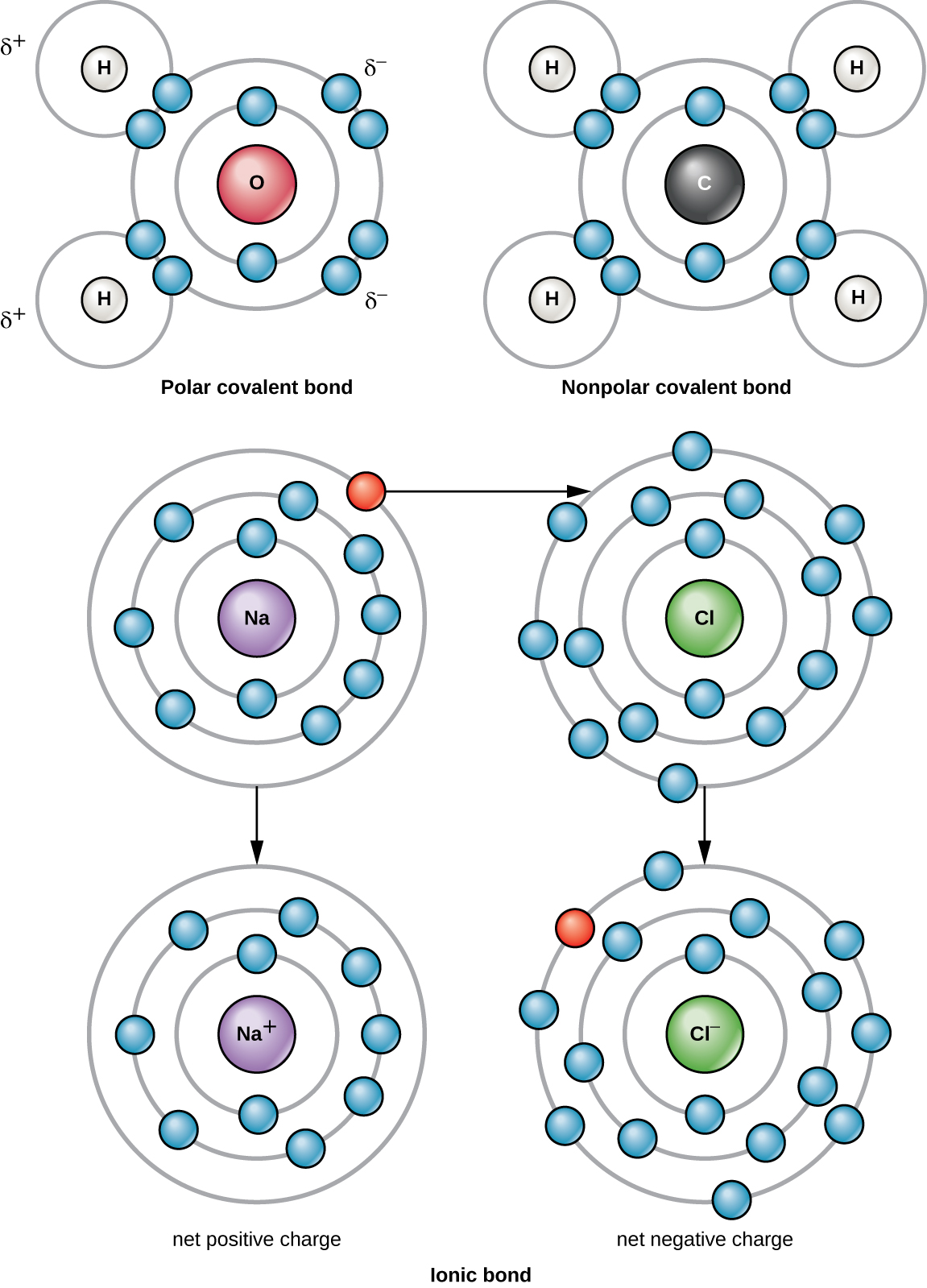
أقوى رابطة كيميائية بين ذرتين أو أكثر هي الرابطة التساهمية. تتكون هذه الروابط عندما يتم تقاسم الإلكترون بين ذرتين، وهذه هي الشكل الأكثر شيوعًا للروابط الكيميائية في الكائنات الحية. تتكون الروابط التساهمية بين ذرات العناصر التي تشكل الجزيئات البيولوجية في خلايانا. مثال لجزيء بسيط يتكون من روابط تساهمية هو الماء، H 2 O، مع VE واحد لكل ذرة H و 6 VE لكل ذرة O. بسبب تكوين VE، تكون كل ذرة H قادرة على قبول VE إضافي واحد وكل ذرة O قادرة على قبول اثنين من VE الإضافيين. عند مشاركة الإلكترونات، تصبح ذرات الهيدروجين والأكسجين التي تتحد لتكوين جزيئات الماء مرتبطة ببعضها البعض بواسطة روابط تساهمية (الشكل\(\PageIndex{2}\)). يقسم الإلكترون من ذرة الهيدروجين وقته بين الغلاف الإلكتروني الخارجي لذرة الهيدروجين والغلاف الإلكتروني الخارجي لذرة الأكسجين. لملء الغلاف الخارجي لذرة الأكسجين بالكامل، هناك حاجة إلى إلكترونين من ذرتي هيدروجين، ومن هنا يشير الحرف «2" إلى ذرتين من H في جزيء H 2 O. وهذه المشاركة هي حالة طاقة أقل لجميع الذرات المعنية مما لو كانت موجودة بدون امتلاء غلافها الخارجي.
هناك نوعان من الروابط التساهمية: القطبية وغير القطبية. تتكون الروابط التساهمية غير القطبية بين ذرتين من نفس العناصر أو عناصر مختلفة تشترك في الإلكترونات بالتساوي (الشكل\(\PageIndex{2}\)). في الرابطة التساهمية القطبية، تقضي الإلكترونات المشتركة بين الذرات وقتًا أقرب إلى نواة واحدة مقارنة بالنواة الأخرى. بسبب التوزيع غير المتكافئ للإلكترونات بين النوى المختلفة، تتطور شحنة موجبة قليلاً (Δ+) أو سالبة قليلاً (—). الماء هو مثال لجزيء يتكون من روابط تساهمية قطبية (الشكل\(\PageIndex{2}\)).
الأيونات والروابط الأيونية
عندما لا تحتوي الذرة على أعداد متساوية من البروتونات والإلكترونات، فإنها تسمى الأيون. نظرًا لأن عدد الإلكترونات لا يساوي عدد البروتونات، فإن كل أيون له شحنة صافية. تتكون الأيونات الموجبة عن طريق فقدان الإلكترونات وتسمى الكاتيونات. تتكون الأيونات السالبة من خلال اكتساب الإلكترونات وتسمى الأنيونات.
على سبيل المثال، تحتوي ذرة الصوديوم على إلكترون واحد فقط في غلافها الخارجي. تحتاج ذرة الصوديوم للتبرع بهذا الإلكترون إلى طاقة أقل مما تتطلبه لقبول سبعة إلكترونات أخرى، والتي ستحتاجها لملء غلافها الخارجي. إذا فقدت ذرة الصوديوم إلكترونًا، فإنها تحتوي الآن على 11 بروتونًا و10 إلكترونات فقط، مما يجعلها ذات شحنة إجمالية قدرها +1. يطلق عليه الآن أيون الصوديوم (Na +).
تحتوي ذرة الكلور على سبعة إلكترونات في غلافها الخارجي. مرة أخرى، يعد اكتساب ذرة الكلور إلكترون واحدًا أكثر كفاءة في استخدام الطاقة بدلاً من فقدان سبعة. لذلك، من المرجح أن يكتسب إلكترونًا لتكوين أيون يحتوي على 17 بروتونًا و 18 إلكترونًا، مما يمنحه شحنة سالبة صافية (—1). يطلق عليه الآن أيون الكلوريد (Cl -). يشار إلى حركة الإلكترونات هذه من ذرة إلى أخرى باسم نقل الإلكترون. نظرًا لأن الشحنات الموجبة والسالبة تتجاذب، تبقى هذه الأيونات معًا وتشكل رابطة أيونية أو رابطة بين الأيونات. عندما تتحد أيونات Na + و Cl لإنتاج NaCl، يبقى الإلكترون من ذرة الصوديوم مع السبعة الأخرى من ذرة الكلور، وتجذب أيونات الصوديوم والكلوريد بعضها البعض في شبكة من الأيونات ذات الشحنة الصفرية الصافية (الشكل\(\PageIndex{2}\)).
تتكون الأيونات متعددة الذرات من ذرات متعددة مرتبطة بروابط تساهمية؛ ولكن على عكس الجزيء، فإن الأيون متعدد الذرات له شحنة موجبة أو سالبة. يعمل ككاتيون أو أنيون وبالتالي يمكنه تكوين روابط أيونية مع أيونات أخرى لتكوين مركبات أيونية. قد تكون الذرات في أيون متعدد الذرات من نفس العنصر أو عناصر مختلفة.
\(\PageIndex{1}\)يسرد الجدول بعض الكاتيونات والأنيونات التي تحدث عادة في علم الأحياء الدقيقة. لاحظ أن هذا الجدول يتضمن أيونات أحادية الذرة وكذلك أيونات متعددة الذرات.
| الايو | الأنيونات | ||
|---|---|---|---|
| صوديوم | نا + | كلوريد | كلور — |
| هيدروجين | إتش + | ثاني كربونات | \(\ce{HCO3-}\) |
| بوتاسيوم | ك + | كربونات | \(\ce{CO3^2-}\) |
| الأمونيوم | \(\ce{NH4+}\) | سلفات هيدروجين | \(\ce{H2SO4^2-}\) |
| نحاس (1) | كوب + | كبريتيد هيدروجين | الولايات المتحدة الأمريكية — |
| نحاس (ثنائي) | كأس 2+ | الهيدروكسيد | أوه — |
| حديد (ثنائي) | فبراير 2+ | هيبوكلوريت | CoL - |
| حديد (ثلاثي) | فبراير 3+ | النتريت | \(\ce{NO2-}\) |
| نترات | \(\ce{NO3-}\) | ||
| بيروكسيد | \(\ce{O2^2-}\) | ||
| فوسفات | \(\ce{PO4^3-}\) | ||
| بيروفوسفات | \(\ce{P2O7^4-}\) | ||
| كبريتيت | \(\ce{SO3^2-}\) | ||
| ثيوسلفات | \(\ce{S2O3^2-}\) | ||
الصيغة الجزيئية والكتلة الجزيئية والمول
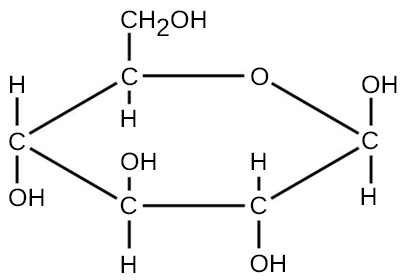
بالنسبة للجزيئات التي تتكون من روابط تساهمية، تمثل الصيغة الجزيئية عدد وأنواع الذرات الأولية التي يتكون منها الجزيء. على سبيل المثال، ضع في اعتبارك جزيء الجلوكوز، الذي يحتوي على الصيغة الجزيئية C 6 H 12 O 6. تشير هذه الصيغة الجزيئية إلى أن جزيء واحد من الجلوكوز يتكون من ست ذرات كربون واثني عشر ذرة هيدروجين وست ذرات أكسجين.
يمكن حساب الكتلة الجزيئية للجزيء باستخدام الصيغة الجزيئية والكتلة الذرية لكل عنصر في الجزيء. يتم ضرب عدد كل نوع من الذرات في الكتلة الذرية؛ ثم تتم إضافة المنتجات للحصول على الكتلة الجزيئية. على سبيل المثال، يتم حساب الكتلة الجزيئية للجلوكوز، C 6 H 12 O 6 (الشكل\(\PageIndex{3}\))، على النحو التالي:
\ [\ ابدأ {مصفوفة} {l}
\ نص {كتلة الكربون} و =12\:\ frac {\ mathrm {amu}} {\ الرياضيات {أتوم}}\ مرات 6\ نص {ذرات} =72\ النص {amu}
\\\ النص {كتلة الهيدروجين} و =1\:\ frac {\ mathrm {\ mathrm {ذرة}\\ مرات 12\ النص {الذرات} =12\ النص {amu}\
\\ النص {كتلة الأكسجين} و ; =16\:\ frac {\ mathrm {amu}} {\ الرياضيات {atom}\ مرات 6\ النص {الذرات} =96\ النص {amu}\\ النص {الكتلة الجزيئية للجلوكوز} و =72
\ النص {amu} +12\ النص {amu} +96\ النص {amu} =180\ النص {amu}\ text {amu}\ text {amu}\\ text {amu}
\\ text {am
تم تحديد عدد الكيانات التي يتكون منها المول تجريبيًا ليكون 6.022 × 10 23، وهو ثابت أساسي يسمى رقم Avogadro (NA) أو ثابت Avogadro. يتم الإبلاغ عن هذا الثابت بشكل صحيح بوحدة صريحة من «لكل مول».
الطاقة
تشير الديناميكا الحرارية إلى دراسة الطاقة ونقل الطاقة بما في ذلك المواد الفيزيائية.
المادة المشاركة في حالة معينة من نقل الطاقة تسمى النظام، وكل شيء خارج هذه المادة يسمى البيئة المحيطة. هناك نوعان من الأنظمة: المفتوحة والمغلقة. في النظام المفتوح، يمكن تبادل الطاقة مع محيطها. لا يمكن للنظام المغلق تبادل الطاقة مع محيطه. الكائنات البيولوجية هي أنظمة مفتوحة. يتم تبادل الطاقة بينهم وبين محيطهم حيث يستخدمون الطاقة من الشمس لإجراء عملية التمثيل الضوئي أو استهلاك جزيئات تخزين الطاقة وإطلاق الطاقة إلى البيئة من خلال القيام بالعمل وإطلاق الحرارة. مثل كل الأشياء في العالم المادي، تخضع الطاقة للقوانين الفيزيائية. بشكل عام، يتم تعريف الطاقة على أنها القدرة على القيام بالعمل، أو إحداث نوع من التغيير. توجد الطاقة بأشكال مختلفة. على سبيل المثال، الطاقة الكهربائية والطاقة الضوئية والطاقة الحرارية كلها أنواع مختلفة من الطاقة. ينص القانون الأول للديناميكا الحرارية، الذي يشار إليه غالبًا باسم قانون الحفاظ على الطاقة، على أن الكمية الإجمالية للطاقة في الكون ثابتة ومحفوظة. توجد الطاقة في العديد من الأشكال المختلفة. وفقًا للقانون الأول للديناميكا الحرارية، يمكن نقل الطاقة من مكان إلى آخر أو تحويلها إلى أشكال مختلفة، ولكن لا يمكن إنشاؤها أو تدميرها.
يتمثل التحدي الذي تواجهه جميع الكائنات الحية في الحصول على الطاقة من محيطها بأشكال يمكنها نقلها أو تحويلها إلى طاقة قابلة للاستخدام للقيام بالعمل. لقد تطورت الكائنات الحية الدقيقة لمواجهة هذا التحدي. يتم نقل الطاقة الكيميائية المخزنة داخل الجزيئات العضوية مثل السكريات والدهون وتحويلها من خلال سلسلة من التفاعلات الكيميائية الخلوية إلى طاقة داخل جزيئات ATP. يمكن الوصول بسهولة إلى الطاقة في جزيئات ATP للقيام بالعمل. تتضمن أمثلة أنواع العمل التي تحتاج الخلايا إلى القيام بها بناء جزيئات معقدة، ونقل المواد، وتشغيل حركة الأهداب أو الأسواط، وتقلص ألياف العضلات لخلق الحركة.
قد تبدو المهام الأساسية للكائنات الحية الدقيقة المتمثلة في الحصول على الطاقة وتحويلها واستخدامها للقيام بالعمل بسيطة. ومع ذلك، يشرح القانون الثاني للديناميكا الحرارية سبب صعوبة هذه المهام أكثر مما تبدو عليه. جميع عمليات نقل الطاقة والتحولات لا تكون فعالة تمامًا أبدًا. في كل عملية نقل للطاقة، يتم فقدان قدر من الطاقة في شكل غير قابل للاستخدام. في معظم الحالات، يكون هذا النموذج عبارة عن طاقة حرارية. من الناحية الديناميكية الحرارية، تُعرَّف الطاقة الحرارية بأنها الطاقة المنقولة من نظام إلى آخر ولا تعمل. على سبيل المثال، يتم فقدان بعض الطاقة كطاقة حرارية أثناء التفاعلات الأيضية الخلوية.
فكلما زاد مقدار الطاقة التي يفقدها النظام في البيئة المحيطة به، كلما قل ترتيب النظام وأصبح النظام أكثر عشوائية. يشير العلماء إلى مقياس العشوائية أو الاضطراب داخل النظام باسم الإنتروبيا. الإنتروبيا العالية تعني اضطرابًا عاليًا وطاقة منخفضة. تحتوي الجزيئات والتفاعلات الكيميائية على إنتروبيا متفاوتة أيضًا. على سبيل المثال، تزداد الإنتروبيا مع انتشار الجزيئات ذات التركيز العالي في مكان واحد وانتشارها. ينص القانون الثاني للديناميكا الحرارية على أن الطاقة ستفقد دائمًا كحرارة في عمليات نقل الطاقة أو تحويلها. يتم ترتيب الكائنات الحية الدقيقة بدرجة عالية، مما يتطلب الحفاظ على مدخلات الطاقة المستمرة في حالة الإنتروبيا المنخفضة.
التفاعلات الكيميائية
تحدث التفاعلات الكيميائية عندما تترابط ذرتان أو أكثر معًا لتكوين جزيئات أو عندما تتكسر الذرات المرتبطة. المواد المستخدمة في التفاعل الكيميائي تسمى المواد المتفاعلة (عادة ما توجد على الجانب الأيسر من المعادلة الكيميائية)، وتعرف المواد الناتجة عن التفاعل بالمنتجات (عادة ما توجد على الجانب الأيمن من المعادلة الكيميائية). عادةً ما يتم رسم سهم بين المواد المتفاعلة والمنتجات للإشارة إلى اتجاه التفاعل الكيميائي؛ هذا الاتجاه ليس دائمًا «طريقًا أحادي الاتجاه».
مثال على التفاعل الكيميائي البسيط هو تكسير جزيئات بيروكسيد الهيدروجين، والتي تتكون كل منها من ذرتين هيدروجين مرتبطتين بذرتين من الأكسجين (H 2 O 2). يتحلل بيروكسيد الهيدروجين المتفاعل إلى ماء يحتوي على ذرة أكسجين واحدة مرتبطة بذرتين هيدروجين (H 2 O) وأكسجين يتكون من ذرتي أكسجين مرتبطتين (O 2). في المعادلة أدناه، يشتمل التفاعل على جزيئين من بيروكسيد الهيدروجين وجزيئين من الماء. هذا مثال لمعادلة كيميائية متوازنة، حيث يكون عدد ذرات كل عنصر هو نفسه على كل جانب من المعادلة. وفقًا لقانون الحفاظ على المادة، يجب أن يكون عدد الذرات قبل التفاعل الكيميائي وبعده متساويًا، بحيث لا يتم إنشاء ذرات أو تدميرها في الظروف العادية.
\[\ce{2H2O2\:(hydrogen\: peroxide)⟶2H2O\:(water) + O2\:(oxygen)}\]
يمكن أن تستمر بعض التفاعلات الكيميائية، مثل تلك الموضحة أعلاه، في اتجاه واحد حتى يتم استنفاد جميع المواد المتفاعلة. تحتوي المعادلات التي تصف هذه التفاعلات على سهم أحادي الاتجاه ولا يمكن التراجع عنها. ردود الفعل العكسية هي تلك التي يمكن أن تسير في أي اتجاه. في التفاعلات العكسية، يتم تحويل المواد المتفاعلة إلى منتجات، ولكن عندما يرتفع تركيز المنتج فوق حد معين (سمة التفاعل المحدد)، سيتم تحويل بعض هذه المنتجات مرة أخرى إلى متفاعلات؛ عند هذه النقطة، يتم عكس تسميات المنتجات والمواد المتفاعلة. تستمر التغييرات في التركيز حتى يحدث توازن نسبي معين في التركيز بين المواد المتفاعلة والمنتجات - وهي حالة تسمى التوازن الكيميائي. في هذه المرحلة، تستمر التفاعلات الأمامية والعكسية في الحدوث، ولكنها تحدث بنفس المعدل، لذلك لا تتغير تركيزات المواد المتفاعلة والمنتجات. غالبًا ما يتم الإشارة إلى حالات التفاعلات العكسية هذه بمعادلة كيميائية بسهم مزدوج الرأس يشير إلى كل من المواد المتفاعلة والمنتجات. على سبيل المثال، عندما يذوب ثاني أكسيد الكربون في الماء، يمكن أن يحدث ذلك كغاز مذاب في الماء أو عن طريق التفاعل مع الماء لإنتاج حمض الكربونك. في خلايا بعض الكائنات الحية الدقيقة، يتم تسريع معدل إنتاج حمض الكربونك بواسطة إنزيم الأنهيدراز الكربوني، كما هو موضح في المعادلة التالية:
\[\ce{CO2 + H2O \stackrel{carbonic}{\stackrel{anhydrase}{\rightleftharpoons}} H2CO3 \rightleftharpoons H+ + HCO3-}\]
خصائص المياه والحلول
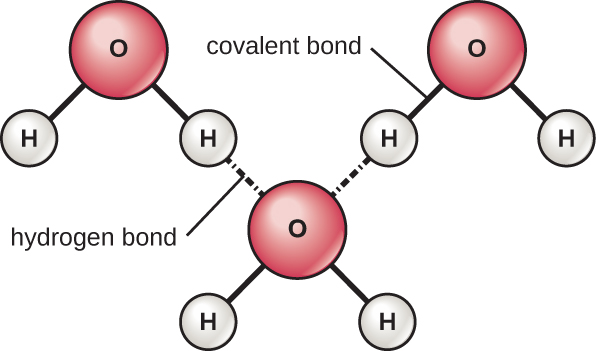
تشكل ذرات الهيدروجين والأكسجين داخل جزيئات الماء روابط تساهمية قطبية. لا توجد شحنة إجمالية لجزيء الماء، ولكن هناك + واحدة على كل ذرة هيدروجين واثنتان - على ذرة الأكسجين. يجذب كل جزيء مائي جزيئات الماء الأخرى بسبب الشحنات الموجبة والسالبة في الأجزاء المختلفة من الجزيء (الشكل\(\PageIndex{4}\)). يجذب الماء أيضًا الجزيئات القطبية الأخرى (مثل السكريات)، مما يشكل روابط هيدروجينية. عندما تشكل المادة روابط هيدروجينية بسهولة بالماء، يمكن أن تذوب في الماء ويشار إليها باسم محبة للماء («محبة للماء»). لا تتشكل الروابط الهيدروجينية بسهولة باستخدام مواد غير قطبية مثل الزيوت والدهون. هذه المركبات غير القطبية كارهة للماء («تخشى الماء») وستبتعد عن الماء وتتجنبه.
تسمح الروابط الهيدروجينية في الماء بامتصاص الطاقة الحرارية وإطلاقها بشكل أبطأ من العديد من المواد الأخرى. هذا يعني أن الماء يعدل التغيرات في درجات الحرارة داخل الكائنات الحية وفي بيئاتها. مع استمرار مدخلات الطاقة، يتأرجح التوازن بين تكوين رابطة الهيدروجين والكسر نحو عدد أقل من الروابط الهيدروجينية: يتم كسر الروابط أكثر مما يتم تكوينه. تؤدي هذه العملية إلى إطلاق جزيئات الماء الفردية على سطح السائل (مثل الجسم المائي أو أوراق النبات أو جلد الكائن الحي) في عملية تسمى التبخر.
على العكس من ذلك، مع انخفاض الحركة الجزيئية وانخفاض درجات الحرارة، توجد طاقة أقل لكسر الروابط الهيدروجينية بين جزيئات الماء. تظل هذه الروابط سليمة وتبدأ في تشكيل هيكل صلب يشبه الشبكة (مثل الجليد). عند التجميد، يكون الثلج أقل كثافة (الجزيئات بعيدة عن بعضها البعض) من الماء السائل. هذا يعني أن الجليد يطفو على سطح جسم مائي. في البحيرات والبرك والمحيطات، سيتشكل الجليد على سطح الماء، مما يخلق حاجزًا عازلًا لحماية الحياة الحيوانية والنباتية تحتها من التجمد في الماء. إذا لم يحدث ذلك، فإن النباتات والحيوانات التي تعيش في الماء ستتجمد في كتلة من الجليد ولا يمكنها التحرك بحرية، مما يجعل الحياة في درجات الحرارة الباردة صعبة أو مستحيلة.
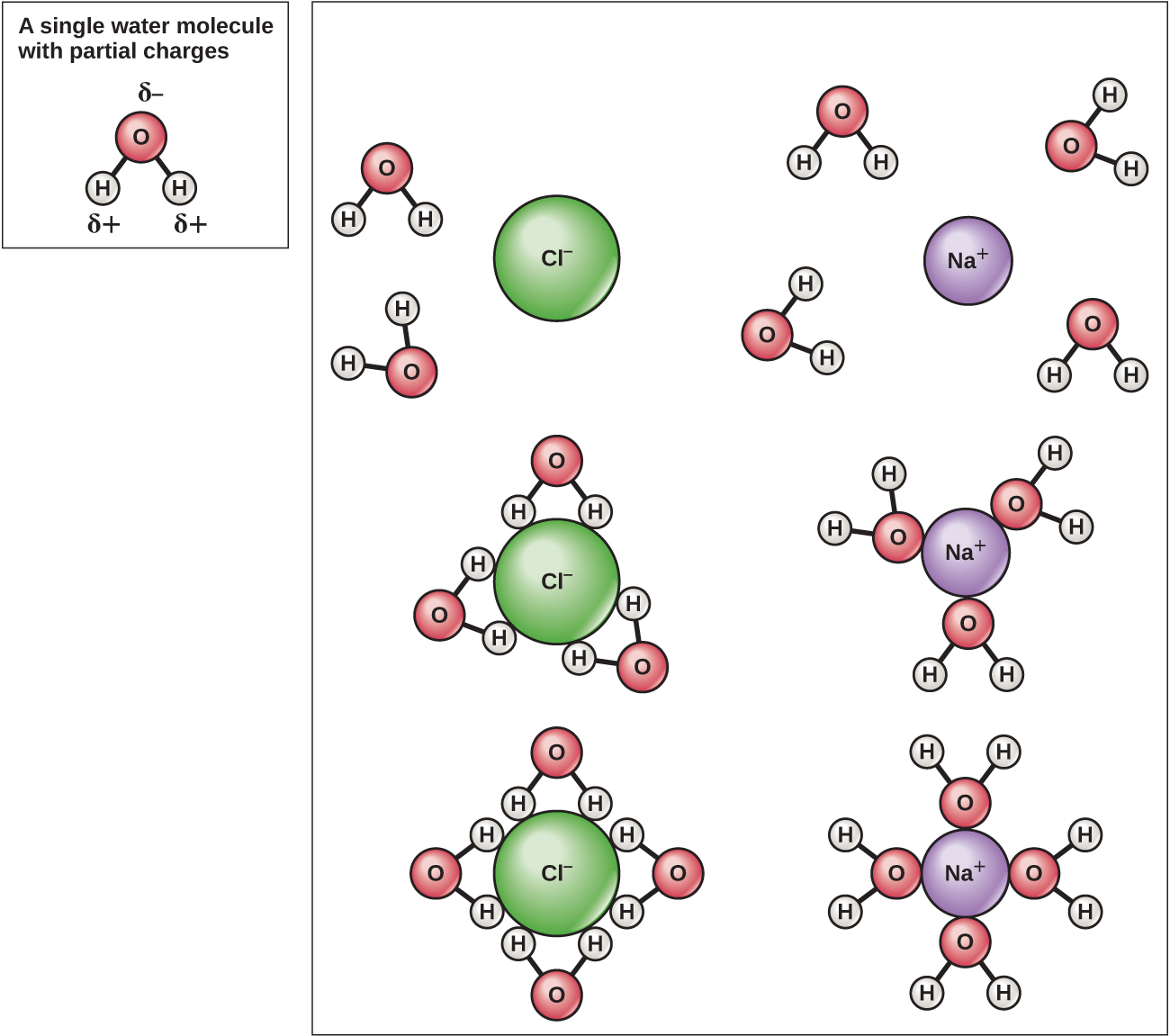
نظرًا لأن الماء قطبي وله شحنات موجبة وسالبة طفيفة، يمكن للمركبات الأيونية والجزيئات القطبية أن تذوب فيه بسهولة. لذلك، فإن الماء هو ما يشار إليه بالمذيب - مادة قادرة على إذابة مادة أخرى. ستشكل الجسيمات المشحونة روابط هيدروجينية مع طبقة محيطة من جزيئات الماء. يشار إلى هذا باسم كرة الترطيب ويعمل على إبقاء الأيونات منفصلة أو منتشرة في الماء (الشكل\(\PageIndex{5}\)). يشار إلى كرات الترطيب هذه أيضًا باسم قشور الترطيب. قطبية جزيء الماء تجعله مذيبًا فعالًا ومهمًا في أدواره العديدة في الأنظمة الحية.
تنتج قدرة الحشرات على الطفو والتزلج عبر مياه البركة من خاصية التماسك. في التماسك، تنجذب جزيئات الماء لبعضها البعض (بسبب الترابط الهيدروجيني)، مما يحافظ على الجزيئات معًا في واجهة الهواء السائل (الغاز). يؤدي التماسك إلى التوتر السطحي، وقدرة المادة على تحمل التمزق عند وضعها تحت التوتر أو الضغط.
ترتبط هذه القوى المتماسكة أيضًا بخاصية التصاق الماء، أو التجاذب بين جزيئات الماء والجزيئات الأخرى. يُلاحظ ذلك عندما «يتسلق» الماء قشة موضوعة في كوب من الماء. ستلاحظ أن الماء يبدو أعلى على جانبي القش منه في المنتصف. هذا لأن جزيئات الماء تنجذب إلى القش وبالتالي تلتصق به.
التماسك والالتصاق هما أيضًا عاملان في المستعمرات البكتيرية وتكوين الأغشية الحيوية. يحافظ التماسك على سلامة المستعمرة (يساعدها على «الالتصاق» بالسطح)، بينما يحافظ الالتصاق على التصاق الخلايا ببعضها البعض. القوى المتماسكة واللاصقة مهمة للحفاظ على الحياة. على سبيل المثال، بسبب هذه القوى، توفر المياه في البيئة الطبيعية الظروف اللازمة للسماح للخلايا البكتيرية والأثرية بالالتصاق والتراكم على الأسطح.
الأحماض والقواعد
درجة الحموضة في المحلول هي مقياس لتركيزات أيون الهيدروجين (H +) وأيون الهيدروكسيد (OH —) ويوصف بالحموضة أو القلوية، على التوالي. يمكن قياس الحموضة والقلوية (يشار إليها أيضًا باسم الأساس) وحسابها. يمكن تمثيل درجة الحموضة ببساطة من خلال المعادلة الرياضية،\(\mathrm{pH=-\log_{10}[H^+]}\). على الجانب الأيسر من المعادلة، تعني «p» «اللوغاريتم السالب لـ» ويمثل H [H +]. على الجانب الأيمن من المعادلة، [H +] هو تركيز H + بالمولز/لتر. ما لا يتم تمثيله في هذه المعادلة البسيطة هو مساهمة OH -، والتي تشارك أيضًا في الحموضة أو القلوية. حساب نتائج درجة الحموضة في نطاق رقمي من 0 إلى 14 يسمى مقياس الأس الهيدروجيني (الشكل\(\PageIndex{6}\)). تشير قيمة pH بين 0 و 6.9 إلى الحمض. ويشار إليه أيضًا باسم درجة الحموضة المنخفضة، بسبب التركيز العالي [H +] وانخفاض [OH -]. تشير قيمة pH بين 7.1 و 14 إلى مادة قلوية أو قاعدة. ويشار إليه أيضًا باسم درجة الحموضة العالية، نظرًا لانخفاض تركيز [H +] وارتفاع [OH —]. يوصف الرقم الهيدروجيني 7 بأنه درجة حموضة محايدة ويحدث عندما [H +] يساوي [OH —].

يمثل تغيير وحدة واحدة على مقياس pH تغيرًا في [H +] بعامل 10، ويمثل التغيير في وحدتين تغييرًا في [H +] بعامل 100. وبالتالي، فإن التغييرات الصغيرة في درجة الحموضة تمثل تغييرات كبيرة في [H +].
الحواشي
- 1 شريفر وكاريل وإيريس شريفر. العيش مع النجوم: كيف يرتبط جسم الإنسان بدورات حياة الأرض والكواكب والنجوم. مطبعة جامعة أكسفورد، الولايات المتحدة الأمريكية، 2015.
- 2 الإدارة الوطنية للمحيطات والغلاف الجوي، «النظائر المستقرة والكربونية لثاني أكسيد الكربون». صفحة الويب. تم الوصول إليه في 19 فبراير 2016 [http://www.esrl.noaa.gov/gmd/outreac...hemistry.html]
- 3 المرجع نفسه.
- 4 المرجع نفسه.


