26.4: الفطريات العصبية والأمراض الطفيلية للجهاز العصبي
- Page ID
- 195240
أهداف التعلم
- حدد الفطريات الأكثر شيوعًا التي يمكن أن تسبب التهابات الجهاز العصبي
- قارن الخصائص الرئيسية لأمراض فطرية معينة تؤثر على الجهاز العصبي
الالتهابات الفطرية للجهاز العصبي، والتي تسمى نيوروميكوسيس، نادرة في الأفراد الأصحاء. ومع ذلك، يمكن أن تكون الفطريات العصبية مدمرة للمرضى الذين يعانون من نقص المناعة أو كبار السن. العديد من الطفيليات حقيقية النواة قادرة أيضًا على إصابة الجهاز العصبي للمضيفين البشريين. على الرغم من أن هذه العدوى غير شائعة نسبيًا، إلا أنها يمكن أن تكون أيضًا مهددة للحياة لدى الأفراد الذين في هذا القسم، سنناقش أولاً الفطريات العصبية، تليها الالتهابات الطفيلية للجهاز العصبي.
التهاب السحايا الخفي
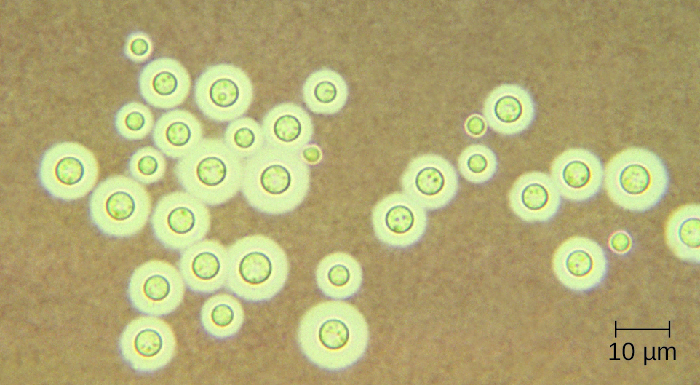
Cryptococcus neoformans هو عامل فطري يمكن أن يسبب التهاب السحايا. توجد هذه الخميرة بشكل شائع في التربة وترتبط بشكل خاص بفضلات الحمام. يحتوي على كبسولة سميكة تعمل كعامل ضراوة مهم، مما يمنع التخلص من البلعمة. تؤدي معظم حالات C. neoformans إلى التهابات الجهاز التنفسي دون السريرية التي عادة ما تزول تلقائيًا لدى الأفراد الأصحاء دون أي عواقب طويلة المدى (انظر الفطريات التنفسية). في المرضى الذين يعانون من نقص المناعة أو أولئك الذين يعانون من أمراض كامنة أخرى، يمكن أن تتطور العدوى للتسبب في التهاب السحايا وتكوين الورم الحبيبي في أنسجة المخ. يمكن أن تعمل مستضدات المكورات الخفية أيضًا على تثبيط المناعة الخلوية وفرط الحساسية المتأخر من النوع.
يمكن زراعة المكورات المشفرة بسهولة في المختبر وتحديدها بناءً على كبسولتها الواسعة (الشكل\(\PageIndex{1}\)). يتم استزراع C. neoformans بشكل متكرر من عينات البول للمرضى الذين يعانون من العدوى المنتشرة.
العلاج المطول بالأدوية المضادة للفطريات مطلوب لعلاج عدوى المكورات الخفية. العلاج المركب مطلوب مع الأمفوتريسين B بالإضافة إلى فلوسيتوزين لمدة 10 أسابيع على الأقل. تواجه العديد من الأدوية المضادة للفطريات صعوبة في عبور الحاجز الدموي الدماغي ولها آثار جانبية قوية تتطلب جرعات منخفضة؛ تساهم هذه العوامل في طول فترة العلاج. المرضى المصابون بالإيدز معرضون بشكل خاص للإصابة بعدوى الكريبتوكوكوس بسبب حالتهم المناعية الضعيفة. يمكن أيضًا علاج مرضى الإيدز المصابين بداء الكريبتوكوكوسيس بالأدوية المضادة للفطريات، لكنهم غالبًا ما يصابون بانتكاسات؛ قد تكون جرعات الفلوكونازول مدى الحياة ضرورية لمنع الإصابة مرة أخرى.
التمارين الرياضية\(\PageIndex{1}\)
- لماذا تعتبر عدوى الفطريات العصبية نادرة في عموم السكان؟
- كيف يتم الحصول على عدوى المكورات الخفية؟
نيوروميكوسيس
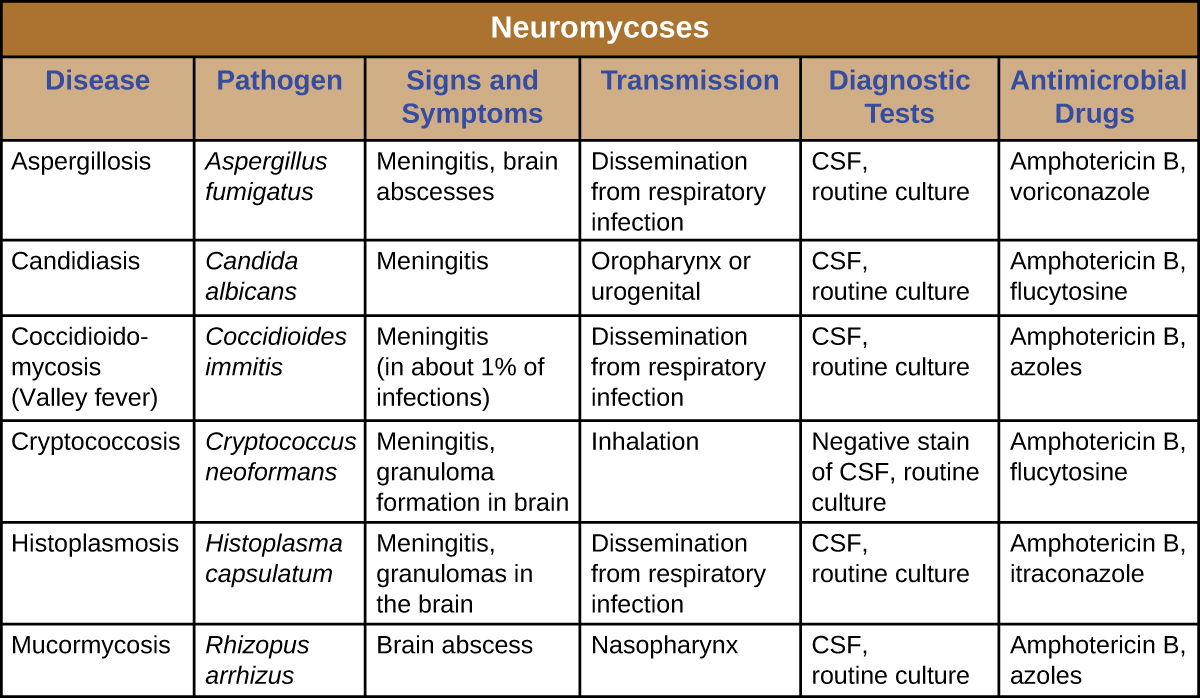
عادةً ما تحدث الفطريات العصبية فقط في الأفراد الذين يعانون من نقص المناعة وعادة ما تغزو الجهاز العصبي فقط بعد إصابة جهاز جسم مختلف لأول مرة. على هذا النحو، تمت مناقشة العديد من الأمراض التي تؤثر أحيانًا على الجهاز العصبي في الفصول السابقة. \(\PageIndex{2}\)يعرض الشكل بعض الالتهابات الفطرية الأكثر شيوعًا المرتبطة بالأمراض العصبية. يتضمن هذا الجدول فقط الجوانب العصبية المرتبطة بهذه الأمراض؛ ولا يتضمن الخصائص المرتبطة بأنظمة الجسم الأخرى.
التركيز السريري: القرار
أثبتت وصفة ديفيد الجديدة لدواءين مضادين للفطريات، الأمفوتريسين B والفلوسيتوزين، فعاليتها، وبدأت حالته في التحسن. أكدت نتائج الزرع من عينات البلغم والجلد والسائل النخاعي لديفيد وجود عدوى فطرية. كانت جميعها إيجابية بالنسبة لـ C. neoformans. كانت الاختبارات المصلية لأنسجته إيجابية أيضًا لمستضد السكاريد الكبسوري C. neoformans.
نظرًا لأنه من المعروف أن C. neoformans تحدث في فضلات الطيور، فمن المحتمل أن يكون ديفيد قد تعرض للفطر أثناء العمل في الحظيرة. على الرغم من هذا التعرض، أوضح له طبيب ديفيد أن الأشخاص ذوي الكفاءة المناعية نادرًا ما يصابون بالتهاب السحايا بالمكورات الخفية وأنه من المحتمل أن يكون جهاز المناعة لديه قد تعرض للخطر بسبب الأدوية المضادة للالتهابات التي كان يتناولها لعلاج مرض كرون. ومع ذلك، لاستبعاد الأسباب المحتملة الأخرى لنقص المناعة، أوصى طبيب ديفيد بإجراء اختبار لفيروس نقص المناعة البشرية.
بعد أن كانت نتيجة اختبار ديفيد سلبية لفيروس نقص المناعة البشرية، قام طبيبه بإزالته من الكورتيكوستيرويد الذي كان يستخدمه لإدارة مرض كرون، واستبدله بفئة مختلفة من الأدوية. بعد عدة أسابيع من العلاجات المضادة للفطريات، تمكن ديفيد من الشفاء التام.
التهاب السحايا الأميبي
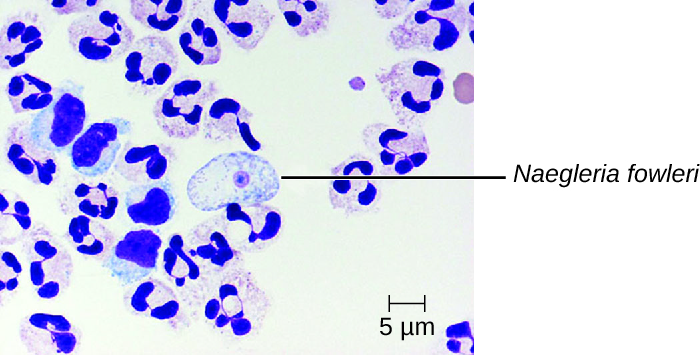
يحدث التهاب السحايا والدماغ الأميبي الأولي (PAM) بسبب نيجليريا فاوليري. عادة ما توجد هذه الأميبوفلاجيلات التي تعيش بحرية في التربة والمياه. يمكن أن يوجد في أحد الأشكال الثلاثة - شكل التروفوزويت الأميبي المعدي، وشكل السوط المتحرك، وشكل الكيس المريح. PAM هو مرض نادر يرتبط بالشباب والأفراد الأصحاء. عادة ما يصاب الأفراد بالأميبا أثناء السباحة في أجسام دافئة من المياه العذبة مثل الأنهار والبحيرات والينابيع الساخنة. يصيب التروفوزويت المُمرض الدماغ عن طريق الدخول في البداية عبر الممرات الأنفية إلى الجيوب الأنفية؛ ثم ينتقل إلى أسفل الألياف العصبية الشمية لاختراق الضفيرة العصبية تحت المخاطية، ويغزو الصفيحة المصغرية، ويصل إلى الفضاء تحت العنكبوتي. الفضاء تحت العنكبوتي شديد الأوعية الدموية وهو طريق لنشر التروفوزويت إلى مناطق أخرى من الجهاز العصبي المركزي، بما في ذلك الدماغ (الشكل\(\PageIndex{3}\)). يؤدي التهاب وتدمير المادة الرمادية إلى صداع شديد وحمى. في غضون أيام، يحدث الارتباك والتشنجات ويتطور سريعًا إلى النوبات والغيبوبة والموت. يمكن أن يكون التقدم سريعًا جدًا، وغالبًا ما لا يتم تشخيص المرض حتى تشريح الجثة.
يمكن تأكيد عدوى N. fowleri من خلال الملاحظة المباشرة لـ CSF؛ غالبًا ما يمكن رؤية الأميبات تتحرك أثناء مشاهدة حامل السائل النخاعي الرطب الجديد من خلال المجهر. يمكن أيضًا العثور على النماذج ذات الجلد أحيانًا في CSF. يمكن تلطيخ الأميبات بعدة بقع لتحديد الهوية، بما في ذلك Giemsa-Wright أو بقعة الترايكروم المعدلة. يمكن استخدام الكشف عن المستضدات باستخدام الفلورة المناعية غير المباشرة، أو التحليل الجيني باستخدام PCR، لتأكيد التشخيص الأولي. تكون عدوى N. fowleri قاتلة دائمًا تقريبًا؛ فقد نجا 3 فقط من 138 مريضًا مصابًا بـ PAM في الولايات المتحدة. 1 يُظهر دواء تجريبي جديد يسمى miltefosine بعض الأمل في علاج هذه العدوى. هذا الدواء هو مشتق من فوسفوتيدل كولين يعتقد أنه يمنع وظيفة الغشاء في N. fowleri، مما يؤدي إلى موت الخلايا المبرمج واضطراب مسارات إشارات الخلايا التي تعتمد على الدهون. 2 عند تناوله في وقت مبكر من الإصابة ويقترن بانخفاض حرارة الجسم العلاجي (خفض درجة حرارة الجسم الأساسية لتقليل الوذمة الدماغية المرتبطة بالعدوى)، تم استخدام هذا الدواء بنجاح لعلاج التهاب الدماغ الأميبي الأولي.
التهاب الدماغ الأميبي الحبيبي
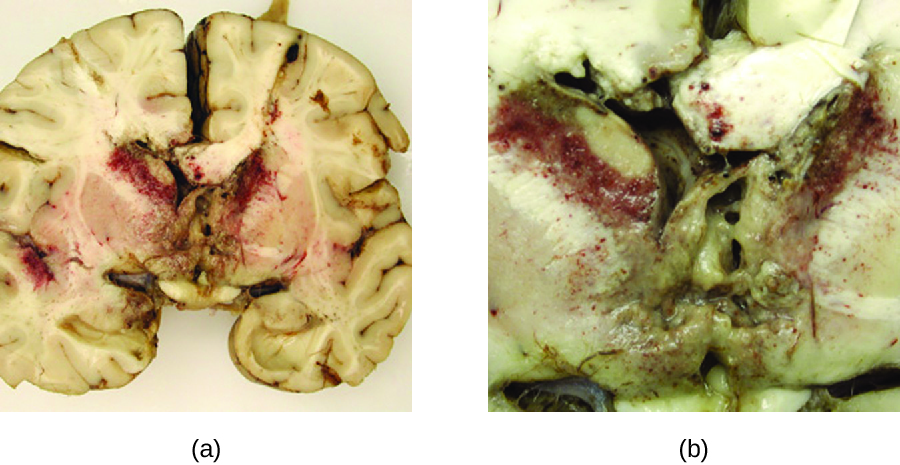
أنواع Acanthamoeba و Balamuthia هي أميبات تعيش بحرية وتوجد في العديد من المسطحات المائية العذبة. حالات العدوى البشرية بهذه الأميبات نادرة. ومع ذلك، يمكن أن تسبب التهاب القرنية الأميبي لدى مرتدي العدسات اللاصقة (انظر التهابات العين الطفيلية والديدانية)، والعدوى المنتشرة في المرضى الذين يعانون من نقص المناعة، والتهاب الدماغ الأميبي الحبيبي (GAE) في الحالات الشديدة. بالمقارنة مع PAM، تميل GAE إلى أن تكون عدوى دون حادة. يُعتقد أن الميكروب يدخل إما من خلال الجيوب الأنفية أو الشقوق في الجلد. يتم نشره بشكل دموي ويمكن أن يغزو الجهاز العصبي المركزي. هناك، تؤدي العدوى إلى الالتهاب وتشكيل الآفات وتطور الأعراض العصبية النموذجية لالتهاب الدماغ (الشكل\(\PageIndex{4}\)). دائمًا ما تكون GAE قاتلة.
غالبًا ما لا يتم تشخيص GAE حتى وقت متأخر من الإصابة. يمكن اكتشاف الآفات الناجمة عن العدوى باستخدام الأشعة المقطعية أو التصوير بالرنين المغناطيسي. يمكن اكتشاف الأميبات الحية مباشرة في CSF أو خزعات الأنسجة. تتوفر الاختبارات المصلية ولكنها ليست ضرورية بشكل عام لإجراء التشخيص الصحيح، لأن وجود الكائن الحي في CSF أمر نهائي. تم استخدام بعض الأدوية المضادة للفطريات، مثل الفلوكونازول، لعلاج التهابات الأكانثامويبل. بالإضافة إلى ذلك، تم مؤخرًا استخدام مزيج من الميلتفوزين والفوريكونازول (مثبط للتخليق الحيوي للإرغوستيرول) لعلاج GAE بنجاح. ولكن حتى مع العلاج، فإن معدل وفيات المرضى الذين يعانون من هذه العدوى مرتفع.
التمارين الرياضية\(\PageIndex{2}\)
كيف يتم تشخيص التهاب الدماغ الأميبي الحبيبي؟
داء المثقبيات الأفريقي البشري
داء المثقبيات الأفريقي البشري (المعروف أيضًا باسم مرض النوم الأفريقي) هو مرض خطير مستوطن في منطقتين متميزتين في أفريقيا جنوب الصحراء الكبرى. يحدث هذا المرض بسبب داء المثقبيات البروسي الذي تنقله الحشرات. يتسبب النوع الفرعي المثقبيات البروسي الروديسي في داء المثقبيات في شرق إفريقيا (EAT)، وهناك نوع فرعي آخر، وهو المثقبيات البروسي الغامبي، يسبب داء المثقبيات في غرب إفريقيا (WAT). يتم الإبلاغ حاليًا عن بضع مئات من حالات EAT كل عام. يتم الإبلاغ عن 3 WAT بشكل أكثر شيوعًا ويميل إلى أن يكون مرضًا مزمنًا. يتم تحديد حوالي 7000 إلى 10000 حالة جديدة من WAT كل عام. 4
تنتقل بكتيريا T. brucei في المقام الأول إلى البشر عن طريق لدغة ذبابة التسي تسي (Glossina spp.). بعد وقت قصير من لدغة ذبابة التسي تسي، تتشكل قرحة في موقع الإصابة. ثم انتشرت السوط وانتقلت إلى الدورة الدموية (الشكل\(\PageIndex{5}\)). تؤدي هذه العدوى الجهازية إلى حمى متموجة، تستمر خلالها الأعراض لمدة يومين أو ثلاثة أيام مع فترات توقف لمدة أسبوع تقريبًا بين النوبات. عندما يدخل المرض مرحلته النهائية، تنتقل مسببات الأمراض من الأوعية اللمفاوية إلى الجهاز العصبي المركزي. تشمل الأعراض العصبية النعاس أثناء النهار والأرق والتدهور العقلي. في EAT، يستمر المرض في مجراه على مدى أسابيع إلى شهور. في المقابل، غالبًا ما يحدث WAT على مدى أشهر إلى سنوات.
على الرغم من وجود استجابة مناعية قوية ضد المثقبيات، إلا أنها لا تكفي للقضاء على العامل الممرض. من خلال التباين المستضدي، يمكن للمثقبيات تغيير البروتينات السطحية إلى أكثر من 100 نوع مصلي. يؤدي هذا الاختلاف إلى الشكل المتموج للمرض الأولي. يؤدي التسمم الأولي الناجم عن العدوى إلى ارتفاع درجة الحرارة. عندما يستجيب الجهاز المناعي للعدوى، ينخفض عدد الكائنات الحية، وتنخفض الأعراض السريرية. ومع ذلك، تقوم مجموعة فرعية من العامل الممرض بعد ذلك بتغيير مستضدات الطبقة السطحية عن طريق التباين المستضدي وتتجنب الاستجابة المناعية. تتكاثر هذه السوط بسرعة وتسبب نوبة أخرى من المرض. وفي حالة عدم علاجها، عادة ما تكون هذه العدوى قاتلة.
يمكن استخدام الأعراض السريرية للتعرف على العلامات المبكرة لداء المثقبيات الأفريقي. ويشمل ذلك تكوين قرحة في موقع الإصابة وعلامة Winterbottom. تشير علامة Winterbottom إلى تضخم الغدد الليمفاوية في الجزء الخلفي من الرقبة - مما يشير غالبًا إلى الالتهابات الدماغية. يمكن ملاحظة داء المثقبيات بشكل مباشر في العينات الملطخة بما في ذلك الدم واللمف والسائل النخاعي وخزعات الجلد من القرح من المرضى. توجد الأجسام المضادة ضد الطفيل في معظم المرضى الذين يعانون من أمراض حادة أو مزمنة. ومع ذلك، لا تُستخدم الاختبارات المصلية بشكل عام للتشخيص، نظرًا لأن الكشف المجهري للطفيلي كافٍ. التشخيص المبكر مهم للعلاج. قبل إصابة الجهاز العصبي، يمكن استخدام أدوية مثل البنتاميدين (مثبط الأيض النووي) والسورامين (الآلية غير واضحة). هذه الأدوية لها آثار جانبية أقل من الأدوية اللازمة لعلاج المرحلة الثانية من المرض. بمجرد أن تبدأ مرحلة مرض النوم، يمكن أن تكون الأدوية القوية بما في ذلك الميلارسوبرول (أحد مشتقات الزرنيخ) والإيفلورنيثين فعالة. بعد العلاج الناجح، لا يزال المرضى بحاجة إلى إجراء فحوصات متابعة لـ CSF لمدة عامين للكشف عن الانتكاسات المحتملة للمرض. أكثر الوسائل فعالية للوقاية من هذه الأمراض هي السيطرة على مجموعات ناقلات الحشرات.
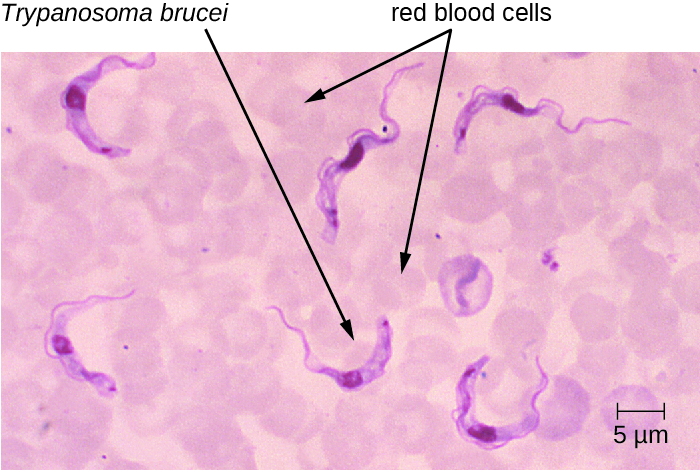
التمارين الرياضية\(\PageIndex{3}\)
- ما هي أعراض عدوى المثقبية الجهازية؟
- ما هي أعراض عدوى التريبانوزوما العصبية؟
- لماذا يصعب القضاء على عدوى المثقبيات؟
داء المقوسات العصبية
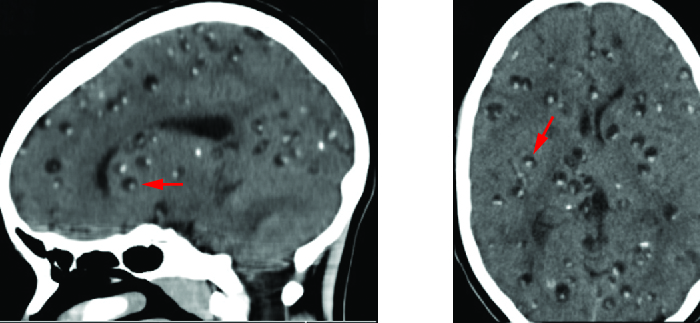
التوكسوبلازما جوندي هو طفيلي موجود في كل مكان داخل الخلايا يمكن أن يسبب التهابات حديثي الولادة. القطط هي المضيف النهائي، ويمكن أن يصاب البشر بعد تناول اللحوم المصابة أو، بشكل أكثر شيوعًا، عن طريق تناول البويضات الموجودة في براز القطط (انظر الالتهابات الطفيلية في الدورة الدموية والجهاز اللمفاوي). يدخل T. gondii الجهاز الدوري بالمرور بين الخلايا البطانية للأوعية الدموية. 5 معظم حالات داء المقوسات تكون بدون أعراض. ومع ذلك، في المرضى الذين يعانون من نقص المناعة، يعد داء المقوسات العصبية الناجم عن عدوى T. gondii أحد الأسباب الأكثر شيوعًا لخراجات الدماغ. 6 يستطيع الكائن الحي عبور الحاجز الدموي الدماغي عن طريق إصابة الخلايا البطانية للشعيرات الدموية في الدماغ. يتكاثر الطفيل داخل هذه الخلايا، وهي خطوة تبدو ضرورية للدخول إلى الدماغ، ثم تتسبب في تحلل الخلية البطانية، مما يؤدي إلى إطلاق النسل في أنسجة المخ. تختلف هذه الآلية تمامًا عن الطريقة التي تستخدمها لدخول مجرى الدم في المقام الأول. 7
يمكن الكشف عن آفات الدماغ المرتبطة بداء المقوسات العصبية بالأشعة باستخدام التصوير بالرنين المغناطيسي أو التصوير المقطعي (الشكل\(\PageIndex{6}\)). يمكن تأكيد التشخيص من خلال الملاحظة المباشرة للكائن الحي في CSF. يمكن أيضًا استخدام فحوصات RT-PCR للكشف عن T. gondii من خلال العلامات الجينية.
يتطلب علاج داء المقوسات العصبية الناجم عن عدوى T. gondii ستة أسابيع من العلاج متعدد الأدوية باستخدام البيريميثامين والسلفاديازين وحمض الفولينك. غالبًا ما تكون جرعات الصيانة طويلة المدى مطلوبة لمنع التكرار.
التمارين الرياضية\(\PageIndex{4}\)
- تحت أي ظروف تكون عدوى التوكسوبلازما خطيرة؟
- كيف تتحايل التوكسوبلازما على الحاجز الدموي الدماغي؟
نيوروسيستيسركوسيس
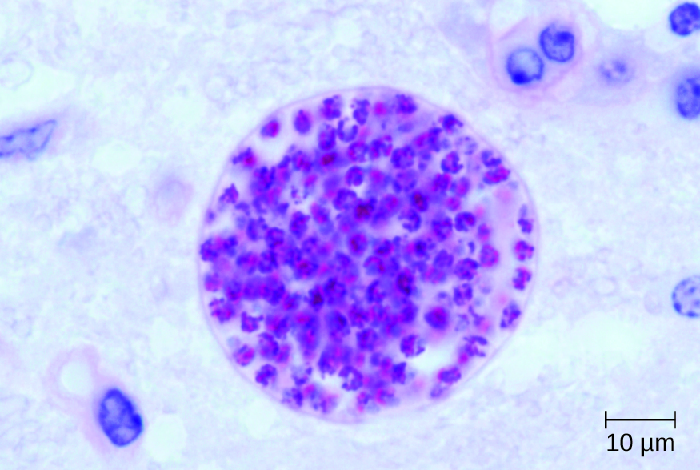
داء الكيسات المذنبة هو عدوى طفيلية ناتجة عن الشكل اليرقي للدودة الشريطية في لحم الخنزير، Taenia solium. عندما تغزو اليرقات الدماغ والحبل الشوكي، يُشار إلى الحالة باسم نيوروسيستيسركوسيس. تؤثر هذه الحالة على ملايين الأشخاص حول العالم وهي السبب الرئيسي للصرع الذي يبدأ عند البالغين في العالم النامي. 8
تمت مناقشة دورة حياة T. solium في العدوى الديدانية في الجهاز الهضمي. بعد الابتلاع، يفقس البيض في الأمعاء لتكوين يرقات تسمى cysticerci. تتكون الديدان الشريطية البالغة في الأمعاء الدقيقة وتنتج بيضًا يتم إلقاؤه في البراز. يمكن أن تصيب هذه البويضات أفرادًا آخرين من خلال التلوث البرازي للطعام أو الأسطح الأخرى. يمكن أن يفقس البيض أيضًا داخل أمعاء المريض الأصلي ويؤدي إلى عدوى ذاتية مستمرة. يمكن أن يهاجر عنق الرحم إلى الدم ويغزو العديد من الأنسجة في الجسم، بما في ذلك الجهاز العصبي المركزي.
عادة ما يتم تشخيص داء الكيسات المذنبة العصبية من خلال تقنيات غير جراحية. يمكن استخدام المعلومات الوبائية كشاشة أولية؛ داء الكيسات المذنبة متوطن في أمريكا الوسطى والجنوبية وأفريقيا وآسيا. التصوير الإشعاعي (التصوير بالرنين المغناطيسي والتصوير المقطعي المحوسب) هو الطريقة الأساسية المستخدمة لتشخيص داء الكيسات المذنبة العصبية؛ يمكن استخدام التصوير للكشف عن الخراجات التي يتراوح طولها من سنتيمتر واحد إلى سنتيمترين والتي تتشكل حول الطفيليات (الشكل\(\PageIndex{7}\)). يمكن أن تشير المستويات المرتفعة من اليوزينيات في الدم أيضًا إلى عدوى طفيلية. تستخدم EIA و ELISA أيضًا للكشف عن المستضدات المرتبطة بمسببات الأمراض.
يعتمد علاج داء الكيسات المذنبة العصبي على موقع الكيسات المذنبة وعددها وحجمها ومرحلتها. يشمل العلاج الكيميائي المضاد للديدان ألبيندازول والبرازيكوانتيل. نظرًا لأن هذه الأدوية تقتل الخراجات القابلة للحياة، فإنها قد تزيد الأعراض بشكل حاد عن طريق إثارة استجابة التهابية ناتجة عن إطلاق مستضدات Taenia cysticerci، حيث يتم تدمير الأكياس بواسطة الأدوية. للتخفيف من هذه الاستجابة، يمكن استخدام الكورتيكوستيرويدات التي تعبر الحاجز الدموي الدماغي (مثل ديكساميثازون) للتخفيف من هذه الآثار. قد يكون التدخل الجراحي مطلوبًا لإزالة الخراجات داخل البطين.
الأمراض الطفيلية للجهاز العصبي
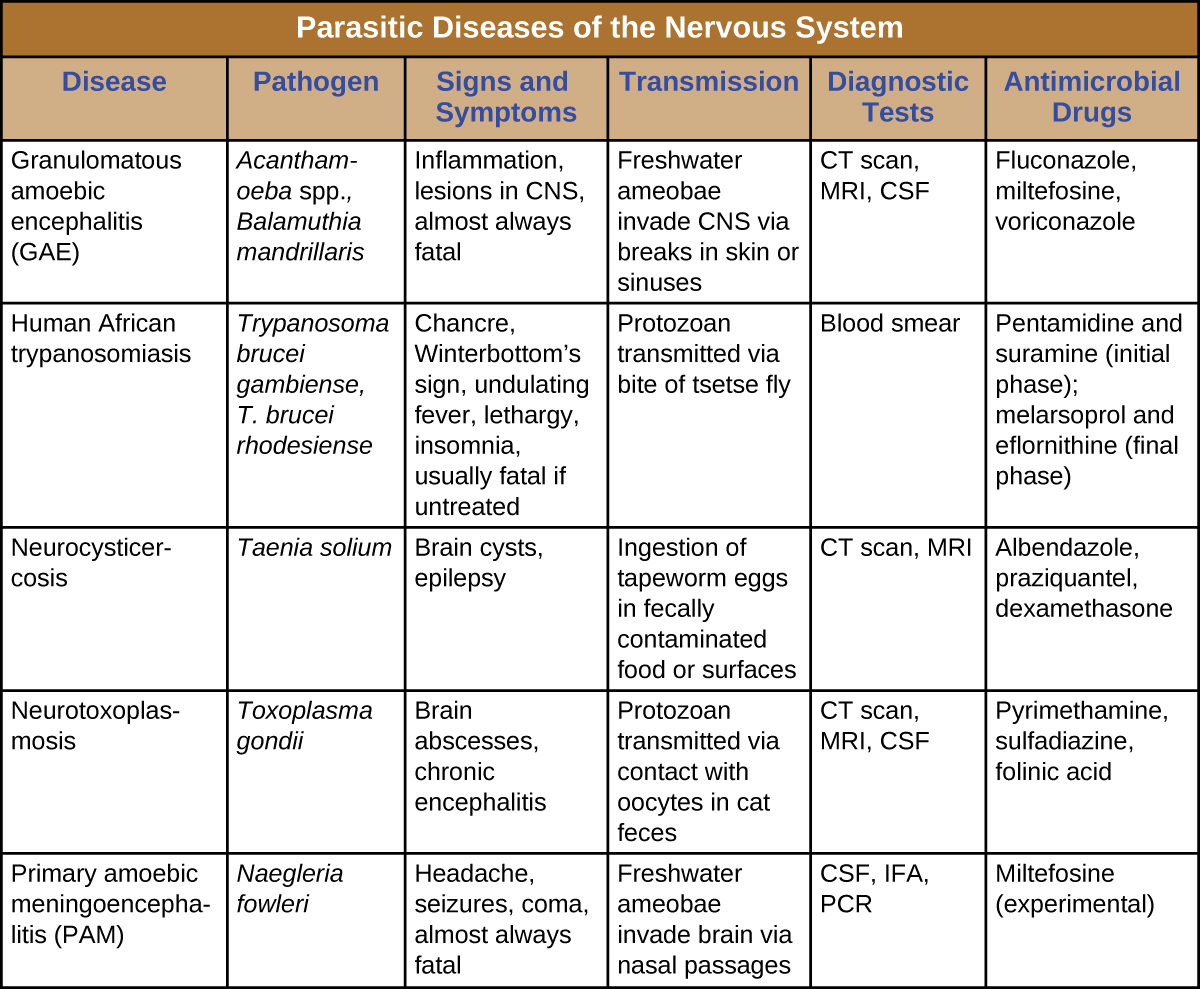
يمكن أن تسبب الطفيليات التي تغزو الجهاز العصبي بنجاح مجموعة واسعة من العلامات والأعراض العصبية. غالبًا ما تسبب آفات يمكن تصورها من خلال التصوير الإشعاعي. عدد من هذه الإصابات قاتلة، ولكن يمكن علاج بعضها (بمستويات متفاوتة من النجاح) بالأدوية المضادة للميكروبات (الشكل\(\PageIndex{8}\)).
التمارين الرياضية\(\PageIndex{5}\)
- ما الحالة العصبية المرتبطة بداء الكيسات المذنبة العصبية؟
- كيف يتم تشخيص نيوروسيستيسركوسيس؟
المفاهيم الأساسية والملخص
- تعتبر الفطريات العصبية غير شائعة في الأشخاص ذوي الكفاءة المناعية، ولكن الأفراد الذين يعانون من نقص المناعة والذين يعانون من الالتهابات الفطرية لديهم معدلات وفيات عالية. يتطلب علاج الفطريات العصبية علاجًا مطولًا بالأدوية المضادة للفطريات بجرعات منخفضة لتجنب الآثار الجانبية والتغلب على تأثير الحاجز الدموي الدماغي.
- تكون بعض حالات عدوى البروستاتا في الجهاز العصبي قاتلة إذا لم يتم علاجها، بما في ذلك التهاب السحايا الأميبي الأولي والتهاب الدماغ الأميبي الحبيبي وداء المثقبيات الأفريقي البشري وداء المقوسات العصبية.
- عادةً ما تكون الأشكال المختلفة من التهاب الدماغ الأميبي الناجم عن الالتهابات الأميبية المختلفة قاتلة حتى مع العلاج، ولكنها نادرة.
- داء المثقبيات الأفريقي هو مرض خطير ولكنه قابل للعلاج مستوطن في منطقتين متميزتين في أفريقيا جنوب الصحراء الكبرى بسبب المثقبيات البروسية التي تنقلها الحشرات.
- يتم علاج Neurocysticercosis باستخدام الأدوية المضادة للديدان أو الجراحة لإزالة الخراجات الكبيرة من الجهاز العصبي المركزي.
الحواشي
- 1 المراكز الأمريكية لمكافحة الأمراض والوقاية منها، «Naegleria fowleri - التهاب السحايا الأميبي الأولي (PAM) - التهاب الدماغ الأميبي،» 2016. تم الوصول إليه في 30 يونيو 2016. http://www.cdc.gov/parasites/naegleria/treatment.html.
- (2) دورلو، وتوماس بي سي، ومانيكا بالاسيغارام، وجوس إتش بيجنن، وبيتر جيه دي فريس، «ميلتفوسين: مراجعة لخصائصه الدوائية وفعاليته العلاجية في علاج داء الليشمانيات»، مجلة العلاج الكيميائي المضاد للميكروبات 67، رقم 11 (2012): 2576-97.
- 3 مراكز أمريكية لمكافحة الأمراض والوقاية منها، «الطفيليات - داء المثقبيات الأفريقي (المعروف أيضًا باسم مرض النوم)، الأسئلة الشائعة حول داء المثقبيات في شرق إفريقيا»، 2012. تم الوصول إليه في 30 يونيو 2016. www.cdc.gov/parasites/sleepin... faqs-east.html.
- 4 مراكز أمريكية لمكافحة الأمراض والوقاية منها، «الطفيليات - داء المثقبيات الأفريقي (المعروف أيضًا باسم مرض النوم)، علم الأوبئة وعوامل الخطر»، 2012. تم الوصول إليه في 30 يونيو 2016. www.cdc.gov/parasites/sleepin... kness/epi.html.
- (5) كاروثرز، فيرن بي، وياسوهيرو سوزوكي، «آثار عدوى التوكسوبلازما غوندي على الدماغ»، نشرة الفصام 33، رقم 3 (2007): 745-51.
- 6 أوبول، جولشان، «داء المقوسات في الجهاز العصبي المركزي في فيروس نقص المناعة البشرية»، 2015. تم الوصول إليه في 30 يونيو 2016. emedicine.medscape.com/articl... 98-نظرة عامة #a3.
- 7 كونرادت، كريستوف، نوريكيو أوينو، ديفيد أ. كريستيان، جوناثان إتش ديلونج، جريتشن هارمز بريتشارد، ياسمين هيرز، ديفيد جيه بزيك وآخرون، «الخلايا البطانية هي مكانة تكرارية لدخول التوكسوبلازما جوندي إلى الجهاز العصبي المركزي»، علم الأحياء الدقيقة الطبيعة 1 (2016): 16001.
- 8 ديجورجيو، كريستوفر م.، ماركو تي ميدينا، رينا دورون، تشي زي، وسوزان بيتش إسكويتا، «نيوروسيستيسركوسيس»، تيارات الصرع 4، رقم 3 (2004): 107-11.


