26.2: الأمراض البكتيرية للجهاز العصبي
- Page ID
- 195256
أهداف التعلم
- حدد البكتيريا الأكثر شيوعًا التي يمكن أن تسبب التهابات الجهاز العصبي
- قارن الخصائص الرئيسية لأمراض بكتيرية محددة تؤثر على الجهاز العصبي
العدوى البكتيرية التي تؤثر على الجهاز العصبي خطيرة ويمكن أن تكون مهددة للحياة. لحسن الحظ، لا يوجد سوى عدد قليل من الأنواع البكتيرية المرتبطة عادة بالتهابات الأعصاب.
التهاب السحايا البكتيري
يعد التهاب السحايا البكتيري أحد أخطر أشكال التهاب السحايا. غالبًا ما تتمكن البكتيريا التي تسبب التهاب السحايا من الوصول إلى الجهاز العصبي المركزي من خلال مجرى الدم بعد الصدمة أو نتيجة عمل السموم البكتيرية. قد تنتشر البكتيريا أيضًا من الهياكل الموجودة في الجهاز التنفسي العلوي، مثل البلعوم الفموي والبلعوم الأنفي والجيوب الأنفية والأذن الوسطى. المرضى الذين يعانون من جروح في الرأس أو غرسات القوقعة (جهاز إلكتروني يوضع في الأذن الداخلية) معرضون أيضًا لخطر الإصابة بالتهاب السحايا.
توجد العديد من البكتيريا التي يمكن أن تسبب التهاب السحايا بشكل شائع في الأشخاص الأصحاء. الأسباب الأكثر شيوعًا لالتهاب السحايا الجرثومي غير الوليدي هي النيسرية السحائية والمكورات العقدية الرئوية والمستدمية النزلية. تنتشر جميع مسببات الأمراض البكتيرية الثلاثة هذه من شخص لآخر عن طريق إفرازات الجهاز التنفسي. يمكن لكل منهما استعمار الأغشية المخاطية للبلعوم الفموي والبلعوم الأنفي وعبورها والدخول إلى الدم. بمجرد دخول الدم، يمكن لمسببات الأمراض هذه أن تنتشر في جميع أنحاء الجسم وتكون قادرة على إحداث العدوى وإحداث الالتهاب في أي موقع من مواقع الجسم، بما في ذلك السحايا (الشكل\(\PageIndex{1}\)). وبدون العلاج الجهازي المناسب المضاد للبكتيريا، يمكن أن يصل معدل الإماتة في الحالات إلى 70%، وقد يُصاب 20% من هؤلاء الناجين بتلف عصبي لا رجعة فيه أو تدمير الأنسجة، مما يؤدي إلى فقدان السمع أو الإعاقة العصبية أو فقدان أحد الأطراف. معدلات الوفيات أقل بكثير (منخفضة تصل إلى 15٪) في المجموعات السكانية التي تتوفر فيها الأدوية العلاجية واللقاحات الوقائية المناسبة. 1
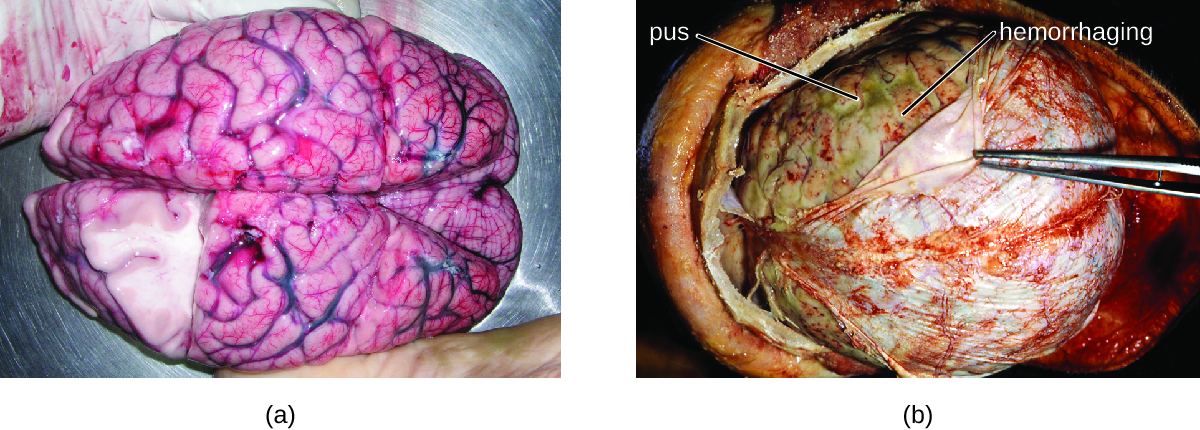
هناك مجموعة متنوعة من البكتيريا الأخرى، بما في ذلك الليستيريا أحادية الخلايا والإشريكية القولونية، قادرة أيضًا على التسبب في التهاب السحايا. تسبب هذه البكتيريا التهابات في الأم العنكبوتية و CSF بعد انتشارها عبر الدورة الدموية أو عن طريق الانتشار من عدوى الجيوب الأنفية أو البلعوم الأنفي. يمكن للمكورات العقدية، الموجودة بشكل شائع في الميكروبات في المهبل والجهاز الهضمي، أن تسبب أيضًا التهاب السحايا البكتيري عند الأطفال حديثي الولادة بعد انتقالها من الأم إما قبل الولادة أو أثناءها.
يمكن أن يؤدي الالتهاب العميق الذي تسببه هذه الميكروبات إلى أعراض مبكرة تشمل الصداع الشديد والحمى والارتباك والغثيان والقيء ورهاب الضوء وتيبس الرقبة. يمكن أن تؤدي الاستجابات الالتهابية الجهازية المرتبطة ببعض أنواع التهاب السحايا البكتيري إلى نزيف وآفات قيحية على الجلد، تليها حالات أكثر حدة تشمل الصدمة والتشنجات والغيبوبة والوفاة - في بعض الحالات، في غضون ساعات قليلة فقط.
من الأفضل تأكيد تشخيص التهاب السحايا البكتيري من خلال تحليل السائل النخاعي الذي تم الحصول عليه عن طريق البزل القطني. < 45 mg/dL), and protein (>تشير المستويات غير الطبيعية من العدلات متعددة الأشكال (PMNs) (> 10 PMnS/mm 3) والجلوكوز (45 ملغم/ديسيلتر) في CSF إلى التهاب السحايا الجرثومي. 2 يتم تفصيل خصائص أشكال محددة من التهاب السحايا البكتيري في الأقسام الفرعية التالية.
التهاب السحايا السحائي
التهاب السحايا بالمكورات السحائية هو عدوى خطيرة تسببها المكورات السالبة الجرام N. meningitidis. في بعض الحالات، يمكن أن تحدث الوفاة في غضون ساعات قليلة من ظهور الأعراض. يمكن أن تؤدي الحالات غير المميتة إلى تلف الأعصاب بشكل لا رجعة فيه، مما يؤدي إلى فقدان السمع وتلف الدماغ، أو بتر الأطراف بسبب نخر الأنسجة.
يمكن أن يصيب التهاب السحايا بالمكورات السحائية الأشخاص في أي عمر، ولكن انتشاره أعلى بين الرضع والمراهقين والشباب. 3 كان التهاب السحايا بالمكورات السحائية في يوم من الأيام السبب الأكثر شيوعًا لأوبئة التهاب السحايا بين البشر. لا يزال هذا هو الحال في منطقة أفريقيا جنوب الصحراء المعروفة باسم حزام التهاب السحايا، ولكن أوبئة التهاب السحايا بالمكورات السحائية أصبحت نادرة في معظم المناطق الأخرى، وذلك بفضل لقاحات المكورات السحائية. ومع ذلك، لا يزال من الممكن حدوث تفشي المرض في المجتمعات والمدارس والكليات والسجون وغيرها من السكان حيث يكون الناس على اتصال مباشر وثيق.
يحتوي التهاب السحايا على تقارب كبير مع الأغشية المخاطية في البلعوم الفموي والبلعوم الأنفي. يعتبر الاتصال بالإفرازات التنفسية المحتوية على N. meningitidis طريقة فعالة لانتقال العدوى. يتم تعزيز إمراضية التهاب السحايا من خلال عوامل الضراوة التي تساهم في التقدم السريع للمرض. وتشمل هذه السموم الداخلية ذات السكاريد الشحمي (LOS)، والقليل من النوع الرابع للتعلق بالأنسجة المضيفة، وكبسولات السكاريد التي تساعد الخلايا على تجنب البلعمة والقتل بوساطة المكملات. تشمل عوامل الفوعة الإضافية بروتين IgA (الذي يكسر الأجسام المضادة لـ IgA)، وعوامل الغزو Opa و Opc والبورين (التي تسهل الدخول عبر الخلايا عبر الحاجز الدموي الدماغي)، وعوامل امتصاص الحديد (التي تجرد وحدات الهيم من الهيموجلوبين في الخلايا المضيفة وتستخدمها للنمو)، والإجهاد البروتينات التي تحمي البكتيريا من جزيئات الأكسجين التفاعلية.
من العلامات الفريدة لالتهاب السحايا بالمكورات السحائية تكوين طفح جلدي على الجلد أو الأغشية المخاطية، يتميز بآفات صغيرة حمراء ومسطحة ونزفية. هذا الطفح الجلدي، الذي يظهر بعد وقت قصير من ظهور المرض، هو استجابة للسموم الداخلية LOS وعوامل ضراوة الالتصاق التي تعطل الخلايا البطانية للشعيرات الدموية والأوردة الصغيرة في الجلد. يؤدي اضطراب الأوعية الدموية إلى تكوين جلطات دموية صغيرة، مما يؤدي إلى تسرب الدم إلى الأنسجة المحيطة. مع تقدم العدوى، تزداد مستويات عوامل الضراوة، ويمكن أن يزداد حجم الآفات النزفية مع استمرار تسرب الدم إلى الأنسجة. عادة ما تحدث الآفات التي يزيد حجمها عن 1.0 سم في المرضى الذين يصابون بالصدمة، حيث تتسبب عوامل الضراوة في زيادة النزف وتكوين الجلطة. يمكن أن يؤدي الإنتان، نتيجة للضرر الجهازي الناجم عن عوامل ضراوة المكورات السحائية، إلى الفشل السريع للأعضاء المتعددة، والصدمة، والتخثر المنتشر داخل الأوعية الدموية، والوفاة.
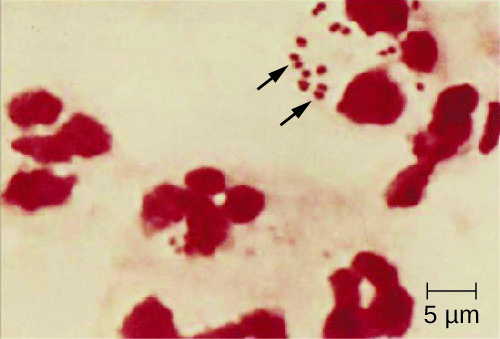
نظرًا لأن التهاب السحايا بالمكورات السحائية يتطور بسرعة كبيرة، يلزم وجود مجموعة أكبر من العينات السريرية للكشف عن التهاب السحايا في الوقت المناسب. يمكن أن تشمل العينات المطلوبة الدم، والسائل النخاعي، والمسحات الأنفية والفموية والبلعومية، ومسحات الإحليل وداخل عنق الرحم، والشفط الحبري، والخزعات. ينبغي دائماً اتباع بروتوكولات السلامة لمناولة ونقل العينات المشتبه في احتوائها على N. meningitidis، حيث إن حالات مرض المكورات السحائية القاتلة حدثت في صفوف العاملين في مجال الرعاية الصحية الذين تعرضوا للقطرات أو الأيروسولات من عينات المرضى. يمكن أن يحدث التشخيص الافتراضي الفوري لالتهاب السحايا بالمكورات السحائية عندما يتم تقييم السائل النخاعي مباشرة بواسطة بقعة الجرام، مما يكشف عن المكورات الثنائية خارج الخلايا وداخل الخلايا سالبة الجرام مع مورفولوجيا مجهرية مميزة لحبوب القهوة مرتبطة بـ PMNs (الشكل\(\PageIndex{2}\)). يمكن أيضًا تحديد الهوية مباشرة من CSF باستخدام تراص اللاتكس واختبارات التشخيص السريع الكروماتوجرافية المناعية الخاصة بالتهاب السحايا. يمكن أيضًا تحديد الأنواع باستخدام مخططات الطباعة القائمة على تسلسل الحمض النووي لبروتينات الغشاء الخارجي شديدة التغير لـ N. meningitidis، التي حلت محل الكتابة المصلية (الفرعية).
يمكن علاج عدوى المكورات السحائية بالعلاج بالمضادات الحيوية، وغالبًا ما يتم استخدام الجيل الثالث من السيفالوسبورين. ومع ذلك، نظرًا لأن النتائج يمكن أن تكون سلبية حتى مع العلاج، فإن التطعيم الوقائي هو أفضل شكل من أشكال العلاج. في عام 2010، بدأت البلدان في حزام التهاب السحايا في أفريقيا باستخدام لقاح متقارن جديد من المجموعة المصلية A للمكورات السحائية. لقد قلل هذا البرنامج بشكل كبير من عدد حالات التهاب السحايا بالمكورات السحائية من خلال منح المناعة الفردية والقطيع.
من المعروف وجود اثني عشر نوعًا مصليًا مختلفًا من التهاب السحايا. الأنماط المصلية A و B و C و W و X و Y هي الأكثر انتشارًا في جميع أنحاء العالم. يوصي مركز مكافحة الأمراض والوقاية منها (CDC) بتطعيم الأطفال الذين تتراوح أعمارهم بين 11 و 12 عامًا بجرعة واحدة من اللقاح رباعي التكافؤ الذي يحمي من الأنماط المصلية A و C و W و Y، مع جرعة معززة في سن 16. 4 يمكن إعطاء معزّز أو حقن إضافية بلقاح المكورات السحائية من المجموعة المصلية B للأفراد في البيئات عالية الخطورة (مثل تفشي الأوبئة في حرم الجامعات).
التهاب السحايا في الحرم الجامعي
يتعرض طلاب الجامعات الذين يعيشون في مساكن الطلبة أو المساكن الجماعية لخطر متزايد للإصابة بالتهاب السحايا الوبائي. من عام 2011 إلى عام 2015، كان هناك ما لا يقل عن تسعة حالات لتفشي المكورات السحائية في حرم الجامعات في الولايات المتحدة. وشملت هذه الحوادث ما مجموعه 43 طالبًا (توفي أربعة منهم). 5 على الرغم من التشخيص السريع والعلاج المكثف بمضادات الميكروبات، عانى العديد من الناجين من عمليات بتر الأطراف أو مشاكل عصبية خطيرة.
يوصى مركز مكافحة الأمراض والوقاية منها بالتطعيم الوقائي لطلاب السنة الأولى من الجامعات الذين يعيشون في مساكن الطلبة، وتغطي شركات التأمين الآن التطعيم ضد المكورات السحائية للطلاب في مساكن الكلية. فرضت بعض الكليات التطعيم بلقاح المكورات السحائية المترافق لبعض الطلاب الذين يدخلون الكلية (الشكل\(\PageIndex{3}\)).
التهاب السحايا بالمكورات الرئوية
يحدث التهاب السحايا بالمكورات الرئوية بسبب بكتيريا S. pneumoniae المغلفة ذات الجرام (المكورات الرئوية، والتي تسمى أيضًا العقدية الرئوية). يوجد هذا الكائن الحي بشكل شائع في الميكروبات في البلعوم لدى 30-70٪ من الأطفال الصغار، اعتمادًا على طريقة أخذ العينات، بينما يمكن العثور على S. pneumoniae في أقل من 5٪ من البالغين الأصحاء. على الرغم من أنه غالبًا ما يكون موجودًا بدون أعراض المرض، إلا أن هذا الميكروب يمكنه عبور الحاجز الدموي الدماغي لدى الأفراد المعرضين للإصابة. في بعض الحالات، قد يؤدي أيضًا إلى تسمم الدم. منذ إدخال لقاح Hib، أصبحت S. pneumoniae السبب الرئيسي لالتهاب السحايا لدى البشر الذين تتراوح أعمارهم بين شهرين وحتى مرحلة البلوغ.
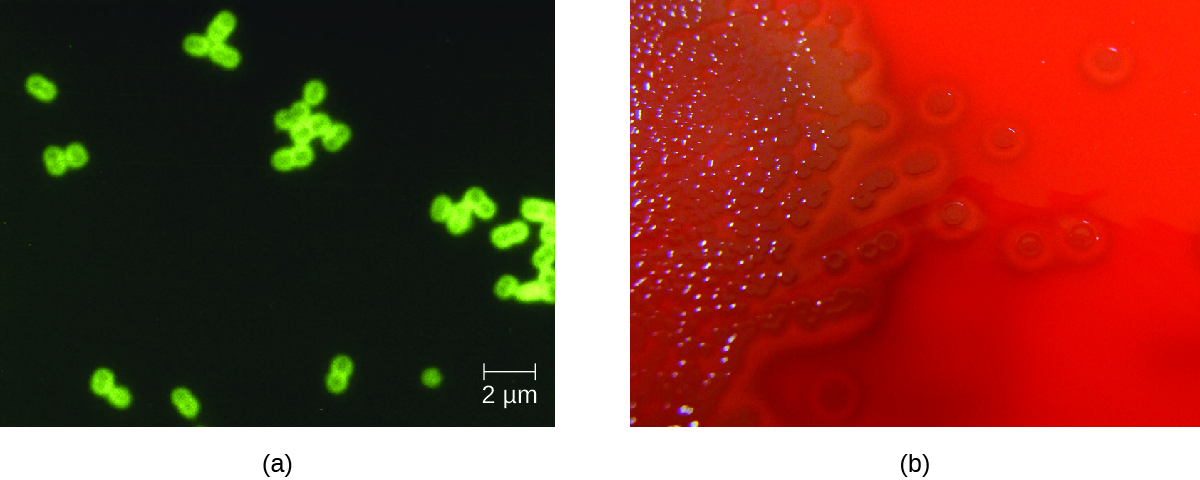
يمكن التعرف على بكتيريا المكورات الرئوية في عينات السائل النخاعي باستخدام العينات الملطخة بالجرام، والتراص اللاتكس، والتصوير الكروماتوجرافي المناعي الخاص بالمكورات الرئوية. في العينات الملطخة بالجرام، تظهر بكتيريا S. pneumoniae على شكل بكتيريا ديبلوكوسي إيجابية الجرام على شكل لانسيت (الشكل\(\PageIndex{4}\)). يمكن أيضًا تحديد S. pneumoniae باستخدام مزارع CSF والدم، ويمكن تحديد 93 نمطًا مصليًا متميزًا على الأقل استنادًا إلى تفاعل Quellung مع السكريات الكبسولة الفريدة. تتوفر أيضًا فحوصات PCR و RT-PCR لتأكيد الهوية.
تشمل عوامل الضراوة الرئيسية التي تنتجها S. pneumoniae PI-1 pilin للالتزام بالخلايا المضيفة (الالتزام بالمكورات الرئوية) وعامل الفوعة B (paVb) للارتباط بخلايا الجهاز التنفسي؛ والبروتينات الرابطة للكولين (CBPa) التي ترتبط بالخلايا الظهارية وتتداخل مع العوامل المناعية IgA و C3؛ والتوكسين البكتيري السيتوبلازمي pneumolysin الذي يؤدي إلى استجابة التهابية.
مع ظهور سلالات مقاومة للأدوية من S. pneumoniae، يُعالج التهاب السحايا بالمكورات الرئوية عادةً بالمضادات الحيوية واسعة الطيف، مثل ليفوفلوكساسين أو سيفوتاكسيم أو البنسلين أو مضادات حيوية أخرى من بيتا لاكتام. تم وصف لقاحي المكورات الرئوية المتاحين في الالتهابات البكتيرية في الجهاز التنفسي.
المستدمية النزلية من النوع ب
يعد التهاب السحايا الناجم عن النمط المصلي B (Hib)، وهو عصيات كوكوكوباسيلي مغلفة متعددة الأشكال سالبة الجرام، غير شائع الآن في معظم البلدان، بسبب استخدام لقاح Hib الفعال. بدون استخدام لقاح Hib، يمكن أن تكون H. influzae السبب الرئيسي لالتهاب السحايا لدى الأطفال الذين تتراوح أعمارهم بين شهرين و5 سنوات. يمكن العثور على H. influzae في حناجر الأفراد الأصحاء، بما في ذلك الرضع والأطفال الصغار. في سن الخامسة، طور معظم الأطفال مناعة ضد هذا الميكروب. ومع ذلك، فإن الأطفال الذين تزيد أعمارهم عن شهرين لا ينتجون استجابة واقية كافية من الأجسام المضادة وهم عرضة للإصابة بأمراض خطيرة. يؤدي الضغط داخل الجمجمة الناجم عن هذه العدوى إلى معدل وفيات بنسبة 5٪ وحدوث 20٪ من الصمم أو تلف الدماغ لدى الناجين. 6
تنتج H. influzae ما لا يقل عن 16 عاملاً مختلفًا من عوامل الضراوة، بما في ذلك LOS، الذي يسبب الالتهاب، وعامل التصاق الهيموفيلوس واختراقه (Hap)، الذي يساعد في الالتصاق وغزو الخلايا الظهارية التنفسية. تحتوي البكتيريا أيضًا على كبسولة السكاريد التي تساعدها على تجنب البلعمة، بالإضافة إلى عوامل مثل بروتياز IgA1 وبروتين P2 التي تسمح لها بتجنب الأجسام المضادة التي تفرز من الأغشية المخاطية. بالإضافة إلى ذلك، تكتسب عوامل مثل البروتين المرتبط بالهيموجلوبين (Hgp) وبروتين ربط الترانسفيرين (Tbp) الحديد من الهيموجلوبين والترانسفيرين، على التوالي، لنمو البكتيريا.
يمكن إجراء التشخيص الأولي لعدوى H. influzae عن طريق PCR المباشر ومسحة CSF. سوف تكشف المسحات الملطخة عن PMNs داخل الخلايا وخارج الخلية ذات العصيات الكوككوباسيلية الصغيرة متعددة الأشكال سالبة الجرام أو الأشكال الخيطية التي تميز H. influzae. يمكن أن يعتمد التأكيد الأولي لهذا الجنس على نموه السريع على أجار الشوكولاتة. تم تأكيد التحديد من خلال متطلبات عوامل النمو البيوكيميائية الخارجية NAD و heme (بواسطة MALDI-TOF) وتراص اللاتكس و RT-PCR.
يُعالج التهاب السحايا الناجم عن الإنفلونزا عادةً بالدوكسيسيكلين والفلوروكينولونات والجيل الثاني والثالث من السيفالوسبورين والكاربابينيمات. أفضل وسيلة للوقاية من عدوى الأنفلونزا H. هي استخدام لقاح Hib متعدد السكاريد المترافق. يوصى بأن يتلقى جميع الأطفال هذا اللقاح في عمر 2 و 4 و 6 أشهر، مع جرعة معززة نهائية في عمر 12 إلى 15 شهرًا. 7
التهاب السحايا الوليدي
S. agalactiae، المجموعة ب من المكورات العقدية (GBS)، هي بكتيريا مغلفة إيجابية الجرام وهي السبب الأكثر شيوعًا لالتهاب السحايا عند الأطفال حديثي الولادة، وهو مصطلح يشير إلى التهاب السحايا الذي يحدث عند الأطفال حتى سن 3 أشهر. 8 يمكن أن تسبب S. agalactiae أيضًا التهاب السحايا لدى الأشخاص من جميع الأعمار ويمكن العثور عليها في الميكروبات البولية التناسلية والجهاز الهضمي لحوالي 10-30٪ من البشر.
تحدث عدوى حديثي الولادة إما كمرض يبدأ مبكرًا أو متأخرًا. يُعرَّف المرض المبكر بأنه يحدث عند الرضع حتى سن 7 أيام. يصاب الرضيع في البداية بعدوى S. agalactiae أثناء الولادة، عندما يمكن نقل البكتيريا من مهبل الأم. يمكن تقليل حدوث التهاب السحايا الوليدي المبكر بشكل كبير عن طريق إعطاء المضادات الحيوية الوريدية للأم أثناء المخاض.
يحدث التهاب السحايا الوليدي المتأخر عند الرضع الذين تتراوح أعمارهم بين أسبوع واحد وثلاثة أشهر. يكون الرضع الذين يولدون لأمهات مصابات ببكتيريا S. agalactiae في الجهاز البولي التناسلي أكثر عرضة للإصابة بالتهاب السحايا المتأخر الظهور، ولكن العدوى التي تظهر في وقت متأخر يمكن أن تنتقل من مصادر أخرى غير الأم؛ وغالبًا ما يكون مصدر العدوى غير معروف. الرضع الذين يولدون قبل الأوان (قبل 37 أسبوعًا من الحمل) أو للأمهات المصابات بالحمى معرضون أيضًا لخطر أكبر للإصابة بالتهاب السحايا الوليدي في وقت متأخر.
تشمل علامات وأعراض المرض المبكر عدم استقرار درجة الحرارة، وانقطاع النفس (توقف التنفس)، وبطء القلب (بطء معدل ضربات القلب)، وانخفاض ضغط الدم، وصعوبة التغذية، والتهيج، والترهل. عند النوم، قد يكون من الصعب إيقاظ الطفل. من المرجح أن تشمل أعراض المرض المتأخر النوبات، واليافوخ المنتفخ (البقعة اللينة)، وتصلب الرقبة، والصداع النصفي (الضعف في أحد جانبي الجسم)، والأوبيثوتونو (الجسم الصلب مع تقوس الظهر والرأس للخلف).
ينتج S. agalactiae ما لا يقل عن 12 عاملاً من عوامل الضراوة التي تشمل FbSA الذي يرتبط بالبروتينات السطحية للخلية المضيفة، وبيليثات PI-1 التي تعزز غزو الخلايا البطانية البشرية، وكبسولة السكاريد التي تمنع تنشيط المسار التكميلي البديل وتمنع البلعمة، وعامل CAMP السام، الذي يشكل المسام في أغشية الخلايا المضيفة ويرتبط بالأجسام المضادة IgG و IgM.
غالبًا ما يتم تأكيد تشخيص التهاب السحايا عند الأطفال حديثي الولادة، ولكن ليس بشكل موحد، من خلال النتائج الإيجابية من ثقافات CSF أو الدم. تشمل الاختبارات الاستزراع الروتيني، والكشف عن المستضد عن طريق المقايسة المناعية الإنزيمية، والتنميط المصلي لأنواع الكبسولات المختلفة، و PCR، و RT-PCR. عادة ما يتم علاجه بالمضادات الحيوية بيتا لاكتام مثل البنسلين الوريدي أو الأمبيسلين بالإضافة إلى الجنتاميسين. حتى مع العلاج، يُلاحظ ما يقرب من 10٪ من الوفيات بين حديثي الولادة المصابين. 9
التمارين الرياضية\(\PageIndex{1}\)
- ما هي المجموعات الأكثر عرضة لكل من أمراض التهاب السحايا الجرثومي؟
- لأي من أمراض التهاب السحايا البكتيري توجد لقاحات متاحة حاليًا؟
- أي كائن حي يمكن أن يسبب التهاب السحايا الوبائي؟
الأمراض المرتبطة بالكلوستريديوم
الأنواع الموجودة في جنس Clostridium عبارة عن قضبان موجبة للجرام وتشكل أبوابًا داخلية تعمل على اللاهوائيات الإجبارية. تنتشر المسام الداخلية لـ Clostridium spp. على نطاق واسع في الطبيعة، وتوجد بشكل شائع في التربة والمياه والبراز والصرف الصحي والرواسب البحرية. ينتج Clostridium spp. أنواعًا من السموم الخارجية البروتينية أكثر من أي جنس بكتيري آخر، بما في ذلك اثنين من السموم الخارجية ذات النشاط البروتيني والتي تعد أقوى السموم البيولوجية المعروفة: توكسين البوتولينوم العصبي (BoNT) والسموم العصبية للكزاز (TENT). يحتوي هذان السمان على جرعات قاتلة تتراوح من 0.2 إلى 10 نانوغرام لكل كيلوغرام من وزن الجسم.
يمكن إنتاج BonT عن طريق سلالات فريدة من C. butyricum و C. baratii؛ ومع ذلك، فإنه يرتبط بشكل أساسي ببكتيريا C. bUTYLIUM وحالة التسمم الغذائي. يتم إنتاج الخيمة، التي تسبب التيتانوس، فقط بواسطة C. tetani. هذه السموم الخارجية العصبية القوية هي عوامل الضراوة الأساسية لمسببات الأمراض هذه. تم وصف طريقة عمل هذه السموم في عوامل ضراوة مسببات الأمراض البكتيرية والفيروسية وتم توضيحها في الشكل 15.3.7.
عادةً ما يتضمن تشخيص التيتانوس أو التسمم الغذائي المقايسات الحيوية التي تكشف عن وجود BoT و Tent في العينات البرازية أو الدم (المصل) أو الأطعمة المشتبه بها. بالإضافة إلى ذلك، يمكن عزل كل من C. botulinum و C. tetani وزراعتهما باستخدام الوسائط المتاحة تجاريًا لعلاج اللاهوائيات. تتوفر أيضًا اختبارات ELISA و RT-PCR.
الكزاز
الكزاز هو مرض غير ساري يتميز بتشنجات عضلية لا يمكن السيطرة عليها (تقلصات) ناتجة عن عمل TENT. يحدث هذا بشكل عام عندما تصيب C. tetani الجرح وتنتج Tent، الذي يرتبط بسرعة بالنسيج العصبي، مما يؤدي إلى تسمم (تسمم) الخلايا العصبية. اعتمادًا على موقع العدوى ومداها، يمكن وصف حالات الكزاز بأنها موضعية أو رأسية أو معممة. الكزاز المعمم الذي يحدث في الأطفال حديثي الولادة يسمى الكزاز الوليدي.
يحدث التيتانوس الموضعي عندما يؤثر Tent فقط على مجموعات العضلات القريبة من موقع الإصابة. لا يوجد تدخل في الجهاز العصبي المركزي، وعادة ما تكون الأعراض خفيفة، مع تشنجات عضلية موضعية ناتجة عن خلل في الخلايا العصبية المحيطة. الأفراد الذين لديهم مناعة جزئية - وخاصة الأفراد الذين تم تطعيمهم سابقًا والذين يهملون الحصول على الحقن المعززة الموصى بها - هم الأكثر عرضة للإصابة بالتيتانوس الموضعي نتيجة إصابة C. tetani بجرح ثقب.
التيتانوس الدماغي هو شكل موضعي نادر من الكزاز يرتبط عمومًا بجروح في الرأس أو الوجه. في حالات نادرة، حدث ذلك في حالات التهاب الأذن الوسطى (عدوى الأذن الوسطى). غالبًا ما يؤدي التيتانوس الرأسي إلى رؤية المرضى لصور مزدوجة، بسبب التشنجات التي تؤثر على العضلات التي تتحكم في حركة العين.
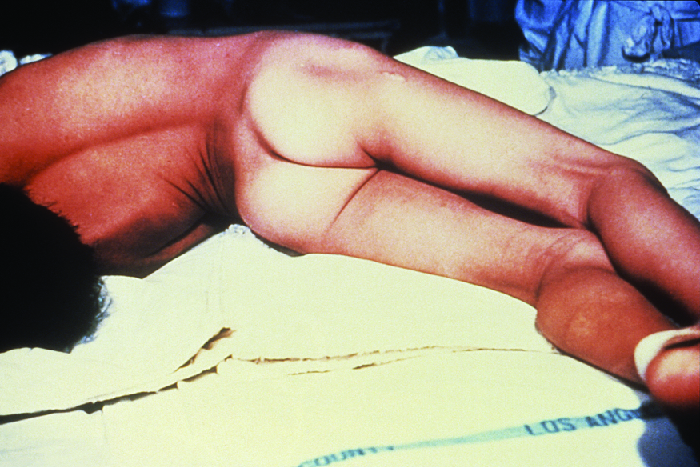
قد يتطور كل من التيتانوس الموضعي والرأسي إلى مرض الكزاز المعمم - وهي حالة أكثر خطورة بكثير - إذا كان Tent قادرًا على الانتشار بشكل أكبر في أنسجة الجسم. في حالة التيتانوس المعمم، يدخل Tent الخلايا العصبية في PNS. من هناك، تنتقل الخيمة من موقع الجرح، عادةً على طرف الجسم، عائدًا (احتياطيًا) إلى الخلايا العصبية المثبطة في الجهاز العصبي المركزي. هناك يمنع إطلاق حمض جاما أمينوبوتيريك (GABA)، الناقل العصبي المسؤول عن استرخاء العضلات. غالبًا ما تحدث التشنجات العضلية الناتجة أولاً في عضلات الفك، مما يؤدي إلى الأعراض المميزة للفك (عدم القدرة على فتح الفم). مع استمرار السم تدريجياً في منع إطلاق الناقلات العصبية، تصاب عضلات أخرى، مما يؤدي إلى تقلصات عضلية مفاجئة لا يمكن السيطرة عليها وقوية بما يكفي للتسبب في تمزق الأوتار وكسر العظام. قد تتسبب التشنجات في عضلات الرقبة والظهر والساقين في تكوين الجسم لقوس صلب وصلب، وهو وضع يسمى opisthotonos (الشكل\(\PageIndex{5}\)). تؤدي التشنجات في الحنجرة والحجاب الحاجز وعضلات الصدر إلى تقييد قدرة المريض على البلع والتنفس، مما يؤدي في النهاية إلى الوفاة بسبب الاختناق (عدم كفاية الإمداد بالأكسجين).
يحدث التيتانوس الوليدي عادةً عندما يكون جذع الحبل السري ملوثًا بجراثيم C. tetani بعد الولادة. على الرغم من أن هذه الحالة نادرة في الولايات المتحدة، إلا أن كزاز الأطفال حديثي الولادة هو السبب الرئيسي لوفيات الرضع في البلدان التي تفتقر إلى تحصين الأمهات ضد الكزاز وحيث تحدث الولادة غالبًا في ظروف غير صحية. في نهاية الأسبوع الأول من العمر، يصبح الأطفال المصابون عصبيين ويتغذون بشكل سيئ ويصابون بالصلابة مع التشنجات. إن تشخيص مرض الكزاز عند الأطفال حديثي الولادة ضعيف للغاية حيث يبلغ معدل الوفيات 70٪ - 100٪. 10
يشمل علاج مرضى التيتانوس التنفس بمساعدة التنفس من خلال استخدام جهاز التنفس الصناعي وتنقية الجروح وتوازن السوائل والعلاج بالمضادات الحيوية باستخدام الميترونيدازول أو البنسلين لوقف نمو C. tetani. بالإضافة إلى ذلك، يتم علاج المرضى بمضادات السموم Tent، ويفضل أن يكون ذلك في شكل غلوبولين مناعي بشري لتحييد السموم غير الثابتة والبنزوديازيبينات لتعزيز تأثير GABA على استرخاء العضلات والقلق.
يتوفر لقاح توكسويد التيتانوس (TT) للحماية والوقاية من التيتانوس. إنه المكون T للقاحات مثل DTaP و Tdap و Td. توصي مراكز مكافحة الأمراض والوقاية منها (CDC) الأطفال بتلقي جرعات من لقاح DTaP في عمر 2 و 4 و 6 و 15-18 شهرًا وأخرى في عمر 4-6 سنوات. يوصى بجرعة واحدة من Td للمراهقين والبالغين كمعزز TT كل 10 سنوات. 11
التسمم الوشيقي
التسمم الوشيقي هو مرض نادر ولكنه مميت في كثير من الأحيان بسبب التسمم بـ BoNT. يمكن أن يحدث ذلك إما كنتيجة للعدوى ببكتيريا C. botulinum، وفي هذه الحالة تنتج البكتيريا BoT في الجسم الحي، أو كنتيجة للإدخال المباشر لـ BoT في الأنسجة.
يمكن أن تؤدي العدوى وإنتاج BonT في الجسم الحي إلى التسمم بالجروح والتسمم الغذائي للرضع وتسمم الأمعاء عند البالغين. عادةً ما يحدث التسمم بالجروح عندما يتم إدخال المطثية البوتولينوم مباشرة إلى الجرح بعد إصابة رضحية أو جرح ثقب عميق أو موقع الحقن. ينتج التسمم الوشيقي لدى الرضع، الذي يحدث عند الرضع الذين تقل أعمارهم عن سنة واحدة، والتسمم المعوي لدى البالغين، الذي يحدث لدى البالغين الذين يعانون من نقص المناعة، عن تناول بكتيريا C. botulinum إندوسباريس في الطعام. تنبت المسام الداخلية في الجسم، مما يؤدي إلى إنتاج BoT في الأمعاء.
تحدث حالات التسمم عندما يتم إنتاج BoT خارج الجسم ثم يتم إدخاله مباشرة إلى الجسم من خلال الطعام (التسمم الغذائي المنقول بالغذاء) أو الهواء (التسمم الوشيقي بالاستنشاق) أو إجراء سريري (التسمم الغذائي غير الوراثي). يحدث التسمم الوشيقي المنقول بالغذاء، وهو أكثر هذه الأشكال شيوعًا، عندما يتم إنتاج BonT في طعام ملوث ثم يتم تناوله مع الطعام (تذكر الحالة في النقطة: A Streak of Bad Potluck). يُعد التسمم الوشيقي بالاستنشاق نادرًا لأن مادة BoT غير مستقرة كرذاذ ولا توجد في الطبيعة؛ ومع ذلك، يمكن إنتاجه في المختبر وتم استخدامه (دون جدوى) كسلاح بيولوجي من قبل الإرهابيين في اليابان في التسعينيات. كما حدثت حالات قليلة من التسمم الوشيقي بالاستنشاق العرضي. يُعد التسمم الغذائي الغذائي الوراثي نادرًا أيضًا؛ فهو مرتبط بحقن مادة BONT المستخدمة لأغراض تجميلية (انظر الروابط الدقيقة: الاستخدامات الطبية لتوكسين البوتولينوم).
عندما يدخل BoNT إلى مجرى الدم في الجهاز الهضمي أو الجرح أو الرئتين، يتم نقله إلى التقاطعات العصبية العضلية للخلايا العصبية الحركية حيث يرتبط بشكل لا رجعة فيه بالأغشية قبل المشبكية ويمنع إطلاق الأسيتيل كولين من المحطة قبل المشبكية للخلايا العصبية الحركية إلى الجهاز العصبي العضلي تقاطع. نتيجة منع إطلاق الأسيتيل كولين هي فقدان نشاط العضلات، مما يؤدي إلى استرخاء العضلات والشلل في النهاية.
إذا تم امتصاص BoNT من خلال الجهاز الهضمي، فإن الأعراض المبكرة للتسمم الغذائي تشمل عدم وضوح الرؤية، وتدلي الجفون، وصعوبة البلع، وتشنجات البطن، والغثيان، والتقيؤ، والإمساك، أو ربما الإسهال. ويتبع ذلك الشلل الرخو التدريجي والضعف التدريجي وفقدان السيطرة على العضلات. يمكن أن تكون تجربة المريض مرعبة بشكل خاص، لأن السمع يظل طبيعيًا، ولا يفقد الوعي، وهو يدرك تمامًا تطور حالته. عند الرضع، تشمل العلامات البارزة للتسمم الغذائي ضعف البكاء، وانخفاض القدرة على الرضاعة، ونقص التوتر (تعرج الرأس أو الجسم). في نهاية المطاف، ينتهي التسمم الغذائي بالموت بسبب فشل الجهاز التنفسي الناجم عن الشلل التدريجي لعضلات مجرى الهواء العلوي والحجاب الحاجز والصدر.
يُعالج التسمم الوشيقي بمضاد للسموم خاص بـ BoNT. إذا تم إعطاؤه في الوقت المناسب، فإن مضاد السموم يوقف تطور الشلل ولكنه لا يعكسه. بمجرد إعطاء مضاد السموم، سيستعيد المريض وظيفته العصبية ببطء، ولكن هذا قد يستغرق عدة أسابيع أو أشهر، اعتمادًا على شدة الحالة. خلال فترة التعافي، يجب على المرضى عمومًا البقاء في المستشفى وتلقي المساعدة في التنفس من خلال جهاز التنفس الصناعي.
التمارين الرياضية\(\PageIndex{2}\)
- كم مرة يجب تحديث التطعيم ضد الكزاز لدى البالغين؟
- ما هي الأسباب الأكثر شيوعًا للتسمم الغذائي؟
- لماذا لا يتم علاج التسمم بالمضادات الحيوية؟
الاستخدامات الطبية لتوكسين البوتولينوم
على الرغم من أنها المادة البيولوجية الأكثر سمية المعروفة للإنسان، غالبًا ما يتم حقن توكسين البوتولينوم عمدًا في الأشخاص لعلاج حالات أخرى. يستخدم توكسين البوتولينوم من النوع A بشكل تجميلي لتقليل التجاعيد. يؤدي حقن كميات دقيقة من هذا السم في الوجه إلى استرخاء عضلات الوجه، مما يمنح البشرة مظهرًا أكثر نعومة. يمكن أيضًا علاج ارتعاش الجفن والعيون المتقاطعة بحقن توكسين البوتولينوم. تشمل الاستخدامات الأخرى لهذا السم علاج فرط التعرق (التعرق الزائد). في الواقع، يمكن استخدام توكسين البوتولينوم للتخفيف من آثار العديد من الأمراض الأخرى التي تبدو غير ميكروبية والتي تنطوي على وظيفة عصبية غير مناسبة. وتشمل هذه الأمراض الشلل الدماغي والتصلب المتعدد ومرض باركنسون. كل من هذه الأمراض يتميز بفقدان السيطرة على تقلصات العضلات؛ العلاج بتوكسين البوتولينوم يعمل على إرخاء العضلات المتقلصة.
داء الليستريات
الليستيريا أحادية الخلية هي قضيب غير مغلف وغير مبيض وإيجابي الجرام وممرض منقول بالغذاء ويسبب داء الليستريات. تشمل المجموعات المعرضة للخطر النساء الحوامل والولدان وكبار السن والذين يعانون من نقص المناعة (راجع دراسات الحالة ذات التركيز السريري في النمو الميكروبي والآليات الميكروبية للإمراضية). يؤدي داء الليستريات إلى التهاب السحايا في حوالي 20٪ من الحالات، وخاصة حديثي الولادة والمرضى الذين تزيد أعمارهم عن 60 عامًا. يحدد مركز السيطرة على الأمراض والوقاية منها داء الليستريات باعتباره السبب الرئيسي الثالث للوفاة بسبب الأمراض المنقولة بالغذاء، حيث تصل معدلات الوفيات الإجمالية إلى 16٪. 12 في النساء الحوامل، يمكن أن يتسبب داء الليستريات أيضًا في الإجهاض التلقائي عند النساء الحوامل بسبب القدرة الفريدة للممرض على عبور المشيمة.
يتم إدخال L. monocytogenes بشكل عام في المواد الغذائية عن طريق التلوث بالتربة أو السماد الحيواني المستخدم كسماد. تشمل الأطعمة المرتبطة عادة بداء الليستريات الفواكه والخضروات الطازجة والخضروات المجمدة واللحوم المصنعة والجبن الطري والحليب الخام. 13 على عكس معظم مسببات الأمراض الأخرى المنقولة بالغذاء، فإن الليستيريا قادرة على النمو في درجات حرارة تتراوح بين 0 درجة مئوية و 50 درجة مئوية، وبالتالي يمكن أن تستمر في النمو، حتى في الأطعمة المبردة.
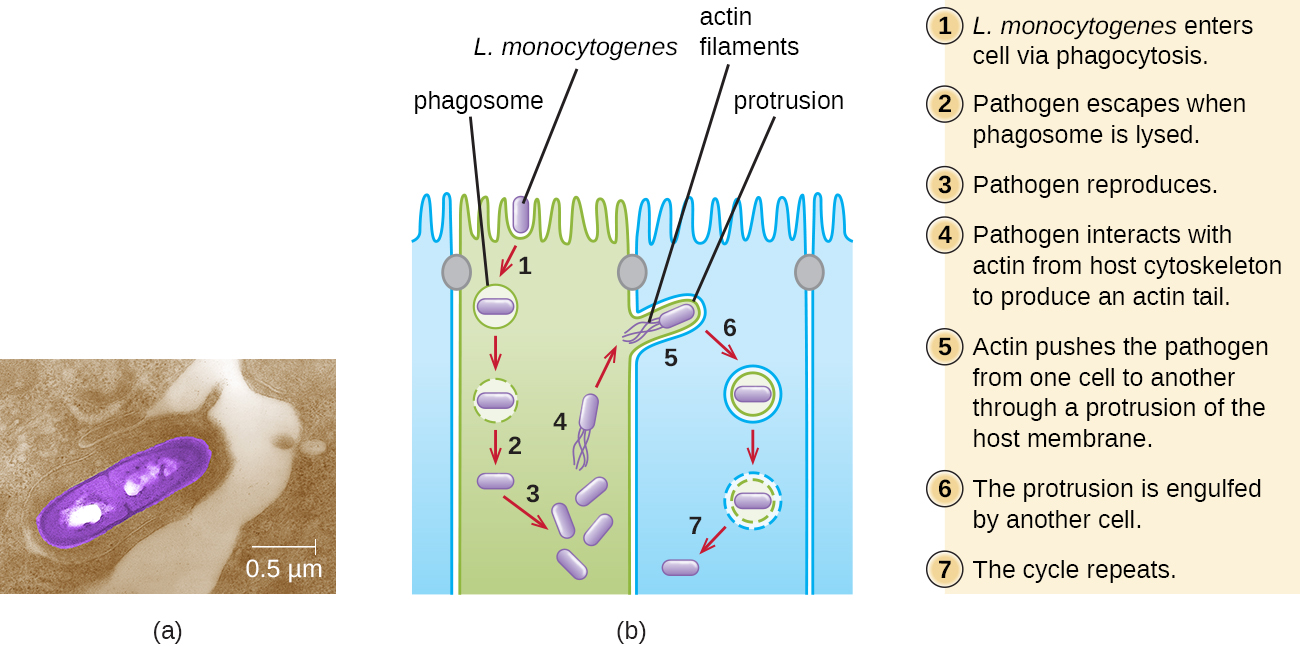
يؤدي تناول الطعام الملوث في البداية إلى إصابة الجهاز الهضمي. ومع ذلك، تنتج L. monocytogenes العديد من عوامل الضراوة الفريدة التي تسمح لها بعبور الحاجز المعوي والانتشار إلى أجهزة الجسم الأخرى. تساعد البروتينات السطحية المسماة interNalins (InLa و InLb) L. monocytogenes على غزو الخلايا والأنسجة غير البلعمية، وتخترق جدار الأمعاء وتنتشر من خلال الجهاز الدوري والجهاز اللمفاوي. تمكّن المواد الداخلية أيضًا L. monocytogenes من اختراق الحواجز المهمة الأخرى، بما في ذلك الحاجز الدموي الدماغي والمشيمة. داخل الأنسجة، تستخدم L. monocytogenes بروتينات أخرى تسمى الليستيريوليسين O و ACTA لتسهيل الحركة بين الخلايا، مما يسمح للعدوى بالانتشار من خلية إلى أخرى (الشكل\(\PageIndex{6}\)).
عادة ما يتم تحديد L. monocytogenes عن طريق زراعة عينات من موقع معقم بشكل طبيعي (مثل الدم أو CSF). يمكن تعزيز استعادة الكائنات الحية باستخدام التخصيب البارد عن طريق احتضان العينات في المرق عند 4 درجات مئوية لمدة أسبوع أو أكثر. عادةً ما يتم تمييز الأنواع والأنواع الفرعية من L. monocytogenes - وهي خطوة مهمة للتشخيص وعلم الأوبئة - باستخدام الرحلان الكهربي للهلام النبضي. يمكن أيضًا تحديد الهوية باستخدام مقايسات مسبار الحمض النووي المضيء الكيميائي و MALDI-TOF.
يشمل علاج داء الليستريات العلاج بالمضادات الحيوية، وهو الأكثر شيوعًا باستخدام الأمبيسلين والجنتاميسين. لا يوجد لقاح متاح.
التمارين الرياضية\(\PageIndex{3}\)
كيف تدخل الليستيريا الجهاز العصبي؟
مرض هانسن (الجذام)
يحدث مرض هانسن (المعروف أيضًا باسم الجذام) بسبب بكتيريا طويلة ورقيقة وخيطية على شكل قضيب Mycobacterium leprae، وهي عامل ممرض إلزامي داخل الخلايا. يتم تصنيف M. leprae على أنها بكتيريا إيجابية الجرام، ولكن من الأفضل رؤيتها مجهريًا مع بقعة ثابتة الحمض ويشار إليها عمومًا باسم البكتيريا سريعة الحموضة. يؤثر مرض هانسن على PNS، مما يؤدي إلى تلف دائم وفقدان الزوائد أو أجزاء الجسم الأخرى.
مرض هانسن مرض معدي ولكنه ليس شديد العدوى؛ ما يقرب من 95٪ من البشر لا يمكن أن يصابوا بسهولة لأن لديهم مناعة طبيعية ضد M. leprae. يحدث انتقال العدوى من شخص لآخر عن طريق استنشاق الغشاء المخاطي للأنف أو الاتصال المطول والمتكرر بالجلد المصاب. كما تورط أرماديلوس، وهو واحد من خمسة ثدييات فقط معرضة للإصابة بمرض هانسن، في انتقال بعض الحالات. 14
في جسم الإنسان، ينمو M. leprae بشكل أفضل في درجات الحرارة المنخفضة الموجودة في الأنسجة الطرفية مثل الأنف وأصابع القدم والأصابع والأذنين. توجد بعض عوامل الضراوة التي تساهم في إمراضية M. leprae على الكبسولة والجدار الخلوي للبكتيريا. تُمكّنها عوامل الضراوة هذه من الارتباط بخلايا شوان وغزوها، مما يؤدي إلى إزالة الميالين تدريجيًا مما يؤدي إلى تدمير الخلايا العصبية في PNS تدريجيًا. يؤدي فقدان وظيفة الخلايا العصبية إلى نقص الحس (التنميل) في الآفات المصابة. يتم بلع M. leprae بسهولة بواسطة البلاعم ولكنه قادر على البقاء داخل البلاعم جزئيًا عن طريق تحييد أنواع الأكسجين التفاعلية المنتجة في الانفجار التأكسدي للبلعمية. مثل L. monocytogenes، يمكن أن ينتقل M. leprae أيضًا مباشرة بين البلاعم لتجنب التخلص من العوامل المناعية.
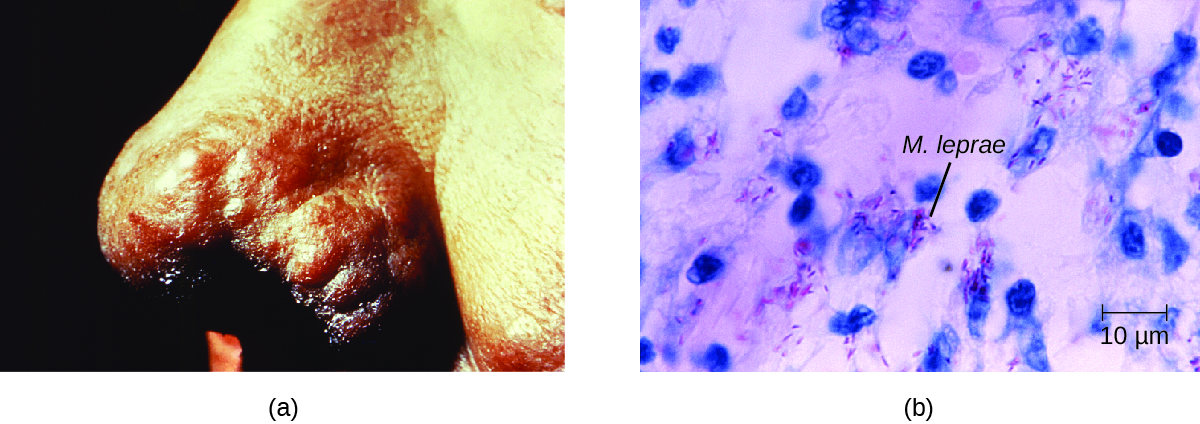
يرتبط مدى المرض بالاستجابة المناعية للمريض. قد لا تظهر الأعراض الأولية لمدة تتراوح من 2 إلى 5 سنوات بعد الإصابة. غالبًا ما تبدأ هذه المناطق بمناطق صغيرة ومبيض ومخدرة من الجلد. في معظم الأفراد، سيتم حل هذه الأعراض تلقائيًا، ولكن قد تتطور بعض الحالات إلى شكل أكثر خطورة من المرض. يتميز مرض هانسن السلي (paucibacilary) بوجود عدد قليل نسبيًا (ثلاثة أو أقل) من الآفات الجلدية المسطحة والمبيض مع وجود عقيدات صغيرة عند الحواف وعدد قليل من البكتيريا الموجودة في الآفة. على الرغم من أن هذه الآفات يمكن أن تستمر لسنوات أو عقود، إلا أن البكتيريا تخضع للسيطرة من خلال استجابة مناعية فعالة بما في ذلك السمية الخلوية. قد يصاب الأفراد غير القادرين على احتواء العدوى لاحقًا بمرض هانسن الورمي (متعدد العصيات). هذا هو الشكل التدريجي للمرض الذي يتميز بالعقيدات المليئة بالعصيات الضامة والبلاعم. يؤدي ضعف وظيفة خلايا Schwann المصابة إلى تلف الأعصاب الطرفية، مما يؤدي إلى فقدان الحواس مما يؤدي إلى حدوث تقرحات وتشوهات وكسور. يعد تلف العصب الزندي (في المعصم) بواسطة M. leprae أحد الأسباب الأكثر شيوعًا لشل اليد. في بعض الحالات، يمكن أن يؤدي تلف الأنسجة المزمن في نهاية المطاف إلى فقدان الأصابع أو أصابع القدم. عندما تكون الأنسجة المخاطية متورطة أيضًا، يمكن أن تحدث أيضًا آفات مشوهة للأنف والوجه (الشكل\(\PageIndex{7}\)).
يتم تشخيص مرض هانسن على أساس العلامات والأعراض السريرية للمرض، ويتم تأكيده من خلال وجود عصيات ثابتة الحمض على مسحات الجلد أو في عينات خزعة الجلد (الشكل\(\PageIndex{7}\)). لا تنمو M. leprae في المختبر على أي وسائط مختبرية معروفة، ولكن يمكن التعرف عليها عن طريق الزراعة في الجسم الحي في وسادات أقدام الفئران المختبرية أو المدرعات. عند الحاجة، يمكن إجراء تفاعل البوليميراز المتسلسل والتنميط الجيني للحمض النووي للمصل الجذمي في الأنسجة البشرية المصابة من أجل التشخيص وعلم الأوبئة.
يستجيب مرض هانسن جيدًا للعلاج، وإذا تم تشخيصه وعلاجه مبكرًا، فإنه لا يسبب الإعاقة. في الولايات المتحدة، يتم علاج معظم المرضى الذين يعانون من مرض هانسن في عيادات الرعاية المتنقلة في المدن الكبرى من خلال البرنامج الوطني لمرض هانسن، المؤسسة الوحيدة في الولايات المتحدة المخصصة حصريًا لمرض هانسن. منذ عام 1995، جعلت منظمة الصحة العالمية العلاج متعدد الأدوية لمرض هانسن متاحًا مجانًا لجميع المرضى في جميع أنحاء العالم. ونتيجة لذلك، انخفض الانتشار العالمي لمرض هانسن من حوالي 5.2 مليون حالة في عام 1985 إلى ما يقرب من 176،000 حالة في عام 2014. 15 يتكون العلاج متعدد الأدوية من الدابسون والريفامبيسين لجميع المرضى ودواء ثالث، كلوفازيمين، للمرضى الذين يعانون من مرض متعدد العصيات.
في الوقت الحالي، لا يوجد لقاح مقبول عالميًا لمرض هانسن. تستخدم الهند والبرازيل لقاح السل ضد مرض هانسن لأن كلا المرضين تسببهما أنواع من المتفطرة. ومع ذلك، فإن فعالية هذه الطريقة مشكوك فيها، حيث يبدو أن اللقاح يعمل في بعض المجموعات ولكن ليس في مجموعات أخرى.
التمارين الرياضية\(\PageIndex{4}\)
- ما الذي يمنع التقدم من مرض السل إلى الجذام الجذام؟
- لماذا يؤثر مرض هانسن عادةً على أعصاب الأطراف؟
مستعمرات الجذام
لقد تم وصم الأمراض المشوهة والمميتة مثل الجذام تاريخياً في العديد من الثقافات. قبل فهم الجذام، كان الضحايا غالبًا ما يتم عزلهم في مستعمرات مرضى الجذام، وهي ممارسة تم ذكرها كثيرًا في النصوص القديمة، بما في ذلك الكتاب المقدس. لكن مستعمرات الجذام ليست مجرد قطعة أثرية من العالم القديم. في هاواي، استمرت مستعمرة الجذام التي تأسست في أواخر القرن التاسع عشر حتى منتصف القرن العشرين، وأجبر سكانها على العيش في ظروف مزرية. 16- وعلى الرغم من أن الجذام مرض معد، فإنه لا يعتبر معدياً (يمكن أن ينتقل بسهولة)، وبالتأكيد لا يشكل خطراً كافياً لتبرير العزلة الدائمة لضحاياه. اليوم، نحتفظ بممارسات العزل والحجر الصحي للمرضى الذين يعانون من أمراض أكثر خطورة، مثل الإيبولا أو البكتيريا المقاومة للأدوية المتعددة مثل المتفطرة السلية والمكورات العنقودية الذهبية. الحجة الأخلاقية لهذه الممارسة هي أن عزل المرضى المصابين ضروري لمنع انتقال وانتشار الأمراض شديدة العدوى - حتى عندما يتعارض ذلك مع رغبات المريض.
بالطبع، من الأسهل بكثير تبرير ممارسة الحجر الصحي المؤقت والسريري مقارنة بالفصل الاجتماعي الدائم، كما حدث في مستعمرات مرضى الجذام. في الثمانينيات، كانت هناك دعوات من قبل بعض المجموعات لإنشاء مخيمات للأشخاص المصابين بالإيدز. على الرغم من أن هذه الفكرة لم يتم تنفيذها فعليًا، إلا أنها تطرح السؤال - أين نرسم الخط؟ هل معسكرات العزل الدائم أو المستعمرات لها ما يبررها طبيًا أو اجتماعيًا؟ لنفترض أنه كان هناك تفشي لمرض مميت ومعد لا يوجد علاج له. هل سيكون من المبرر فرض العزلة الاجتماعية على المصابين بالمرض؟ كيف يمكننا الموازنة بين حقوق المصابين والمخاطر التي يشكلونها للآخرين؟ إلى أي مدى يجب أن يتوقع المجتمع من الأفراد تعريض صحتهم للخطر من أجل معاملة الآخرين بطريقة إنسانية؟
الالتهابات البكتيرية للجهاز العصبي
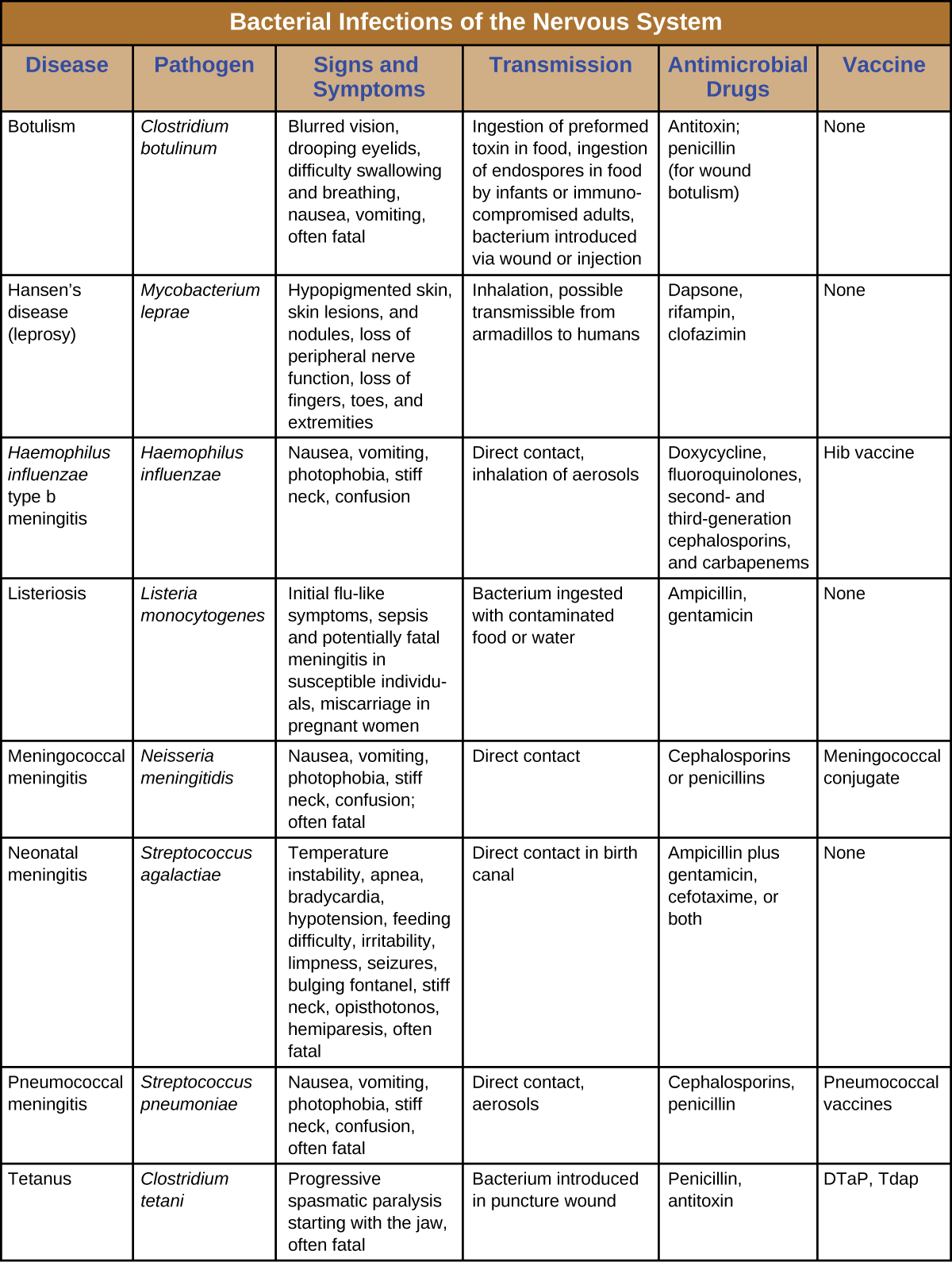
على الرغم من الدفاعات الهائلة التي تحمي الجهاز العصبي، فمن المعروف أن عددًا من مسببات الأمراض البكتيرية تسبب التهابات خطيرة في الجهاز العصبي المركزي أو PNS. لسوء الحظ، غالبًا ما تكون هذه العدوى خطيرة ومهددة للحياة. \(\PageIndex{8}\)يلخص الشكل بعض الإصابات المهمة في الجهاز العصبي.
المفاهيم الأساسية والملخص
- يمكن أن يحدث التهاب السحايا الجرثومي بسبب عدة أنواع من البكتيريا المغلفة، بما في ذلك المستدمية النزلية والنيسرية السحائية والمكورات العقدية الرئوية والمكورات العقدية (المكورات العقدية من المجموعة ب). تصيب الأنفلونزا في المقام الأول الأطفال الصغار والولدان، والتهاب السحايا هو العامل الممرض الوحيد المعدي ويؤثر في الغالب على الأطفال والشباب، وتؤثر المكورات الرئوية في الغالب على الأطفال الصغار، وتؤثر بكتيريا S. agalactiae على المواليد الجدد خلال فترة وجيزة أو في وقت قريب بعد الولادة.
- تشمل أعراض التهاب السحايا البكتيري الحمى وتصلب الرقبة والصداع والارتباك والتشنجات والغيبوبة والموت.
- يتم تشخيص التهاب السحايا البكتيري من خلال الملاحظات وزراعة الكائنات الحية في CSF. يتم علاج التهاب السحايا البكتيري بالمضادات الحيوية. تتوفر لقاحات H.inflenzae و N. miningitidis.
- تسبب أنواع الكلوستريديوم أمراضًا عصبية، بما في ذلك التسمم والتيتانوس، عن طريق إنتاج السموم العصبية القوية التي تتداخل مع إطلاق الناقلات العصبية. عادةً ما تتأثر PNS. لا يكون علاج عدوى كلوستريديوم فعالاً إلا من خلال التشخيص المبكر بإعطاء المضادات الحيوية للسيطرة على العدوى ومضادات السموم لتحييد السموم الداخلية قبل دخولها الخلايا.
- الليستيريا أحادية الخلية هي أحد مسببات الأمراض المنقولة بالغذاء والتي يمكن أن تصيب الجهاز العصبي المركزي وتسبب التهاب السحايا. يمكن أن تنتقل العدوى عبر المشيمة إلى الجنين. يتم التشخيص من خلال زراعة الدم أو CSF. يتم العلاج بالمضادات الحيوية ولا يوجد لقاح.
- يحدث مرض هانسن (الجذام) بسبب الطفيل داخل الخلايا Mycobacterium leprae. تتسبب العدوى في إزالة الخلايا العصبية، مما يؤدي إلى انخفاض الإحساس في الزوائد الطرفية ومواقع الجسم. يتم العلاج بالمضادات الحيوية متعددة الأدوية، ولا يوجد لقاح معترف به عالميًا.
الحواشي
- 1 ثيغبين، مايكل سي، سينثيا جي ويتني، نانسي إي ميسونييه، إليزابيث آر زيل، روث لينفيلد، جيمس إل هادلر، لي إتش هاريسون وآخرون، «التهاب السحايا البكتيري في الولايات المتحدة، 1998-2007"، مجلة نيو إنجلاند للطب 364، رقم 21 (2011): 2016-25.
- 2 بوبوفيتش، ت.، وآخرون. منظمة الصحة العالمية، «دليل المختبر لتشخيص التهاب السحايا الناجم عن النيسرية السحائية والمكورات العقدية الرئوية والمستدمية الأنفلونزا»، 1999.
- 3 مراكز أمريكية لمكافحة الأمراض والوقاية منها، «مرض المكورات السحائية»، 5 أغسطس 2015. تم الوصول إليه في 28 يونيو 2015. www.cdc.gov/inmingococcal/sur... nce/index.html
- 4 مراكز أمريكية لمكافحة الأمراض والوقاية منها، «جدول التحصين الموصى به للأشخاص الذين تتراوح أعمارهم بين 0 و 18 عامًا، الولايات المتحدة، 2016"، 1 فبراير 2016. تم الوصول إليه في 28 يونيو 2016. www.cdc.gov/vaccies/schedule... dolescent.html
- 5 الرابطة الوطنية لالتهاب السحايا، «تفشي مرض المكورات السحائية من المجموعة المصلية B في حرم الجامعات الأمريكية»، 2016. تم الوصول إليه في 28 يونيو 2016. http://www.nmaus.org/disease-prevent...ase/outbreaks/.
- (6) وزارة الصحة والخدمات الإنسانية بالولايات المتحدة، «Hib (الهيموفيلوس الإنفلونزا من النوع B)»، تم الوصول إليه في 28 يونيو 2016. http://www.vaccines.gov/diseases/hib/ #.
- 7 مراكز أمريكية لمكافحة الأمراض والوقاية منها، «مرض المكورات السحائية، اتجاهات الأمراض»، 2015. تم الوصول إليه في 13 سبتمبر 2016. www.cdc.gov/inmingococcal/sur... nce/index.html
- 8 ثيغبين، مايكل سي، سينثيا جي ويتني، نانسي إي ميسونييه، إليزابيث آر زيل، روث لينفيلد، جيمس إل هادلر، لي إتش هاريسون وآخرون، «التهاب السحايا البكتيري في الولايات المتحدة، 1998-2007"، مجلة نيو إنجلاند للطب 364، رقم 21 (2011): 2016-25.
- 9 ثيغبين، مايكل سي، سينثيا جي ويتني، نانسي إي ميسونييه، إليزابيث آر زيل، روث لينفيلد، جيمس إل هادلر، لي إتش هاريسون وآخرون، «التهاب السحايا البكتيري في الولايات المتحدة، 1998-2007"، مجلة نيو إنجلاند للطب 364، رقم 21 (2011): 2016-25؛ هيث، بول تي، غيل بلفور، آبي م. وايزنر، وأندرولا إفراتيو، وتيريزا إل لاماني، وهيلين تيغي، وليام إيه إف أوكونيل وآخرون، «مرض المكورات العقدية من المجموعة ب في المملكة المتحدة والرضع الأيرلنديين الذين تقل أعمارهم عن 90 يومًا»، ذا لانسيت 363، رقم 9405 (2004): 292-4.
- (10) صندوق الأمم المتحدة للسكان واليونيسيف ومنظمة الصحة العالمية، «القضاء على كزاز الأمهات والمواليد بحلول عام 2005"، 2000. www.unicef.org/immunization/f tegy_paper.pdf
- 11 مركزًا أمريكيًا لمكافحة الأمراض والوقاية منها، «تطعيم الكزاز»، 2013. تم الوصول إليه في 29 يونيو 2016. http://www.cdc.gov/tetanus/vaccination.html.
- 12 سكالان، إيلين، روبرت إم هويكسترا، فريدريك جيه أنغولو، روبرت ف. تاوكس، مارك ألين ويددوسون، شارون إل روي، جيفري إل جونز، وباتريشيا إم غريفين، «الأمراض المنقولة بالغذاء المكتسبة في الولايات المتحدة - مسببات الأمراض الرئيسية»، الأمراض المعدية الناشئة 17، رقم 1 (2011): 7-15.
- 13 مركزًا أمريكيًا لمكافحة الأمراض والوقاية منها، «تفشي الليستيريا»، 2016. تم الوصول إليه في 29 يونيو 2016. https://www.cdc.gov/listeria/outbreaks/index.html.
- 14 شارما، راهول، بوشبيندرا سينغ، دبليو جي لوغري، جيه ميتشل لوكهارت، دبليو باري إنمان، مالكولم إس دوثي، ماريا تي بينا وآخرون، «الجذام الحيواني في جنوب شرق الولايات المتحدة»، الأمراض المعدية الناشئة 21، رقم 12 (2015): 2127-34.
- (15) منظمة الصحة العالمية، «صحيفة وقائع الجذام»، 2016. تم الوصول إليه في 13 سبتمبر 2016. http://www.who.int/mediacentre/factsheets/fs101/en/.
- 16 خدمة المتنزهات الوطنية، «تاريخ موجز لكالاوبابا»، تم الوصول إليها في 2 فبراير 2016. www.nps.gov/kala/learn/histor... -kalaupapa.htm.


