19.1: فرط الحساسية
- Page ID
- 194628
أهداف التعلم
- تحديد ومقارنة الخصائص المميزة والآليات والأمثلة الرئيسية لفرط الحساسية من النوع الأول والثاني والثالث والرابع
التركيز السريري: الجزء الأول
حددت كيري، وهي طيارة في شركة طيران تبلغ من العمر 40 عامًا، موعدًا مع طبيب الرعاية الأولية الخاص بها لمناقشة الطفح الجلدي الذي يحدث عندما تقضي وقتًا في الشمس. كما تشرح لطبيبها، لا تبدو مثل حروق الشمس. تحرص على عدم قضاء الكثير من الوقت في الشمس وتستخدم واقي الشمس. على الرغم من هذه الاحتياطات، لا يزال الطفح الجلدي يظهر على شكل بقع حمراء بارزة تصبح متقشرة قليلاً. يستمر الطفح الجلدي لمدة 7 إلى 10 أيام في كل مرة، ويبدو أنه يختفي من تلقاء نفسه إلى حد كبير. في الآونة الأخيرة، بدأ الطفح الجلدي أيضًا في الظهور على خديها وفوق عينيها على جانبي جبهتها.
التمارين\(\PageIndex{1}\)
- هل تشعر كيري بالقلق، أم ينبغي عليها ببساطة أن تكون أكثر حذرًا بشأن التعرض لأشعة الشمس؟
- هل هناك حالات قد تنجم عن التعرض لأشعة الشمس يجب على طبيب كيري أخذها في الاعتبار؟
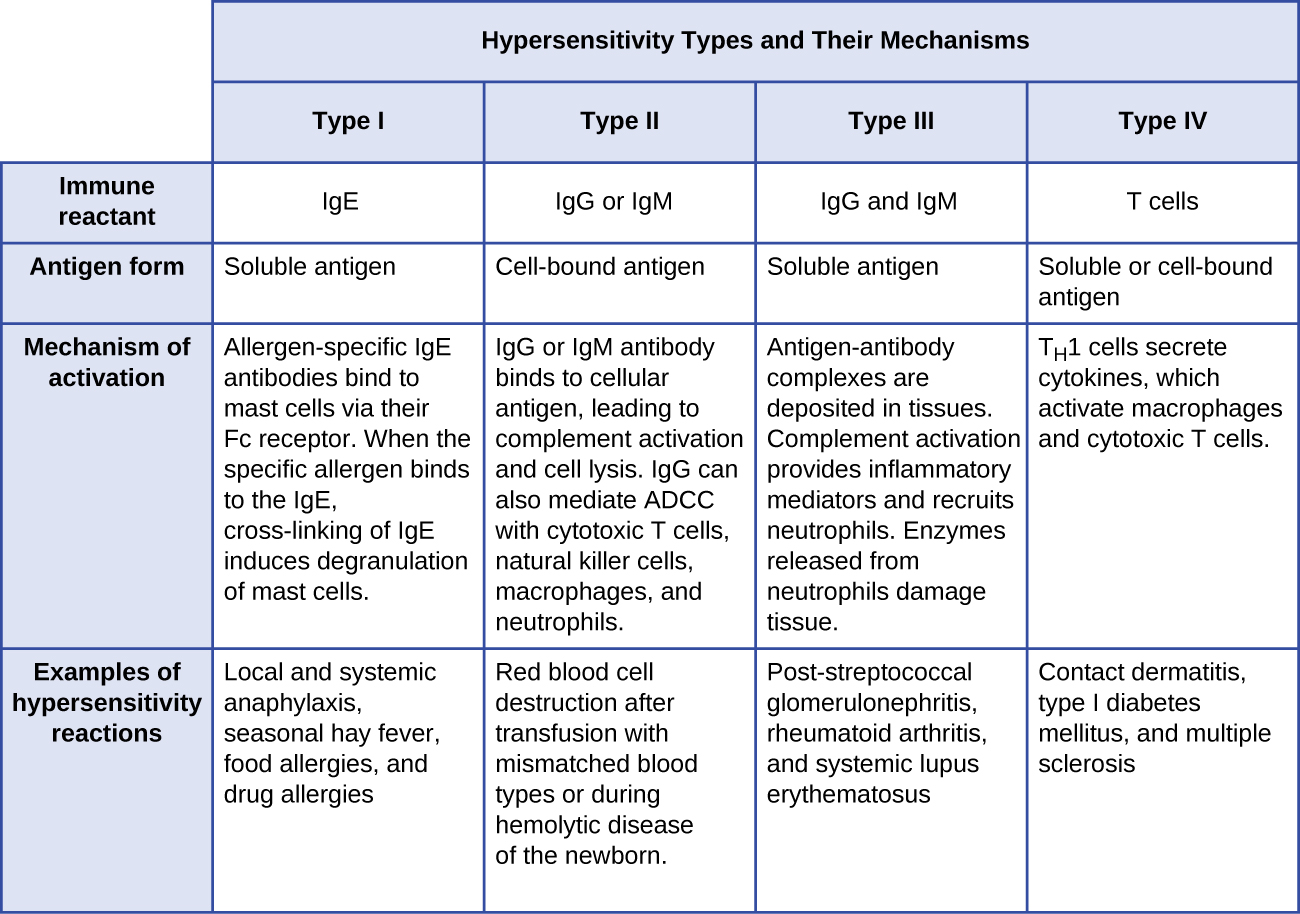
في دفاعات المضيف التكيفية المحددة، ناقشنا الآليات التي تحمينا من خلالها الدفاعات المناعية التكيفية، الخلطية والخلوية، من الأمراض المعدية. ومع ذلك، يمكن أن تكون هذه الدفاعات المناعية الواقية مسؤولة أيضًا عن ردود فعل غير مرغوب فيها تسمى تفاعلات فرط الحساسية. يتم تصنيف تفاعلات فرط الحساسية حسب آلية المناعة الخاصة بها.
- تتضمن تفاعلات فرط الحساسية من النوع الأول الجسم المضاد للغلوبولين المناعي E (IgE) ضد المستضد القابل للذوبان، مما يؤدي إلى تحلل الخلايا البدينة.
- تتضمن تفاعلات فرط الحساسية من النوع الثاني الأجسام المضادة IgG و IgM الموجهة ضد المستضدات الخلوية، مما يؤدي إلى تلف الخلايا بوساطة مؤثرات الجهاز المناعي الأخرى.
- تتضمن تفاعلات فرط الحساسية من النوع الثالث تفاعلات IgG و IgM وأحيانًا الأجسام المضادة IgA 1 مع المستضد لتكوين مجمعات مناعية. يؤدي تراكم المركبات المناعية في الأنسجة إلى تلف الأنسجة بوساطة مؤثرات أخرى في الجهاز المناعي.
- تفاعلات فرط الحساسية من النوع الرابع هي تفاعلات بوساطة الخلايا التائية يمكن أن تنطوي على تلف الأنسجة بوساطة البلاعم المنشطة والخلايا التائية السامة للخلايا.
فرط الحساسية من النوع الأول
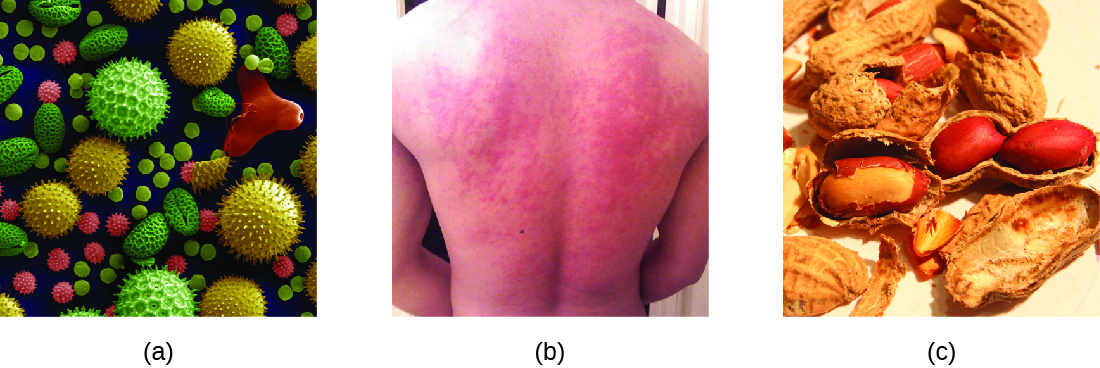
عندما يتعرض الفرد الذي تم عرضه لمسببات الحساسية، يمكن أن يؤدي ذلك إلى استجابة مناعية سريعة تحدث على الفور تقريبًا. تسمى هذه الاستجابة بالحساسية وتصنف على أنها فرط الحساسية من النوع الأول. قد تبدو المواد المسببة للحساسية مواد غير ضارة مثل وبر الحيوانات أو العفن أو حبوب اللقاح. قد تكون المواد المسببة للحساسية أيضًا مواد تعتبر أكثر خطورة بالفطرة، مثل سم الحشرات أو الأدوية العلاجية. يمكن أن يؤدي عدم تحمل الطعام أيضًا إلى ردود فعل تحسسية عندما يصبح الأفراد حساسين للأطعمة مثل الفول السوداني أو المحار (الشكل\(\PageIndex{1}\)). بغض النظر عن مسببات الحساسية، فإن التعرض الأول ينشط استجابة الأجسام المضادة IgE الأولية التي تحسس الفرد لتفاعل فرط الحساسية من النوع الأول عند التعرض اللاحق.
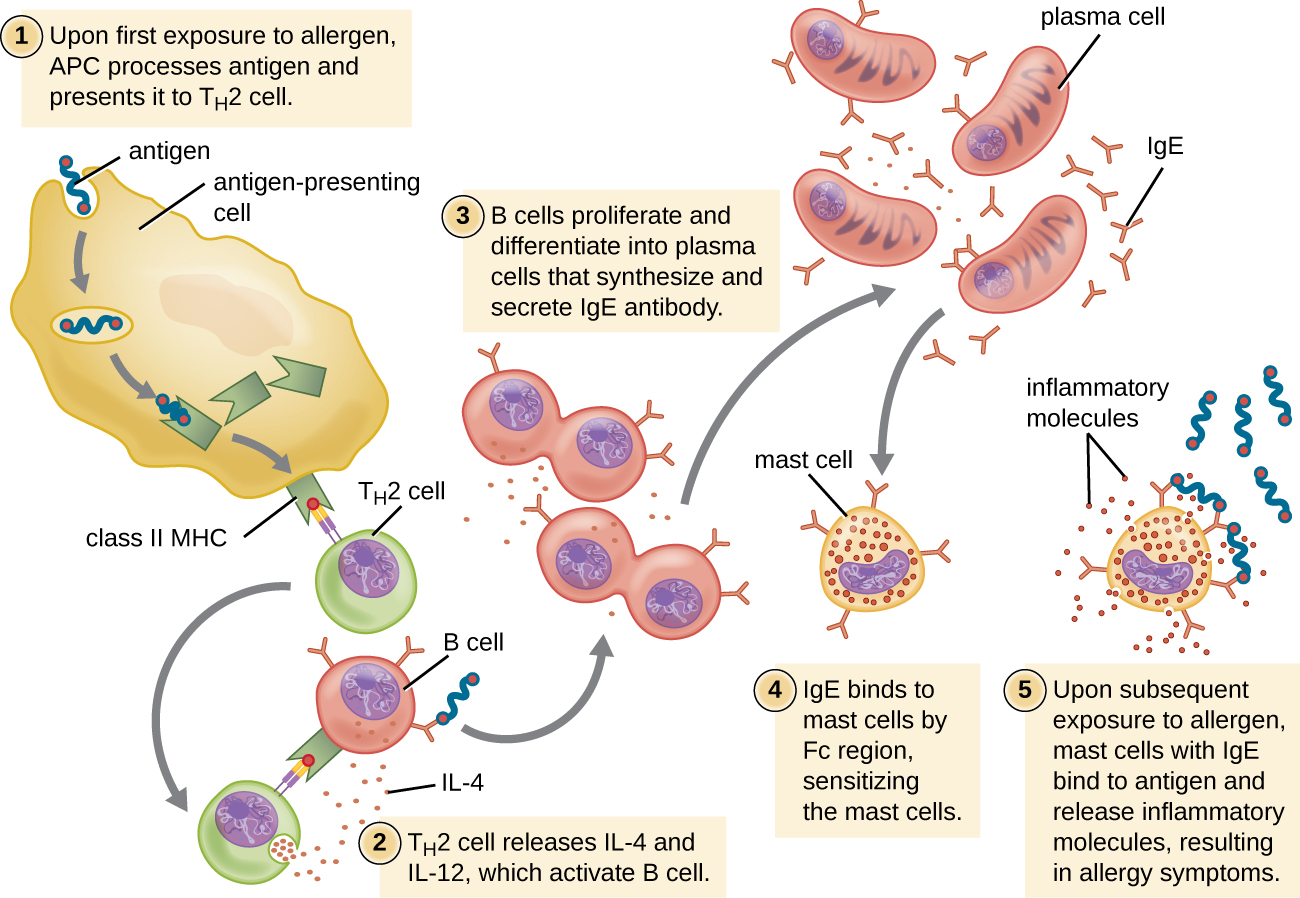
بالنسبة للأفراد المعرضين للإصابة، يؤدي التعرض الأول لمسببات الحساسية إلى تنشيط استجابة خلايا T H 2 القوية (الشكل\(\PageIndex{2}\)). تعمل السيتوكينات إنترلوكين (IL) -4 و IL-13 من خلايا T H 2 على تنشيط الخلايا البائية الخاصة بنفس مسببات الحساسية، مما يؤدي إلى التكاثر النسيلي والتمايز في خلايا البلازما والتحول من فئة الأجسام المضادة من إنتاج IgM إلى إنتاج IgE. ترتبط المناطق الشظية القابلة للبلورة (Fc) من الأجسام المضادة IgE بمستقبلات محددة على سطح الخلايا البدينة في جميع أنحاء الجسم. تشير التقديرات إلى أن كل خلية من الخلايا البدينة يمكنها ربط ما يصل إلى 500000 جزيء IgE، حيث يحتوي كل جزيء IgE على موقعين خاصين بمسببات الحساسية لربط المستضد (Fab) لربط مسببات الحساسية عند التعرض اللاحق. في الوقت الذي يحدث فيه ذلك، غالبًا ما لا تكون مسببات الحساسية موجودة ولا يوجد رد فعل تحسسي، ولكن الخلايا البدينة تستعد للتعرض اللاحق ويكون الفرد حساسًا لمسببات الحساسية.
عند التعرض اللاحق، ترتبط المواد المسببة للحساسية بجزيئات IgE المتعددة على الخلايا البدينة، مما يؤدي إلى ربط جزيئات IgE. في غضون دقائق، ينشط هذا الربط المتقاطع لـ IgE الخلايا البدينة ويؤدي إلى التحلل، وهو تفاعل يتم فيه إطلاق محتويات الحبيبات في الخلية البدينة إلى البيئة خارج الخلية. تشمل المكونات مسبقة التشكيل التي يتم إطلاقها من الحبيبات الهيستامين والسيروتونين والبراديكينين (الجدول\(\PageIndex{1}\)). تطلق الخلايا البدينة المنشطة أيضًا وسطاء شحميين تم تكوينهم حديثًا (الليكوترين والبروستاجلاندين من استقلاب حمض الأراكادونك الغشائي) والسيتوكينات مثل عامل نخر الورم (الجدول\(\PageIndex{2}\)).
| مكون الحبيبات | نشاط |
|---|---|
| هيبارين | يحفز إنتاج البراديكينين، مما يؤدي إلى زيادة نفاذية الأوعية الدموية وتوسع الأوعية وانقباض القصبات وزيادة إفراز المخاط |
| الهيستامين | يسبب تقلص العضلات الملساء، ويزيد من نفاذية الأوعية الدموية، ويزيد من تكوين المخاط والدموع |
| السيروتونين | يزيد من نفاذية الأوعية الدموية ويسبب توسع الأوعية وتقلص العضلات الملساء |
تتسبب المواد الكيميائية الوسيطة التي تطلقها الخلايا البدينة بشكل جماعي في الالتهاب والعلامات والأعراض المرتبطة بتفاعلات فرط الحساسية من النوع الأول. يحفز الهيستامين إفراز المخاط في الممرات الأنفية وتكوين الدموع من الغدد الدمعية، مما يعزز سيلان الأنف والعيون المائية للحساسية. تفاعل الهيستامين مع النهايات العصبية يسبب الحكة والعطس. يمكن أن يؤدي توسع الأوعية الذي يسببه العديد من الوسطاء إلى الشرى والصداع والوذمة الوعائية (التورم الذي يؤثر غالبًا على الشفاه والحلق واللسان) وانخفاض ضغط الدم (انخفاض ضغط الدم). يؤدي انقباض القصبات الناجم عن بعض المواد الكيميائية الوسيطة إلى الصفير وضيق التنفس (صعوبة التنفس) والسعال، وفي الحالات الأكثر شدة، الازرقاق (لون مزرق للجلد أو الأغشية المخاطية). يمكن أن ينتج القيء عن تحفيز مركز القيء في المخيخ بواسطة الهيستامين والسيروتونين. يمكن أن يسبب الهيستامين أيضًا ارتخاء العضلات الملساء المعوية والإسهال.
| الوسيط الكيميائي | نشاط |
|---|---|
| ليوكوت برين | يسبب تقلص العضلات الملساء وإفراز المخاط، ويزيد من نفاذية الأوعية الدموية |
| البروستاجلاندين | يسبب تقلص العضلات الملساء وتوسع الأوعية |
| TNF-ألفا (السيتوكين) | يسبب الالتهاب ويحفز إنتاج السيتوكين بواسطة أنواع الخلايا الأخرى |
يمكن أن تكون تفاعلات فرط الحساسية من النوع الأول موضعية أو جهازية. تشمل تفاعلات فرط الحساسية الموضعية من النوع الأول حمى القش والتهاب الأنف والشرى والربو (الجدول\(\PageIndex{3}\)). يشار إلى تفاعلات فرط الحساسية الجهازية من النوع الأول باسم الحساسية المفرطة أو صدمة الحساسية. على الرغم من أن الحساسية المفرطة تشترك في العديد من الأعراض الشائعة مع تفاعلات فرط الحساسية الموضعية من النوع الأول، فإن تورم اللسان والقصبة الهوائية، وانسداد الشعب الهوائية، والانخفاض الخطير في ضغط الدم، وتطور الصدمة يمكن أن يجعل الحساسية المفرطة شديدة ومهددة للحياة. في الواقع، يمكن أن تحدث الوفاة في غضون دقائق من ظهور العلامات والأعراض.
قد تتطور تفاعلات المرحلة المتأخرة من فرط الحساسية من النوع الأول بعد 4 إلى 12 ساعة من المرحلة المبكرة وتتوسطها الحمضات والعدلات والخلايا الليمفاوية التي تم تجنيدها بواسطة العوامل الكيميائية المنبعثة من الخلايا البدينة. يؤدي تنشيط هذه الخلايا المجندة إلى إطلاق المزيد من المواد الكيميائية الوسيطة التي تسبب تلف الأنسجة وأعراض المرحلة المتأخرة من تورم واحمرار الجلد والسعال والصفير وإفرازات الأنف.
من المتوقع أن يعاني الأفراد الذين يمتلكون جينات للسمات غير القادرة على التكيف، مثل تفاعلات فرط الحساسية الشديدة من النوع الأول تجاه مكونات البيئة غير الضارة، من انخفاض النجاح الإنجابي. مع هذا النوع من الضغط الانتقائي التطوري، لا يُتوقع أن تستمر هذه السمات في السكان. يشير هذا إلى أن فرط الحساسية من النوع الأول قد يكون له وظيفة تكيفية. هناك أدلة على أن IgE الذي يتم إنتاجه أثناء تفاعلات فرط الحساسية من النوع الأول يهدف في الواقع إلى مواجهة عدوى الديدان الطفيلية 2. الديدان الطفيلية هي واحدة من الكائنات الحية القليلة التي تمتلك البروتينات التي يستهدفها IgE. بالإضافة إلى ذلك، هناك أدلة على أن عدوى الديدان الطفيلية في سن مبكرة تقلل من احتمالية فرط الحساسية من النوع الأول للمواد غير الضارة في وقت لاحق من الحياة. وبالتالي قد تكون الحساسية نتيجة مؤسفة للاختيار القوي في سلالة الثدييات أو قبل ذلك للدفاع ضد الديدان الطفيلية.
| الاسم الشائع | سبب | العلامات والأعراض |
|---|---|---|
| الربو الناجم عن الحساسية | استنشاق المواد المسببة للحساسية | انقباض القصبات الهوائية وصعوبة التنفس والسعال والقشعريرة وآلام الجسم |
| الحساسية المفرطة | رد فعل نظامي لمسببات | الشرى والحكة وتورم اللسان والحلق والغثيان والقيء وانخفاض ضغط الدم والصدمة |
| حمى القش | استنشاق العفن أو حبوب اللقاح | سيلان الأنف والعيون الدامعة والعطس |
| خلايا النحل (الشرى) | المواد المسببة للحساسية الغذائية أو الدوائية، لسعات الحشرات | طفح جلدي مرتفع وعرج مصحوب بحكة؛ قد تتلاقى النتوءات في مناطق مرتفعة كبيرة |
التمارين\(\PageIndex{2}\)
- ما هي الخلايا التي تسبب تفاعل فرط الحساسية من النوع الأول؟
- وصف الاختلافات بين تفاعلات فرط الحساسية من النوع الأول الفورية والمتأخرة.
- ضع قائمة بعلامات وأعراض الحساسية المفرطة.
فرضية النظافة
في معظم المجتمعات الحديثة، ترتبط النظافة الجيدة بالاستحمام المنتظم والصحة الجيدة بالنظافة. لكن بعض الدراسات الحديثة تشير إلى أن العلاقة بين الصحة والحياة النظيفة قد تكون خاطئة. يذهب البعض إلى حد اقتراح أنه يجب تشجيع الأطفال على اللعب في الأوساخ - أو حتى تناول الأوساخ 3 - لصالح صحتهم. تستند هذه التوصية إلى ما يسمى بفرضية النظافة، والتي تقترح أن تعرض الأطفال للمستضدات من مجموعة متنوعة من الميكروبات يؤدي إلى تحسين أداء الجهاز المناعي في وقت لاحق من الحياة.
تم اقتراح فرضية النظافة لأول مرة في عام 1989 من قبل ديفيد ستراكان 4، الذي لاحظ وجود علاقة عكسية بين عدد الأطفال الأكبر سنًا في الأسرة وحدوث حمى القش. على الرغم من زيادة حمى القش لدى الأطفال بشكل كبير خلال منتصف القرن العشرين، إلا أن معدل الإصابة بها كان أقل بكثير في الأسر التي لديها عدد أكبر من الأطفال. اقترح ستراكان أن انخفاض معدل الإصابة بالحساسية في العائلات الكبيرة يمكن أن يرتبط بالعدوى المكتسبة من الأشقاء الأكبر سنًا، مما يشير إلى أن هذه العدوى جعلت الأطفال أقل عرضة للحساسية. جادل ستراشان أيضًا بأن الاتجاهات نحو العائلات الصغيرة والتركيز الأكبر على النظافة في القرن العشرين قد قللت من التعرض لمسببات الأمراض وبالتالي أدت إلى ارتفاع المعدلات الإجمالية للحساسية والربو واضطرابات المناعة الأخرى.
لاحظ باحثون آخرون وجود علاقة عكسية بين حدوث الاضطرابات المناعية والأمراض المعدية التي أصبحت الآن نادرة في البلدان الصناعية ولكنها لا تزال شائعة في البلدان الأقل صناعية. 5 في الدول المتقدمة، لا يتعرض الأطفال الذين تقل أعمارهم عن 5 سنوات للعديد من الميكروبات والجزيئات والمستضدات التي كان من المؤكد أنهم كانوا سيواجهونها قبل قرن من الزمان. قد يؤدي عدم وجود تحديات مبكرة لجهاز المناعة من قبل الكائنات الحية التي تطور معها البشر وأسلافهم إلى فشل في عمل الجهاز المناعي في وقت لاحق من الحياة.
فرط الحساسية من النوع الثاني (سام للخلايا)
يتم التوسط في التفاعلات المناعية المصنفة على أنها فرط الحساسية من النوع الثاني، أو فرط الحساسية السامة للخلايا، عن طريق الأجسام المضادة IgG و IgM المرتبطة بمستضدات سطح الخلية أو المستضدات المرتبطة بالمصفوفة على أغشية الطابق السفلي. يمكن لهذه الأجسام المضادة إما تنشيط المكمل، مما يؤدي إلى استجابة التهابية وتحلل الخلايا المستهدفة، أو يمكن أن تشارك في السمية الخلوية التي تعتمد على الأجسام المضادة بوساطة الخلايا (ADCC) مع الخلايا التائية السامة للخلايا.
في بعض الحالات، قد يكون المستضد مستضدًا ذاتيًا، وفي هذه الحالة يمكن وصف التفاعل أيضًا بأنه أحد أمراض المناعة الذاتية. (يتم وصف أمراض المناعة الذاتية في اضطرابات المناعة الذاتية). في حالات أخرى، قد ترتبط الأجسام المضادة بجزيئات طبيعية ولكن خارجية على سطح الخلية مثل المستضدات المرتبطة بفصيلة الدم الموجودة في خلايا الدم الحمراء (RBCs). هذا يؤدي إلى طلاء كرات الدم الحمراء بواسطة الأجسام المضادة، وتنشيط السلسلة التكميلية، والتحلل التكميلي لخلايا الدم الحمراء بوساطة تكميلية، بالإضافة إلى تأنيب كرات الدم الحمراء لعلاج البلعمة. مثالان لتفاعلات فرط الحساسية من النوع الثاني التي تشمل كرات الدم الحمراء هما تفاعل نقل الدم الانحلالي (HTR) ومرض الانحلالي عند الوليد (HDN). يتم تلخيص تفاعلات فرط الحساسية من النوع الثاني، والتي سيتم مناقشتها بمزيد من التفصيل، في الجدول\(\PageIndex{4}\).
علم الدم المناعي هو دراسة الدم والأنسجة المكونة للدم فيما يتعلق بالاستجابة المناعية. الاستجابات التي تبدأها الأجسام المضادة ضد خلايا الدم هي فرط الحساسية من النوع الثاني، وبالتالي تقع في مجال أمراض المناعة. بالنسبة للطلاب الذين يتعلمون لأول مرة عن أمراض الدم المناعية، يصبح فهم الآليات المناعية المعنية أكثر صعوبة من خلال نظام التسميات المعقد المستخدم لتحديد مستضدات فصيلة الدم المختلفة، والتي تسمى غالبًا أنواع الدم. استخدمت مستضدات فصيلة الدم الأولى إما أسماء أبجدية أو تم تسميتها لأول شخص معروف بإنتاج أجسام مضادة لمستضد خلايا الدم الحمراء (على سبيل المثال، Kell أو Duffy أو Diego). ومع ذلك، في عام 1980، أنشأت فرقة العمل المعنية بالمصطلحات التابعة للجمعية الدولية لنقل الدم (ISBT) معيارًا لمصطلحات فصيلة الدم في محاولة لتحديد مستضدات فصيلة الدم المكتشفة حديثًا بشكل أكثر اتساقًا. يتم الآن إعطاء المستضدات الجديدة رقمًا ويتم تخصيصها لنظام فصيلة الدم أو المجموعة أو السلسلة. ومع ذلك، حتى مع هذا الجهد، لا تزال تسمية فصيلة الدم غير متسقة.
| الاسم الشائع | سبب | العلامات والأعراض |
|---|---|---|
| مرض انحلالي لحديثي الولادة (HDN) | IgG من الأم يعبر المشيمة ويستهدف كرات الدم الحمراء للجنين للتدمير | فقر الدم، الوذمة، تضخم الكبد أو الطحال، الاستسقاء المائي (سائل في تجويف الجسم)، مما يؤدي إلى وفاة المولود الجديد في الحالات الشديدة |
| تفاعلات نقل الدم الانحلالية (HTR) | يرتبط IgG و IgM بالمستضدات الموجودة على كريات الدم الحمراء المنقولة، ويستهدفان خلايا الدم الحمراء المانحة لتدميرها | الحمى واليرقان وانخفاض ضغط الدم والتخثر المنتشر داخل الأوعية الدموية، مما قد يؤدي إلى الفشل الكلوي والوفاة |
عدم توافق فصيلة الدم ABO
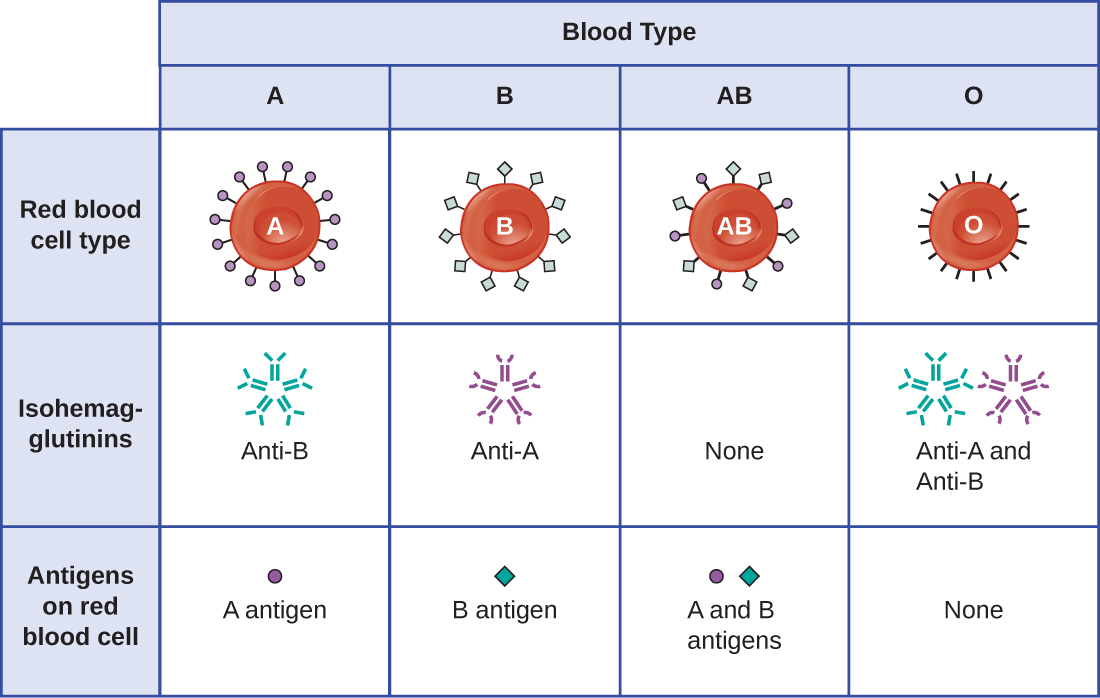
وصف كارل لاندستينر (1868-1943) الاعتراف بأن الأفراد لديهم أنواع دم مختلفة لأول مرة في أوائل القرن العشرين، بناءً على ملاحظته أن مصل الدم من شخص ما يمكن أن يتسبب في تكتل خلايا الدم الحمراء من شخص آخر. قادت هذه الدراسات Landsteiner إلى تحديد أربعة أنواع دم متميزة. حدد بحث لاحق أجراه علماء آخرون أن أنواع الدم الأربعة كانت تستند إلى وجود أو عدم وجود البروتينات السكرية السطحية «A» و «B»، وهذا وفر الأساس لنظام فصيلة الدم ABO الذي لا يزال قيد الاستخدام حتى اليوم (الشكل\(\PageIndex{3}\)). وظائف هذه المستضدات غير معروفة، ولكن بعضها مرتبط بالوظائف البيوكيميائية العادية للخلية. علاوة على ذلك، يتم توريث فصيلة دم ABO على شكل أليلات (واحدة من كل والد)، وتظهر أنماطًا من الميراث السائد والمهيمن. تهيمن الأليلات الخاصة بفئتي الدم A و B على بعضها البعض، وكلاهما مهيمن على فصيلة الدم O. لذلك، فإن الأفراد الذين لديهم أنماط وراثية من AA أو AO لديهم دم من النوع A ويعبّرون عن مستضد البروتين السكري A على سطح كرات الدم الحمراء الخاصة بهم. الأشخاص الذين لديهم أنماط وراثية من BB أو BO لديهم دم من النوع B ويعبرون عن مستضد البروتين السكري B على سطح كرات الدم الحمراء الخاصة بهم. أولئك الذين لديهم النمط الجيني من AB لديهم دم من النوع AB ويعبّرون عن مستضدات البروتين السكري A و B على سطح كرات الدم الحمراء الخاصة بهم. أخيرًا، الأفراد الذين لديهم النمط الجيني لـ OO لديهم دم من النوع O ويفتقرون إلى البروتينات السكرية A و B على سطح كرات الدم الحمراء الخاصة بهم.
من المهم ملاحظة أن كرات الدم الحمراء لجميع أنواع الدم الأربعة ABO تشترك في جزيء مستقبلات البروتين المشترك، وأن إضافة كربوهيدرات معينة إلى مستقبلات البروتين هي التي تحدد أنواع الدم A و B و AB. تقوم الجينات الموروثة لأنواع الدم A و B و AB بترميز الإنزيمات التي تضيف مكون الكربوهيدرات إلى مستقبلات البروتين. لا يزال الأفراد المصابون بفصيلة الدم O يمتلكون مستقبلات البروتين ولكنهم يفتقرون إلى الإنزيمات التي من شأنها أن تضيف الكربوهيدرات التي من شأنها أن تصنع خلايا الدم الحمراء من النوع A أو B أو AB.
تسمى الأجسام المضادة IgM في البلازما التي تتفاعل مع مستضدات فصيلة الدم غير الموجودة في كرات الدم الحمراء الخاصة بالفرد باسم isohemaglutinins (الشكل\(\PageIndex{3}\)). يتم إنتاج Isohemagglutinins في غضون الأسابيع القليلة الأولى بعد الولادة وتستمر طوال الحياة. يتم إنتاج هذه الأجسام المضادة استجابة للتعرض للمستضدات البيئية من الأغذية والكائنات الحية الدقيقة. يحتوي الشخص المصاب بنوع الدم A على مستضدات A على سطح كرات الدم الحمراء الخاصة به وسينتج أجسامًا مضادة لـ B للمستضدات البيئية التي تشبه مكون الكربوهيدرات في مستضدات B. يحتوي الشخص المصاب بنوع الدم B على مستضدات B على سطح كرات الدم الحمراء الخاصة به وسينتج أجسامًا مضادة لـ A للمستضدات البيئية التي تشبه مكون الكربوهيدرات في مستضدات A. يفتقر الأشخاص المصابون بفصيلة الدم O إلى كل من مستضدات A و B في كرات الدم الحمراء الخاصة بهم، وبالتالي ينتجون أجسامًا مضادة لـ A و B. على العكس من ذلك، فإن الأشخاص الذين يعانون من فصيلة الدم AB لديهم مستضدات A و B على كرات الدم الحمراء الخاصة بهم، وبالتالي يفتقرون إلى الأجسام المضادة المضادة لـ A و B.
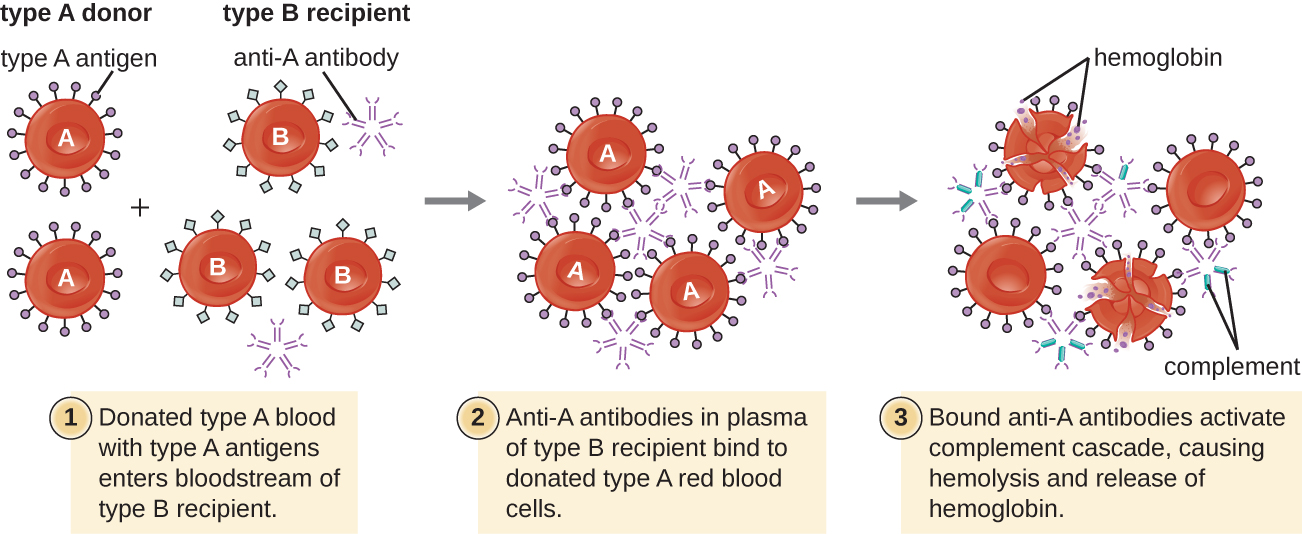
قد يحتاج المريض إلى نقل الدم لأنه يفتقر إلى كمية كافية من كرات الدم الحمراء (فقر الدم) أو لأنه عانى من فقدان كبير في حجم الدم من خلال الصدمة أو المرض. على الرغم من أن نقل الدم يتم لمساعدة المريض، إلا أنه من الضروري أن يتلقى المريض عملية نقل مع فصيلة دم ABO المطابقة. قد يؤدي نقل الدم مع فصيلة دم ABO غير المتوافقة إلى استجابة قوية ومميتة من النوع الثاني من فرط الحساسية السامة للخلايا تسمى تفاعل نقل الدم الانحلالي (HTR) (الشكل\(\PageIndex{4}\)).
على سبيل المثال، إذا تلقى شخص مصاب بنوع الدم B عملية نقل دم من النوع A، فإن أجسامه المضادة المضادة لـ A سترتبط وتتراكم كرات الدم الحمراء المنقولة. بالإضافة إلى ذلك، سيؤدي تنشيط سلسلة المكملات الكلاسيكية إلى استجابة التهابية قوية، وسيقوم مجمع هجوم الغشاء التكميلي (MAC) بالتوسط في انحلال الدم الهائل لخلايا الدم الحمراء المنقولة. يمكن أن يؤدي الحطام الناتج عن كرات الدم الحمراء التالفة والمدمرة إلى انسداد الأوعية الدموية في الحويصلات الهوائية في الرئتين وكبيبات الكلى. في غضون 1 إلى 24 ساعة من نقل الدم غير المتوافق، يعاني المريض من الحمى والقشعريرة والحكة (الحكة) والأرتكاريا (الشرى) وضيق التنفس والهيموجلوبين (الهيموجلوبين في البول) وانخفاض ضغط الدم (انخفاض ضغط الدم). في أخطر ردود الفعل، يمكن أن يؤدي انخفاض ضغط الدم بشكل خطير إلى الصدمة وفشل الأعضاء المتعددة وموت المريض.
عادةً ما تستخدم المستشفيات والمراكز الطبية والمختبرات السريرية المرتبطة بها أنظمة مراقبة الدم لتقليل مخاطر HTRs بسبب الأخطاء الكتابية. أنظمة Hemovigilance هي إجراءات تتبع معلومات نقل الدم من مصدر المتبرع ومنتجات الدم التي يتم الحصول عليها لمتابعة المرضى المتلقين. تحدد أنظمة Hemovigilance المستخدمة في العديد من البلدان تقارير HTRs ونتائجها من خلال الإبلاغ الإلزامي (على سبيل المثال، إلى إدارة الغذاء والدواء في الولايات المتحدة)، وهذه المعلومات قيمة للمساعدة في منع حدوث مثل هذه الحوادث في المستقبل. على سبيل المثال، إذا تبين أن HTR ناتج عن خطأ مختبري أو كتابي، فيمكن تحديد منتجات الدم الإضافية التي تم جمعها من المتبرع في ذلك الوقت وتمييزها بشكل صحيح لتجنب المزيد من HTRs. نتيجة لهذه الإجراءات، تحدث الوفيات المرتبطة بـ HTR في الولايات المتحدة بحوالي واحدة لكل 2 مليون وحدة منقولة. 6
عوامل الرطوبة
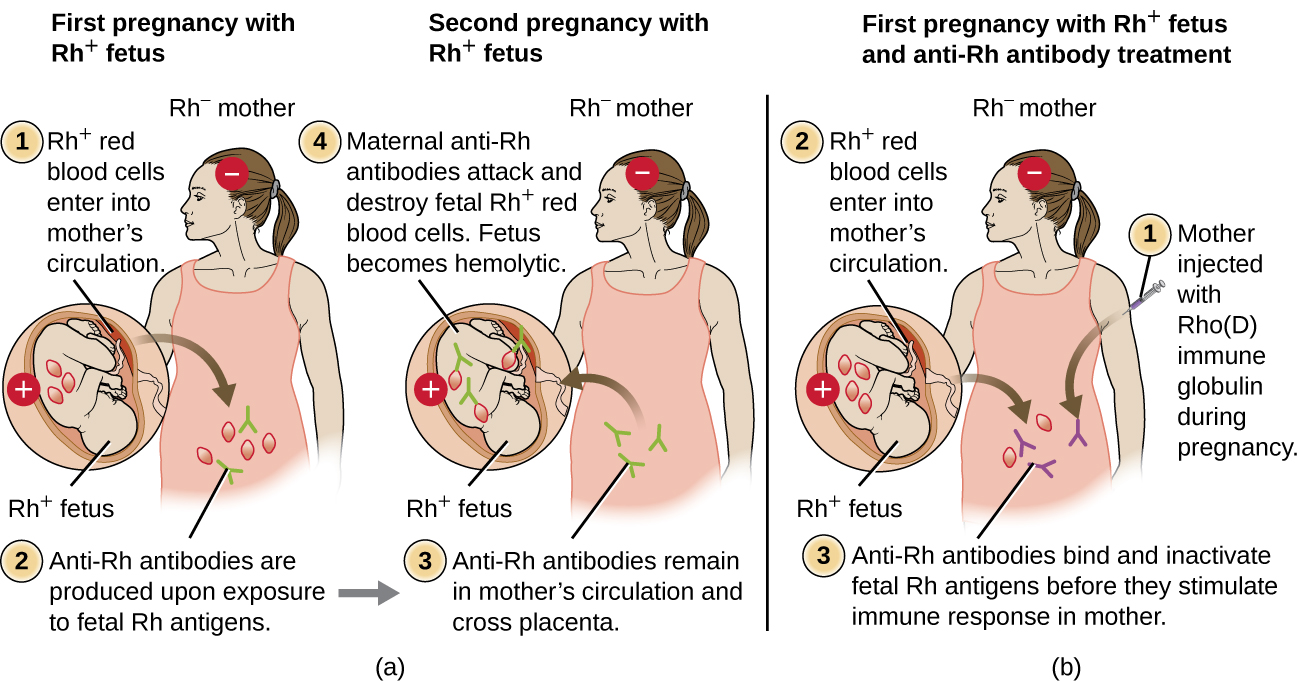
تم اكتشاف العديد من الأنواع المختلفة من مستضدات كرات الدم الحمراء منذ وصف مستضدات الخلايا الحمراء ABO. ثاني أكثر مستضدات كرات الدم الحمراء شيوعًا هو عوامل Rh، التي سميت على اسم عوامل ريسوس المكاك (Macaca mulatta) التي حددها كارل لاندستينر وألكسندر وينر في عام 1940. نظام Rh لمستضدات Rb هو نظام فصيلة الدم الأكثر تعقيدًا ومناعًا، حيث تم تحديد أكثر من 50 خصوصية حتى الآن. من بين جميع مستضدات Rh، فإن المستضدات المعينة Rho (Weiner) أو D (Fisher-Race) هي الأكثر مناعًا. يتم تصنيف الخلايا على أنها إيجابية Rh (Rh+) إذا كان مستضد Rh/D موجودًا أو على أنها سلبية Rh (Rh−) إذا كان مستضد Rh/D غائبًا. على عكس جزيئات الكربوهيدرات التي تميز مجموعات الدم ABO والتي هي أهداف IgM isohemaglutinins في HTRs، فإن مستضدات عامل Rh هي بروتينات. كما تمت مناقشته في الخلايا الليمفاوية البائية والمناعة الخلطية، تقوم مستضدات البروتين بتنشيط الخلايا البائية وإنتاج الأجسام المضادة من خلال آلية تعتمد على الخلايا التائية، وتحفز خلايا T H 2 التحول الطبقي من IgM إلى فئات الأجسام المضادة الأخرى. في حالة مستضدات عامل Rh، تحفز خلايا T H 2 التحول الطبقي إلى IgG، وهذا له آثار مهمة على آلية HDN.
مثل عدم توافق ABO، يمكن أن تتسبب عمليات نقل الدم من متبرع لديه مستضدات عامل Rh الخاطئة في فرط الحساسية من النوع الثاني HTR. ومع ذلك، على النقيض من IgM isohemaglutinins المنتجة في وقت مبكر من الحياة من خلال التعرض للمستضدات البيئية، يتطلب إنتاج الأجسام المضادة لعامل Rh تعريض الفرد المصاب بدم Rh− إلى كرات الدم الحمراء الإيجابية Rh+ وتفعيل استجابة الجسم المضاد الأولية. على الرغم من أن هذه الاستجابة الأولية للجسم المضاد يمكن أن تسبب HTR في مريض نقل الدم، فإن التفاعل الانحلالي قد يتأخر لمدة تصل إلى أسبوعين خلال فترة التأخر الممتدة لاستجابة الجسم المضاد الأولية (الخلايا الليمفاوية B والمناعة الخلطية). ومع ذلك، إذا تلقى المريض عملية نقل لاحقة باستخدام Rh+ RbCs، فسيحدث HTR أسرع مع وجود جسم مضاد لعامل RH بالفعل في الدم. علاوة على ذلك، فإن الاستجابة السريعة للأجسام المضادة الثانوية ستوفر المزيد من الأجسام المضادة لعامل RH لـ HTR.
يمكن أن يؤدي عدم توافق عامل Rh بين الأم والجنين أيضًا إلى تفاعل انحلالي فرط الحساسية من النوع الثاني، يشار إليه باسم المرض الانحلالي لحديثي الولادة (HDN) (الشكل\(\PageIndex{5}\)). إذا حملت امرأة Rh− طفلًا من Rh+ حتى الولادة، فقد يتعرض الجهاز المناعي للأم لخلايا الدم الحمراء الجنينية Rh+. يحدث هذا التعرض عادة خلال الأشهر الثلاثة الأخيرة من الحمل وأثناء عملية الولادة. في حالة حدوث هذا التعرض، ستقوم كرات الدم الحمراء Rh+ الجنينية بتنشيط الاستجابة المناعية التكيفية الأولية لدى الأم، وسيتم إنتاج الأجسام المضادة لعامل RH IgG. الأجسام المضادة IgG هي الفئة الوحيدة من الأجسام المضادة التي يمكنها عبور المشيمة من الأم إلى الجنين؛ ومع ذلك، في معظم الحالات، لا يتأثر طفل Rh+ الأول بهذه الأجسام المضادة لأن التعرض الأول يحدث عادةً في وقت متأخر بما يكفي من الحمل بحيث لا يكون لدى الأم الوقت الكافي لتكوين أولي كافٍ استجابة الجسم المضاد قبل ولادة الطفل.
ومع ذلك، في حالة حدوث حمل لاحق بجنين Rh+، فإن التعرض الثاني للأم لمستضدات عامل Rh يتسبب في استجابة ثانوية قوية للأجسام المضادة التي تنتج كميات أكبر من عامل IgG المضاد لـ Rh. يمكن لهذه الأجسام المضادة أن تعبر المشيمة من الأم إلى الجنين وتسبب HDN، وهي حالة مميتة محتملة للطفل (الشكل\(\PageIndex{5}\)).
قبل تطوير تقنيات التشخيص والوقاية، كان عدم توافق عامل Rh هو السبب الأكثر شيوعًا لـ HDN، مما أدى إلى آلاف وفيات الرضع كل عام في جميع أنحاء العالم. 7 لهذا السبب، يتم فحص عوامل Rh للآباء المحتملين بانتظام، وقد تم تطوير العلاجات لمنع HDN الناجم عن عدم توافق Rh. لمنع HDN الناتج عن عامل Rh، يتم حقن الجلوبيولين المناعي Rho (D) البشري (مثل RhoGam) عن طريق الوريد أو العضل في الأم خلال الأسبوع الثامن والعشرين من الحمل وفي غضون 72 ساعة بعد الولادة. يمكن إعطاء جرعات إضافية بعد الأحداث التي قد تؤدي إلى نزيف عبر المشيمة (على سبيل المثال، أخذ عينات من الدم السري، وأخذ عينات من الزغابات المشيمية، والصدمات البطنية، وبزل السلى). يبدأ هذا العلاج خلال الحمل الأول بجنين Rh+. سترتبط الأجسام المضادة لـ RH في الجلوبيولين المناعي Rho (D) بعامل Rh لأي خلايا حمراء جنينية يمكنها الوصول إلى مجرى دم الأم، مما يمنع خلايا Rh+ هذه من تنشيط استجابة الأجسام المضادة الأولية للأم. بدون استجابة أولية للجسم المضاد لعامل RH، سيكون للحمل التالي باستخدام Rh+ الحد الأدنى من خطر الإصابة بـ HDN. ومع ذلك، ستحتاج الأم إلى التعافي مع الجلوبيولين المناعي Rho (D) أثناء ذلك الحمل لمنع الاستجابة الأولية المضادة لـ RH التي يمكن أن تهدد حالات الحمل اللاحقة.
استخدم لعبة طباعة الدم التفاعلية هذه لتعزيز معرفتك بفصيلة الدم.
التمارين\(\PageIndex{3}\)
- ماذا يحدث للخلايا التي تمتلك مستضدات غير متوافقة في تفاعل فرط الحساسية من النوع الثاني؟
- وصف المرض الانحلالي عند الوليد وشرح كيف يمكن الوقاية منه.
التركيز السريري: الجزء 2
لا تعرف طبيبة الرعاية الأولية لدى كيري سبب إصابة كيري بالطفح الجلدي بعد قضاء بعض الوقت في الشمس، لذلك تطلب تحليل البول واختبارات الدم الأساسية. كشفت النتائج أن كيري يعاني من البروتينوريا (مستويات البروتين غير الطبيعية في البول)، والهيموجلوبين (الهيموجلوبين الزائد في البول)، وانخفاض نسبة الهيماتوكريت (عدد كرات الدم الحمراء). تشير هذه الاختبارات إلى أن كيري يعاني من نوبة خفيفة من فقر الدم الانحلالي. يشتبه الطبيب في أن المشكلة قد تكون المناعة الذاتية، لذلك تحيل كيري إلى طبيب الروماتيزم لمزيد من الاختبارات والتشخيص.
التمارين\(\PageIndex{4}\)
يتخصص أطباء الروماتيزم في أمراض العضلات والعظام مثل التهاب المفاصل وهشاشة العظام وآلام المفاصل. لماذا قد يحيلها طبيب كيري إلى هذا النوع الخاص من المتخصصين على الرغم من أنها لا تظهر أي من هذه الأعراض؟
فرط الحساسية من النوع الثالث
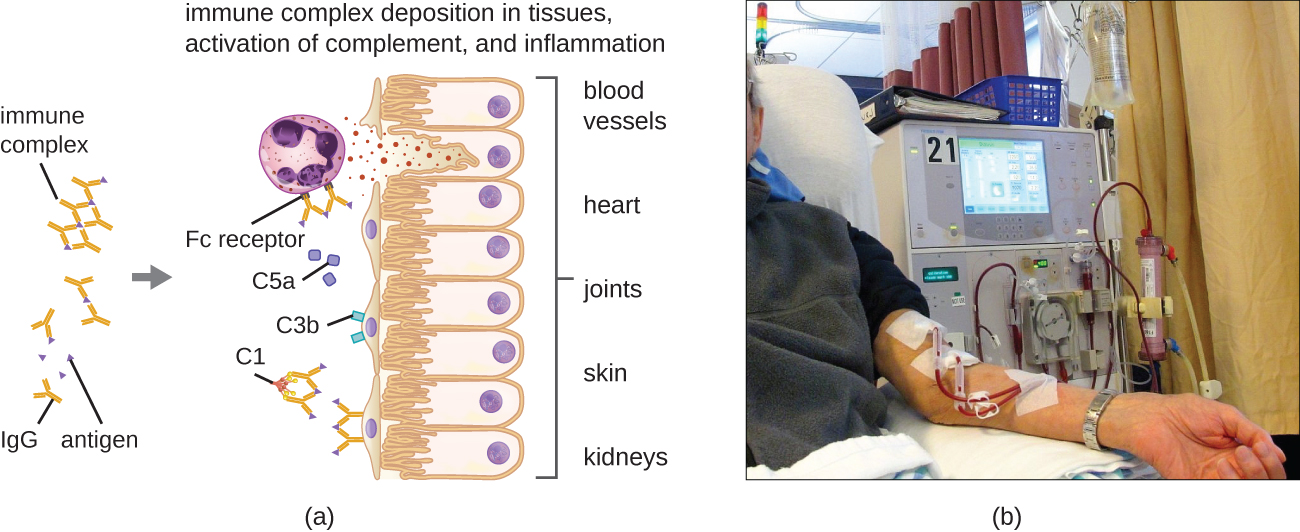
فرط الحساسية من النوع الثالث عبارة عن تفاعلات مناعية معقدة وصفها لأول مرة نيكولا موريس أرثوس (1862-1945) في عام 1903. لإنتاج أجسام مضادة للإجراءات التجريبية، قام Arthus بتحصين الأرانب عن طريق حقنها بمصل من الخيول. ومع ذلك، أثناء تحصين الأرانب بشكل متكرر بمصل الحصان، لاحظ Arthus نزيفًا موضعيًا غير متوقع وغير مُبلغ عنه سابقًا مع تورم في موقع الحقن. تطور هذا التفاعل في غضون 3 إلى 10 ساعات بعد الحقن. كان هذا التفاعل الموضعي لبروتينات المصل غير الذاتية يسمى تفاعل Arthus. يحدث تفاعل Arthus عندما ترتبط المستضدات القابلة للذوبان بـ IgG بنسبة تؤدي إلى تراكم مجاميع الأجسام المضادة للمستضد تسمى المجمعات المناعية.
من الخصائص الفريدة لفرط الحساسية من النوع الثالث زيادة الأجسام المضادة (IgG بشكل أساسي)، إلى جانب تركيز منخفض نسبيًا للمستضد، مما يؤدي إلى تكوين مجمعات مناعية صغيرة تترسب على سطح الخلايا الظهارية المبطنة للتجويف الداخلي للأوعية الدموية الصغيرة أو على الأسطح من الأنسجة (الشكل\(\PageIndex{6}\)). يؤدي هذا التراكم المناعي المركب إلى سلسلة من الأحداث الالتهابية التي تشمل ما يلي:
- ارتباط IgG بمستقبلات الأجسام المضادة على الخلايا البدينة الموضعية، مما يؤدي إلى تحلل الخلايا البدينة
- استكمل التنشيط بإنتاج C3a و C5a المؤيدة للالتهابات (انظر الدفاعات الكيميائية)
- زيادة نفاذية الأوعية الدموية مع التوظيف الكيميائي للعدلات والبلاعم
نظرًا لأن هذه المركبات المناعية ليست بالحجم الأمثل ويتم ترسيبها على أسطح الخلايا، فلا يمكن بلعمتها بالطريقة المعتادة بواسطة العدلات والبلاعم، والتي بدورها غالبًا ما توصف بأنها «محبطة». على الرغم من عدم حدوث البلعمة، إلا أن تحلل العدلات يؤدي إلى إطلاق الإنزيمات الليزوزومية التي تسبب تدميرًا خارج الخلية لمجمع المناعة، مما يؤدي إلى إتلاف الخلايا الموضعية في هذه العملية. يحدث أيضًا تنشيط مسارات التخثر، مما يؤدي إلى تجلط الدم (جلطات الدم) التي تسد الأوعية الدموية وتسبب نقص التروية الذي يمكن أن يؤدي إلى نخر الأوعية الدموية والنزيف الموضعي.
يحدث فرط الحساسية الجهازية من النوع الثالث (داء المصل) عندما تترسب المركبات المناعية في مواقع الجسم المختلفة، مما يؤدي إلى استجابة التهابية جهازية أكثر عمومية. تتضمن هذه المركبات المناعية بروتينات غير ذاتية مثل الأجسام المضادة المنتجة في الحيوانات من أجل المناعة السلبية الاصطناعية (انظر اللقاحات)، أو بعض الأدوية، أو المستضدات الميكروبية التي يتم إطلاقها باستمرار بمرور الوقت أثناء العدوى المزمنة (مثل التهاب الشغاف البكتيري تحت الحاد، والتهاب الشغاف الجرثومي تحت الحاد، والفيروسي المزمن التهاب الكبد). تتشابه آليات داء المصل مع تلك الموصوفة في فرط الحساسية الموضعي من النوع الثالث ولكنها تنطوي على تنشيط واسع النطاق للخلايا البدينة والمكملات والعدلات والبلاعم، مما يتسبب في تدمير الأنسجة في مناطق مثل الكلى والمفاصل والأوعية الدموية. نتيجة لتدمير الأنسجة، تشمل أعراض مرض المصل القشعريرة والحمى والطفح الجلدي والتهاب الأوعية الدموية والتهاب المفاصل. من الممكن أيضًا تطوير التهاب كبيبات الكلى أو التهاب الكبد.
يمكن أن تنطوي أمراض المناعة الذاتية مثل الذئبة الحمامية الجهازية (SLE) والتهاب المفاصل الروماتويدي أيضًا على تفاعلات فرط الحساسية الضارة من النوع الثالث عندما تشكل الأجسام المضادة الذاتية مجمعات مناعية مع مستضدات ذاتية. تمت مناقشة هذه الحالات في اضطرابات المناعة الذاتية.
التمارين\(\PageIndex{5}\)
- لماذا تعتبر الأجسام المضادة مهمة في فرط الحساسية من النوع الثالث؟
- وصف الاختلافات بين تفاعل Arthus ومرض المصل.
مضاد السموم للدفتيريا
أصبحت الأمصال المضادة للبكتيريا أقل شيوعًا بكثير الآن مما كانت عليه في الماضي، حيث تم استبدالها بلقاحات التوكسويد. ومع ذلك، فإن مضاد الدفتيريا الذي تنتجه الخيول هو أحد الأمثلة على هذا العلاج الذي لا يزال مستخدمًا في بعض أنحاء العالم. على الرغم من أن مضاد الدفتيريا غير مرخص من قبل إدارة الغذاء والدواء الأمريكية للاستخدام في الولايات المتحدة، إلا أنه يمكن استخدام مضاد الدفتيريا لعلاج حالات الدفتيريا، التي تسببها بكتيريا Corynebacterium deptiveriae. 8 لكن العلاج لا يخلو من المخاطر. يمكن أن يحدث مرض المصل عندما يطور المريض استجابة مناعية لبروتينات الخيول غير الذاتية. تتكون المجمعات المناعية بين بروتينات الحصان والأجسام المضادة المتداولة عندما يوجد الاثنان بنسب معينة. يمكن أن تترسب هذه المركبات المناعية في الأعضاء، مما يتسبب في أضرار مثل التهاب المفاصل والتهاب الكلية والطفح الجلدي والحمى. عادة ما يكون مرض المصل عابرًا دون أي ضرر دائم ما لم يتعرض المريض بشكل مزمن للمستضد، مما قد يؤدي بعد ذلك إلى تلف لا رجعة فيه لمواقع الجسم مثل المفاصل والكلى. مع مرور الوقت، تتمكن الخلايا البلعمية مثل البلاعم من إزالة مستضدات مصل الحصان، مما يؤدي إلى تحسين حالة المريض وانخفاض الأعراض مع تبدد الاستجابة المناعية.
التركيز السريري: الجزء 3
لا يصل كيري إلى طبيب الروماتيزم. إنها تعاني من نوبة صرع أثناء مغادرتها مكتب طبيب الرعاية الأولية. يتم نقلها بسرعة إلى قسم الطوارئ، حيث يروي طبيب الرعاية الأولية تاريخها الطبي ونتائج الاختبارات الأخيرة. يقوم طبيب قسم الطوارئ باستدعاء أخصائي أمراض الروماتيزم من طاقم المستشفى للاستشارة. استنادًا إلى الأعراض ونتائج الاختبار، يشتبه طبيب الروماتيزم في إصابة كيري بمرض الذئبة ويطلب إجراء زوج من اختبارات الدم: اختبار الأجسام المضادة للنواة (ANA) للبحث عن الأجسام المضادة المرتبطة بالحمض النووي واختبار آخر يبحث عن الأجسام المضادة التي ترتبط بمستضد ذاتي يسمى مستضد سميث (Sm).
التمارين\(\PageIndex{6}\)
بناءً على اختبارات الدم المطلوبة، ما نوع رد الفعل الذي يشتبه طبيب الروماتيزم في أنه يسبب نوبة كيري؟
فرط الحساسية من النوع الرابع
لا تتوسط فرط الحساسية من النوع الرابع الأجسام المضادة مثل الأنواع الثلاثة الأخرى من فرط الحساسية. بدلاً من ذلك، يتم تنظيم فرط الحساسية من النوع الرابع بواسطة الخلايا التائية وتنطوي على عمل الخلايا المستجيبة. يمكن تنظيم هذه الأنواع من فرط الحساسية في ثلاث فئات فرعية بناءً على النوع الفرعي للخلايا التائية ونوع المستضد وآلية المستجيب الناتجة (الجدول\(\PageIndex{5}\)).
في الفئة الفرعية الأولى من النوع الرابع، توصف التفاعلات بوساطة CD4 T H 1 بأنها فرط الحساسية من النوع المتأخر (DTH). تتضمن خطوة التحسس إدخال المستضد إلى الجلد وزيادة البلعمة بواسطة الخلايا التي تعرض المستضد المحلي (APCs). تقوم APCs بتنشيط الخلايا التائية المساعدة، مما يحفز التكاثر النسيلي والتمايز في خلايا الذاكرة T H 1. عند التعرض اللاحق للمستضد، تطلق خلايا الذاكرة الحساسة T H 1 السيتوكينات التي تنشط البلاعم، وتكون البلاعم المنشطة مسؤولة عن الكثير من تلف الأنسجة. توجد أمثلة على فرط الحساسية بوساطة T H 1 في السلين واختبار Mantoux للجلد والتهاب الجلد التماسي، كما يحدث في تفاعلات الحساسية تجاه اللاتكس.
في الفئة الفرعية الثانية من النوع الرابع، تؤدي التفاعلات بوساطة CD4 T H 2 إلى الربو المزمن أو التهاب الأنف التحسسي المزمن. في هذه الحالات، يتم استنشاق المستضد القابل للذوبان أولاً، مما يؤدي إلى تجنيد اليوزينوفيل وتنشيطه مع إطلاق السيتوكينات والوسطاء الالتهابيين.
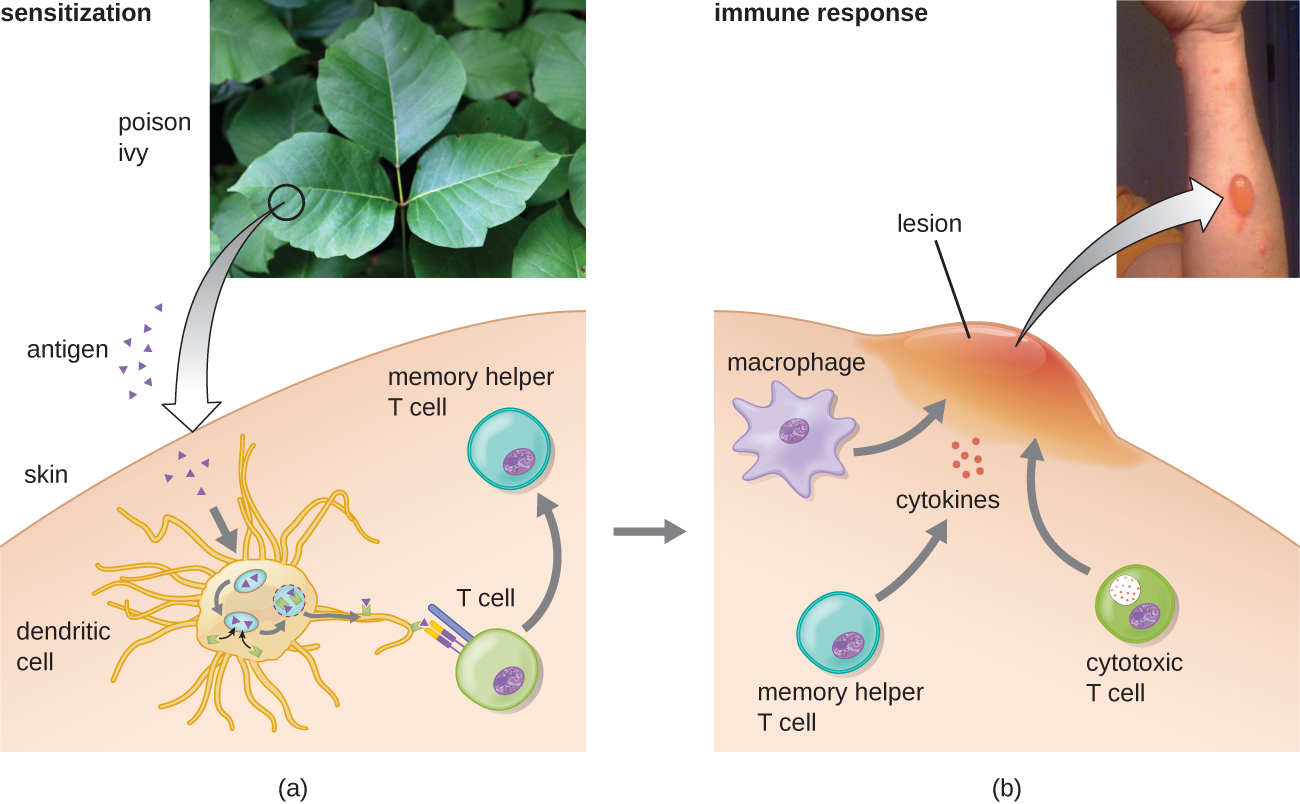
في الفئة الفرعية الثالثة من النوع الرابع، ترتبط تفاعلات CD8 اللمفاوية التائية السامة للخلايا (CTL) برفض زراعة الأنسجة والتهاب الجلد التماسي (الشكل\(\PageIndex{7}\)). بالنسبة لهذا الشكل من فرط الحساسية بوساطة الخلية، تقوم APCs بمعالجة وتقديم المستضد باستخدام MHC I إلى خلايا CD8 T الساذجة. عندما يتم تنشيط خلايا CD8 T الساذجة هذه، فإنها تتكاثر وتتفرق إلى CTLs. يمكن لخلايا T H 1 المنشطة أيضًا تعزيز تنشيط CTLs. ثم تستهدف CTLs المنشطة وتحفز موت الخلايا المبرمج بوساطة الجرانزيم في الخلايا التي تقدم نفس المستضد مع MHC I. يمكن أن تكون هذه الخلايا المستهدفة خلايا «ذاتية» امتصت المستضد الأجنبي (مثل التهاب الجلد التماسي بسبب اللبلاب السام)، أو يمكن أن تكون خلايا نسيجية مزروعة تظهر غريبة مستضد من المتبرع.
| فئة فرعية | المستضد | آلية المستجيب | أمثلة |
|---|---|---|---|
| 1 | مستضد قابل للذوبان | تتسبب البلاعم النشطة في تلف الأنسجة وتعزيز الاستجابة الالتهابية | التهاب الجلد التماسي (مثل التعرض لمادة اللاتكس) وفرط الحساسية المتأخر من النوع (مثل تفاعل السلين) |
| 2 | مستضد قابل للذوبان | يؤدي توظيف Eosinophil وتنشيطه إلى إطلاق السيتوكينات والمواد الكيميائية المؤيدة للالتهابات | الربو المزمن والتهاب الأنف التحسسي المزمن |
| 3 | المستضد المرتبط بالخلايا | السمية الخلوية بوساطة CTL | التهاب الجلد التماسي (مثل ملامسة اللبلاب السام) ورفض زراعة الأنسجة |
التمارين\(\PageIndex{7}\)
- وصف الأنواع الفرعية الثلاثة من فرط الحساسية من النوع الرابع.
- اشرح كيف تساهم الخلايا التائية في تلف الأنسجة في فرط الحساسية من النوع الرابع.
استخدام فرط الحساسية المتأخر لاختبار السل
وصف طبيب الأطفال النمساوي كليمانز فون بيركيت (1874-1929) لأول مرة آليات الحساسية، بما في ذلك داء المصل من النوع الثالث. 9 أدى اهتمامه إلى تطوير اختبار السل (TB)، باستخدام مستضد التوبركولين، استنادًا إلى عمل سابق لتحديد مسببات مرض السل الذي أجراه روبرت كوخ. تضمنت طريقة Pirquet الخدش، مما يؤدي إلى ثقوب متعددة في وقت واحد، باستخدام جهاز مزود بمجموعة من الإبر لكسر الجلد عدة مرات في منطقة صغيرة. كان جهاز Pirquet المستخدم مشابهًا لجهاز اختبار الصفيح الذي يحتوي على أربع إبر موضحة في الشكل\(\PageIndex{8}\).
يتم تغليف أطراف جميع الإبر في المصفوفة بالتوبركولين، وهو مستخلص بروتيني من بكتيريا السل، مما يؤدي إلى إدخال التوبركولين بشكل فعال إلى الجلد. بعد يوم إلى ثلاثة أيام، يمكن فحص المنطقة بحثًا عن تفاعل فرط الحساسية المتأخر، وتشمل علاماته التورم والاحمرار.
كما يمكنك أن تتخيل، لم يكن الخدش تجربة ممتعة (10)، كما أن الثقوب الجلدية العديدة عرضت المريض لخطر الإصابة بعدوى بكتيرية في الجلد. قامت Mantoux بتعديل اختبار Pirquet لاستخدام حقنة واحدة تحت الجلد من مادة التوبركولين النقية. لا يعني الاختبار الإيجابي، الذي يشير إليه التورم الموضعي المتأخر في موقع الحقن، بالضرورة أن المريض مصاب حاليًا بالسل النشط. نظرًا لأن فرط الحساسية من النوع الرابع (النوع المتأخر) يتم التوسط فيه عن طريق إعادة تنشيط خلايا الذاكرة التائية، فقد تكون هذه الخلايا قد تكونت مؤخرًا (بسبب عدوى حالية نشطة) أو قبل سنوات (إذا كان المريض مصابًا بالسل وقام بإزالته تلقائيًا، أو إذا كان قد دخل في زمن الاستجابة). ومع ذلك، يمكن استخدام الاختبار لتأكيد الإصابة في الحالات التي تشير فيها الأعراض لدى المريض أو نتائج التصوير الشعاعي إلى وجودها.

فرط الحساسية (التهاب رئوي)
بعض الأمراض التي تسببها فرط الحساسية لا تنتج حصريًا عن نوع واحد. على سبيل المثال، يحدث التهاب الرئة الناتج عن فرط الحساسية (HP)، والذي غالبًا ما يكون مرضًا مهنيًا أو بيئيًا، عندما تلتهب الرئتان بسبب رد فعل تحسسي تجاه الغبار المستنشق أو المسام الداخلية أو ريش الطيور أو فضلات الطيور أو العفن أو المواد الكيميائية. تستخدم HP العديد من الأسماء المختلفة المرتبطة بأشكال التعرض المختلفة (الشكل\(\PageIndex{9}\)). يُطلق على HP المرتبطة بفضلات الطيور أحيانًا اسم رئة مربي الحمام أو رئة عامل الدواجن - وكلاهما شائع في مربي الطيور والمتعاملين معها. يعد مرض معالج الجبن ورئة المزارع ومرض متعاطي الساونا ورئة حوض الاستحمام الساخن من الأسماء الأخرى لـ HP المرتبطة بالتعرض للعفن في بيئات مختلفة.
يمكن أن تكون الأمراض المرتبطة بـ HP ناتجة عن فرط الحساسية من النوع الثالث (بوساطة المركبات المناعية) والنوع الرابع (بوساطة خلايا T H 1 والبلاعم). يمكن أن يسبب التعرض المتكرر لمسببات الحساسية التهاب الأسناخ بسبب تكوين مجمعات مناعية في الجدار السنخي للرئة مصحوبة بتراكم السوائل، وتشكيل الأورام الحبيبية والآفات الأخرى في الرئة نتيجة تنشيط البلاعم بوساطة T H 1. يؤدي التهاب الأسناخ مع تكوين السوائل والورم الحبيبي إلى ضعف نضح الأكسجين في الحويصلات الهوائية، والذي بدوره يمكن أن يسبب أعراضًا مثل السعال وضيق التنفس والقشعريرة والحمى والتعرق والألم العضلي والصداع والغثيان. قد تحدث الأعراض بسرعة تصل إلى ساعتين بعد التعرض ويمكن أن تستمر لأسابيع إذا تركت دون علاج.

التمارين\(\PageIndex{8}\)
اشرح لماذا يعتبر التهاب الرئة الناتج عن فرط الحساسية مرضًا مهنيًا.
\(\PageIndex{10}\)يلخص الشكل آليات وتأثيرات كل نوع من أنواع فرط الحساسية التي تمت مناقشتها في هذا القسم.
تشخيص فرط الحساسية
يعد تشخيص فرط الحساسية من النوع الأول عملية معقدة تتطلب العديد من الاختبارات التشخيصية بالإضافة إلى تاريخ المريض الموثق جيدًا. يمكن قياس مستويات IgE في المصل، لكن ارتفاع IgE وحده لا يؤكد مرض الحساسية. كجزء من عملية تحديد المستضدات المسؤولة عن حساسية التفاعل من النوع الأول، يمكن إجراء الاختبار من خلال اختبار ثقب الجلد (PPST) أو اختبار داخل الأدمة. يتم إجراء PPST بإدخال مسببات الحساسية في سلسلة من الوخز الجلدي السطحي على ظهر المريض أو ذراعيه (الشكل\(\PageIndex{11}\)). تعتبر PPSTs الطريقة الأكثر ملاءمة والأقل تكلفة لتشخيص الحساسية، وفقًا للمجلس الأمريكي المشترك للحساسية والأكاديمية الأوروبية للحساسية والمناعة. يتطلب النوع الثاني من الاختبارات، وهو الاختبار داخل الأدمة، الحقن في الأدمة بإبرة صغيرة. هذه الإبرة، المعروفة أيضًا باسم إبرة التوبركولين، متصلة بحقنة تحتوي على كمية صغيرة من مسببات الحساسية. تتم ملاحظة كل من اختبارات PPST والاختبارات داخل الأدمة لمدة 15-20 دقيقة لتفاعل توهج العجلة مع مسببات الحساسية. يشير قياس أي تورم (نتوء مرتفع ومثير للحكة) والتوهج (الاحمرار) في غضون دقائق إلى فرط الحساسية من النوع الأول، وكلما زاد تفاعل توهج العجلة، زادت حساسية المريض لمسببات الحساسية.
غالبًا ما يتم تشخيص فرط الحساسية من النوع الثالث بشكل خاطئ بسبب طبيعتها الالتهابية غير المحددة. يمكن رؤية الأعراض بسهولة، ولكنها قد ترتبط بأي من عدد من الأمراض الأخرى. يعد التاريخ القوي والشامل للمريض أمرًا بالغ الأهمية للتشخيص الصحيح والدقيق. تشمل الاختبارات المستخدمة لتحديد تشخيص التهاب الرئة الناتج عن فرط الحساسية (الناتج عن فرط الحساسية من النوع الثالث) غسل القصبات الهوائية (BAL) واختبارات وظائف الرئة والتصوير المقطعي عالي الدقة (HRCT).
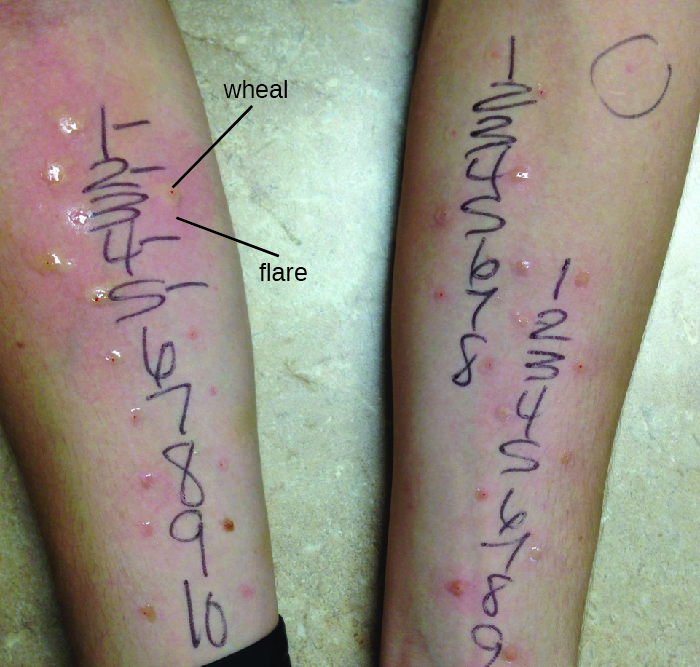
التمارين\(\PageIndex{9}\)
- وصف اختبار ثقب الجلد بالوخز.
- اشرح لماذا يصعب تشخيص فرط الحساسية من النوع الثالث
علاجات فرط الحساسية
يمكن علاج ردود الفعل التحسسية بطرق مختلفة. يمكن تحقيق الوقاية من ردود الفعل التحسسية عن طريق علاج إزالة الحساسية (نقص الحساسية)، والذي يمكن استخدامه لتقليل تفاعل فرط الحساسية من خلال الحقن المتكرر لمسببات الحساسية. يتم حقن تركيزات مخففة للغاية من مسببات الحساسية المعروفة (المحددة من اختبارات مسببات الحساسية) في المريض على فترات محددة (على سبيل المثال، أسبوعيًا). تزداد كمية المواد المسببة للحساسية التي تنتجها الحقن ببطء خلال فترة التراكم حتى يتم تحديد الجرعة الفعالة والحفاظ على تلك الجرعة طوال فترة العلاج، والتي يمكن أن تستمر لسنوات. عادة ما يتم تشجيع المرضى على البقاء في عيادة الطبيب لمدة 30 دقيقة بعد تلقي الحقن في حالة تسبب مسببات الحساسية التي يتم تناولها في رد فعل جهازي شديد. يجب أن تكون مكاتب الأطباء التي تدير علاج إزالة الحساسية مستعدة لتوفير الإنعاش والعلاج الدوائي في حالة حدوث مثل هذا الحدث.
يستخدم علاج إزالة الحساسية لحساسية لدغات الحشرات والحساسية البيئية. تحفز حقن الحساسية إنتاج مختلف من الإنترلوكين واستجابات الأجسام المضادة IgG بدلاً من IgE. عندما يتم إنتاج الأجسام المضادة IgG الزائدة الخاصة بمسببات الحساسية وربطها بمسببات الحساسية، فإنها يمكن أن تعمل كأجسام مضادة لتحييد مسببات الحساسية قبل أن تتمكن من ربط IgE بالخلايا البدينة. هناك دراسات مبكرة تستخدم العلاج الفموي لإزالة الحساسية الغذائية الواعدة. 11 12 تتضمن هذه الدراسات إطعام الأطفال الذين يعانون من الحساسية بكميات صغيرة من مسببات الحساسية (مثل دقيق الفول السوداني) أو البروتينات ذات الصلة بمرور الوقت. أظهر العديد من الأشخاص انخفاضًا في شدة رد الفعل تجاه مسببات الحساسية الغذائية بعد العلاج.
هناك أيضًا علاجات مصممة لعلاج ردود الفعل التحسسية الشديدة. يتم علاج الحساسية المفرطة الجهازية الطارئة في البداية عن طريق حقن الإيبينيفرين، والذي يمكن أن يقاوم انخفاض ضغط الدم. غالبًا ما يحمل الأفراد الذين يعانون من الحساسية الشديدة المعروفة حاقن تلقائي ذاتي الإدارة يمكن استخدامه في حالة التعرض لمسببات الحساسية (على سبيل المثال، لدغة الحشرات أو الابتلاع العرضي للطعام الذي يسبب تفاعلًا شديدًا). من خلال إعطاء حقنة الإيبينيفرين ذاتيًا (أو أحيانًا اثنتين)، يمكن للمريض إيقاف التفاعل لفترة كافية لطلب العناية الطبية. يتضمن علاج المتابعة عمومًا إعطاء المريض مضادات الهيستامين والكورتيكوستيرويدات بطيئة المفعول لعدة أيام بعد التفاعل لمنع التفاعلات المحتملة في المرحلة المتأخرة. ومع ذلك، لم تتم دراسة آثار مضادات الهيستامين والعلاج بالكورتيكوستيرويد جيدًا ويتم استخدامها بناءً على اعتبارات نظرية.
عادةً ما يتضمن علاج ردود الفعل التحسسية الخفيفة مضادات الهيستامين والأدوية الأخرى المضادة للالتهابات. تتوفر مجموعة متنوعة من أدوية مضادات الهيستامين، سواء بوصفة طبية أو من دون وصفة طبية. هناك أيضًا أدوية مضادة لليوكوترين ومضادة للبروستاجلاندين يمكن استخدامها جنبًا إلى جنب مع أدوية مضادات الهيستامين في نظام علاج مشترك (وأكثر فعالية).
تشمل علاجات فرط الحساسية من النوع الثالث منع التعرض الإضافي للمستضد واستخدام الأدوية المضادة للالتهابات. يمكن حل بعض الحالات عند منع التعرض للمستضد. يمكن أيضًا استخدام أجهزة الاستنشاق المضادة للالتهابات بالكورتيكوستيرويد لتقليل الالتهاب للسماح لآفات الرئة بالشفاء. يعتبر العلاج الجهازي بالكورتيكوستيرويد، عن طريق الفم أو الوريد، شائعًا أيضًا في حالات فرط الحساسية من النوع الثالث التي تؤثر على يشمل علاج التهاب الرئة الناتج عن فرط الحساسية تجنب مسببات الحساسية، إلى جانب إمكانية إضافة الستيرويدات التي تُصرف بوصفة طبية مثل بريدنيزون لتقليل الالتهاب.
يشمل علاج فرط الحساسية من النوع الرابع مضادات الهيستامين والأدوية المضادة للالتهابات والمسكنات، وإذا أمكن، القضاء على المزيد من التعرض للمستضد.
التمارين\(\PageIndex{10}\)
- وصف علاج إزالة التحسس.
- شرح دور الإيبينيفرين في علاج تفاعلات فرط الحساسية.
المفاهيم الأساسية والملخص
- الحساسية هي استجابة مناعية تكيفية، وأحيانًا مهددة للحياة، لمسببات الحساسية.
- يتطلب فرط الحساسية من النوع الأول تحسس الخلايا البدينة بـ IgE، بما في ذلك استجابة أولية للأجسام المضادة IgE وارتباط IgE بالخلايا البدينة. عند التعرض للمرة الثانية لمسببات الحساسية، يؤدي الربط المتقاطع لجزيئات IgE على الخلايا البدينة إلى تحلل التحبيب وإطلاق وسطاء الالتهاب الكيميائي المشكل مسبقًا والمكون حديثًا. قد يكون فرط الحساسية من النوع الأول موضعيًا وصغيرًا نسبيًا (الشرى وحمى القش) أو على مستوى النظام وخطيرًا (الحساسية المفرطة الجهازية).
- تنجم فرط الحساسية من النوع الثاني عن ارتباط الأجسام المضادة بالمستضدات على الخلايا وبدء الاستجابات السامة للخلايا. ومن الأمثلة على ذلك تفاعل نقل الدم الانحلالي ومرض الانحلالي عند الوليد.
- تنجم فرط الحساسية من النوع الثالث عن تكوين وتراكم المجمعات المناعية في الأنسجة، مما يحفز الاستجابات الالتهابية الضارة.
- لا يتم التوسط في فرط الحساسية من النوع الرابع عن طريق الأجسام المضادة، ولكن عن طريق تنشيط الخلايا التائية المساعدة للبلاعم والحمضات والخلايا التائية السامة للخلايا.
الحواشي
- 1 دي إس ستراير وآخرون (محرران). علم أمراض روبين: الأسس السريرية الباثولوجية للطب. الطبعة السابعة 2 فيلادلفيا، بنسلفانيا: ليبينكوت، ويليامز وويلكينز، 2014.
- 2 سي إم فيتزسيمونز وآخرون «مسببات الحساسية للديدان، IgE الخاص بالطفيليات، ودورها الوقائي في مناعة الإنسان.» الحدود في علم المناعة 5 (2015) :47.
- 3 إس تي فايس «تناول الأوساخ - فرضية النظافة وأمراض الحساسية». مجلة نيو إنجلاند للطب 347 رقم 12 (2002): 930-931.
- 4 D.P. Strachan «حمى القش والنظافة وحجم الأسرة». المجلة الطبية البريطانية 299 رقم 6710 (1989): 1259.
- 5 إتش أوكادا وآخرون. «فرضية النظافة» لأمراض المناعة الذاتية والحساسية: تحديث.» علم المناعة السريري والتجريبي 160 رقم 1 (2010): 1-9.
- 6 إي سي فامفاكاس، إم إيه بلانشمان. «الوفيات المرتبطة بنقل الدم: المخاطر المستمرة لنقل الدم الخيفي والاستراتيجيات المتاحة للوقاية منها.» الدم 113 رقم 15 (2009): 3406-3417.
- 7 جي ريالي. «أربعون عامًا من الوقاية المناعية المضادة لـ D.» نقل الدم رقم 5 رقم 1 (2007): 3-6.
- 8 مراكز للسيطرة على الأمراض والوقاية منها. «مضاد السموم للدفتيريا». http://www.cdc.gov/diphtheria/dat.html. تم الوصول إليه في 25 مارس 2016.
- 9 B. Huber «100 Jahre Allergie: كليمنس فون بيريكيت—شتاين Allergiebegriff und as him zugrunde liegende Krankheitsverständnis.» وينر كلينيش ووتشنشكريفت 118 رقم 19-20 (2006): 573-579.
- 10 سي إيه ستيوارت. «اختبار Pirquet: مقارنة بين طرق الخدش والثقب في التطبيق.» أرشيف طب الأطفال والمراهقين 35 رقم 3 (1928): 388-391.
- 11 سي إل شنايدر وآخرون. «دراسة تجريبية لأوماليزوماب لتسهيل إزالة الحساسية الفموية السريعة لدى مرضى حساسية الفول السوداني المعرضين للخطر.» مجلة الحساسية والمناعة السريرية 132 رقم 6 (2013): 1368—1374.
- 12 بي. فارشني وآخرون. «دراسة عشوائية مضبوطة للعلاج المناعي الفموي للفول السوداني: إزالة الحساسية السريرية وتعديل الاستجابة التحسسية.» مجلة الحساسية والمناعة السريرية 127 رقم 3 (2011): 654-660.


