15.3: عوامل الفوعة
- Page ID
- 194677
أهداف التعلم
- اشرح كيف تساهم عوامل الضراوة في علامات وأعراض الأمراض المعدية
- فرّق بين السموم الداخلية والسموم الخارجية
- وصف وتمييز أنواع مختلفة من السموم الخارجية
- وصف الآليات التي تستخدمها الفيروسات للالتصاق والتغير المستضدي
أوضحنا في القسم السابق أن بعض مسببات الأمراض أكثر ضراوة من غيرها. ويرجع ذلك إلى عوامل الضراوة الفريدة التي تنتجها مسببات الأمراض الفردية، والتي تحدد مدى وشدة المرض الذي قد تسببه. يتم ترميز عوامل ضراوة العامل الممرض بواسطة الجينات التي يمكن تحديدها باستخدام افتراضات Koch الجزيئية. عندما يتم تعطيل الجينات التي ترمز إلى عوامل الضراوة، تقل ضراوة العامل الممرض. في هذا القسم، ندرس أنواعًا مختلفة وأمثلة محددة لعوامل الضراوة وكيفية مساهمتها في كل خطوة من خطوات التسبب في المرض.
عوامل الضراوة للالتصاق
كما تمت مناقشته في القسم السابق، فإن أول خطوتين في التسبب في المرض هما التعرض والالتصاق. تذكر أن مادة الأديسين عبارة عن بروتين أو بروتين سكري موجود على سطح العامل الممرض الذي يرتبط بمستقبلات الخلية المضيفة. توجد المواد اللاصقة في مسببات الأمراض البكتيرية والفيروسية والفطرية والبروتوزوان. أحد الأمثلة على الالتصاق البكتيري هو اللاصق الغشائي من النوع الأول، وهو جزيء موجود على أطراف فيمبريا الإشريكية القولونية المعوية (ETEC). تذكر أن الألياف عبارة عن شعيرات بروتينية تشبه الشعر على سطح الخلية. يسمح الالتصاق الغشائي من النوع الأول لأغشية خلايا ETEC بالالتصاق بالجليكان المانوز المعبر عنه في الخلايا الظهارية المعوية. \(\PageIndex{1}\)يسرد الجدول المواد اللاصقة الشائعة الموجودة في بعض مسببات الأمراض التي ناقشناها أو سنراها لاحقًا في هذا الفصل.
| العامل الممرض | مرض | مادة لاصقة | موقع المرفقات | |
|---|---|---|---|---|
| المكورات العقدية المقيحة | التهاب الحلق | بروتين إف | الخلايا الظهارية التنفسية | |
| المكورات العقدية الطافرة | تسوس الأسنان | لاصق P1 | أسنان | |
| النيسرية السيلانية | مرض السيلان | حبوب منع الحمل من النوع الرابع | الخلايا الظهارية الإحليلية | |
| الإشريكية القولونية المعوية (ETEC) | إسهال المسافر | نوع 1 فيمبريا | الخلايا الظهارية المعوية | |
| فيبريو كوليرا | كوليرا | حمض إن-ميثيل فينيلالانين | الخلايا الظهارية المعوية |
التركيز السريري: الجزء 3
يعد وجود البكتيريا في دم مايكل علامة على الإصابة، لأن الدم عادة ما يكون عقيمًا. ليس هناك ما يشير إلى أن البكتيريا دخلت الدم من خلال الإصابة. بدلاً من ذلك، يبدو أن بوابة الدخول كانت طريق الجهاز الهضمي. استنادًا إلى أعراض مايكل، ونتائج فحص دمه، وحقيقة أن مايكل كان الوحيد في العائلة الذي شارك في تناول الهوت دوغ، يشتبه الطبيب في أن مايكل يعاني من حالة من مرض الليستريات.
تعد الليستيريا أحادية الخلية، العامل الممرض الاختياري داخل الخلايا الذي يسبب داء الليستريات، من الملوثات الشائعة في الأطعمة الجاهزة للأكل مثل لحوم الغداء ومنتجات الألبان. بمجرد تناولها، تغزو هذه البكتيريا الخلايا الظهارية المعوية وتنتقل إلى الكبد، حيث تنمو داخل الخلايا الكبدية. يعتبر داء الليستريات مميتًا في حوالي واحد من كل خمسة أشخاص أصحاء عاديين، ومعدلات الوفيات أعلى قليلاً في المرضى الذين يعانون من حالات موجودة مسبقًا تضعف الاستجابة المناعية. مجموعة من جينات الضراوة المشفرة على جزيرة مسببة للأمراض هي المسؤولة عن إمراضية L. monocytogenes. يتم تنظيم هذه الجينات بواسطة عامل نسخ يعرف باسم عامل إطلاق سلسلة الببتيد 1 (PrFa). أحد الجينات التي ينظمها PrFa هو hyl، الذي يقوم بتشفير السم المعروف باسم الليستيريوليسين O (LLO)، والذي يسمح للبكتيريا بالهروب من الفجوات عند الدخول إلى الخلية المضيفة. الجين الثاني الذي ينظمه PrFa هو acTA، الذي يقوم بترميز البروتين السطحي المعروف باسم البروتين المحفز لتجميع الأكتين (ActA). يتم التعبير عن ACTa على سطح الليستيريا ويقوم بلمر أكتين المضيف. يتيح ذلك للبكتيريا إنتاج ذيول الأكتين، والتحرك حول السيتوبلازم في الخلية، والانتشار من خلية إلى أخرى دون الخروج إلى المقصورة خارج الخلية.
بدأت حالة مايكل في التدهور. وهو يعاني الآن من تيبس الرقبة وشلل نصفي (ضعف أحد جانبي الجسم). خوفًا من انتشار العدوى، يقرر الطبيب إجراء اختبارات إضافية لتحديد سبب هذه الأعراض الجديدة.
التمارين\(\PageIndex{1}\)
- ما نوع العامل الممرض الذي يسبب داء الليستريات، وما هي عوامل الضراوة التي تساهم في العلامات والأعراض التي يعاني منها مايكل؟
- هل من المحتمل أن تنتشر العدوى من دم مايكل؟ إذا كان الأمر كذلك، كيف يمكن أن يفسر هذا أعراضه الجديدة؟
الإنزيمات الخارجية البكتيرية والسموم كعوامل ضراوة
بعد التعرض والالتصاق، فإن الخطوة التالية في التسبب في المرض هي الغزو، والذي يمكن أن يشمل الإنزيمات والسموم. تحقق العديد من مسببات الأمراض الغزو عن طريق دخول مجرى الدم، وهي وسيلة فعالة للنشر لأن الأوعية الدموية تمر بالقرب من كل خلية في الجسم. الجانب السلبي لآلية التشتت هذه هو أن الدم يتضمن أيضًا العديد من عناصر الجهاز المناعي. تُستخدم مصطلحات مختلفة تنتهي بـ -emia لوصف وجود مسببات الأمراض في مجرى الدم. يسمى وجود البكتيريا في الدم بتجرثم الدم. تُسمى تجرثم الدم التي تشمل الكائنات الحية (البكتيريا المكونة للقيح) بالبيميا. عندما يتم العثور على الفيروسات في الدم، يطلق عليها اسم فيريميا. يصف مصطلح توكسيميا الحالة عندما توجد السموم في الدم. إذا كانت البكتيريا موجودة وتتكاثر في الدم، فإن هذه الحالة تسمى تسمم الدم.
يُوصف المرضى الذين يعانون من تسمم الدم بأنهم يعانون من تعفن الدم، مما قد يؤدي إلى حدوث صدمة، وانخفاض ضغط الدم الذي يهدد الحياة (الضغط الانقباضي <90 ملم زئبق) الذي يمنع الخلايا والأعضاء من تلقي كمية كافية من الأكسجين والمواد المغذية. يمكن لبعض البكتيريا أن تسبب صدمة من خلال إطلاق السموم (عوامل الضراوة التي يمكن أن تسبب تلف الأنسجة) وتؤدي إلى انخفاض ضغط الدم. تلتهم الخلايا البلعمية في الجهاز المناعي البكتيريا سالبة الجرام، والتي تطلق بعد ذلك عامل نخر الورم، وهو جزيء يشارك في الالتهاب والحمى. يرتبط عامل نخر الورم بالشعيرات الدموية لزيادة نفاذيتها، مما يسمح للسوائل بالخروج من الأوعية الدموية إلى الأنسجة، مما يسبب التورم أو الوذمة (الشكل\(\PageIndex{1}\)). مع التركيزات العالية لعامل نخر الورم، يكون التفاعل الالتهابي شديدًا ويتم فقدان كمية كافية من السوائل من الجهاز الدوري بحيث ينخفض ضغط الدم إلى مستويات منخفضة بشكل خطير. يمكن أن يكون لهذا عواقب وخيمة لأن القلب والرئتين والكلى تعتمد على ضغط الدم الطبيعي من أجل الوظيفة المناسبة؛ وبالتالي، يمكن أن يحدث فشل متعدد الأعضاء والصدمة والموت.
إنزيمات خارجية
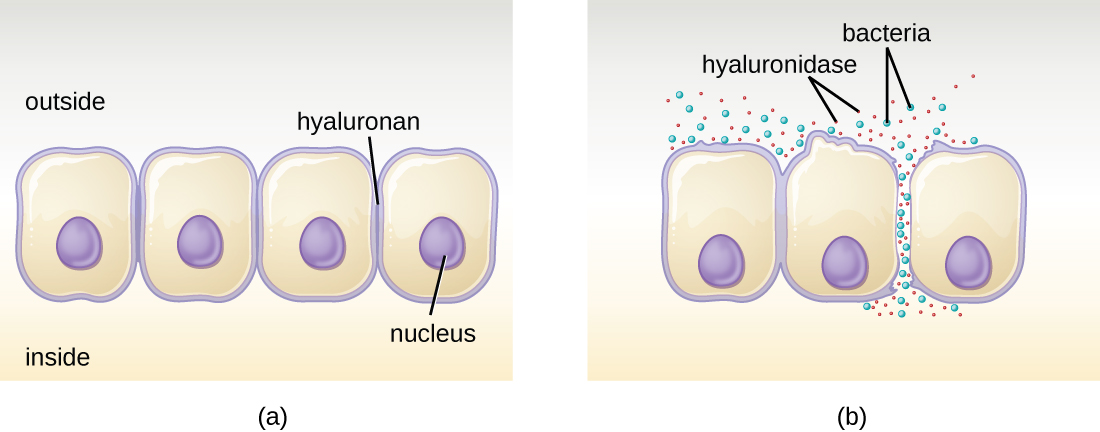
تنتج بعض مسببات الأمراض إنزيمات خارج الخلية، أو إنزيمات خارجية، تمكنها من غزو الخلايا المضيفة والأنسجة العميقة. تحتوي الإنزيمات الخارجية على مجموعة متنوعة من الأهداف. يتم سرد بعض الفئات العامة من الإنزيمات الخارجية ومسببات الأمراض المرتبطة بها في الجدول\(\PageIndex{2}\). تعمل كل من هذه الإنزيمات الخارجية في سياق بنية نسيج معينة لتسهيل الغزو أو دعم نموها والدفاع ضد جهاز المناعة. على سبيل المثال، يقوم هيالورونيداز S، وهو إنزيم تنتجه مسببات الأمراض مثل المكورات العنقودية الذهبية والمكورات العقدية المقيحة والكلوستريديوم بيرفرينجنز، بتحلل جليكوسيد هيلورونان (حمض الهيالورونيك)، الذي يعمل كأسمنت بين الخلايا بين الخلايا المجاورة في الجهاز الضام. الأنسجة (الشكل\(\PageIndex{2}\)). هذا يسمح للممرض بالمرور عبر طبقات الأنسجة عند بوابة الدخول والانتشار في مكان آخر في الجسم (الشكل\(\PageIndex{2}\)).
| فئة | مثال | وظيفة |
|---|---|---|
| جليكوهدرولاز | هيالورونيداز A في المكورات العنقودية الذهبية | يحلل حمض الهيالورونيك الذي يعزز الخلايا معًا لتعزيز الانتشار عبر الأنسجة |
| النيوكليازات | Dnase من إنتاج S. aureus | يحلل الحمض النووي المنبعث من الخلايا الميتة (البكتيريا والخلايا المضيفة) التي يمكن أن تحبس البكتيريا، وبالتالي تعزيز الانتشار |
| فوسفوليباز | فوسفوليباز C من عصيات الجمرة الخبيثة | يحلل الطبقة الفسفورية الثنائية للخلايا المضيفة، مما يتسبب في التحلل الخلوي، ويؤدي إلى تحلل غشاء البلعمات لتمكين التسرب إلى السيتوبلازم |
| البروتياز | كولاجيناز في كلوستريديوم بيرفرينجنز | يحلل الكولاجين في الأنسجة الضامة لتعزيز الانتشار |
تعمل النيوكليزات المنتجة لمسببات الأمراض، مثل DNase الذي تنتجه S. aureus، على تحلل الحمض النووي خارج الخلية كوسيلة للهروب والانتشار عبر الأنسجة. عندما تموت الخلايا البكتيرية والمضيفة في موقع الإصابة، فإنها تتحلل وتطلق محتوياتها داخل الخلايا. كروموسوم الحمض النووي هو أكبر الجزيئات داخل الخلايا، ويمكن لكتل الحمض النووي خارج الخلية أن تحبس البكتيريا وتمنع انتشارها. تنتج S. aureus مادة DNaSE لتحلل شبكة الحمض النووي خارج الخلية حتى تتمكن من الهروب والانتشار إلى الأنسجة المجاورة. تُستخدم هذه الإستراتيجية أيضًا من قبل S. aureus ومسببات الأمراض الأخرى لتحلل وهروب من شبكات الحمض النووي خارج الخلية التي تنتجها الخلايا البلعمية في الجهاز المناعي لاحتجاز البكتيريا.
تسمى الإنزيمات التي تؤدي إلى تحلل الفسفوليبيدات في أغشية الخلايا بالفوسفوليباز. أفعالهم محددة فيما يتعلق بنوع الفوسفوليبيدات التي تعمل عليها وأين تلتصق بالجزيئات إنزيميًا. ينتج العامل الممرض المسؤول عن الجمرة الخبيثة، B. anthracis، فوسفوليباز C. عندما يتم ابتلاع بكتيريا الجمرة الخبيثة بواسطة الخلايا البلعمية في الجهاز المناعي، فإن الفوسفوليباز C يحلل غشاء البلعمية قبل أن يندمج مع الليزوزوم، مما يسمح للممرض بالهروب إلى السيتوبلازم ويتكاثر. يمكن أن تستهدف الفسفوليبازات أيضًا الغشاء الذي يحيط بالبلعمية داخل الخلايا البلعمية. كما هو موضح سابقًا في هذا الفصل، هذه هي الآلية التي تستخدمها مسببات الأمراض داخل الخلايا مثل L. monocytogenes وريكيتسيا للهروب من البلعمية والتكاثر داخل السيتوبلازم للخلايا البلعمية. لا يقتصر دور الفوسفوليباز في ضراوة البكتيريا على الهروب البلعمي. تنتج العديد من مسببات الأمراض الفسفوليبازات التي تعمل على تحلل أغشية الخلايا وتسبب تحلل الخلايا المستهدفة. تشارك هذه الفسفوليبازات في تحلل خلايا الدم الحمراء وخلايا الدم البيضاء وخلايا الأنسجة.
تنتج مسببات الأمراض البكتيرية أيضًا العديد من الإنزيمات المهضمة للبروتين أو البروتياز. يمكن تصنيف البروتياز وفقًا لهدف الركيزة (على سبيل المثال، تستهدف بروتياز السيرين البروتينات مع سيرين الأحماض الأمينية) أو إذا كانت تحتوي على معادن في موقعها النشط (على سبيل المثال، تحتوي ميتالوبروتياز الزنك على أيون الزنك، وهو أمر ضروري للنشاط الأنزيمي).
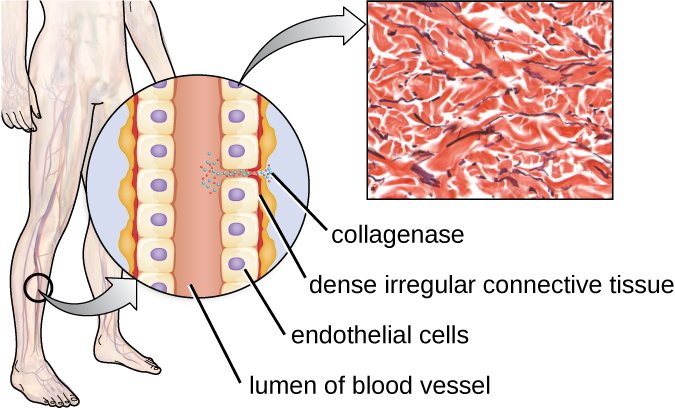
أحد الأمثلة على البروتياز الذي يحتوي على أيون معدني هو إنزيم الكولاجيناز. يعمل الكولاجيناز على هضم الكولاجين، وهو البروتين السائد في الأنسجة الضامة. يمكن العثور على الكولاجين في المصفوفة خارج الخلية، خاصة بالقرب من الأغشية المخاطية والأوعية الدموية والأعصاب وفي طبقات الجلد. على غرار هيالورونيداز، يسمح الكولاجيناز للممرض بالاختراق والانتشار عبر الأنسجة المضيفة عن طريق هضم بروتين النسيج الضام هذا. على سبيل المثال، يسمح الكولاجيناز الذي تنتجه بكتيريا Clostridium perfringens الإيجابية بالجرام للبكتيريا بأن تشق طريقها عبر طبقات الأنسجة ثم تدخل وتتكاثر في الدم (تسمم الدم). ثم تستخدم بكتيريا C. perfrengens السموم والفوسفوليباز للتسبب في التحلل الخلوي والنخر. بمجرد موت الخلايا المضيفة، تنتج البكتيريا الغاز عن طريق تخمير الكربوهيدرات العضلية. يعتبر نخر الأنسجة الواسع النطاق والغاز المصاحب من خصائص الحالة المعروفة باسم الغرغرينا الغازية (الشكل\(\PageIndex{3}\)).
السموم
بالإضافة إلى الإنزيمات الخارجية، فإن بعض مسببات الأمراض قادرة على إنتاج السموم والسموم البيولوجية التي تساعد في قدرتها على الغزو والتسبب في تلف الأنسجة. تسمى قدرة العامل الممرض على إنتاج السموم لإحداث تلف للخلايا المضيفة بالتسمم.
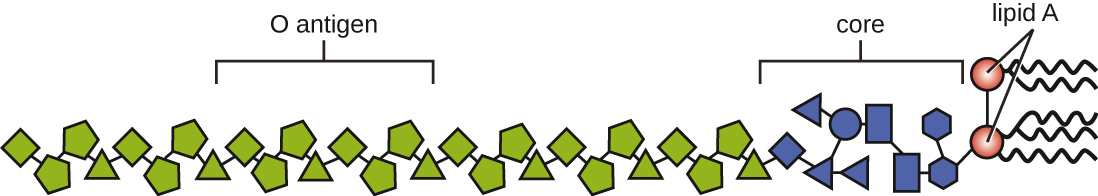
يمكن تصنيف السموم على أنها السموم الداخلية أو السموم الخارجية. يسمى عديد السكاريد الدهني (LPS) الموجود على الغشاء الخارجي للبكتيريا سالبة الجرام بالتوكسين الداخلي (الشكل\(\PageIndex{4}\)). أثناء العدوى والمرض، تطلق مسببات الأمراض البكتيرية سالبة الجرام السموم الداخلية إما عندما تموت الخلية، مما يؤدي إلى تفكك الغشاء، أو عندما تخضع البكتيريا للانشطار الثنائي. المكون الدهني في السموم الداخلية، الدهون A، مسؤول عن الخصائص السامة لجزيء LPS. يتم حفظ الدهون A نسبيًا عبر أجناس مختلفة من البكتيريا سالبة الجرام؛ لذلك، تتشابه الخصائص السامة للدهون A بغض النظر عن العامل الممرض سالب الجرام. بطريقة مشابهة لعامل نخر الورم، تحفز الدهون A الاستجابة الالتهابية للجهاز المناعي (انظر الالتهاب والحمى). إذا كان تركيز السموم الداخلية في الجسم منخفضًا، فقد توفر الاستجابة الالتهابية للمضيف دفاعًا فعالًا ضد العدوى؛ من ناحية أخرى، يمكن أن تتسبب التركيزات العالية من السموم الداخلية في الدم في استجابة التهابية مفرطة، مما يؤدي إلى انخفاض حاد في ضغط الدم، متعدد الأعضاء الفشل والموت.
الطريقة الكلاسيكية للكشف عن السموم الداخلية هي استخدام اختبار ليمولوس الأميبات (LAL). في هذا الإجراء، يتم خلط خلايا الدم (الخلايا الأميبية) في سرطان حدوة الحصان (Limulus polyphemus) بمصل المريض. سوف تتفاعل الخلايا الأميبية مع وجود أي توكسين داخلي. يمكن ملاحظة هذا التفاعل إما من الناحية الكروموجينية (اللون) أو من خلال البحث عن التخثر (تفاعل التخثر) داخل المصل. الطريقة البديلة التي تم استخدامها هي مقايسة الامتصاص المناعي المرتبط بالإنزيم (ELISA) التي تستخدم الأجسام المضادة للكشف عن وجود السموم الداخلية.
على عكس الدهون السامة A في السموم الداخلية، فإن السموم الخارجية هي جزيئات بروتينية تنتجها مجموعة متنوعة من البكتيريا الحية المسببة للأمراض. على الرغم من أن بعض مسببات الأمراض التي لا تحتوي على جرامات تنتج سموم خارجية، فإن معظمها ينتج عن مسببات الأمراض الإيجابية للجرام. تختلف السموم الخارجية عن السموم الداخلية في العديد من الخصائص الرئيسية الأخرى، الملخصة في الجدول\(\PageIndex{3}\). على عكس السموم الداخلية، التي تحفز الاستجابة الالتهابية الجهازية العامة عند إطلاقها، تكون السموم الخارجية أكثر تحديدًا في عملها والخلايا التي تتفاعل معها. يستهدف كل توكسين خارجي مستقبلات محددة على خلايا معينة ويدمر تلك الخلايا من خلال آليات جزيئية فريدة. يظل التوكسين الداخلي مستقرًا في درجات الحرارة المرتفعة، ويتطلب التسخين عند 121 درجة مئوية (250 درجة فهرنهايت) لمدة 45 دقيقة حتى يتم تعطيله. على النقيض من ذلك، فإن معظم السموم الخارجية معرضة للحرارة بسبب تركيبتها البروتينية، والعديد منها يتغير طبيعته (معطل) عند درجات حرارة أعلى من 41 درجة مئوية (106 درجة فهرنهايت). كما تمت مناقشته سابقًا، يمكن للتوكسين الداخلي أن يحفز الاستجابة الالتهابية القاتلة بتركيزات عالية جدًا وله LD 50 مقاسًا يبلغ 0.24 ملغم/كغم. على النقيض من ذلك، يمكن أن تكون التركيزات الصغيرة جدًا من السموم الخارجية قاتلة. على سبيل المثال، يحتوي توكسين البوتولينوم، الذي يسبب التسمم، على LD50 من 0.000001 mg/kg (240000 مرة أكثر فتكًا من السموم الداخلية).
| صفة | إندوتوكسين | إكسوتوكسين |
|---|---|---|
| مصدر | بكتيريا سالبة الجرام | بكتيريا إيجابية الجرام (بشكل أساسي) وسالبة الجرام |
| التكوين | مكون الدهون A من عديد السكاريد الشحمي | بروتين |
| التأثير على المضيف | الأعراض الجهازية العامة للالتهاب والحمى | ضرر محدد للخلايا يعتمد على استهداف الخلايا بوساطة المستقبلات وآليات عمل محددة |
| استقرار الحرارة | مستقر للحرارة | معظمها قابل للحرارة، لكن بعضها مستقر للحرارة |
| 50 دينار كويتي | مرتفع | منخفض |
يمكن تصنيف السموم الخارجية في ثلاث فئات بناءً على هدفها: الاستهداف داخل الخلايا وتعطيل الأغشية والمستضدات الفائقة. \(\PageIndex{4}\)يقدم الجدول أمثلة على السموم المميزة جيدًا ضمن كل فئة من هذه الفئات الثلاث.
| الفئة | مثال | العامل الممرض | الآلية والمرض |
|---|---|---|---|
| السموم التي تستهدف الخلايا | توكسين الكوليرا | فيبريو كوليرا | تنشيط الأدينيل سيكلاز في الخلايا المعوية، مما يتسبب في زيادة مستويات أحادي فوسفات الأدينوزين الدوري (CamP) وإفراز السوائل والإلكتروليتات خارج الخلية، مما يسبب الإسهال |
| توكسين الكزاز | اختبار كلوستريديوم في | يمنع إطلاق الناقلات العصبية المثبطة في الجهاز العصبي المركزي، مما يسبب الشلل التشنجي | |
| سم البوتولينوم | كلوستريديوم البوتولينوم | يمنع إطلاق الناقل العصبي أستيل كولين من الخلايا العصبية، مما يؤدي إلى الشلل الرخو | |
| توكسين الدفتيريا | جرثومة الذرة | تثبيط تخليق البروتين، مما يسبب الموت الخلوي | |
| السموم المعطلة للغشاء | ستربتوليسين | المكورات العقدية المقيحة | البروتينات التي تتجمع في المسام في أغشية الخلايا، مما يعطل وظيفتها ويقتل الخلية |
| بنيوموليسين | المكورات العقدية الرئوية | ||
| ألفا توكسين | المكورات العنقودية الذهبية | ||
| ألفا توكسين | كلوستريديوم بيرفرينجنز | الفسفوليباز الذي يحلل فوسفوليبيدات غشاء الخلية، ويعطل وظيفة الغشاء ويقتل الخلية | |
| فوسفوليباز C | الزائفة الزنجارية | ||
| بيتا توكسين | المكورات العنقودية الذهبية | ||
| المستضدات الفائقة | توكسين متلازمة الصدمة السمية | المكورات العنقودية الذهبية | يحفز التنشيط المفرط لخلايا الجهاز المناعي وإطلاق السيتوكينات (الوسطاء الكيميائيين) من خلايا الجهاز المناعي. والنتيجة هي الحمى والالتهاب والصدمة التي تهدد الحياة. |
| توكسين خارجي ميتوجيني للمكورات العقدية | المكورات العقدية المقيحة | ||
| السموم البيروجينية للمكورات العقدية | المكورات العقدية المقيحة |
تتكون السموم المستهدفة داخل الخلايا من عنصرين: A للنشاط و B للربط. وبالتالي، تُعرف هذه الأنواع من السموم باسم السموم الخارجية A-B (الشكل\(\PageIndex{5}\)). يعتبر المكون B مسؤولاً عن الخصوصية الخلوية للتوكسين ويتوسط في الارتباط الأولي للسم بمستقبلات سطح الخلية المحددة. بمجرد ارتباط توكسين A-B بالخلية المضيفة، يتم إدخاله إلى الخلية عن طريق إندوسيتوسيس وحبسه في فجوة. تنفصل الوحدات الفرعية A و B مع تحمض الفجوة. ثم تدخل الوحدة الفرعية A السيتوبلازم الخلوي وتتداخل مع الوظيفة الخلوية الداخلية المحددة التي تستهدفها.
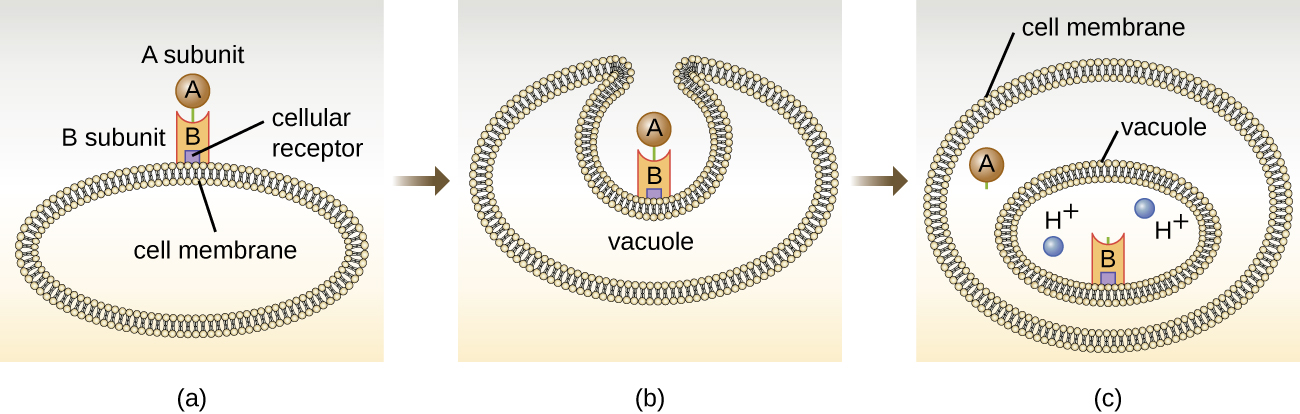
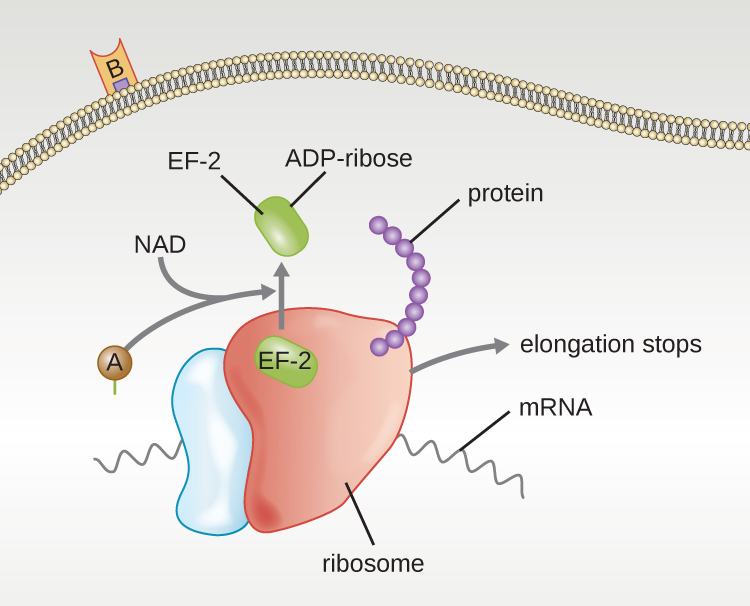
أربعة أمثلة فريدة لسموم A-B هي سموم الدفتيريا والكوليرا والبوتولينوم والكزاز. يتم إنتاج توكسين الدفتيريا بواسطة بكتيريا Corynebacterium debatriae الإيجابية للجرام، وهي العامل المسبب للدفتيريا الأنفية البلعومية والجلدية. بعد أن تنفصل الوحدة الفرعية A من توكسين الدفتيريا وتحصل على إمكانية الوصول إلى السيتوبلازم، فإنها تسهل نقل ثنائي فوسفات الأدينوزين (ADP) - الريبوز إلى بروتين عامل الاستطالة (EF-2) اللازم لتخليق البروتين. وبالتالي، فإن توكسين الدفتيريا يمنع تخليق البروتين في الخلية المضيفة، مما يؤدي في النهاية إلى قتل الخلية (الشكل\(\PageIndex{6}\)).
توكسين الكوليرا هو سم معوي تنتجه بكتيريا Vibrio cholerae سالبة الجرام ويتكون من وحدة فرعية A وخمس وحدات فرعية B. آلية عمل توكسين الكوليرا معقدة. ترتبط الوحدات الفرعية B بالمستقبلات الموجودة على الخلية الظهارية المعوية للأمعاء الدقيقة. بعد الدخول إلى السيتوبلازم للخلية الظهارية، تقوم الوحدة الفرعية A بتنشيط بروتين G داخل الخلايا. يؤدي بروتين G المنشط بدوره إلى تنشيط إنزيم أدينيل سيكلاز، الذي يبدأ في إنتاج زيادة في تركيز AMP الدوري (جزيء رسول ثانوي). تؤدي زيادة CAMP إلى تعطيل الفيزيولوجيا الطبيعية للخلايا الظهارية المعوية وتجعلها تفرز كميات مفرطة من السوائل والإلكتروليتات في تجويف القناة المعوية، مما يؤدي إلى إسهال شديد من «براز ماء الأرز» المميز للكوليرا.
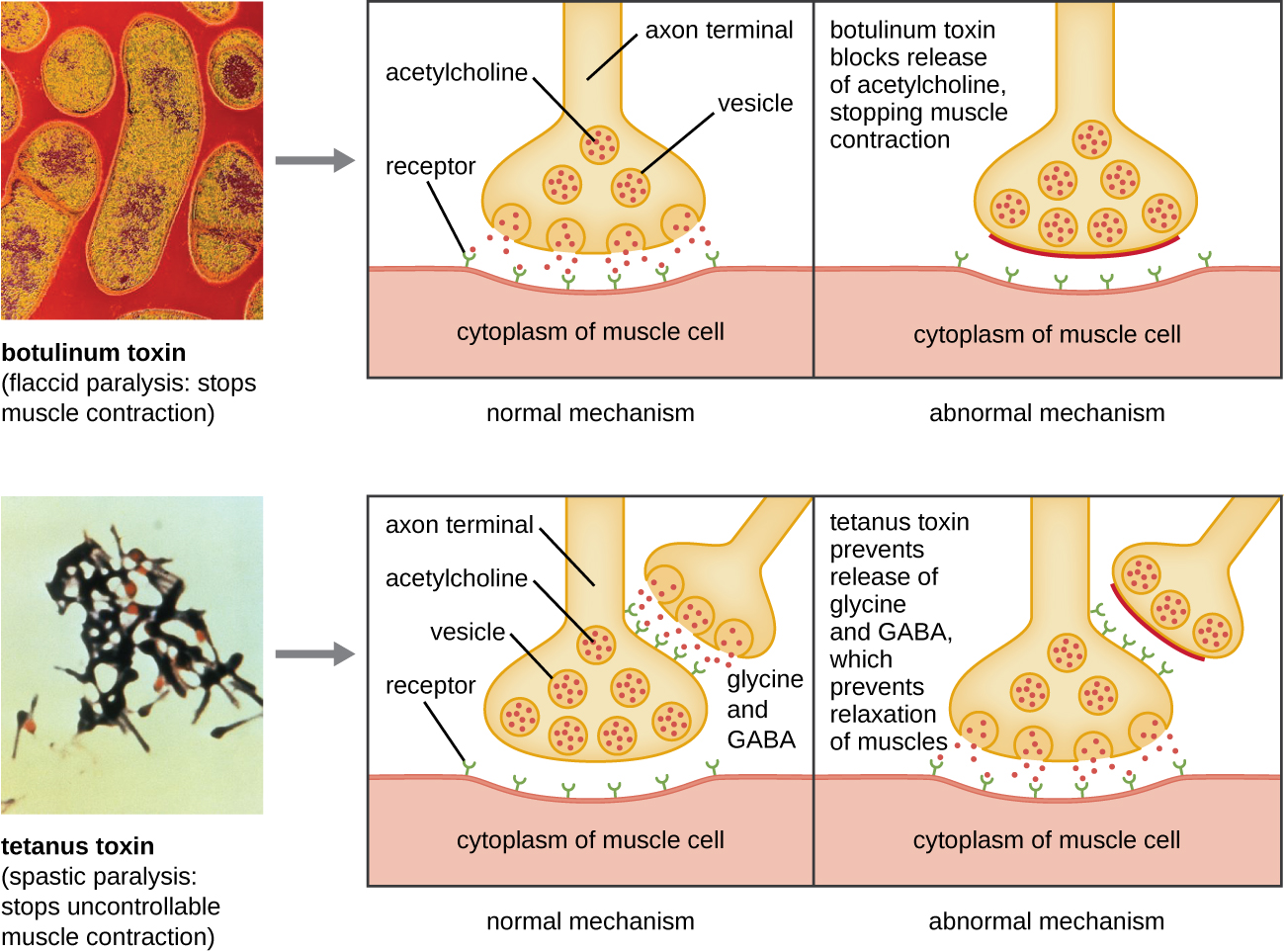
توكسين البوتولينوم (المعروف أيضًا باسم البوتوكس) هو سم عصبي تنتجه بكتيريا كلوستريديوم البوتولينوم الإيجابية بالجرام. إنها المادة الأكثر سمية المعروفة حتى الآن. يتكون السم من وحدة فرعية A خفيفة ووحدة فرعية من سلسلة البروتين الثقيل B. ترتبط الوحدة الفرعية B بالخلايا العصبية للسماح لتوكسين البوتولينوم بدخول الخلايا العصبية عند التقاطع العصبي العضلي. تعمل الوحدة الفرعية A كبروتياز، حيث تقوم بشق البروتينات المشاركة في إطلاق العصبون للأسيتيل كولين، وهو جزيء ناقل عصبي. عادة، تطلق الخلايا العصبية الأسيتيل كولين للحث على تقلصات ألياف العضلات. تؤدي قدرة السم على منع إطلاق الأسيتيل كولين إلى تثبيط تقلصات العضلات، مما يؤدي إلى استرخاء العضلات. هذا لديه القدرة على التوقف عن التنفس والتسبب في الموت. بسبب تأثيره، يتم استخدام تركيزات منخفضة من البوتوكس في الإجراءات التجميلية والطبية، بما في ذلك إزالة التجاعيد وعلاج فرط نشاط المثانة.
وهناك سم عصبي آخر هو توكسين التيتانوس، الذي تنتجه بكتيريا كلوستريديوم تيتاني الإيجابية بالجرام. يحتوي هذا السم أيضًا على وحدة فرعية A خفيفة ووحدة فرعية من سلسلة البروتين الثقيل B. على عكس توكسين البوتولينوم، يرتبط توكسين الكزاز بالخلايا العصبية المثبطة، المسؤولة عن إطلاق الناقلات العصبية المثبطة الجليسين وحمض جاما أمينوبوتيريك (GABA). عادةً ما ترتبط هذه الناقلات العصبية بالخلايا العصبية عند الموصل العصبي العضلي، مما يؤدي إلى تثبيط إطلاق الأسيتيل كولين. يمنع توكسين التيتانوس إطلاق الجليسين وGABA من الخلايا العصبية الداخلية، مما يؤدي إلى تقلص دائم للعضلات. عادةً ما يكون العرض الأول هو تصلب الفك (الفك المقفل). ويتبع ذلك تشنجات عضلية عنيفة في أجزاء أخرى من الجسم، وعادة ما تبلغ ذروتها بفشل الجهاز التنفسي والوفاة. \(\PageIndex{7}\)يوضح الشكل إجراءات كل من توكسين البوتولينوم والكزاز.
تؤثر السموم المعطلة للغشاء على وظيفة غشاء الخلية إما عن طريق تكوين المسام أو عن طريق تعطيل الطبقة الفسفورية الثنائية في أغشية الخلايا المضيفة. هناك نوعان من السموم الخارجية التي تعطل الأغشية وهما الهيموليزين والليوكوسيدين، اللذان يشكلان المسام في أغشية الخلايا، مما يتسبب في تسرب المحتويات السيتوبلازمية وتحلل الخلايا. كان يُعتقد في الأصل أن هذه السموم تستهدف خلايا الدم الحمراء (كريات الدم الحمراء) وخلايا الدم البيضاء (كريات الدم البيضاء)، على التوالي، ولكننا نعلم الآن أنها يمكن أن تؤثر على الخلايا الأخرى أيضًا. تنتج بكتيريا Streptococcus pyogenes الإيجابية بالجرام الستربتوليسين، وهي مادة هلامية قابلة للذوبان في الماء ترتبط بزوائد الكوليسترول في غشاء الخلية المضيفة لتكوين مسام. يتم تصنيف نوعي الستربتوليسين، O و S، حسب قدرتهما على التسبب في انحلال الدم في كريات الدم الحمراء في غياب الأكسجين أو وجوده. لا ينشط Streptolysin O في وجود الأكسجين، بينما ينشط الستربتوليسين S في وجود الأكسجين. تشمل السموم المهمة الأخرى التي تؤدي إلى تعطيل الأغشية المكونة للمسام توكسين ألفا للمكورات العنقودية الذهبية وpneumolysin of Streptococcus pneumoniae.
الفسفوليبازات البكتيرية هي سموم تعطل الغشاء وتؤدي إلى تدهور الطبقة الفسفورية الثنائية لأغشية الخلايا بدلاً من تكوين المسام. لقد ناقشنا بالفعل الفسفوليبازات المرتبطة بأنواع B. anthracis و L. pneumophila و Ricketsia التي تمكن هذه البكتيريا من التأثير على تحلل الفاجوسومات. هذه الفوسفوليبازات نفسها هي أيضًا هيموليزين. تشمل الفسفوليبازات الأخرى التي تعمل كهيموليزين توكسين ألفا من كلوستريديوم بيرفرينجنز، وفسفوليباز C من P. aeruginosa، وتوكسين بيتا للمكورات العنقودية الذهبية.
تنتج بعض سلالات S. aureus أيضًا مادة ليوكوسيدين تسمى بانتون-فالنتين لوكوسيدين (PVL). يتكون PVL من وحدتين فرعيتين، S و F. يعمل المكون S مثل الوحدة الفرعية B من السم الخارجي A-B من حيث أنه يرتبط بالجليكوليبيدات الموجودة على غشاء البلازما الخارجي للخلايا الحيوانية. يعمل المكون F مثل الوحدة الفرعية A من السم الخارجي A-B ويحمل النشاط الأنزيمي. يدخل السم ويتجمع في مسام في الغشاء. تتواجد الجينات التي تشفر PVL بشكل متكرر في سلالات S. aureus التي تسبب التهابات الجلد والالتهاب الرئوي. 1 يعزز PVL التهابات الجلد عن طريق التسبب في الوذمة والاحمرار (احمرار الجلد بسبب تمدد الأوعية الدموية) ونخر الجلد. كما ثبت أن PVL يسبب الالتهاب الرئوي الناخر. يعزز PVL التأثيرات المؤيدة للالتهابات والسامة للخلايا على كريات الدم البيضاء السنخية. يؤدي هذا إلى إطلاق إنزيمات من كريات الدم البيضاء، والتي بدورها تسبب تلفًا لأنسجة الرئة.
الفئة الثالثة من السموم الخارجية هي المستضدات الفائقة. هذه هي السموم الخارجية التي تؤدي إلى تحفيز مفرط وغير محدد للخلايا المناعية لإفراز السيتوكينات (الناقلات الكيميائية). يؤدي الإنتاج المفرط للسيتوكينات، الذي يُطلق عليه غالبًا عاصفة السيتوكين، إلى إثارة استجابة مناعية والتهابات قوية يمكن أن تسبب حمى شديدة تهدد الحياة، وانخفاض ضغط الدم، وفشل الأعضاء المتعددة، والصدمة، والموت. المستضد الفائق النموذجي هو سم متلازمة الصدمة السامة لـ S. aureus. ترتبط معظم حالات متلازمة الصدمة السامة باستعمار المهبل عن طريق إنتاج S. aureus للسموم في النساء في فترة الحيض؛ ومع ذلك، يمكن أن يحدث استعمار لمواقع الجسم الأخرى أيضًا. تنتج بعض سلالات المكورات العقدية المقيحة أيضًا مستضدات فائقة؛ ويشار إليها باسم السموم الخارجية الميتوجينية للمكورات العقدية والسموم البيروجينية للمكورات العقدية.
التمارين\(\PageIndex{2}\)
- وصف كيفية مساهمة الإنزيمات الخارجية في الغزو البكتيري.
- اشرح الفرق بين السموم الخارجية والسموم الداخلية.
- قم بتسمية الفئات الثلاث من السموم الخارجية.
عوامل الضراوة للبقاء على قيد الحياة في المضيف والتهرب المناعي
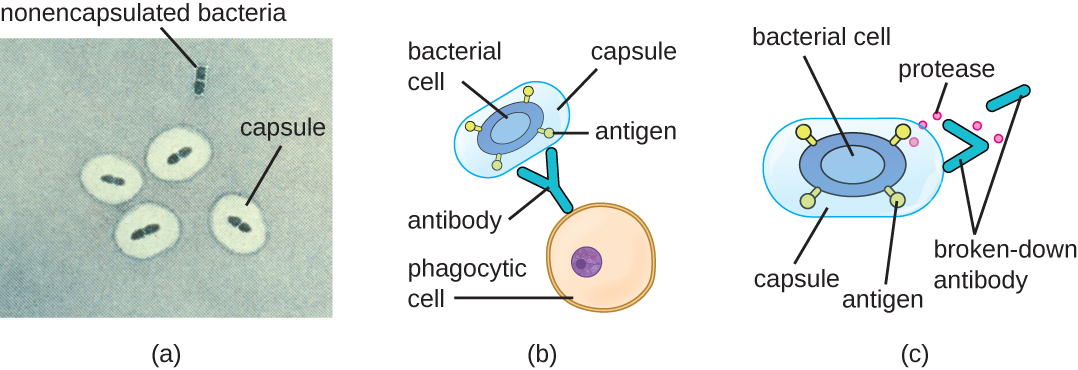
التهرب من جهاز المناعة مهم أيضًا للتدخل. تستخدم البكتيريا مجموعة متنوعة من عوامل الضراوة لتجنب البلعمة بواسطة خلايا الجهاز المناعي. على سبيل المثال، تنتج العديد من البكتيريا كبسولات تستخدم في الالتصاق ولكنها تساعد أيضًا في التهرب المناعي عن طريق منع ابتلاع الخلايا البلعمية. يمنع تكوين الكبسولة الخلايا المناعية من الالتصاق ثم بلع الخلية. بالإضافة إلى ذلك، تجعل الكبسولة الخلية البكتيرية أكبر بكثير، مما يجعل من الصعب على الخلايا المناعية ابتلاع العامل الممرض (الشكل\(\PageIndex{8}\)). من بين البكتيريا البارزة المنتجة للكبسولات هي العامل الممرض Streptococcus pneumoniae الإيجابي بالجرام، والذي يسبب الالتهاب الرئوي بالمكورات الرئوية والتهاب السحايا وتسمم الدم والتهابات الجهاز التنفسي الأخرى. تعتبر السلالات المغلفة من S. pneumoniae أكثر ضراوة من السلالات غير المغلفة وهي أكثر عرضة لغزو مجرى الدم والتسبب في تسمم الدم والتهاب السحايا.
يمكن لبعض مسببات الأمراض أيضًا إنتاج البروتياز لحماية نفسها من البلعمة. كما هو موضح في دفاعات المضيف التكيفية المحددة، ينتج الجهاز المناعي البشري أجسامًا مضادة ترتبط بالجزيئات السطحية الموجودة في بكتيريا معينة (مثل الكبسولات والفيمبريات والأسوط وLPS). يؤدي هذا الارتباط إلى بدء البلعمة والآليات الأخرى لقتل البكتيريا وإزالتها. تحارب البروتياز القتل والإزالة بوساطة الأجسام المضادة من خلال مهاجمة جزيئات الأجسام المضادة وهضمها (الشكل\(\PageIndex{8}\)).
بالإضافة إلى الكبسولات والبروتياز، تنتج بعض مسببات الأمراض البكتيرية عوامل ضراوة أخرى تسمح لها بالتهرب من جهاز المناعة. تحتوي أغشية بعض أنواع المكورات العقدية على بروتين M، الذي يغير سطح المكورات العقدية ويمنع البلعمة عن طريق منع ارتباط الجزيئات التكميلية التي تساعد الخلايا البلعمية في تناول مسببات الأمراض البكتيرية. تنتج بكتيريا المتفطرة السلية سريعة الحمض (العامل المسبب لمرض السل) مادة شمعية تعرف باسم حمض الميكوليك في غلاف الخلية. عندما تغمرها الخلايا البلعمية في الرئة، فإن طبقة حمض الميكوليك الواقية تمكّن البكتيريا من مقاومة بعض آليات القتل داخل البلعمية.
تنتج بعض البكتيريا عوامل ضراوة تعزز العدوى عن طريق استغلال الجزيئات التي ينتجها المضيف بشكل طبيعي. على سبيل المثال، تنتج معظم سلالات Staphylococcus aureus مادة التخثر الخارجية، التي تستغل الآلية الطبيعية لتجلط الدم للتهرب من جهاز المناعة. عادةً ما يحدث تخثر الدم استجابة لتلف الأوعية الدموية؛ تبدأ الصفائح الدموية في سد الجلطة، وتحدث سلسلة من التفاعلات التي يتم فيها شق الفيبرينوجين، وهو بروتين قابل للذوبان يصنعه الكبد، إلى الفيبرين. الفيبرين هو بروتين غير قابل للذوبان يشبه الخيط يرتبط بالصفائح الدموية والروابط المتقاطعة ويتقلص ليشكل شبكة من الصفائح الدموية المتكتلة وخلايا الدم الحمراء. تمنع الجلطة الناتجة المزيد من فقدان الدم من الأوعية الدموية التالفة. ومع ذلك، إذا أطلقت البكتيريا تجلط الدم في مجرى الدم، يتم تشغيل سلسلة الفيبرينوجين إلى الفيبرين في حالة عدم حدوث تلف في الأوعية الدموية. تغطي الجلطة الناتجة البكتيريا في الفيبرين، مما يحمي البكتيريا من التعرض للخلايا المناعية البلعمية المنتشرة في مجرى الدم.
في حين أن التخثر يتسبب في تجلط الدم، فإن الكينازات لها تأثير عكسي من خلال تحفيز تحويل البلازمينوجين إلى البلازمين، الذي يشارك في هضم جلطات الفيبرين. من خلال هضم الجلطة، تسمح الكينازات لمسببات الأمراض العالقة في الجلطة بالهروب والانتشار، على غرار الطريقة التي يسهل بها الكولاجيناز والهيالورنيداز والداناز انتشار العدوى. ومن أمثلة الكينازات المكورات العنقودية والستربتوكينازات، التي تنتجها المكورات العنقودية الذهبية والمكورات العقدية المقيحة، على التوالي. من المثير للاهتمام أن S. aureus يمكنها إنتاج كل من التخثر لتعزيز التخثر والمكورات العنقودية لتحفيز هضم الجلطات. يوفر تأثير التخثر حاجزًا وقائيًا مهمًا من الجهاز المناعي، ولكن عندما تقل إمدادات المغذيات أو تشير ظروف أخرى إلى حاجة العامل الممرض للهروب والانتشار، يمكن أن يبدأ إنتاج المكورات العنقودية في هذه العملية.
الآلية النهائية التي يمكن لمسببات الأمراض استخدامها لحماية نفسها من الجهاز المناعي تسمى التباين المستضدي، وهو تغيير البروتينات السطحية بحيث لم يعد الجهاز المناعي للمضيف يتعرف على العامل الممرض. على سبيل المثال، تحتوي بكتيريا Borrelia burgdorferi، العامل المسبب لمرض لايم، على بروتين شحمي سطحي يعرف باسم VLSE. بسبب إعادة التركيب الجيني أثناء تكرار الحمض النووي وإصلاحه، يخضع هذا البروتين البكتيري للتنوع المستضدي. في كل مرة تحدث فيها الحمى، يمكن أن يختلف بروتين VLSE في B. burgdorferi كثيرًا بحيث لا تكون الأجسام المضادة ضد تسلسلات VLSE السابقة فعالة. يُعتقد أن هذا الاختلاف في VLSE يساهم في قدرة B. burgdorferi على التسبب في مرض مزمن. من العوامل الممرضة البكتيرية البشرية المهمة الأخرى التي تستخدم التباين المستضدي لتجنب الجهاز المناعي النيسرية السيلان، التي تسبب مرض السيلان الذي ينتقل عن طريق الاتصال الجنسي. تشتهر هذه البكتيريا بقدرتها على الخضوع للاختلاف المستضدي من النوع الرابع من الزوائد اللحمية لتجنب الدفاعات المناعية.
التمارين\(\PageIndex{3}\)
- اذكر طريقتين على الأقل توفر الكبسولة الحماية من جهاز المناعة.
- إلى جانب الكبسولات، اذكر عاملي ضراوة آخرين تستخدمهما البكتيريا للتهرب من جهاز المناعة.
التركيز السريري: القرار
استنادًا إلى الأعراض التي أبلغ عنها مايكل لتصلب الرقبة وشلل نصفي الدماغ، يشتبه الطبيب في أن العدوى ربما انتشرت إلى جهازه العصبي. يقرر الطبيب طلب البزل الشوكي للبحث عن أي بكتيريا قد تكون غزت السحايا والسائل النخاعي (CSF)، والتي عادة ما تكون معقمة. لإجراء البزل الشوكي، يتم مسح الجزء السفلي من ظهر مايكل بمطهر اليود ثم تغطيته بورقة معقمة. تتم إزالة الإبرة بشكل معقم من العبوة البلاستيكية المختومة الخاصة بالشركة المصنعة بواسطة قفاز الطبيب. يتم إدخال الإبرة وسحب حجم صغير من السائل إلى أنبوب العينة المرفق. تتم إزالة الأنبوب وتغطيته ويتم لصق ملصق مُعد ببيانات مايكل عليه. تنقسم عينة STAT (التحليل العاجل أو الفوري المطلوب) إلى ثلاثة أنابيب معقمة منفصلة، كل منها يحتوي على 1 مل من CSF. يتم نقل هذه الأنابيب على الفور إلى مختبر المستشفى، حيث يتم تحليلها في أقسام الكيمياء السريرية وأمراض الدم وعلم الأحياء الدقيقة. تشير النتائج الأولية من جميع الأقسام الثلاثة إلى حدوث عدوى في النخاع الشوكي، حيث أبلغ قسم الأحياء الدقيقة عن وجود قضيب إيجابي الجرام في CSF الخاص بمايكل.
تؤكد هذه النتائج ما يشتبه به طبيبه: أعراض مايكل الجديدة هي نتيجة التهاب السحايا والالتهاب الحاد للأغشية التي تحمي الدماغ والحبل الشوكي. نظرًا لأن التهاب السحايا يمكن أن يكون مهددًا للحياة ولأن العلاج بالمضادات الحيوية الأول لم يكن فعالًا في منع انتشار العدوى، فقد تم وصف مايكل بدورة مكثفة من اثنين من المضادات الحيوية، الأمبيسلين والجنتاميسين، ليتم إعطاؤهما عن طريق الوريد. يبقى مايكل في المستشفى لعدة أيام للحصول على الرعاية الداعمة والمراقبة. بعد أسبوع، يُسمح له بالعودة إلى المنزل للراحة في الفراش والمضادات الحيوية الفموية. بعد 3 أسابيع من هذا العلاج، يتعافى تمامًا.
ضراوة فيروسية
على الرغم من أن مسببات الأمراض الفيروسية لا تشبه مسببات الأمراض البكتيرية من حيث التركيب، إلا أن بعض الخصائص التي تساهم في ضراوتها متشابهة. تستخدم الفيروسات المواد اللاصقة لتسهيل الالتصاق بالخلايا المضيفة، وتعتمد بعض الفيروسات المغلفة على التباين المستضدي لتجنب الدفاعات المناعية للمضيف. تتم مناقشة عوامل الفوعة هذه بمزيد من التفصيل في الأقسام التالية.
مواد لاصقة فيروسية
واحدة من الخطوات الأولى في أي عدوى فيروسية هي التصاق الفيروس بمستقبلات محددة على سطح الخلايا. يتم التوسط في هذه العملية عن طريق مواد لاصقة تشكل جزءًا من الغلاف الفيروسي أو الغلاف الغشائي. إن تفاعل المواد اللاصقة الفيروسية مع مستقبلات خلوية محددة يحدد تروبيسم الفيروسات (الاستهداف التفضيلي) لخلايا وأنسجة وأعضاء معينة في الجسم. يُعد بروتين الهيماغلوتينين المثير الموجود في فيروس الإنفلونزا مثالاً على مادة لاصقة فيروسية؛ فهي تسمح للفيروس بالارتباط بحمض السياليك الموجود على غشاء الخلايا التنفسية والأمعاء المضيفة. مادة لاصقة فيروسية أخرى هي البروتين السكري gp20، الموجود في فيروس نقص المناعة البشرية. لكي يصيب فيروس نقص المناعة البشرية خلايا الجهاز المناعي، يجب أن يتفاعل مع اثنين من المستقبلات على سطح الخلايا. يتضمن التفاعل الأول الربط بين gp120 والعلامة الخلوية CD4 الموجودة في بعض خلايا الجهاز المناعي الأساسية. ومع ذلك، قبل أن يحدث دخول الفيروس إلى الخلية، يجب أن يحدث تفاعل ثانٍ بين gp120 وواحد من اثنين من مستقبلات الكيموكين (CCR5 و CXCR4). \(\PageIndex{5}\)يسرد الجدول المواد اللاصقة لبعض مسببات الأمراض الفيروسية الشائعة والمواقع المحددة التي تسمح هذه المواد اللاصقة للفيروسات بالارتباط بها.
| العامل الممرض | مرض | مادة لاصقة | موقع المرفقات |
|---|---|---|---|
| فيروس الإنفلونزا | أنفلونزا | هيماغلوتينين | حمض السياليك للخلايا التنفسية والمعوية |
| فيروس الهربس البسيط الأول أو الثاني | هربس الفم، هربس الأعضاء التناسلية | البروتينات السكرية GB، Gc، Gd | كبريتات الهيباران على الأسطح المخاطية للفم والأعضاء التناسلية |
| فيروس نقص المناعة البشرية | نقص المناعة | بروتين سكري gp120 | CD4 و CCR5 أو CXCR4 لخلايا الجهاز المناعي |
التباين المستضدي في الفيروسات
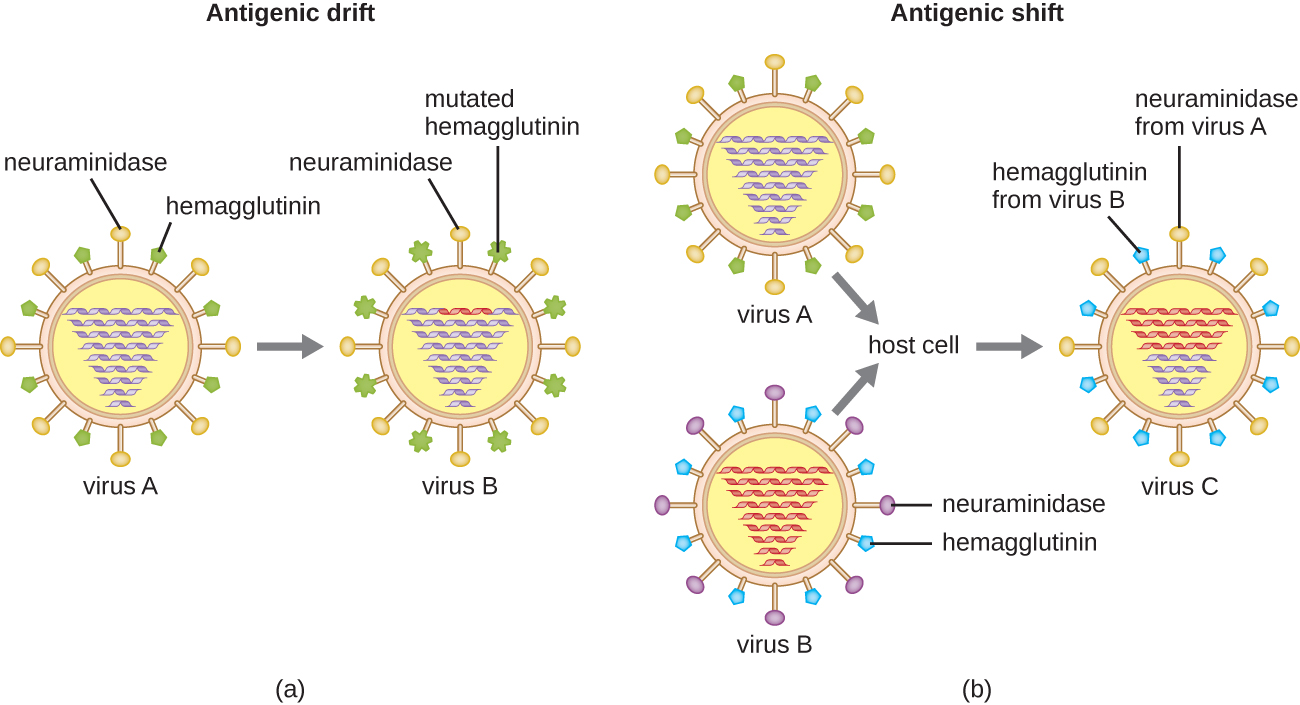
يحدث التباين المستضدي أيضًا في أنواع معينة من الفيروسات المغلفة، بما في ذلك فيروسات الأنفلونزا، التي تظهر شكلين من الاختلاف المستضدي: الانجراف المستضدي والتحول المستضدي (الشكل\(\PageIndex{9}\)). الانجراف المستضدي هو نتيجة الطفرات النقطية التي تسبب تغيرات طفيفة في بروتينات السنبلة هيماغلوتينين (H) والنورامينيداز (N). من ناحية أخرى، يعد التحول المستضدي تغييرًا كبيرًا في بروتينات السنبلة بسبب إعادة تصنيف الجينات. تحدث عملية إعادة التشكيل هذه للتحول المستضدي عادةً عندما يصيب فيروسان مختلفان من فيروسات الإنفلونزا نفس المضيف.
معدل التباين المستضدي في فيروسات الأنفلونزا مرتفع جدًا، مما يجعل من الصعب على الجهاز المناعي التعرف على العديد من السلالات المختلفة لفيروس الإنفلونزا. على الرغم من أن الجسم قد يطور مناعة ضد سلالة واحدة من خلال التعرض الطبيعي أو التطعيم، إلا أن التباين المستضدي يؤدي إلى استمرار ظهور سلالات جديدة لن يتعرف عليها الجهاز المناعي. هذا هو السبب الرئيسي لضرورة إعطاء اللقاحات ضد فيروس الأنفلونزا سنويًا. يوفر لقاح الإنفلونزا لكل عام الحماية ضد السلالات الأكثر انتشارًا في ذلك العام، ولكن السلالات الجديدة أو المختلفة قد تكون أكثر انتشارًا في العام التالي.
للحصول على شرح آخر لكيفية حدوث التحول المستضدي والانجراف، شاهد هذا الفيديو.
التمارين\(\PageIndex{4}\)
- وصف دور المواد اللاصقة في التسمم الفيروسي.
- اشرح الفرق بين الانجراف المستضدي والتحول المستضدي.
المفاهيم الأساسية والملخص
تساهم عوامل الضراوة في قدرة العامل الممرض على التسبب في المرض. تسمح الإنزيمات الخارجية والسموم لمسببات الأمراض بغزو الأنسجة المضيفة والتسبب في تلف الأنسجة. يتم تصنيف الإنزيمات الخارجية وفقًا للجزيء الكبير الذي تستهدفه ويتم تصنيف السموم الخارجية بناءً على آلية عملها. تشمل السموم البكتيرية السموم الداخلية والسموم الخارجية. التوكسين الداخلي هو المكون الدهني A في LPS في غلاف الخلية سالب الجرام. السموم الخارجية هي بروتينات تفرزها بشكل أساسي بكتيريا إيجابية الجرام، ولكن يتم إفرازها أيضًا بواسطة بكتيريا سالبة الجرام. قد تتجنب مسببات الأمراض البكتيرية الاستجابة المناعية للمضيف عن طريق إنتاج كبسولات لتجنب البلعمة، أو البقاء على قيد الحياة في البيئة داخل الخلايا البلعمية، أو تحلل الأجسام المضادة، أو من خلال التباين المستضدي. تستخدم مسببات الأمراض الفيروسية المواد اللاصقة لبدء العدوى والتنوع المستضدي لتجنب الدفاعات المناعية. تستخدم فيروسات الأنفلونزا كلاً من الانجراف المستضدي والتحول المستضدي لتجنب التعرف عليها من قبل جهاز المناعة.
الحواشي
- 1 V. ميكا. «بانتون-فالنتين ليوكوسيدين». http://www.antimicrobe.org/h04c.file...L-S-aureus.asp


