13.3: استخدام المواد الكيميائية للتحكم في الكائنات الدقيقة
- Page ID
- 194495
أهداف التعلم
- فهم ومقارنة المواد الكيميائية المختلفة المستخدمة للتحكم في نمو الميكروبات، بما في ذلك استخداماتها ومزاياها وعيوبها، والتركيب الكيميائي، وطريقة العمل
بالإضافة إلى الطرق الفيزيائية للتحكم الميكروبي، تستخدم المواد الكيميائية أيضًا للتحكم في نمو الميكروبات. يمكن استخدام مجموعة متنوعة من المواد الكيميائية كمطهرات أو مطهرات. عند اختيار المنتج المراد استخدامه، من المهم مراعاة نوع الميكروب المستهدف؛ ومدى نظافة المنتج؛ وتأثير المطهر على سلامة المنتج؛ وسلامته للحيوانات والبشر والبيئة؛ ونفقاته؛ وسهولة استخدامه. يصف هذا القسم مجموعة متنوعة من المواد الكيميائية المستخدمة كمطهرات ومطهرات، بما في ذلك آليات عملها واستخداماتها الشائعة.
علم الفينولات
في القرن التاسع عشر، بدأ العلماء بتجربة مجموعة متنوعة من المواد الكيميائية للتطهير. في ستينيات القرن التاسع عشر، بدأ الجراح البريطاني جوزيف ليستر (1827-1912) باستخدام حمض الكربوليك، المعروف باسم الفينول، كمطهر لعلاج الجروح الجراحية (انظر أسس نظرية الخلية الحديثة). في عام 1879، ألهمت أعمال ليستر الكيميائي الأمريكي جوزيف لورانس (1836-1909) لتطوير الليسترين، وهو خليط قائم على الكحول من العديد من المركبات ذات الصلة التي لا تزال تستخدم حتى اليوم كمطهر للفم. اليوم، لم يعد حمض الكربوليك يستخدم كمطهر جراحي لأنه مهيج للجلد، ولكن المركبات الكيميائية الموجودة في غسولات الفم المطهرة ومستحلبات الحلق تسمى الفينولات.
كيميائيًا، يتكون الفينول من حلقة بنزين مع مجموعة —OH، والفينولات عبارة عن مركبات تحتوي على هذه المجموعة كجزء من تركيبها الكيميائي (الشكل\(\PageIndex{1}\)). توجد الفينولات مثل الثيمول والأوكاليبتول بشكل طبيعي في النباتات. يمكن اشتقاق الفينولات الأخرى من الكريوسوت، وهو أحد مكونات قطران الفحم. تميل الفينولات إلى أن تكون مستقرة وثابتة على الأسطح وأقل سمية من الفينول. إنها تمنع نمو الميكروبات عن طريق تغيير طبيعة البروتينات وتعطيل الأغشية.
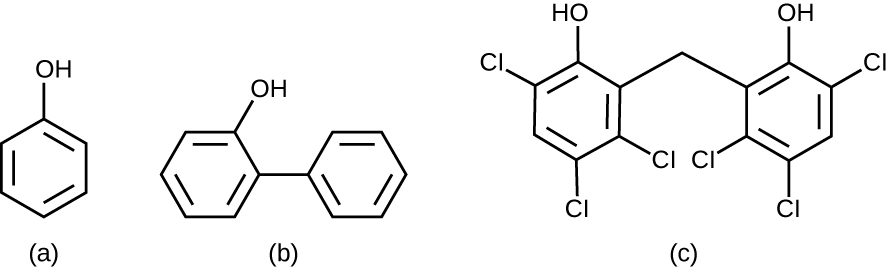
منذ عهد ليستر، تم استخدام العديد من المركبات الفينولية للتحكم في نمو الميكروبات. كانت الفينولات مثل الكريسول (الفينولات الميثيلية) و o-phenylphenol من المكونات النشطة في تركيبات مختلفة من اللايسول منذ اختراعه في عام 1889، كما كان يستخدم O-phenylphenol بشكل شائع في الزراعة للتحكم في نمو البكتيريا والفطريات في المحاصيل المحصودة، وخاصة الحمضيات، ولكن استخدامه في الولايات المتحدة الدول الآن محدودة أكثر بكثير. يعتبر بيسفينول هيكساكلوروفين، وهو مطهر، العنصر النشط في PhisoHex، وهو منظف موضعي يستخدم على نطاق واسع لغسل اليدين في المستشفيات. PhisoHex فعال بشكل خاص ضد البكتيريا المصابة بالجرام، بما في ذلك تلك التي تسبب التهابات الجلد بالمكورات العنقودية والمكورات العقدية. كان يستخدم سابقًا لاستحمام الرضع، ولكن تم إيقاف هذه الممارسة لأنه ثبت أن التعرض لسداسي كلوروفين يمكن أن يؤدي إلى مشاكل عصبية.
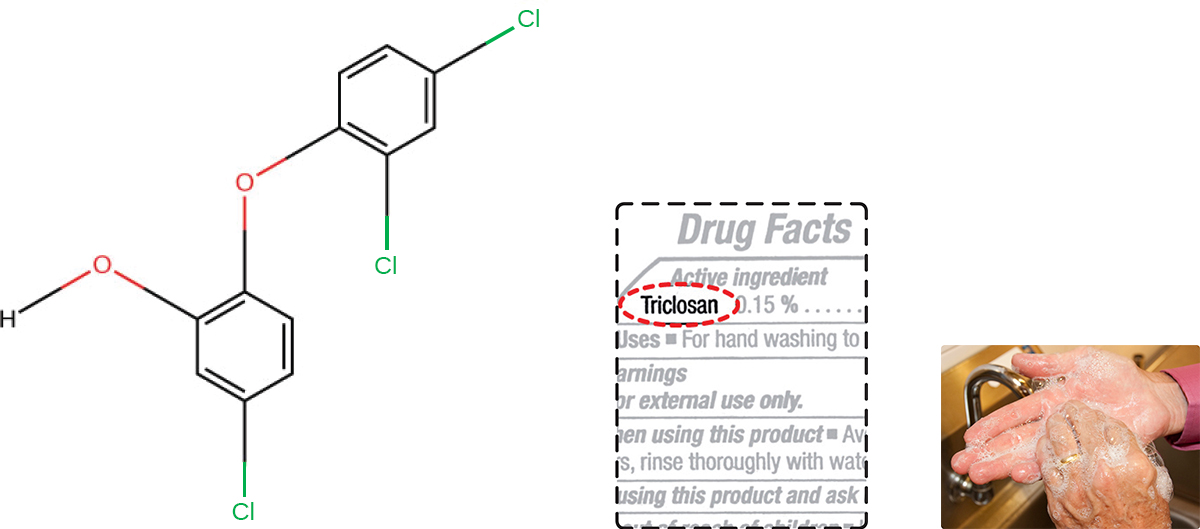
التريكلوسان هو مركب بيسفينول آخر شهد تطبيقًا واسعًا في المنتجات المضادة للبكتيريا على مدى العقود العديدة الماضية. يُستخدم التريكلوسان في البداية في معاجين الأسنان، وهو الآن شائع الاستخدام في صابون اليدين ويتم تشريبه بشكل متكرر في مجموعة متنوعة من المنتجات الأخرى، بما في ذلك ألواح التقطيع والسكاكين وستائر الاستحمام والملابس والخرسانة، لجعلها مضادة للميكروبات. إنه فعال بشكل خاص ضد البكتيريا إيجابية الجرام على الجلد، وكذلك بعض البكتيريا والخمائر سالبة الجرام. 1
تريكلوسان: المبالغة المضادة للبكتيريا؟
غالبًا ما يتم تسويق صابون اليدين ومنتجات التنظيف الأخرى على أنها «مضادة للبكتيريا»، مما يشير إلى أنها توفر مستوى من النظافة يفوق مستوى الصابون والمنظفات التقليدية. ولكن هل المكونات المضادة للبكتيريا في هذه المنتجات آمنة وفعالة حقًا؟
يحتوي حوالي 75٪ من صابون اليدين السائل المضاد للبكتيريا و 30٪ من صابون البار على مادة التريكلوسان الكيميائية، الفينول، (الشكل\(\PageIndex{2}\)). 2 يحجب التريكلوسان إنزيمًا في مسار التخليق الحيوي للأحماض الدهنية البكتيرية غير الموجود في المسار البشري المماثل. على الرغم من زيادة استخدام التريكلوسان في المنزل بشكل كبير خلال التسعينيات، إلا أن أكثر من 40 عامًا من الأبحاث التي أجرتها إدارة الغذاء والدواء الأمريكية لم تظهر أي دليل قاطع على أن الغسيل بالمنتجات المحتوية على التريكلوسان يوفر فوائد صحية متزايدة مقارنة بالغسيل بالصابون التقليدي. على الرغم من أن بعض الدراسات تشير إلى أن عددًا أقل من البكتيريا قد تبقى على يدي الشخص بعد غسله بالصابون الذي يحتوي على تريكلوسان، مقارنة بالصابون التقليدي، لا توجد أدلة تشير إلى أي انخفاض في انتقال البكتيريا التي تسبب أمراض الجهاز التنفسي والجهاز الهضمي. باختصار، قد يزيل الصابون الذي يحتوي على تريكلوسان أو يقتل بعض الجراثيم الأخرى ولكن ليس كافيًا للحد من انتشار المرض.
ولعل الأمر الأكثر إثارة للقلق هو ظهور بعض المخاطر الواضحة المرتبطة بالصابون الذي يحتوي على تريكلوسان. أدى الاستخدام الواسع للتريكلوسان إلى زيادة السلالات البكتيرية المقاومة للتريكلوسان، بما في ذلك السلالات ذات الأهمية السريرية، مثل السالمونيلا المعوية؛ قد تجعل هذه المقاومة التريكلوسان عديم الفائدة كمضاد للبكتيريا على المدى الطويل. 3 4 يمكن للبكتيريا أن تكتسب بسهولة مقاومة التريكلوسان من خلال التغيير إلى جين واحد يشفر الإنزيم المستهدف في مسار تخليق الأحماض الدهنية البكتيرية. المطهرات الأخرى ذات طريقة العمل الأقل تحديدًا تكون أقل عرضة بكثير لتوليد المقاومة لأنها تتطلب أكثر من تغيير جيني واحد.
كما أدى استخدام التريكلوسان على مدى العقود العديدة الماضية إلى تراكم المادة الكيميائية في البيئة. يتم إدخال تريكلوسان في صابون اليدين مباشرة في أنظمة مياه الصرف الصحي والصرف الصحي نتيجة لعملية غسل اليدين. هناك، يمكن لخصائصه المضادة للبكتيريا أن تمنع أو تقتل البكتيريا المسؤولة عن تحلل مياه الصرف الصحي، مما يتسبب في انسداد أنظمة الصرف الصحي وانسحابها احتياطيًا. في النهاية، يجد التريكلوسان الموجود في مياه الصرف الصحي طريقه إلى المياه السطحية والجداول والبحيرات والرواسب والتربة، مما يعطل التجمعات الطبيعية للبكتيريا التي تؤدي وظائف بيئية مهمة، مثل تثبيط الطحالب. يجد التريكلوسان أيضًا طريقه إلى أجسام البرمائيات والأسماك، حيث يمكن أن يعمل كمثبط للغدد الصماء. كما تم العثور على مستويات يمكن اكتشافها من التريكلوسان في سوائل جسم الإنسان المختلفة، بما في ذلك حليب الأم والبلازما والبول. 5 في الواقع، وجدت دراسة أجراها مركز مكافحة الأمراض والوقاية منها (CDC) مستويات يمكن اكتشافها من التريكلوسان في البول لدى 75% من 2,517 شخصًا تم اختبارهم في الفترة 2003-2004. 6 هذه النتيجة أكثر إثارة للقلق بالنظر إلى الأدلة على أن التريكلوسان قد يؤثر على وظيفة المناعة لدى البشر. 7
في ديسمبر 2013، أعطت إدارة الغذاء والدواء الأمريكية مصنعي الصابون حتى عام 2016 لإثبات أن الصابون المضاد للبكتيريا يوفر فائدة كبيرة على الصابون التقليدي؛ إذا لم تتمكن من القيام بذلك، فسيضطر المصنعون إلى إزالة هذه المنتجات من السوق.
التمارين\(\PageIndex{1}\)
لماذا يعتبر التريكلوسان مضادًا حيويًا أكثر من كونه مطهرًا تقليديًا؟
معادن ثقيلة
كانت بعض المطهرات والمطهرات الكيميائية الأولى التي تم استخدامها هي المعادن الثقيلة. تقتل المعادن الثقيلة الميكروبات عن طريق الارتباط بالبروتينات، وبالتالي تثبيط النشاط الأنزيمي (الشكل\(\PageIndex{3}\)). المعادن الثقيلة قليلة الديناميكية، مما يعني أن التركيزات الصغيرة جدًا تُظهر نشاطًا كبيرًا مضادًا للميكروبات. ترتبط أيونات المعادن الثقيلة بالأحماض الأمينية المحتوية على الكبريت بقوة وتتراكم بيولوجيًا داخل الخلايا، مما يسمح لهذه المعادن بالوصول إلى تركيزات محلية عالية. يؤدي هذا إلى تغيير طبيعة البروتينات.
المعادن الثقيلة ليست سامة بشكل انتقائي للخلايا الميكروبية. قد تتراكم بيولوجيًا في الخلايا البشرية أو الحيوانية أيضًا، ويمكن أن يكون للتركيزات المفرطة تأثيرات سامة على البشر. إذا تراكم الكثير من الفضة في الجسم، على سبيل المثال، فقد يؤدي ذلك إلى حالة تسمى الأرجيريا، حيث يتحول الجلد إلى اللون الرمادي الأزرق بشكل لا رجعة فيه. تتمثل إحدى طرق تقليل السمية المحتملة للمعادن الثقيلة في التحكم بعناية في مدة التعرض وتركيز المعدن الثقيل.

زئبق
الزئبق هو مثال على المعدن الثقيل الذي تم استخدامه لسنوات عديدة للتحكم في نمو الميكروبات. تم استخدامه لعدة قرون لعلاج مرض الزهري. مركبات الزئبق مثل كلوريد الزئبق هي في الأساس مضادة للجراثيم ولها طيف واسع جدًا من النشاط. ترتبط أشكال مختلفة من الزئبق بالأحماض الأمينية المحتوية على الكبريت داخل البروتينات، مما يثبط وظائفها.
وفي العقود الأخيرة، انخفض استخدام هذه المركبات بسبب سمية الزئبق. وهو سام للجهاز العصبي المركزي والجهاز الهضمي والكلى بتركيزات عالية، وله آثار بيئية سلبية، بما في ذلك التراكم البيولوجي في الأسماك. كانت المطهرات الموضعية مثل Mercurochrome، الذي يحتوي على الزئبق بتركيزات منخفضة، والميرثيولات، وهي صبغة (محلول من الزئبق المذاب في الكحول) شائعة الاستخدام ذات مرة. ومع ذلك، بسبب المخاوف بشأن استخدام مركبات الزئبق، لم تعد هذه المطهرات تباع في الولايات المتحدة.
فضة
تستخدم الفضة منذ فترة طويلة كمطهر. في العصور القديمة، تم تخزين مياه الشرب في أباريق فضية. 8 يستخدم كريم Silvadene بشكل شائع لعلاج الجروح الموضعية وهو مفيد بشكل خاص في منع العدوى في جروح الحروق. كان يتم تطبيق قطرات النترات الفضية بشكل روتيني على عيون الأطفال حديثي الولادة للحماية من أمراض العيون حديثي الولادة، وهي التهابات العين التي يمكن أن تحدث بسبب التعرض لمسببات الأمراض في قناة الولادة، ولكن كريمات المضادات الحيوية شائعة الاستخدام الآن. غالبًا ما يتم دمج الفضة مع المضادات الحيوية، مما يجعل المضادات الحيوية أكثر فعالية بآلاف المرات. 9 يتم أيضًا دمج الفضة بشكل شائع في القسطرات والضمادات، مما يجعلها مضادة للميكروبات؛ ومع ذلك، هناك أدلة على أن المعادن الثقيلة قد تعزز أيضًا اختيار مقاومة المضادات الحيوية. 10
النحاس والنيكل والزنك
تظهر العديد من المعادن الثقيلة الأخرى أيضًا نشاطًا مضادًا للميكروبات. كبريتات النحاس هي مبيد حشري شائع يستخدم للتحكم في نمو الطحالب في حمامات السباحة وخزانات الأسماك. كما أصبح استخدام النحاس المعدني لتقليل نمو الميكروبات أكثر انتشارًا. تساعد البطانات النحاسية في الحاضنات على تقليل تلوث مزارع الخلايا. يتم التحقيق في استخدام الأواني النحاسية لتخزين المياه في البلدان المتخلفة كوسيلة لمكافحة أمراض الإسهال. أصبحت الطلاءات النحاسية شائعة أيضًا في الأشياء التي يتم التعامل معها بشكل متكرر مثل مقابض الأبواب وأجهزة الخزائن والتركيبات الأخرى في مرافق الرعاية الصحية في محاولة للحد من انتشار الميكروبات.
يتم الآن استخدام الطلاء بالنيكل والزنك بطريقة مماثلة. كما تستخدم أشكال أخرى من الزنك، بما في ذلك كلوريد الزنك وأكسيد الزنك، تجاريًا. كلوريد الزنك آمن تمامًا للبشر ويوجد بشكل شائع في غسولات الفم، مما يزيد بشكل كبير من طول فعاليتها. يوجد أكسيد الزنك في مجموعة متنوعة من المنتجات، بما في ذلك الكريمات المطهرة الموضعية مثل غسول الكالامين ومراهم الحفاضات ومسحوق الأطفال وشامبو قشرة الرأس.
التمارين\(\PageIndex{2}\)
لماذا تعتبر العديد من المعادن الثقيلة مضادة للميكروبات وسامة للبشر؟
الهالوجينات
المواد الكيميائية الأخرى التي يشيع استخدامها للتطهير هي الهالوجينات واليود والكلور والفلور. يعمل اليود عن طريق أكسدة المكونات الخلوية، بما في ذلك الأحماض الأمينية المحتوية على الكبريت والنيوكليوتيدات والأحماض الدهنية، وزعزعة استقرار الجزيئات الكبيرة التي تحتوي على هذه الجزيئات. غالبًا ما يستخدم كصبغة موضعية، ولكنه قد يسبب تلطيخًا أو تهيجًا للجلد. اليودوفور هو مركب من اليود مركب مركب بجزيء عضوي، مما يزيد من استقرار اليود وبالتالي فعاليته. أحد اليودوفور الشائع هو بوفيدون اليود، والذي يتضمن عامل ترطيب يطلق اليود ببطء نسبيًا. البيتادين هو علامة تجارية من البوفيدون واليود يشيع استخدامها كمقشر لليدين من قبل الطاقم الطبي قبل الجراحة وللتعقيم الموضعي لجلد المريض قبل الشق (الشكل\(\PageIndex{4}\)).
الكلور هو هالوجين آخر شائع الاستخدام للتطهير. عندما يتم خلط غاز الكلور بالماء، فإنه ينتج مادة مؤكسدة قوية تسمى حمض هيبوكلوروس، وهو غير مشحون ويدخل الخلايا بسهولة. يشيع استخدام غاز الكلور في محطات معالجة مياه الشرب والمياه العادمة البلدية، حيث ينتج حمض هيبوكلوروس الناتج التأثير الفعلي المضاد للميكروبات. يحتاج أولئك الذين يعملون في مرافق معالجة المياه إلى توخي الحذر الشديد لتقليل التعرض الشخصي لغاز الكلور. هيبوكلوريت الصوديوم هو المكون الكيميائي للتبييض المنزلي الشائع، ويستخدم أيضًا لمجموعة متنوعة من أغراض التطهير. تستخدم أملاح هيبوكلوريت، بما في ذلك هيبوكلوريت الصوديوم والكالسيوم، لتطهير حمامات السباحة. يعتبر غاز الكلور وهيبوكلوريت الصوديوم وهيبوكلوريت الكالسيوم أيضًا من المطهرات الشائعة الاستخدام في صناعات تجهيز الأغذية والمطاعم للحد من انتشار الأمراض المنقولة بالغذاء. يحتاج العاملون في هذه الصناعات أيضًا إلى الحرص على استخدام هذه المنتجات بشكل صحيح لضمان سلامتهم وكذلك سلامة المستهلكين. أشار بيان مشترك صدر مؤخرًا عن منظمة الأغذية والزراعة (الفاو) التابعة للأمم المتحدة ومنظمة الصحة العالمية إلى أن الاستخدامات المفيدة العديدة لمنتجات الكلور في تصنيع الأغذية للحد من انتشار الأمراض المنقولة بالغذاء لا تشكل مخاطر على المستهلكين. 11
تستخدم فئة أخرى من المركبات المكلورة تسمى الكلورامين على نطاق واسع كمطهرات. تعتبر الكلورامين مستقرة نسبيًا، حيث تطلق الكلور على مدى فترات زمنية طويلة. الكلورامين هي مشتقات الأمونيا عن طريق استبدال ذرة هيدروجين واحدة أو اثنتين أو كل ذرات الهيدروجين الثلاث بذرات الكلور (الشكل\(\PageIndex{5}\)).
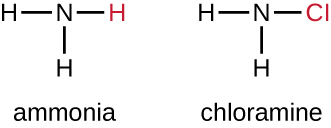
يمكن استخدام الكلورامين ومركبات الكلورين الأخرى لتطهير مياه الشرب، وكثيرًا ما يستخدم الجيش أقراص الكلورامين لهذا الغرض. بعد وقوع كارثة طبيعية أو أي حدث آخر يضر بإمدادات المياه العامة، يوصي مركز السيطرة على الأمراض بتطهير مياه الصنبور بإضافة كميات صغيرة من مواد التبييض المنزلية العادية. تشير الأبحاث الحديثة إلى أن ثنائي كلورو إيزوسيانورات الصوديوم (NADCC) قد يكون أيضًا بديلاً جيدًا لتطهير مياه الشرب. حاليًا، تتوفر أقراص NADCC للاستخدام العام وللاستخدام من قبل الجيش أو المخيمين أو أولئك الذين لديهم احتياجات طارئة؛ لهذه الاستخدامات، يفضل NADCC على أقراص الكلورامين. كما يستخدم ثاني أكسيد الكلور، وهو عامل غازي يستخدم في تبخير وتعقيم المناطق المغلقة، بشكل شائع لتطهير المياه.
على الرغم من أن المركبات المكلورة تعتبر مطهرات فعالة نسبيًا، إلا أن لها عيوبها قد يتسبب بعضها في تهيج الجلد أو الأنف أو العيون لبعض الأفراد، وقد لا تقضي تمامًا على بعض الكائنات الحية القوية من مياه الشرب الملوثة. يحتوي فطر Cryptosporidium، على سبيل المثال، على غلاف خارجي واقي يجعله مقاومًا للمطهرات المكلورة. وبالتالي، يوصى بغلي مياه الشرب في حالات الطوارئ عندما يكون ذلك ممكنًا.
من المعروف أيضًا أن الفلور الهالوجيني له خصائص مضادة للميكروبات تساهم في الوقاية من تسوس الأسنان (التجاويف). 12 الفلوريد هو المكون النشط الرئيسي لمعجون الأسنان ويضاف أيضًا بشكل شائع إلى ماء الصنبور لمساعدة المجتمعات في الحفاظ على صحة الفم. كيميائيًا، يمكن دمج الفلوريد في هيدروكسيباتيت مينا الأسنان، مما يجعله أكثر مقاومة للأحماض المسببة للتآكل الناتجة عن تخمير الميكروبات الفموية. يعزز الفلوريد أيضًا امتصاص أيونات الكالسيوم والفوسفات في مينا الأسنان، مما يعزز إعادة التمعدن. بالإضافة إلى تقوية المينا، يبدو الفلورايد أيضًا مضادًا للجراثيم. يتراكم في البكتيريا المكونة للويحات، مما يتداخل مع عملية التمثيل الغذائي ويقلل من إنتاجها من الأحماض التي تساهم في تسوس الأسنان.
التمارين\(\PageIndex{3}\)
ما فائدة الكلورامين على هيبوكلوريت للتطهير؟
الكحوليات
تشكل الكحوليات مجموعة أخرى من المواد الكيميائية التي يشيع استخدامها كمطهرات ومطهرات. وهي تعمل عن طريق تغيير طبيعة البروتينات بسرعة، والتي تمنع استقلاب الخلايا، وتعطيل الأغشية، مما يؤدي إلى تحلل الخلايا. بمجرد تغيير طبيعتها، يمكن إعادة تعبئة البروتينات في حالة وجود كمية كافية من الماء في المحلول. تُستخدم الكحوليات عادةً بتركيزات تبلغ حوالي 70٪ من المحلول المائي، وفي الواقع، تعمل بشكل أفضل في المحاليل المائية من محاليل الكحول بنسبة 100٪. هذا لأن الكحول يخثر البروتينات. في تركيزات الكحول العالية، يمنع التخثر السريع للبروتينات السطحية الاختراق الفعال للخلايا. أكثر أنواع الكحول شيوعًا للتطهير هي الكحول الإيثيلي (الإيثانول) وكحول الأيزوبروبيل (الأيزوبروبانول، الكحول المحمر) (الشكل\(\PageIndex{6}\)).
تميل الكحوليات إلى أن تكون مبيدة للجراثيم والفطريات، ولكنها قد تكون أيضًا مبيدًا للفيروسات المغلفة فقط. على الرغم من أن الكحول ليس مبيدًا للأبواغ، إلا أنه يمنع عمليات التبويض والإنبات. تتطاير الكحوليات وتجف بسرعة، ولكنها قد تسبب أيضًا تهيجًا للجلد لأنها تجفف الجلد في موقع التطبيق. أحد الاستخدامات السريرية الشائعة للكحول هو مسح الجلد لإزالة الجراثيم قبل الحقن بالإبرة. تعتبر المشروبات الكحولية أيضًا من المكونات النشطة في معقمات اليدين الفورية، والتي اكتسبت شعبية في السنوات الأخيرة. يعمل الكحول الموجود في مطهرات اليدين هذه عن طريق تغيير طبيعة البروتينات وتعطيل غشاء الخلية الميكروبية، ولكنه لن يعمل بفعالية في وجود الأوساخ المرئية.
أخيرًا، يتم استخدام الكحول لصنع الصبغات بمطهرات أخرى، مثل صبغات اليود التي تمت مناقشتها سابقًا في هذا الفصل. بشكل عام، تعتبر المشروبات الكحولية غير مكلفة وفعالة للغاية لتطهير مجموعة واسعة من الميكروبات النباتية. ومع ذلك، فإن أحد عيوب الكحول هو تقلباته العالية، مما يحد من فعاليته فور استخدامه.

التمارين الرياضية\(\PageIndex{4}\)
- اذكر ثلاث مزايا على الأقل للكحول كمطهرات.
- وصف العديد من التطبيقات المحددة للكحول المستخدم في المنتجات المطهرة.
مواد التوتر السطحي
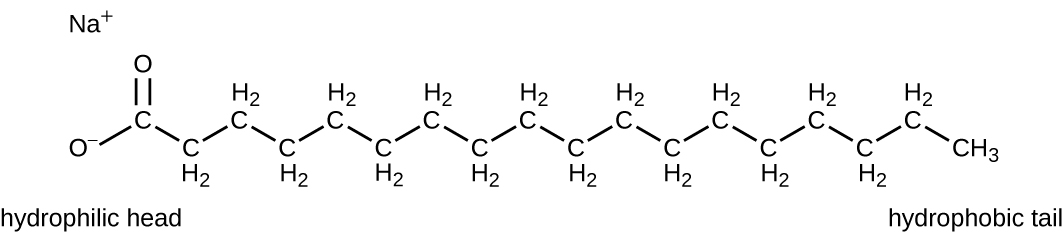
العوامل السطحية النشطة، أو المواد الخافضة للتوتر السطحي، هي مجموعة من المركبات الكيميائية التي تخفض التوتر السطحي للماء. المواد الخافضة للتوتر السطحي هي المكونات الرئيسية في الصابون والمنظفات. الصابون عبارة عن أملاح أحماض دهنية طويلة السلسلة ولها مناطق قطبية وغير قطبية، مما يسمح لها بالتفاعل مع المناطق القطبية وغير القطبية في الجزيئات الأخرى (الشكل\(\PageIndex{7}\)). يمكن أن تتفاعل مع الزيوت والشحوم غير القطبية لتكوين مستحلبات في الماء، مما يؤدي إلى تخفيف وإزالة الأوساخ والميكروبات من الأسطح والجلد. لا يقتل الصابون أو يمنع نمو الميكروبات وبالتالي لا يعتبر مطهرات أو مطهرات. ومع ذلك، فإن الاستخدام السليم للصابون يزيل الكائنات الحية الدقيقة ميكانيكيًا، مما يؤدي إلى تدهور السطح بشكل فعال. تحتوي بعض أنواع الصابون على عوامل إضافية مضادة للجراثيم مثل تريكلوكاربان أو كلوفلوكاربان، وهي مركبات مرتبطة هيكليًا بالتريكلوسان، والتي تقدم خصائص مطهرة أو مطهرة للصابون.
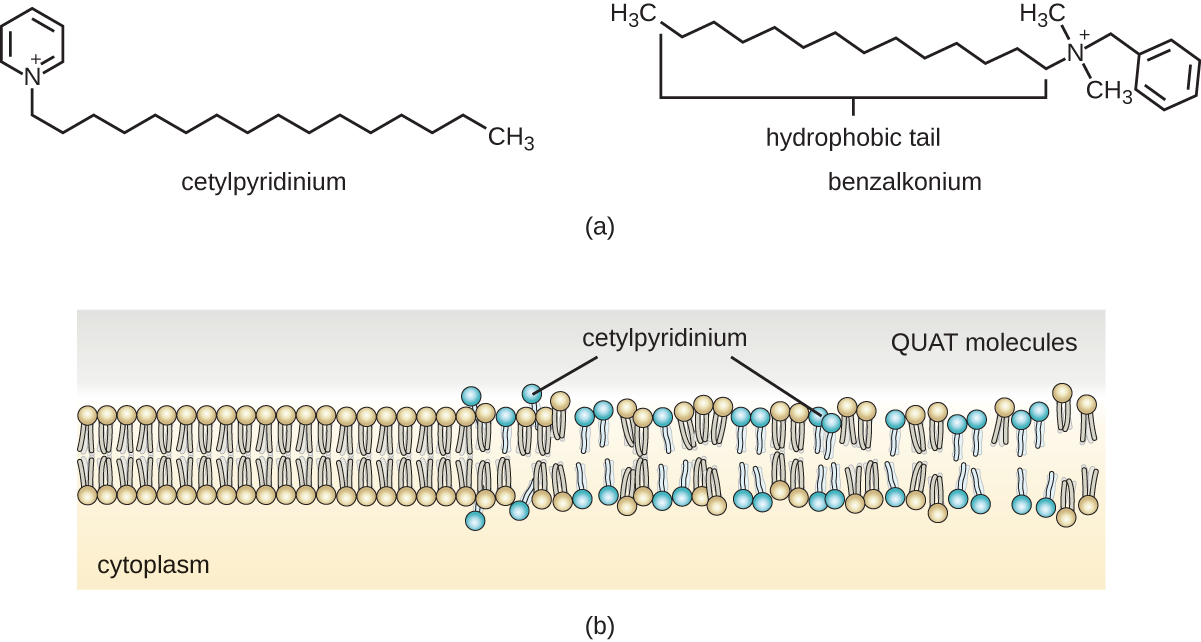
ومع ذلك، غالبًا ما يشكل الصابون أغشية يصعب شطفها، خاصة في الماء العسر، الذي يحتوي على تركيزات عالية من أملاح الكالسيوم والمغنيسيوم المعدنية. تحتوي المنظفات على جزيئات اصطناعية خافضة للتوتر السطحي ذات مناطق قطبية وغير قطبية تتمتع بنشاط تطهير قوي ولكنها أكثر قابلية للذوبان، حتى في الماء العسر، وبالتالي لا تترك وراءها أي رواسب صابونية. تحتوي المنظفات الأنيونية، مثل تلك المستخدمة في غسيل الملابس، على أنيون سالب الشحنة في أحد طرفيه متصل بسلسلة طويلة مقاومة للماء، في حين أن المنظفات الكاتيونية تحتوي على كاتيونات موجبة الشحنة بدلاً من ذلك. تشمل المنظفات الكاتيونية فئة مهمة من المطهرات والمطهرات تسمى أملاح الأمونيوم الرباعية (الكوات)، والتي سميت باسم ذرة النيتروجين الرباعية المميزة التي تمنح الشحنة الموجبة (الشكل\(\PageIndex{8}\)). بشكل عام، يحتوي الكوات على خصائص مشابهة للفوسفوليبيدات، وله نهايات محبة للماء ومقاومة للماء. على هذا النحو، تتمتع الكوات بالقدرة على الإدخال في الطبقة الثنائية الفوسفورية البكتيرية وتعطيل سلامة الغشاء. يبدو أن الشحنة الكاتيونية للكوات تضفي خصائصها المضادة للميكروبات، والتي تتضاءل عند تحييدها. يحتوي الكوات على العديد من الخصائص المفيدة. فهي مستقرة وغير سامة وغير مكلفة وعديمة اللون والرائحة والطعم. تميل إلى أن تكون مبيدة للجراثيم عن طريق تعطيل الأغشية. كما أنها نشطة ضد الفطريات والبروتوزوان والفيروسات المغلفة، ولكن لا تتأثر المسام الداخلية. في البيئات السريرية، يمكن استخدامها كمطهرات أو لتطهير الأسطح. توجد أيضًا مخاليط الكوات بشكل شائع في المنظفات المنزلية والمطهرات، بما في ذلك العديد من التركيبات الحالية لمنتجات العلامة التجارية Lysol، والتي تحتوي على كلوريد البنزالكونيوم كمكونات نشطة. توجد أيضًا كلوريد بنزالكونيوم، إلى جانب كلوريد كوات سيتيل بيريميدين، في منتجات مثل مطهرات الجلد وشطف الفم وغسول الفم.
التمارين الرياضية\(\PageIndex{5}\)
لماذا لا يعتبر الصابون مطهرات؟
غسل اليدين بالطريقة الصحيحة
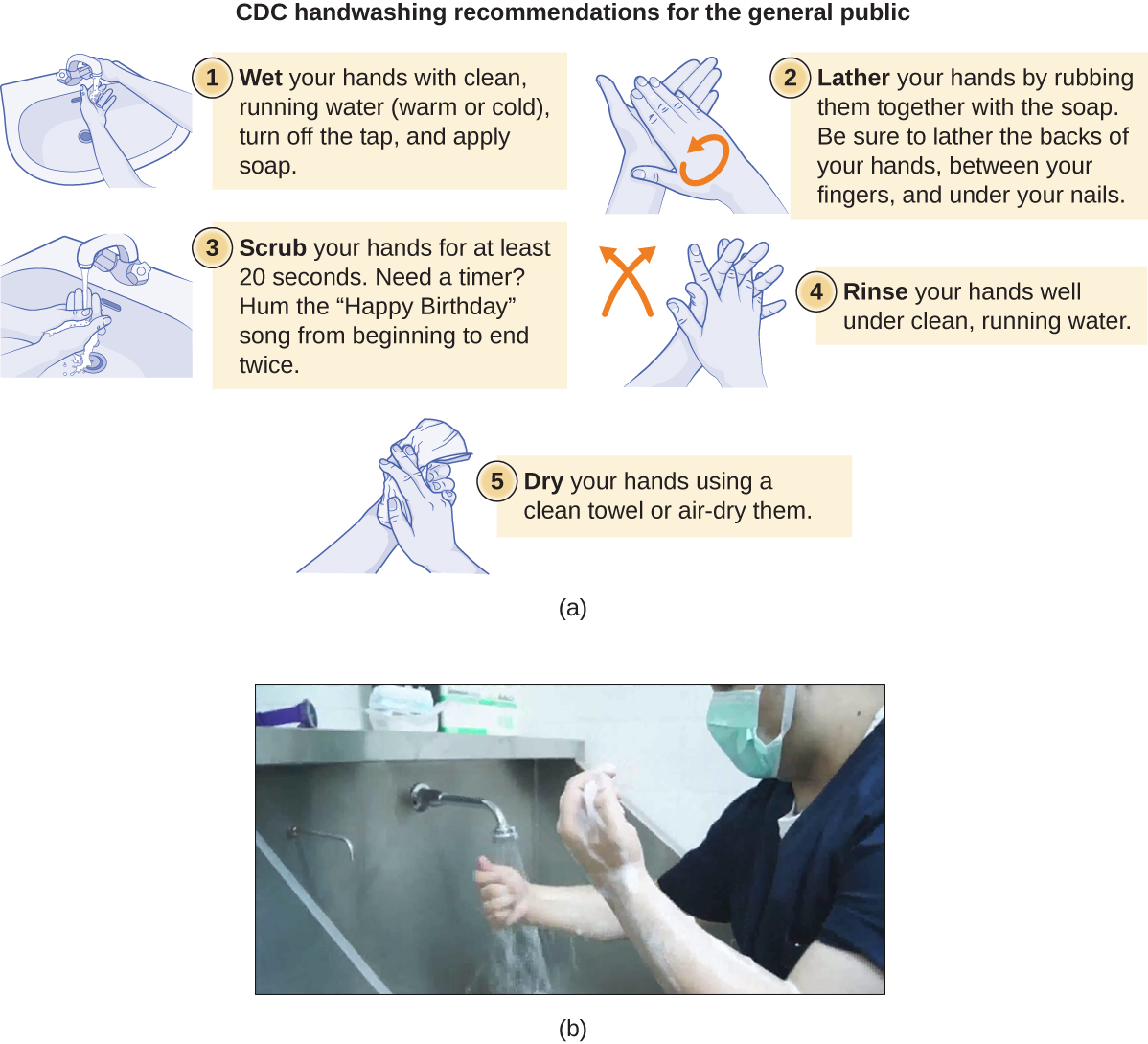
غسل اليدين أمر بالغ الأهمية للصحة العامة ويجب التأكيد عليه في البيئة السريرية. بالنسبة لعامة الناس، يوصي مركز مكافحة الأمراض والوقاية منها بغسل اليدين قبل وأثناء وبعد مناولة الطعام؛ قبل الأكل؛ قبل وبعد التعامل مع شخص مريض؛ قبل وبعد علاج الجرح؛ بعد استخدام المرحاض أو تغيير الحفاضات؛ بعد السعال أو العطس أو نفخ الأنف؛ بعد التعامل مع القمامة؛ وبعد التفاعل مع الحيوان أو علفه أو نفاياته. \(\PageIndex{9}\)يوضح الشكل الخطوات الخمس لغسل اليدين بشكل صحيح التي أوصت بها مراكز مكافحة الأمراض والوقاية منها.
يعتبر غسل اليدين أكثر أهمية بالنسبة للعاملين في مجال الرعاية الصحية، الذين يجب عليهم غسل أيديهم جيدًا بين كل اتصال بالمريض، وبعد إزالة القفازات، وبعد ملامسة سوائل الجسم والأمراض المعدية المحتملة، وقبل وبعد مساعدة الجراح في الإجراءات الجراحية. حتى مع استخدام الملابس الجراحية المناسبة، بما في ذلك القفازات، فإن التنظيف بالجراحة أكثر أهمية من غسل اليدين الروتيني. الهدف من التنظيف الجراحي هو تقليل الميكروبات الطبيعية على سطح الجلد لمنع إدخال هذه الميكروبات في الجروح الجراحية للمريض.
لا يوجد بروتوكول واحد مقبول على نطاق واسع للتنظيف الجراحي. قد تعتمد بروتوكولات طول الوقت المستغرق في التنظيف على مضادات الميكروبات المستخدمة؛ يجب على العاملين في مجال الرعاية الصحية دائمًا التحقق من توصيات الشركة المصنعة. وفقًا لجمعية تقنيي الجراحة (AST)، يمكن إجراء الدعك الجراحي باستخدام الفرشاة أو بدونها (الشكل\(\PageIndex{9}\)).
لمعرفة المزيد عن غسل اليدين بشكل صحيح، قم بزيارة موقع CDC.
البزبيغوانيد
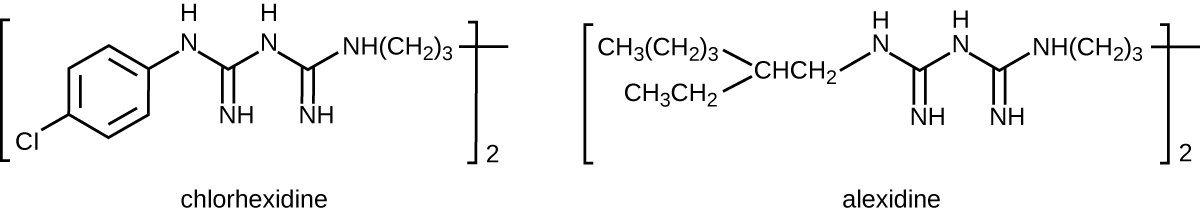
تم تصنيع البسيغوانيدات لأول مرة في القرن العشرين وهي جزيئات كاتيونية (مشحونة إيجابًا) معروفة بخصائصها المطهرة (الشكل\(\PageIndex{10}\)). أحد مطهرات البيسبيغوانيد المهمة هو الكلورهيكسيدين. له نشاط واسع الطيف ضد الخمائر والبكتيريا الإيجابية بالجرام والبكتيريا سالبة الجرام، باستثناء Pseudomonas aeruginosa، التي قد تطور المقاومة عند التعرض المتكرر. 13 الكلورهيكسيدين يعطل أغشية الخلايا وهو مضاد للجراثيم بتركيزات منخفضة أو مبيد للجراثيم بتركيزات أعلى، مما يؤدي فعليًا إلى تماسك محتويات الخلايا السيتوبلازمية. كما أن لديها نشاطًا ضد الفيروسات المغلفة. ومع ذلك، فإن الكلورهيكسيدين غير فعال ضد المتفطرة السلية والفيروسات غير المغلفة، كما أنه ليس مبيدًا للجراثيم. يُستخدم الكلورهيكسيدين عادةً في البيئة السريرية كمقشر جراحي ولاحتياجات غسل اليدين الأخرى للعاملين في المجال الطبي، وكذلك كمطهر موضعي للمرضى قبل الجراحة أو الحقن بالإبرة. وهو أكثر ثباتًا من اليودوفور، حيث يوفر نشاطًا مضادًا للميكروبات يدوم طويلاً. يمكن أيضًا استخدام محاليل الكلورهيكسيدين كغسول للفم بعد الإجراءات الفموية أو لعلاج التهاب اللثة. ويكتسب البيسبيغوانيد الآخر، وهو ألكسيدين، شعبية كمقشر جراحي وشطف للفم لأنه يعمل بشكل أسرع من الكلورهيكسيدين.
التمارين الرياضية\(\PageIndex{6}\)
ما تأثيران الكلورهيكسيدين على الخلايا البكتيرية؟
عوامل الألكلة
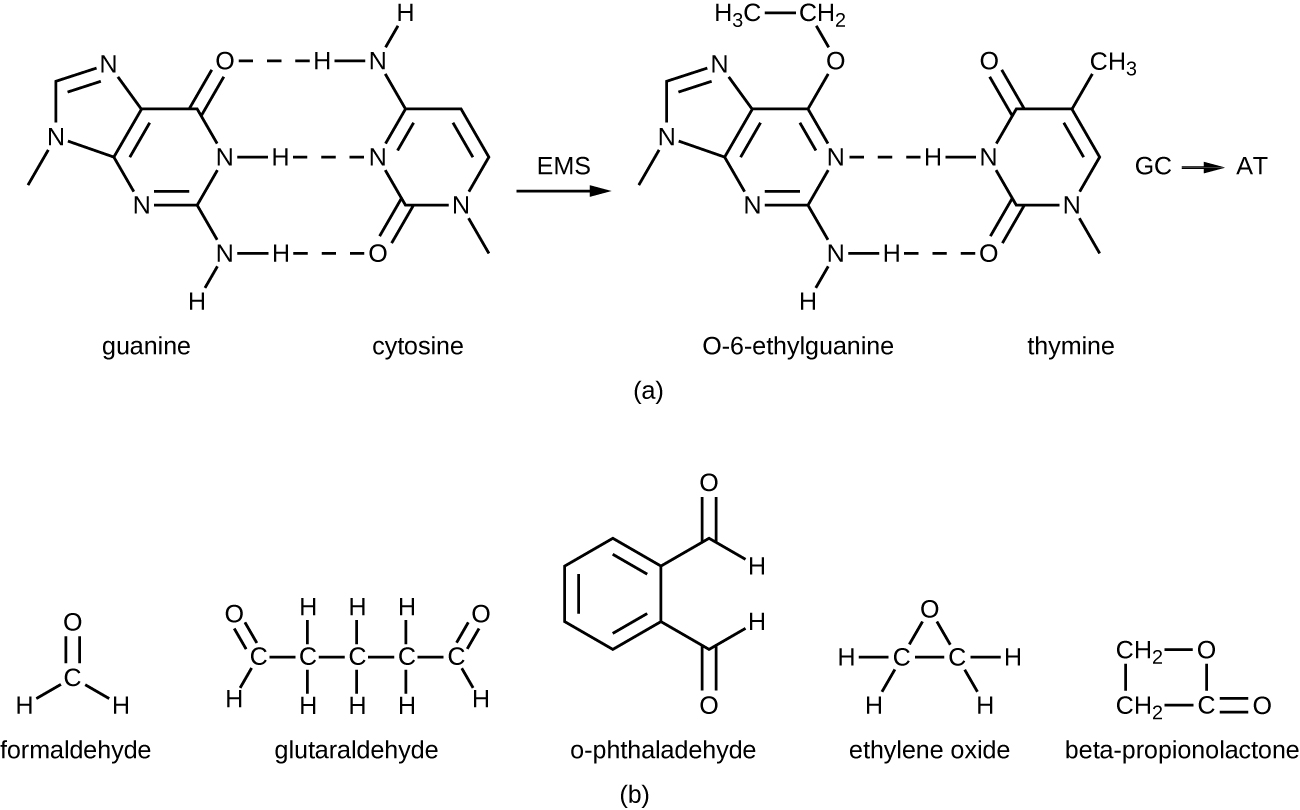
العوامل الألكلة هي مجموعة من المواد الكيميائية المطهرة القوية التي تعمل عن طريق استبدال ذرة الهيدروجين داخل الجزيء بمجموعة ألكيل (C n H 2n+1)، وبالتالي تعطيل الإنزيمات والأحماض النووية (الشكل\(\PageIndex{11}\)). يشيع استخدام عامل الألكلة الفورمالديهايد (CH 2 OH) في المحلول بتركيز 37٪ (المعروف باسم الفورمالين) أو كمطهر غازي ومبيد حيوي. إنه مطهر قوي واسع الطيف ومبيد حيوي له القدرة على قتل البكتيريا والفيروسات والفطريات والمسام الداخلية، مما يؤدي إلى التعقيم في درجات حرارة منخفضة، وهو أحيانًا بديل مناسب لطرق التعقيم الحراري الأكثر كثافة في العمل. كما أنه يربط البروتينات ويستخدم على نطاق واسع كمثبت كيميائي. لهذا السبب، يتم استخدامه لتخزين عينات الأنسجة وكسائل للتحنيط. كما تم استخدامه لتثبيط العوامل المعدية في تحضير اللقاح. الفورمالديهايد مهيج جدًا للأنسجة الحية وهو أيضًا مادة مسرطنة؛ لذلك لا يستخدم كمطهر.
يشبه الجلوتارالديهيد هيكليًا الفورمالديهايد ولكنه يحتوي على مجموعتين من الألدهيد التفاعلية، مما يسمح له بالعمل بسرعة أكبر من الفورمالديهايد. يتم استخدامه بشكل شائع كحل بنسبة 2٪ للتعقيم ويتم تسويقه تحت اسم العلامة التجارية Cidex. يتم استخدامه لتطهير مجموعة متنوعة من الأسطح والمعدات الجراحية والطبية. ومع ذلك، على غرار الفورمالديهايد، فإن الجلوتارالدهيد يهيج الجلد ولا يستخدم كمطهر.
هناك نوع جديد من المطهرات يكتسب شعبية لتطهير المعدات الطبية وهو o-fthaldehyde (OPA)، والذي يوجد في بعض التركيبات الجديدة من Cidex والمنتجات المماثلة، ليحل محل الجلوتارالدهيد. يحتوي O-phthaldehyde أيضًا على مجموعتين من الألدهيد التفاعليتين، ولكنهما مرتبطان بجسر عطري. o - يُعتقد أن الفثالالديهيد يعمل بشكل مشابه للجلوتارالديهيد والفورمالديهايد، ولكنه أقل تهيجًا للجلد والممرات الأنفية، وينتج رائحة قليلة، ولا يتطلب معالجة قبل الاستخدام، وهو أكثر فعالية ضد البكتيريا الفطرية.
أكسيد الإيثيلين هو نوع من عوامل الألكلة التي تستخدم للتعقيم الغازي. إنه عالي الاختراق ويمكنه تعقيم المواد داخل الأكياس البلاستيكية مثل القسطرات والمواد التي تستخدم لمرة واحدة في المختبرات والأماكن السريرية (مثل أطباق بيتري المعبأة) وغيرها من المعدات. التعرض لأكسيد الإيثيلين هو شكل من أشكال التعقيم البارد، مما يجعله مفيدًا لتعقيم المواد الحساسة للحرارة. ومع ذلك، يجب توخي الحذر الشديد عند استخدام أكسيد الإيثيلين؛ فهو مادة مسرطنة، مثل العوامل الألكلة الأخرى، كما أنه شديد الانفجار. مع الاستخدام الدقيق والتهوية المناسبة للمنتجات بعد المعالجة، يكون أكسيد الإيثيلين فعالًا للغاية، وتوجد معقمات أكسيد الإيثيلين بشكل شائع في البيئات الطبية لتعقيم المواد المعبأة.
-propionolactone هو عامل ألكلة له بنية كيميائية مختلفة عن العوامل الأخرى التي تمت مناقشتها بالفعل. مثل العوامل الألكلة الأخرى، يرتبط بيتا بروبينولاكتون بالحمض النووي، وبالتالي يعطله (الشكل\(\PageIndex{11}\)). إنه سائل شفاف ذو رائحة قوية ولديه القدرة على قتل المسام الداخلية. على هذا النحو، تم استخدامه إما في صورة سائلة أو كبخار لتعقيم الأدوات الطبية وطعوم الأنسجة، وهو مكون شائع في اللقاحات، يستخدم للحفاظ على تعقيمها. كما تم استخدامه لتعقيم مرق المغذيات وكذلك بلازما الدم والحليب والماء. يتم استقلابه بسرعة من قبل الحيوانات والبشر إلى حمض اللاكتيك. ومع ذلك، فهو أيضًا مهيج وقد يؤدي إلى تلف دائم في العينين أو الكلى أو الكبد. بالإضافة إلى ذلك، فقد ثبت أنه يسبب السرطان في الحيوانات؛ وبالتالي، فإن الاحتياطات ضرورية لتقليل تعرض الإنسان إلى بيتا بروبيونولاكتون. 14
التمارين الرياضية\(\PageIndex{7}\)
- ما التفاعل الكيميائي الذي تشارك فيه عوامل الألكلة؟
- لماذا لا تستخدم عوامل الألكلة كمطهرات؟
ديهارد بريونز
من المعروف أن البريونات، وهي البروتينات غير الخلوية غير المطوية المسؤولة عن الأمراض غير القابلة للشفاء والمميتة مثل مرض كورو ومرض كروتزفيلدت-جاكوب (انظر الفيروسات والفيروسوميات والبريونات)، يصعب تدميرها. البريونات مقاومة للغاية للحرارة والمواد الكيميائية والإشعاع. كما أنها معدية للغاية ومميتة؛ وبالتالي، فإن التعامل مع المواد المصابة بالبريون والتخلص منها يتطلب تدريبًا مكثفًا وحذرًا شديدًا.
يمكن للطرق النموذجية للتطهير أن تقلل من عدوى البريونات ولكن لا تقضي عليها. الأوتوكلاف ليس فعالًا تمامًا، ولا توجد مواد كيميائية مثل الفينول والكحول والفورمالين وبيتا بروبيولاكتون. حتى عندما يتم تثبيتها في الفورمالين، تظل أنسجة الدماغ والنخاع الشوكي المصابة معدية.
يجب على الموظفين الذين يتعاملون مع العينات أو المعدات الملوثة أو الذين يعملون مع المرضى المصابين ارتداء معطف واقي وحماية للوجه وقفازات مقاومة للقطع. يجب غسل أي ملامسة للجلد على الفور بمنظف وماء دافئ دون فرك. يجب بعد ذلك غسل الجلد باستخدام 1 N NaOH أو تخفيف بنسبة 1:10 من مادة التبييض لمدة دقيقة واحدة. يجب حرق النفايات الملوثة أو تعقيمها في محلول أساسي قوي، ويجب تنظيف الأدوات وغمرها في محلول أساسي قوي.
لمزيد من المعلومات حول التعامل مع الحيوانات والمواد الملوثة بالبريون، قم بزيارة الإرشادات المنشورة على مواقع CDC ومنظمة الصحة العالمية.
البيروكسيجينات
البيروكسيجينات هي عوامل مؤكسدة قوية يمكن استخدامها كمطهرات أو مطهرات. البيروكسيجين الأكثر استخدامًا هو بيروكسيد الهيدروجين (H 2 O 2)، والذي يستخدم غالبًا في محلول لتطهير الأسطح ويمكن استخدامه أيضًا كعامل غازي. محاليل بيروكسيد الهيدروجين عبارة عن مطهرات جلدية غير مكلفة تتحلل إلى ماء وغاز أكسجين، وكلاهما آمن بيئيًا. يتم تسريع هذا التحلل في وجود الضوء، لذلك تُباع محاليل بيروكسيد الهيدروجين عادةً في زجاجات بنية أو غير شفافة. من عيوب استخدام بيروكسيد الهيدروجين كمطهر أنه يتسبب أيضًا في تلف الجلد مما قد يؤخر الشفاء أو يؤدي إلى حدوث ندبات. غالبًا ما تحتوي منظفات العدسات اللاصقة على بيروكسيد الهيدروجين كمطهر.
يعمل بيروكسيد الهيدروجين عن طريق إنتاج الجذور الحرة التي تتلف الجزيئات الخلوية الكبيرة. يحتوي بيروكسيد الهيدروجين على نشاط واسع الطيف، ويعمل ضد البكتيريا الإيجابية والجرام السالبة للجرام (مع فعالية أكبر قليلاً ضد البكتيريا الإيجابية للجرام) والفطريات والفيروسات والمسام الداخلية. ومع ذلك، فإن البكتيريا التي تنتج إنزيمات إزالة السموم من الأكسجين الكاتالاز أو البيروكسيديز قد تتحمل بشكل متأصل تركيزات بيروكسيد الهيدروجين المنخفضة (الشكل\(\PageIndex{12}\)). لقتل المسام الداخلية، يجب زيادة طول التعرض أو تركيز محاليل بيروكسيد الهيدروجين. يتميز بيروكسيد الهيدروجين الغازي بفعالية أكبر ويمكن استخدامه كمعقم للغرف أو المعدات.

البلازما، وهو غاز ساخن مؤين، يوصف بأنه الحالة الرابعة للمادة، مفيد في تعقيم المعدات لأنه يخترق الأسطح ويقتل الخلايا النباتية والمسام الداخلية. يمكن إدخال كل من بيروكسيد الهيدروجين وحمض البيروكسيتيك، وهو بيروكسيجين آخر شائع الاستخدام، كبلازما. يمكن استخدام حمض البيروكسيتيك كمعقم سائل أو بلازما بقدر ما يقتل المسام الداخلية بسهولة، وهو أكثر فعالية من بيروكسيد الهيدروجين حتى بتركيزات منخفضة نوعًا ما، وهو محصن ضد التعطيل بواسطة الكاتالاز والبيروكسيداز. كما أنه يتحلل إلى مركبات غير ضارة بيئيًا؛ في هذه الحالة، حمض الأسيتيك والأكسجين.
تشمل الأمثلة الأخرى للبيروكسيجينات بيروكسيد البنزويل وبيروكسيد الكارباميد. البنزويل بيروكسايد هو بيروكسيجين يستخدم في حلول علاج حب الشباب. فهو يقتل بكتيريا حب الشباب البروبيونيباكتريوم المرتبطة بحب الشباب. بيروكسيد الكارباميد، أحد المكونات المستخدمة في معجون الأسنان، هو بيروكسيد الأكسجين الذي يحارب الأغشية الحيوية الفموية التي تسبب تغير لون الأسنان ورائحة الفم الكريهة (رائحة الفم الكريهة). 15 أخيرًا، غاز الأوزون هو بيروكسيد ذو خصائص مطهرة ويستخدم لتنظيف الهواء أو إمدادات المياه. بشكل عام، تعتبر البيروكسيجينات فعالة للغاية وشائعة الاستخدام، دون أي مخاطر بيئية مرتبطة بها.
التمارين الرياضية\(\PageIndex{8}\)
كيف تقتل البيروكسيدات الخلايا؟
السوائل فوق الحرجة
خلال الـ 15 عامًا الماضية، اكتسب استخدام السوائل فوق الحرجة، وخاصة ثاني أكسيد الكربون فوق الحرج (SCCo 2)، شعبية في بعض تطبيقات التعقيم. عندما يصل ثاني أكسيد الكربون إلى ما يقرب من 10 أضعاف الضغط الجوي، فإنه يصل إلى حالة فوق حرجة لها خصائص فيزيائية بين تلك الخاصة بالسوائل والغازات. يمكن تعقيم المواد التي يتم وضعها في غرفة يتم فيها ضغط ثاني أكسيد الكربون بهذه الطريقة بسبب قدرة SCCo 2 على اختراق الأسطح.
يعمل ثاني أكسيد الكربون فوق الحرج عن طريق اختراق الخلايا وتشكيل حمض الكربونك، وبالتالي خفض درجة الحموضة في الخلية بشكل كبير. هذه التقنية فعالة ضد الخلايا النباتية وتستخدم أيضًا مع حمض البيروتيك لقتل المسام الداخلية. يمكن أيضًا زيادة فعاليته بزيادة درجة الحرارة أو من خلال دورات سريعة من الضغط وخفض الضغط، والتي من المرجح أن تؤدي إلى تحلل الخلايا.
تشمل فوائد SCCo 2 الخصائص غير التفاعلية وغير السامة وغير القابلة للاشتعال لثاني أكسيد الكربون، وهذا البروتوكول فعال في درجات الحرارة المنخفضة. على عكس الطرق الأخرى، مثل الحرارة والإشعاع، التي يمكن أن تؤدي إلى تدهور الكائن الذي يتم تعقيمه، فإن استخدام SCCo 2 يحافظ على سلامة الكائن ويستخدم بشكل شائع لمعالجة الأطعمة (بما في ذلك التوابل والعصائر) والأجهزة الطبية مثل المناظير الداخلية. كما أنها تكتسب شعبية لتطهير الأنسجة مثل الجلد والعظام والأوتار والأربطة قبل الزرع. يمكن أيضًا استخدام SCCo 2 لمكافحة الآفات لأنه يمكن أن يقتل بيض الحشرات واليرقات داخل المنتجات.
التمارين الرياضية\(\PageIndex{9}\)
لماذا يكتسب استخدام ثاني أكسيد الكربون فوق الحرج شعبية للاستخدامات التجارية والطبية؟
المواد الحافظة الكيميائية للأغذية
تستخدم المواد الحافظة الكيميائية لمنع نمو الميكروبات وتقليل التلف في بعض الأطعمة. تشمل المواد الحافظة الكيميائية الشائعة الاستخدام حمض السوربيك وحمض البنزويك وحمض البروبيونيك وأملاحها الأكثر قابلية للذوبان وسوربات البوتاسيوم وبنزوات الصوديوم وبروبيونات الكالسيوم، وكلها تستخدم للتحكم في نمو العفن في الأطعمة الحمضية. كل من هذه المواد الحافظة غير سامة ويتم استقلابها بسهولة من قبل البشر. كما أنها عديمة النكهة، لذا فهي لا تؤثر سلبًا على نكهة الأطعمة التي تحتفظ بها.
تُظهر أحماض السوربيك والبنزويك فعالية متزايدة مع انخفاض درجة الحموضة. يُعتقد أن حمض السوربيك يعمل عن طريق تثبيط الإنزيمات الخلوية المختلفة، بما في ذلك تلك الموجودة في دورة حمض الستريك، وكذلك الكاتالاز والبيروكسيداز. يتم إضافته كمادة حافظة في مجموعة متنوعة من الأطعمة، بما في ذلك منتجات الألبان والخبز والفواكه والخضروات. يوجد حمض البنزويك بشكل طبيعي في العديد من أنواع الفواكه والتوت والتوابل والمنتجات المخمرة. يُعتقد أنه يعمل عن طريق تقليل درجة الحموضة داخل الخلايا، والتدخل في آليات مثل الفسفرة التأكسدية وامتصاص الجزيئات مثل الأحماض الأمينية في الخلايا. تشمل الأطعمة المحفوظة بحمض البنزويك أو بنزوات الصوديوم عصائر الفاكهة والمربى والآيس كريم والمعجنات والمشروبات الغازية والعلكة والمخللات.
يُعتقد أن حمض البروبيونيك يثبط الإنزيمات ويقلل درجة الحموضة داخل الخلايا، ويعمل بشكل مشابه لحمض البنزويك. ومع ذلك، فإن حمض البروبيونيك مادة حافظة أكثر فاعلية عند درجة حموضة أعلى من حمض السوربيك أو حمض البنزويك. يتم إنتاج حمض البروبيونيك بشكل طبيعي بواسطة بعض أنواع الجبن أثناء نضجها ويضاف إلى أنواع أخرى من الجبن والمخبوزات لمنع تلوث العفن. يتم إضافته أيضًا إلى العجين الخام لمنع التلوث ببكتيريا Bacillus mesentericus، والتي تجعل الخبز يصبح روبيًا.
تشمل المواد الحافظة الكيميائية الأخرى شائعة الاستخدام ثاني أكسيد الكبريت والنتريت. يمنع ثاني أكسيد الكبريت تحمير الأطعمة ويستخدم لحفظ الفواكه المجففة؛ وقد تم استخدامه في صناعة النبيذ منذ العصور القديمة. يذوب غاز ثاني أكسيد الكبريت في الماء بسهولة، مكونًا الكبريتات. على الرغم من أن الجسم يمكن أن يستقلب الكبريتات، إلا أن بعض الأشخاص يعانون من حساسية الكبريتات، بما في ذلك تفاعلات الربو. بالإضافة إلى ذلك، تعمل الكبريتات على تحلل الثيامين، وهو عنصر غذائي مهم في بعض الأطعمة. طريقة عمل الكبريتات ليست واضحة تمامًا، ولكنها قد تتداخل مع تكوين رابطة ثنائي كبريتيد (انظر الشكل 7.4.5) في البروتينات، مما يثبط النشاط الإنزيمي. وبدلاً من ذلك، قد تقلل من درجة الحموضة داخل الخلية، مما يتداخل مع الآليات التي تحركها قوة دافع البروتون.
تتم إضافة النتريت إلى اللحوم المصنعة للحفاظ على اللون ووقف إنبات أبواغ كلوستريديوم البوتولينوم. يتم تقليل النتريت إلى أكسيد النيتريك، الذي يتفاعل مع مجموعات الهيم ومجموعات الحديد والكبريت. عندما يتفاعل أكسيد النيتريك مع مجموعة الهيم داخل ميوغلوبين اللحوم، يتشكل منتج أحمر يعطي اللحم لونه الأحمر. بدلاً من ذلك، يُعتقد أنه عندما يتفاعل حمض النيتريك مع إنزيم فيريدوكسين للحديد والكبريت داخل البكتيريا، يتم تدمير حامل سلسلة نقل الإلكترون هذا، مما يمنع تخليق ATP. ومع ذلك، فإن النتروزامين مادة مسرطنة ويمكن إنتاجها من خلال التعرض للحوم المحفوظة بالنيتريت (مثل النقانق ولحم الغداء وسجق الإفطار ولحم الخنزير المقدد واللحوم في الحساء المعلب) للتسخين أثناء الطهي.
مواد حافظة غذائية كيميائية طبيعية
وقد أضاف اكتشاف المواد الطبيعية المضادة للميكروبات التي تنتجها الميكروبات الأخرى إلى ترسانة المواد الحافظة المستخدمة في الغذاء. النيسين هو ببتيد مضاد للميكروبات تنتجه بكتيريا Lactococcus lactis وهو فعال بشكل خاص ضد الكائنات الحية الإيجابية للجرام. يعمل Nisin عن طريق تعطيل إنتاج جدار الخلية، مما يجعل الخلايا أكثر عرضة للتحلل. يتم استخدامه لحفظ الجبن واللحوم والمشروبات.
Natamycin هو مضاد حيوي ماكروليد مضاد للفطريات تنتجه بكتيريا Streptomyces natalensis. تمت الموافقة عليه من قبل إدارة الغذاء والدواء الأمريكية في عام 1982 ويستخدم لمنع نمو الفطريات في أنواع مختلفة من منتجات الألبان، بما في ذلك الجبن وشرائح الجبن والجبن المبشور. يستخدم Natamycin أيضًا لحفظ اللحوم في بلدان خارج الولايات المتحدة.
التمارين الرياضية\(\PageIndex{10}\)
ما هي مزايا وعيوب استخدام الكبريتات والنتريت كمواد حافظة للأغذية؟
المفاهيم الأساسية والملخص
- لطالما استخدمت المعادن الثقيلة، بما في ذلك الزئبق والفضة والنحاس والزنك، للتطهير والحفظ، على الرغم من أن بعضها ينطوي على مخاطر سمية وبيئية مرتبطة بها.
- كما تستخدم الهالوجينات، بما في ذلك الكلور والفلور واليود، بشكل شائع للتطهير. تُستخدم مركبات الكلور، بما في ذلك هيبوكلوريت الصوديوم والكلورامين وثاني أكسيد الكلور، بشكل شائع لتطهير المياه. يعتبر اليود، في كل من أشكال الصبغة واليودوفور، مطهرًا فعالًا.
- الكحول، بما في ذلك الكحول الإيثيلي وكحول الأيزوبروبيل، هي مطهرات شائعة الاستخدام تعمل عن طريق تغيير طبيعة البروتينات وتعطيل الأغشية.
- الفينولات عبارة عن مطهرات مستقرة وطويلة المفعول تشوه البروتينات وتعطل الأغشية. توجد بشكل شائع في المنظفات المنزلية وغسول الفم ومطهرات المستشفيات، وتستخدم أيضًا للحفاظ على المحاصيل المحصودة.
- يعتبر مركب التريكلوسان الفينول الموجود في الصابون المضاد للبكتيريا والبلاستيك والمنسوجات مضادًا حيويًا من الناحية الفنية بسبب طريقة عمله المحددة في تثبيط تخليق الأحماض الدهنية البكتيرية..
- تعمل المواد الخافضة للتوتر السطحي، بما في ذلك الصابون والمنظفات، على خفض التوتر السطحي للماء لتكوين مستحلبات تنقل الميكروبات ميكانيكيًا. الصابون عبارة عن أحماض دهنية طويلة السلسلة، بينما المنظفات عبارة عن مواد اصطناعية خافضة للتوتر السطحي.
- مركبات الأمونيوم الرباعية (الكوارتز) هي منظفات كاتيونية تعطل الأغشية. يتم استخدامها في المنظفات المنزلية ومطهرات الجلد وشطف الفم وغسول الفم.
- يعمل البزبيجوانيدات على تعطيل أغشية الخلايا، مما يتسبب في هضم محتويات الخلية. يشيع استخدام الكلورهيكسيدين والأكسيدين في المقشرات الجراحية وغسل اليدين في البيئات السريرية وفي شطف الفم بوصفة طبية.
- تقوم عوامل الألكلة بتعقيم المواد بشكل فعال في درجات حرارة منخفضة ولكنها تسبب السرطان وقد تهيج الأنسجة أيضًا. يتم استخدام الجلوتارالدهيد والأو-فثالالديهيد كمطهرات للمستشفيات ولكن ليس كمطهرات. يستخدم الفورمالديهايد لتخزين عينات الأنسجة، وكسائل للتحنيط، وفي تحضير اللقاح لتثبيط العوامل المعدية. أكسيد الإيثيلين هو معقم بالغاز يمكن أن يتغلغل في المواد المعبأة الحساسة للحرارة، ولكنه أيضًا قابل للانفجار ومسببًا للسرطان.
- البيروكسيجينات، بما في ذلك بيروكسيد الهيدروجين وحمض البيروكسيتيك وبيروكسيد البنزويل وغاز الأوزون، هي عوامل مؤكسدة قوية تنتج الجذور الحرة في الخلايا، مما يؤدي إلى إتلاف جزيئاتها الكبيرة. إنها آمنة بيئيًا وهي مطهرات ومطهرات فعالة للغاية.
- يتغلغل ثاني أكسيد الكربون المضغوط في شكل سائل فوق حرج بسهولة في المواد والخلايا المعبأة، مما يشكل حمض الكربوميك ويخفض درجة الحموضة داخل الخلايا. ثاني أكسيد الكربون فوق الحرج غير تفاعلي وغير سام وغير قابل للاشتعال وفعال في درجات الحرارة المنخفضة لتعقيم الأجهزة الطبية والغرسات والأنسجة المزروعة.
- تتم إضافة المواد الحافظة الكيميائية إلى مجموعة متنوعة من الأطعمة. يعمل حمض السوربيك وحمض البنزويك وحمض البروبيونيك وأملاحها الأكثر قابلية للذوبان على تثبيط الإنزيمات أو تقليل درجة الحموضة داخل الخلايا.
- تستخدم الكبريتات في صناعة النبيذ ومعالجة الأغذية لمنع تحول الأطعمة إلى اللون البني.
- تستخدم النتريت لحفظ اللحوم والحفاظ على لونها، ولكن طهي اللحوم المحفوظة بالنيتريت قد ينتج نيتروزامين مسرطنة.
- نيسين وناتاميسين من المواد الحافظة المنتجة بشكل طبيعي والمستخدمة في الجبن واللحوم. نيسين فعال ضد البكتيريا الإيجابية للجرام والناتاميسين ضد الفطريات.
الحواشي
- 1 إدارة الغذاء والدواء الأمريكية. «تريكلوسان: ما يجب أن يعرفه المستهلكون». 2015. www.fda.gov/forconsumers/Cons... /ucm205999.htm. تم الوصول إليه في 9 يونيو 2016.
- 2 جي سترومبرغ. «خمسة أسباب لماذا يجب عليك التوقف عن استخدام الصابون المضاد للبكتيريا.» سميثسونيان. كوم 3 يناير 2014. www.smithsonianmag.com/science... 948078/? لا توجد قائمة. تم الوصول إليه في 9 يونيو 2016.
- 3 إس بي يازدانخاه وآخرون. «التريكلوسان ومقاومة مضادات الميكروبات في البكتيريا: نظرة عامة.» مقاومة الأدوية الميكروبية رقم 12 رقم 2 (2006): 83-90.
- 4 - ل. بيروشوفا و السيد ميكولاشوفا. «تطوير مقاومة التريكلوسان والمضادات الحيوية في السالمونيلا المعوية والسيروفار التيفيموريوم.» مجلة الميكروبيولوجيا الطبية 58 رقم 4 (2009): 436-441.
- 5 أ. ب دان، أ. هونتيلا. «تريكلوسان: التعرض البيئي والسمية وآليات العمل.» مجلة علم السموم التطبيقي 31 رقم 4 (2011): 285-311.
- 6 مراكز أمريكية لمكافحة الأمراض والوقاية منها. «صحيفة وقائع تريكلوسان». 2013. www.cdc.gov/biomonitoring/tri... FactSheet.html. تم الوصول إليه في 9 يونيو 2016.
- 7 إي إم كلايتون وآخرون. «تأثير البيسفينول A والتريكلوسان على المعلمات المناعية في سكان الولايات المتحدة، NHANES 2003-2006.» آفاق الصحة البيئية 119 رقم 3 (2011): 390.
- 8 ن. سيلفستري-رودريغيز وآخرون. «الفضة كمطهر». في مراجعات التلوث البيئي وعلم السموم، الصفحات 23-45. حرره جي دبليو وير ودي إم وايتاكر. نيويورك: سبرينغر، 2007.
- 9 ب. أوينز. «الفضة تجعل المضادات الحيوية أكثر فعالية بآلاف المرات.» الطبيعة 19 يونيو 2013. http://www.nature.com/news/silver-ma...ective-1.13232
- 10 سي سيلر، تو بيريندونك. «الاختيار المشترك القائم على المعادن الثقيلة لمقاومة المضادات الحيوية في التربة والأجسام المائية المتأثرة بالزراعة وتربية الأحياء المائية.» الحدود في علم الأحياء الدقيقة 3 (2012): 399.
- 11 منظمة الصحة العالمية. «فوائد ومخاطر استخدام المطهرات المحتوية على الكلور في إنتاج الأغذية وتجهيز الأغذية: تقرير اجتماع الخبراء المشترك بين منظمة الأغذية والزراعة ومنظمة الصحة العالمية.» جنيف، سويسرا: منظمة الصحة العالمية، 2009.
- 12 ريد ماركيز. «الإجراءات المضادة للميكروبات للفلورايد لبكتيريا الفم.» المجلة الكندية لعلم الأحياء الدقيقة 41 رقم 11 (1995): 955-964.
- 13 ل. توماس وآخرون «تطوير المقاومة لثنائي أسيتات الكلورهيكسيدين في الزائفة الزنجارية وتأثير التركيز «المتبقي».» مجلة عدوى المستشفى 46 رقم 4 (2000): 297-303.
- 14 معهد الطب. «الآثار الصحية طويلة المدى للمشاركة في مشروع SHAD (المخاطر على متن السفن والدفاع).» واشنطن العاصمة: مطبعة الأكاديميات الوطنية، 2007.
- 15 ياو، سي إس وآخرون. «التأثير المضاد للبكتيريا في المختبر لبيروكسيد الكارباميد على البيوفيلم الفموي.» مجلة علم الأحياء الدقيقة الفموي 12 يونيو 2013. http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3682087/. دوي: 10.3402/jom.v5i0.20392.


