11.7: تنظيم الجينات - نظرية أوبيرون
- Page ID
- 194642
أهداف التعلم
- قارن بين الأشخاص المستحثين والأشخاص الذين يمكن كبتهم
- وصف سبب أهمية تنظيم العمليات
تحتوي كل خلية نووية في كائن متعدد الخلايا على نسخ من نفس الحمض النووي. وبالمثل، تحتوي جميع الخلايا في مزرعتين بكتريتين نقيتين تم تلقيحهما من نفس المستعمرة الأولية على نفس الحمض النووي، باستثناء التغييرات التي تنشأ عن الطفرات العفوية. إذا كانت كل خلية في كائن حي متعدد الخلايا لها نفس الحمض النووي، فكيف تظهر الخلايا في أجزاء مختلفة من جسم الكائن الحي خصائص مختلفة؟ وبالمثل، كيف يمكن لنفس الخلايا البكتيرية داخل ثقافتين نقيتين معرضتين لظروف بيئية مختلفة أن تظهر أنماطًا ظاهرية مختلفة؟ في كلتا الحالتين، لا تقوم كل خلية متطابقة وراثيًا بتشغيل أو التعبير عن نفس مجموعة الجينات. يتم التعبير فقط عن مجموعة فرعية من البروتينات في خلية في وقت معين.
يحتوي الحمض النووي الجيني على كل من الجينات الهيكلية، التي تقوم بترميز المنتجات التي تعمل كهياكل خلوية أو إنزيمات، والجينات التنظيمية، التي تقوم بترميز المنتجات التي تنظم التعبير الجيني. يعد التعبير عن الجين عملية منظمة للغاية. في حين أن تنظيم التعبير الجيني في الكائنات متعددة الخلايا يسمح بالتمايز الخلوي، في الكائنات أحادية الخلية مثل بدائيات النواة، فإنه يضمن في المقام الأول عدم إهدار موارد الخلية في صنع البروتينات التي لا تحتاجها الخلية في ذلك الوقت.
إن توضيح الآليات التي تتحكم في التعبير الجيني مهم لفهم صحة الإنسان. تؤدي الأعطال في هذه العملية عند البشر إلى تطور السرطان وأمراض أخرى. يعد فهم التفاعل بين التعبير الجيني لمسببات الأمراض ومضيفها البشري أمرًا مهمًا لفهم مرض معدي معين. يتضمن تنظيم الجينات شبكة معقدة من التفاعلات داخل خلية معينة بين الإشارات من بيئة الخلية وجزيئات الإشارة داخل الخلية والحمض النووي للخلية. تؤدي هذه التفاعلات إلى التعبير عن بعض الجينات وقمع البعض الآخر، اعتمادًا على الظروف.
تشترك بدائيات النوى وحقيقيات النوى في بعض أوجه التشابه في آلياتها لتنظيم التعبير الجيني؛ ومع ذلك، فإن التعبير الجيني في حقيقيات النوى أكثر تعقيدًا بسبب الفصل الزمني والمكاني بين عمليات النسخ والترجمة. وبالتالي، على الرغم من أن معظم تنظيم التعبير الجيني يحدث من خلال التحكم النسخي في بدائيات النواة، فإن تنظيم التعبير الجيني في حقيقيات النوى يحدث على مستوى النسخ وما بعد النسخ (بعد إعداد النص الأولي).
تنظيم الجينات بدائية النواة
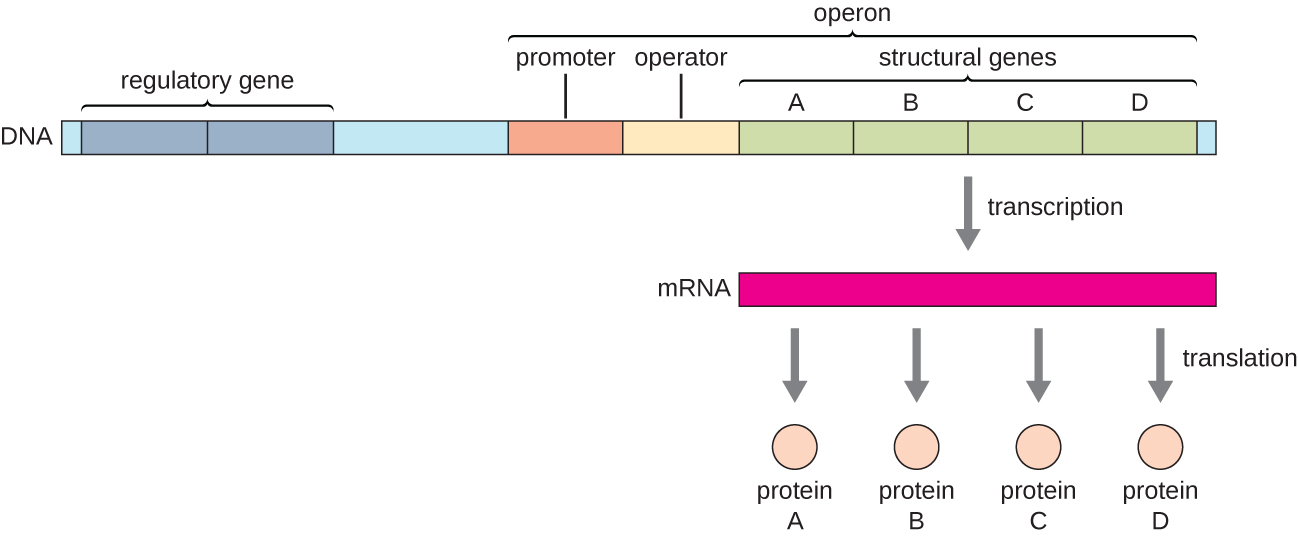
في البكتيريا والعتيقة، عادة ما يتم ترميز البروتينات الهيكلية ذات الوظائف ذات الصلة معًا داخل الجينوم في كتلة تسمى أوبيرون ويتم نسخها معًا تحت سيطرة محفز واحد، مما يؤدي إلى تكوين نسخة متعددة الكيسترونية (الشكل\(\PageIndex{1}\)). وبهذه الطريقة، يمكن التحكم في تنظيم نسخ جميع الجينات الهيكلية التي ترميز الإنزيمات التي تحفز الخطوات العديدة في مسار كيميائي حيوي واحد في وقت واحد، لأنه إما ستكون هناك حاجة إليها جميعًا في نفس الوقت، أو لن تكون هناك حاجة إليها. على سبيل المثال، في E. coli، تقع جميع الجينات الهيكلية التي تقوم بترميز الإنزيمات اللازمة لاستخدام اللاكتوز كمصدر للطاقة بجانب بعضها البعض في أوبرون اللاكتوز (أو lac) تحت سيطرة مروج واحد، وهو مروج اللاكتوز. كان العالمان الفرنسيان فرانسوا جاكوب (1920-2013) وجاك مونود في معهد باستير أول من أظهر تنظيم الجينات البكتيرية إلى أوبيرونات، من خلال دراساتهما حول لاك أوبيرون للإشريكية القولونية. لهذا العمل، فازوا بجائزة نوبل في علم وظائف الأعضاء أو الطب في عام 1965. على الرغم من أن الجينات حقيقية النواة لا يتم تنظيمها في أوبيرونات، إلا أن العوامل بدائية النواة تعد نماذج ممتازة للتعرف على تنظيم الجينات بشكل عام. توجد بعض مجموعات الجينات في حقيقيات النوى التي تعمل بشكل مشابه للأوبيرونات. يمكن تطبيق العديد من المبادئ على أنظمة حقيقيات النواة والمساهمة في فهمنا للتغيرات في التعبير الجيني في حقيقيات النوى التي يمكن أن تؤدي إلى تغيرات مرضية مثل السرطان.
يتضمن كل أوبرون تسلسلات الحمض النووي التي تؤثر على النسخ الخاص بها؛ وتقع هذه التسلسلات في منطقة تسمى المنطقة التنظيمية. تشمل المنطقة التنظيمية المروج والمنطقة المحيطة بالمروج، والتي يمكن أن ترتبط بها عوامل النسخ والبروتينات المشفرة بالجينات التنظيمية. تؤثر عوامل النسخ على ارتباط بوليميراز الحمض النووي الريبي بالمروج وتسمح بتقدمه لنسخ الجينات الهيكلية. المثبط هو عامل النسخ الذي يمنع نسخ الجين استجابةً لمحفز خارجي عن طريق الارتباط بتسلسل الحمض النووي داخل المنطقة التنظيمية التي تسمى المشغل، والتي تقع بين موقع ربط بوليميراز الحمض النووي الريبي للمروج وموقع البدء النسخي الأول الجين الهيكلي. يمنع الارتباط المانع ماديًا بوليميراز الحمض النووي الريبي من نسخ الجينات الهيكلية. على العكس من ذلك، فإن المنشط هو عامل نسخ يزيد من نسخ الجين استجابة لمحفز خارجي من خلال تسهيل ربط بوليميراز الحمض النووي الريبي بالمروج. المحفز، وهو نوع ثالث من الجزيء التنظيمي، هو جزيء صغير يقوم إما بتنشيط النسخ أو كبته من خلال التفاعل مع مثبط أو منشط.
في بدائيات النوى، هناك أمثلة على الأشخاص الذين تكون منتجاتهم الجينية مطلوبة بشكل ثابت إلى حد ما، وبالتالي فإن تعبيرهم غير منظم. يتم التعبير عن هذه العوامل بشكل تأسيسي، مما يعني أنه يتم نسخها وترجمتها باستمرار لتزويد الخلية بمستويات وسيطة ثابتة من منتجات البروتين. تقوم هذه الجينات بترميز الإنزيمات المشاركة في وظائف التدبير المنزلي المطلوبة للصيانة الخلوية، بما في ذلك تكرار الحمض النووي وإصلاحه والتعبير عنه، وكذلك الإنزيمات المشاركة في عملية التمثيل الغذائي الأساسية. في المقابل، هناك معاملات بدائية النواة أخرى يتم التعبير عنها فقط عند الحاجة ويتم تنظيمها بواسطة أدوات قمع ومنشطات ومحفزات.
التمارين\(\PageIndex{1}\)
- ما هي الأجزاء في تسلسل الحمض النووي للأوبيرون؟
- ما أنواع الجزيئات التنظيمية الموجودة؟
التنظيم عن طريق القمع
عادة ما يتم التحكم في العمليات بدائية النواة عن طريق ربط الكابتات بمناطق المشغل، وبالتالي منع نسخ الجينات الهيكلية. يتم تصنيف هؤلاء الأشخاص على أنهم إما أشخاص قابلون للقمع أو أشخاص مستحثين. تحتوي العمليات القابلة للكبت، مثل تريبتوفان (trp) أوبيرون، عادةً على جينات ترميز الإنزيمات المطلوبة لمسار التخليق الحيوي. طالما أن منتج المسار، مثل التربتوفان، لا يزال مطلوبًا من قبل الخلية، سيستمر التعبير عن أوبيرون يمكن كبته. ومع ذلك، عندما يبدأ منتج مسار التخليق الحيوي في التراكم في الخلية، مما يلغي الحاجة إلى استمرار الخلية في إنتاج المزيد، يتم قمع تعبير الأوبرون. على العكس من ذلك، غالبًا ما تحتوي الأورام المستحثة، مثل lac operon لـ E. coli، على جينات ترميز الإنزيمات في مسار يشارك في عملية التمثيل الغذائي لركيزة معينة مثل اللاكتوز. هذه الإنزيمات مطلوبة فقط عندما تكون تلك الركيزة متاحة، وبالتالي لا يتم التعبير عن الأيرونات عادةً إلا في وجود الركيزة.
عملية الرحلة: عملية قابلة للقمع
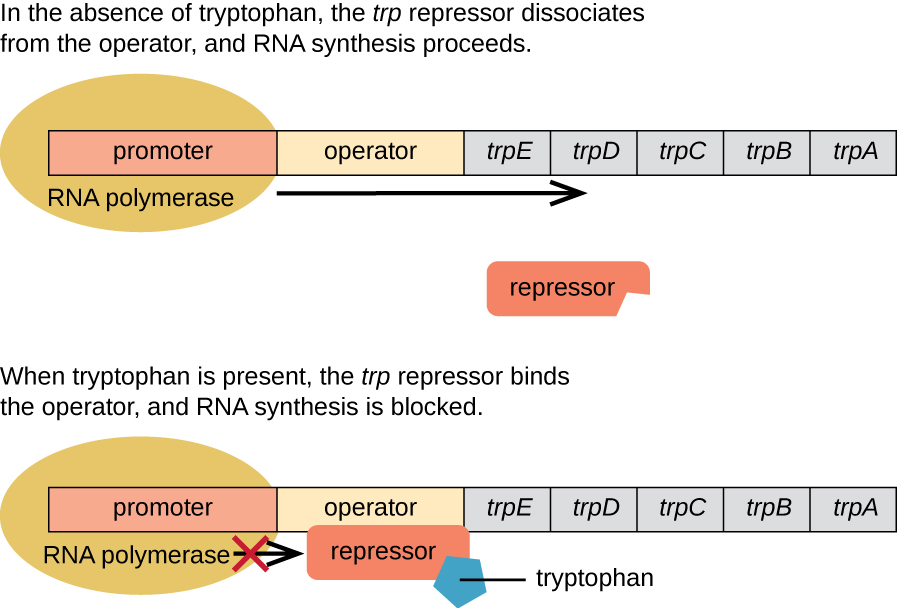
يمكن للإشريكية القولونية تصنيع التربتوفان باستخدام الإنزيمات التي يتم ترميزها بواسطة خمسة جينات هيكلية تقع بجانب بعضها البعض في trp operon (الشكل\(\PageIndex{2}\)). عندما يكون التربتوفان البيئي منخفضًا، يتم تشغيل أوبيرون. هذا يعني أن النسخ يبدأ، ويتم التعبير عن الجينات، ويتم تصنيع التربتوفان. ومع ذلك، في حالة وجود التربتوفان في البيئة، يتم إيقاف تشغيل جهاز الرحلة. لا يحدث النسخ ولا يتم تصنيع التربتوفان.
عندما لا يكون التربتوفان موجودًا في الخلية، لا يرتبط المثبط بحد ذاته بالمشغل؛ لذلك، يكون المعامل نشطًا ويتم تصنيع التربتوفان. ومع ذلك، عندما يتراكم التربتوفان في الخلية، يرتبط جزيئان من التريبتوفان بجزيء مثبط التربتوفان، الذي يغير شكله، مما يسمح له بالارتباط بمشغل التربتوفان. هذا الارتباط للشكل النشط لمثبط التشريب بالمشغل يمنع بوليميراز الحمض النووي الريبي من نسخ الجينات الهيكلية، مما يوقف التعبير عن العامل. وبالتالي، فإن المنتج الفعلي لمسار التخليق الحيوي الذي يتحكم فيه أوبيرون ينظم التعبير عن العامل.
شاهد هذا الفيديو لمعرفة المزيد عن رحلة operon.
عملية البلاك: عملية مستحثة
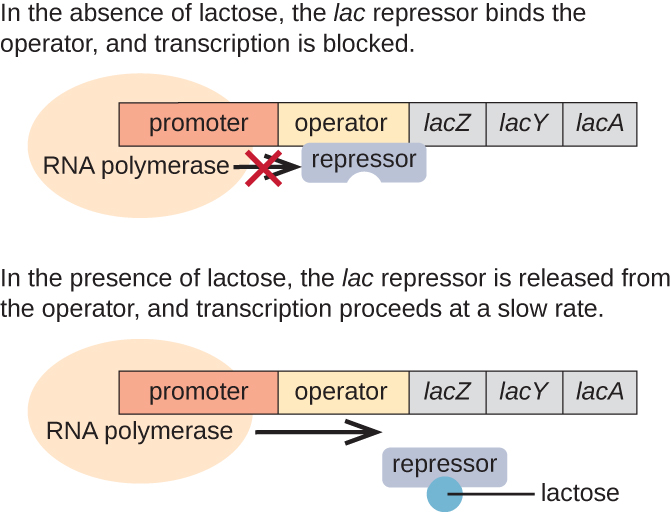
يعتبر Lac operon مثالاً على عامل مستحث يخضع أيضًا للتنشيط في حالة عدم وجود الجلوكوز (الشكل\(\PageIndex{3}\)). يقوم lac operon بتشفير ثلاثة جينات هيكلية ضرورية للحصول على اللاكتوز ثنائي السكاريد ومعالجته من البيئة، وتكسيره إلى السكريات البسيطة والجلوكوز والجالاكتوز. لكي يتم التعبير عن الليك أوبرون، يجب أن يكون اللاكتوز موجودًا. هذا أمر منطقي للخلية لأنه سيكون من الإسراف الشديد إنشاء الإنزيمات لمعالجة اللاكتوز إذا لم يكن اللاكتوز متاحًا.
في حالة عدم وجود اللاكتوز، يرتبط مثبط اللاك بمنطقة المشغل في lac operon، مما يمنع فعليًا بوليميراز الحمض النووي الريبي من نسخ الجينات الهيكلية. ومع ذلك، عند وجود اللاكتوز، يتم تحويل اللاكتوز داخل الخلية إلى ألولاكتوز. يعمل Allolactose كجزيء محفز، يرتبط بالكامع ويغير شكله بحيث لم يعد قادرًا على الارتباط بالحمض النووي للمشغل. تسمح إزالة الكابح في وجود اللاكتوز لبوليميراز الحمض النووي الريبي بالانتقال عبر منطقة المشغل والبدء في نسخ الجينات الهيكلية لللاك.
بلاك أوبيرون: التنشيط بواسطة بروتين منشط الكاتابوليت
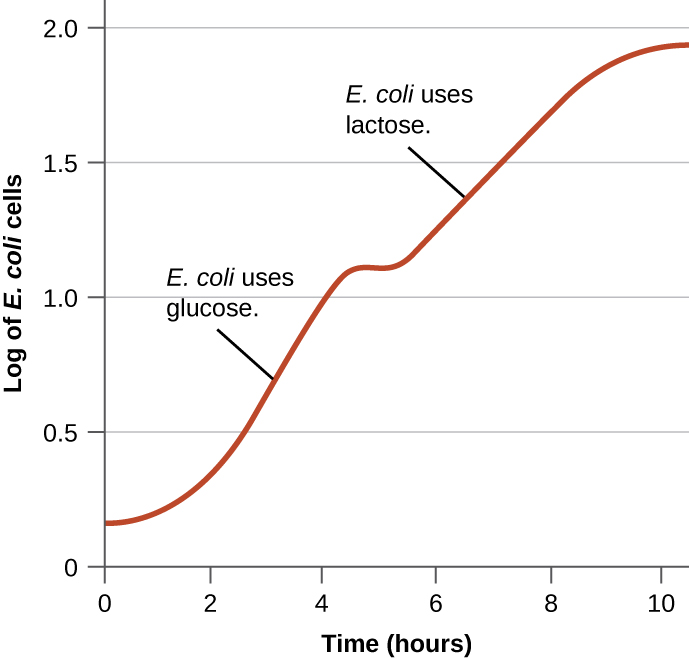
تمتلك البكتيريا عادةً القدرة على استخدام مجموعة متنوعة من الركائز كمصادر للكربون. ومع ذلك، نظرًا لأن الجلوكوز عادة ما يكون أفضل من الركائز الأخرى، فإن البكتيريا لديها آليات لضمان استخدام الركائز البديلة فقط عند استنفاد الجلوكوز. بالإضافة إلى ذلك، تمتلك البكتيريا آليات لضمان التعبير عن الجينات التي تقوم بترميز الإنزيمات لاستخدام ركائز بديلة فقط عند توفر الركيزة البديلة. في الأربعينيات من القرن الماضي، كان جاك مونود أول من أظهر تفضيل ركائز معينة على غيرها من خلال دراساته لنمو E. coli عند استزراعه في وجود ركيزتين مختلفتين في وقت واحد. أنتجت مثل هذه الدراسات منحنيات نمو ثنائية، مثل تلك الموضحة في الشكل\(\PageIndex{4}\). على الرغم من استخدام جلوكوز الركيزة المفضل أولاً، إلا أن E. coli تنمو بسرعة وتنعدم إنزيمات استقلاب اللاكتوز. ومع ذلك، بمجرد استنفاد مستويات الجلوكوز، تتباطأ معدلات النمو، مما يؤدي إلى التعبير عن الإنزيمات اللازمة لعملية التمثيل الغذائي للركيزة الثانية، اللاكتوز. لاحظ كيف أن معدل نمو اللاكتوز أبطأ، كما يتضح من الانحدار المنخفض لمنحنى النمو.
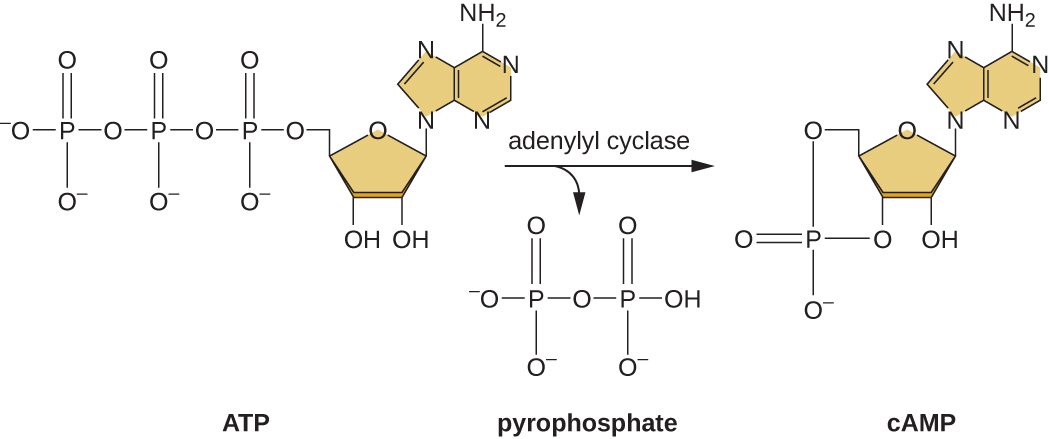
القدرة على التحول من استخدام الجلوكوز إلى ركيزة أخرى مثل اللاكتوز هي نتيجة لنشاط إنزيم يسمى Enzyme IIA (EIIA). عندما تنخفض مستويات الجلوكوز، تنتج الخلايا كمية أقل من ATP من الهدم (انظر هدم الكربوهيدرات)، ويصبح EIIA مفسورًا. ينشط EIIA الفوسفوري سيكلاز الأدينيل، وهو إنزيم يحول بعضًا من ATP المتبقي إلى AMP دوري (CaMP)، وهو مشتق دوري من AMP وجزيء إشارة مهم يشارك في استقلاب الجلوكوز والطاقة في E. coli. ونتيجة لذلك، تبدأ مستويات CamP في الارتفاع في الخلية (الشكل\(\PageIndex{5}\)).
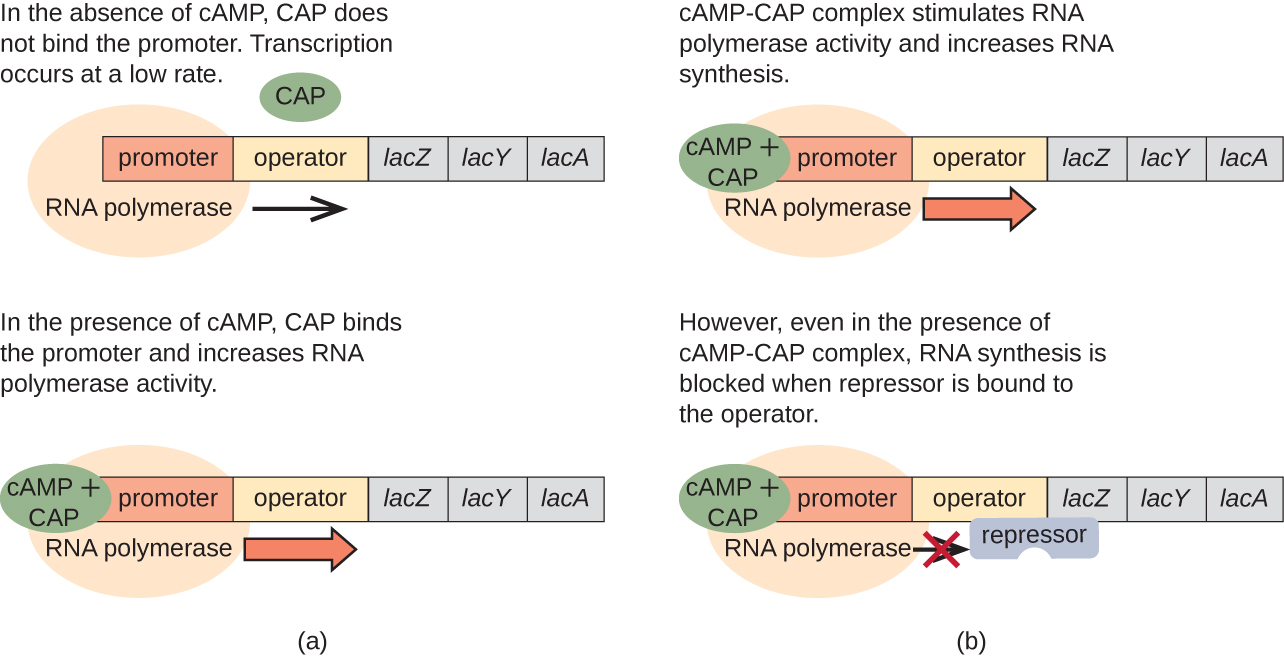
يلعب lac operon أيضًا دورًا في هذا التحول من استخدام الجلوكوز إلى استخدام اللاكتوز. عندما يكون الجلوكوز نادرًا، يرتبط CaMP المتراكم الناتج عن زيادة نشاط الدينيل سيكلاز ببروتين المنشط التقويضي (CAP)، المعروف أيضًا باسم بروتين مستقبلات CaMP (CRP). يرتبط المجمع بالمنطقة المروجة في لاك أوبرون (الشكل\(\PageIndex{6}\)). في المناطق التنظيمية لهذه العمليات، يقع موقع ربط CAP في الجزء العلوي من موقع ربط بوليميراز الحمض النووي الريبي في المروج. يزيد ربط مجمع Cap-camp بهذا الموقع من قدرة ربط بوليميراز الحمض النووي الريبي بمنطقة المروج لبدء نسخ الجينات الهيكلية. وبالتالي، في حالة lac operon، لكي يحدث النسخ، يجب أن يكون اللاكتوز موجودًا (إزالة بروتين مثبط اللاك) ويجب استنفاد مستويات الجلوكوز (مما يسمح بربط البروتين المنشط). عندما تكون مستويات الجلوكوز مرتفعة، يحدث قمع تقويضي للأوبيرونات التي ترمز إلى الإنزيمات من أجل استقلاب الركائز البديلة. نظرًا لانخفاض مستويات CamP في ظل هذه الظروف، لا توجد كمية كافية من مجمع Cap-camp لتنشيط نسخ هذه العمليات. انظر الجدول\(\PageIndex{1}\) للحصول على ملخص لتنظيم Lac operon.
| جلوكوز | ربط كاب | لاكتوز | يربط القامع | النسخ |
|---|---|---|---|---|
| + | — | — | + | لا |
| + | — | + | — | بعض |
| — | + | — | + | لا |
| — | + | + | — | نعم |
شاهد برنامجًا تعليميًا متحركًا حول طريقة عمل lac operon هنا.
التمارين\(\PageIndex{2}\)
- ما الذي يؤثر على ربط مثبط تشغيل الرحلة بالمشغل؟
- كيف ومتى يتم تغيير سلوك البروتين المثبط للكتلة؟
- بالإضافة إلى كونه قابلاً للقمع، وإلا كيف يتم تنظيم عملية الغسيل؟
الاستجابات العالمية لبدائيات النواة
في بدائيات النواة، هناك أيضًا عدة مستويات أعلى من تنظيم الجينات التي لديها القدرة على التحكم في نسخ العديد من العمليات ذات الصلة في وقت واحد استجابة لإشارة بيئية. تسمى مجموعة من العمليات التي يتم التحكم فيها جميعًا في وقت واحد باسم Regulon.
أرمونيس
عند استشعار الإجهاد الوشيك، تقوم بدائيات النواة بتغيير تعبير مجموعة متنوعة من الأشخاص للاستجابة بالتنسيق. ويقومون بذلك من خلال إنتاج الأرمونات، وهي مشتقات نيوكليوتيد صغيرة داخل الخلايا. تعمل أجهزة الإنذار على تغيير الجينات التي يتم التعبير عنها وتحفيز التعبير عن جينات محددة للاستجابة للتوتر. يبدو أن استخدام أجهزة الإنذار لتغيير التعبير الجيني استجابة للإجهاد مهم في البكتيريا المسببة للأمراض. عند مواجهة آليات الدفاع عن المضيف والظروف القاسية الأخرى أثناء الإصابة، يتم تنظيم العديد من العمليات التي تقوم بترميز جينات الفوعة استجابة لإشارات الإنذار. إن معرفة هذه الاستجابات هي المفتاح للقدرة على الفهم الكامل لعملية العدوى للعديد من مسببات الأمراض ولتطوير العلاجات لمواجهة هذه العملية.
عوامل بديلة
نظرًا لأن الوحدة الفرعية من بوليميراز الحمض النووي الريبي البكتيري تمنح خصوصية فيما يتعلق بالمحفزات التي يجب نسخها، فإن تغيير عامل المستخدم هو طريقة أخرى للبكتيريا لتغيير اللوائح التي يتم نسخها في وقت معين بسرعة وعلى مستوى العالم. يتعرف عامل على التسلسلات داخل محفز بكتيري، لذلك سيتعرف كل عامل من عوامل المختلفة على تسلسلات مروجة مختلفة قليلاً. بهذه الطريقة، عندما تستشعر الخلية ظروفًا بيئية محددة، قد تستجيب بتغيير عامل الذي تعبر عنه، وتحطيم العامل القديم وإنتاج عامل جديد لنسخ العوامل التي ترمز الجينات التي ستكون منتجاتها مفيدة في ظل الظروف البيئية الجديدة. على سبيل المثال، في بكتيريا التبويض من أجناس Bacillus و Clostridium (والتي تشمل العديد من مسببات الأمراض)، تتحكم مجموعة من العوامل في التعبير عن العديد من الجينات اللازمة للتبويض استجابة لإشارات تحفيز التبويض.
التمارين\(\PageIndex{3}\)
- ما الاسم الذي يطلق على مجموعة من الأشخاص التي يمكن تنظيمها كمجموعة؟
- ما نوع التحفيز الذي قد يؤدي إلى نسخ عامل مختلف؟
طرق إضافية للتنظيم في البكتيريا: التوهين ومفاتيح الريبو
على الرغم من أن معظم التعبير الجيني يتم تنظيمه على مستوى بدء النسخ في بدائيات النواة، إلا أن هناك أيضًا آليات للتحكم في كل من إكمال النسخ والترجمة بشكل متزامن. منذ اكتشافها، ثبت أن هذه الآليات تتحكم في إكمال نسخ وترجمة العديد من العمليات بدائية النواة. نظرًا لأن هذه الآليات تربط تنظيم النسخ والترجمة بشكل مباشر، فهي خاصة ببدائيات النواة، لأن هذه العمليات يتم فصلها ماديًا في حقيقيات النواة.
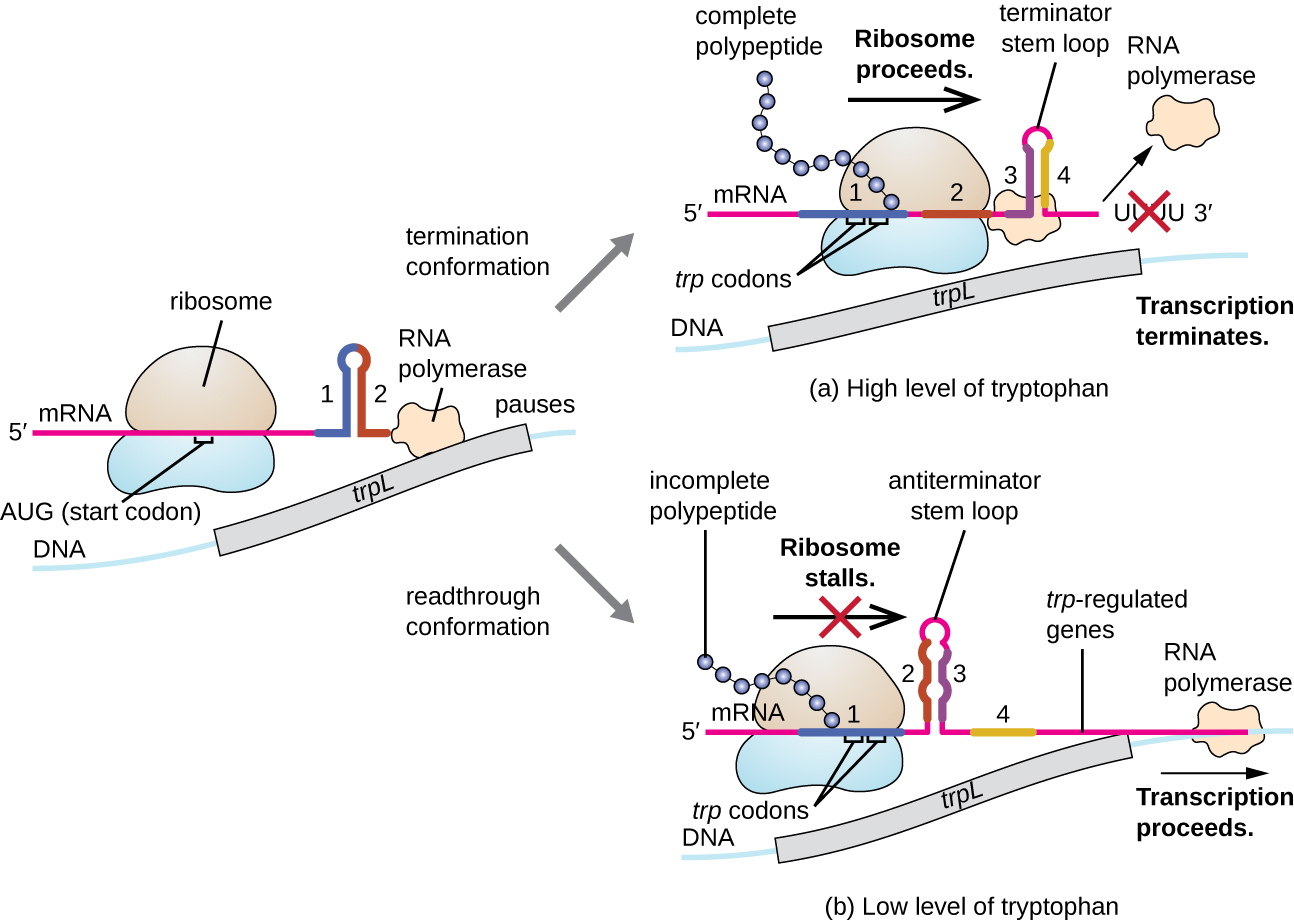
أحد هذه الأنظمة التنظيمية هو التوهين، حيث تحدد الهياكل الثانوية ذات الحلقات الجذعية المتكونة في الطرف الخامس من الحمض النووي الريبي الذي يتم نسخه ما إذا كان النسخ لإكمال تركيب هذا الحمض النووي الريبي سيحدث وما إذا كان سيتم استخدام هذا mRNA للترجمة. بالإضافة إلى آلية القمع النسخي التي تمت مناقشتها بالفعل، يتحكم التوهين أيضًا في التعبير عن الترب أوبرون في E. coli (الشكل\(\PageIndex{7}\)). تحتوي المنطقة التنظيمية لـ trp operon على تسلسل رائد يسمى trpL بين المشغل والجين الهيكلي الأول، والذي يحتوي على أربعة امتدادات من الحمض النووي الريبي التي يمكن أن تتزاوج مع بعضها البعض في مجموعات مختلفة. عندما تتشكل الحلقة الجذعية المنهاة، ينتهي النسخ، مما يؤدي إلى إطلاق بوليميراز الحمض النووي الريبي من mRNA. ومع ذلك، عندما تتشكل حلقة جذعية مضادة للإنهاء، فإن هذا يمنع تكوين الحلقة الجذعية المبيد، لذلك يمكن لبوليميراز الحمض النووي الريبي نسخ الجينات الهيكلية.
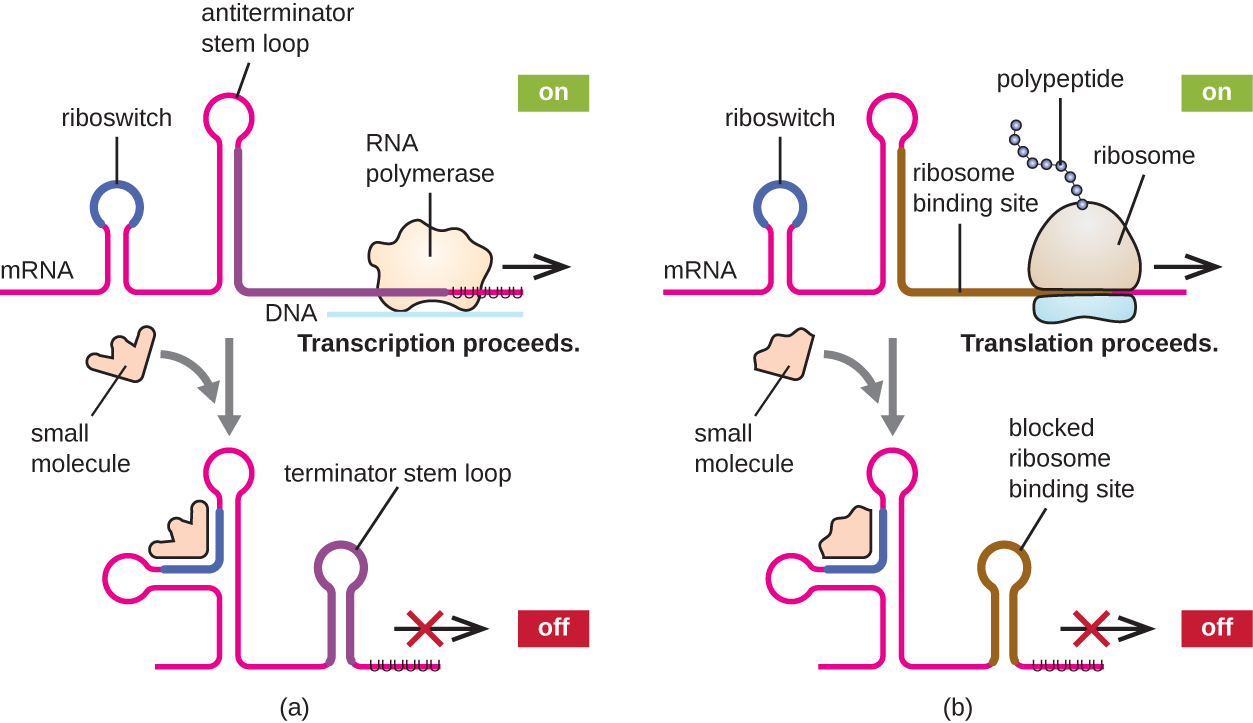
تتمثل إحدى الآليات ذات الصلة بالتنظيم المتزامن للنسخ والترجمة في بدائيات النواة في استخدام الريبوسويتش، وهي منطقة صغيرة من الحمض النووي الريبي غير المشفر الموجودة في الطرف الخامس من بعض جزيئات mRNA بدائية النواة (الشكل\(\PageIndex{8}\)). قد يرتبط مفتاح الريبوسويتش بجزيء صغير داخل الخلايا لتثبيت بعض الهياكل الثانوية لجزيء mRNA. يحدد ارتباط الجزيء الصغير تكوين بنية الحلقة الجذعية، مما يؤثر على إكمال تخليق mRNA وتخليق البروتين.
عوامل أخرى تؤثر على التعبير الجيني في بدائيات النواة وحقائق النوى
على الرغم من أن التركيز على مناقشتنا للتحكم في النسخ استخدم معاملات بدائية النواة كأمثلة، إلا أن التحكم في النسخ حقيقي النواة مشابه في العديد من الطرق. كما هو الحال في بدائيات النواة، يمكن التحكم في النسخ حقيقي النواة من خلال ربط عوامل النسخ بما في ذلك الكابتات والمنشطات. ومن المثير للاهتمام أن النسخ حقيقي النواة يمكن أن يتأثر بربط البروتينات بمناطق الحمض النووي، والتي تسمى المعززات، بعيدًا جدًا عن الجين، من خلال حلقات الحمض النووي التي يتم تسهيلها بين المحسن والمروج (الشكل\(\PageIndex{9}\)). بشكل عام، يعد تنظيم النسخ طريقة فعالة للغاية للتحكم في التعبير الجيني في كل من بدائيات النواة وحقيقيات النوى. ومع ذلك، يمكن تحقيق التحكم في التعبير الجيني في حقيقيات النوى استجابة للضغوط البيئية والخلوية بطرق إضافية دون ربط عوامل النسخ بالمناطق التنظيمية.
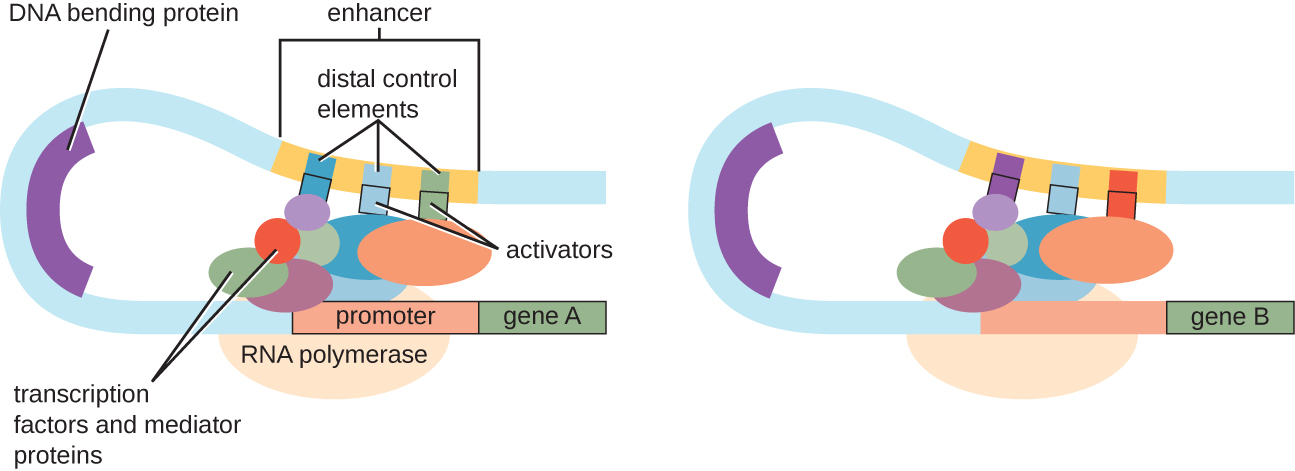
التحكم في مستوى الحمض النووي
في حقيقيات النوى، يمكن تعديل جزيئات الحمض النووي أو الهستونات المرتبطة بها كيميائيًا بطريقة تؤثر على النسخ؛ وهذا ما يسمى التنظيم اللاجيني. وقد ثبت أن ميثيل بعض نيوكليوتيدات السيتوزين في الحمض النووي استجابة للعوامل البيئية يؤثر على استخدام هذا الحمض النووي للنسخ، مع ارتباط ميثيل الحمض النووي عادة بمستويات منخفضة من التعبير الجيني. بالإضافة إلى ذلك، استجابةً للعوامل البيئية، يمكن أيضًا تعديل بروتينات الهستون لتعبئة الحمض النووي كيميائيًا بطرق متعددة، بما في ذلك الأسيتيل وإزالة الأسيتيل، مما يؤثر على حالة تغليف الحمض النووي وبالتالي يؤثر على توافر الحمض النووي ذي الجرح الفضفاض للنسخ. يمكن أحيانًا الحفاظ على هذه التعديلات الكيميائية من خلال جولات متعددة من الانقسام الخلوي، مما يجعل بعض هذه التغييرات اللاجينية على الأقل قابلة للتوريث.
يصف هذا الفيديو كيف يتحكم التنظيم اللاجيني في التعبير الجيني.
التمارين\(\PageIndex{}\)
- ما الذي يوقف النسخ أو يسمح له بالمضي قدمًا عند تشغيل التوهين؟
- ما الذي يحدد حالة الريبوسويتش؟
- وصف وظيفة المُحسِّن.
- وصف آليتين للتنظيم اللاجيني في حقيقيات النوى.
التركيز السريري: القرار
على الرغم من أن مارك نجا من نوبة التهاب اللفافة الناخر، إلا أنه سيتعين عليه الآن الخضوع لجراحة ترقيع الجلد، يليها علاج طبيعي طويل الأمد. بناءً على كمية الكتلة العضلية التي فقدها، من غير المرجح أن تعود ساقه إلى قوتها الكاملة، لكن معالجه الطبيعي متفائل بأنه سيستعيد بعض استخدام ساقه.
كشفت الاختبارات المعملية أن العامل المسبب لعدوى مارك هو سلالة من المكورات العقدية من المجموعة أ (بكتيريا المجموعة أ). وفقًا لما يقتضيه القانون، تم الإبلاغ عن حالة مارك إلى وزارة الصحة بالولاية وفي النهاية إلى مراكز السيطرة على الأمراض والوقاية منها (CDC). في مركز مكافحة الأمراض والوقاية منها، تم تحليل سلالة بكتيريا المجموعة A المعزولة من مارك بشكل أكثر شمولاً لمقاومة الميثيسيلين.
يتم ترميز مقاومة الميثيسيلين وراثيًا وأصبحت أكثر شيوعًا في بكتيريا المجموعة A من خلال النقل الأفقي للجينات. في حالة التهاب اللفافة الناخر، عادةً ما يكون تدفق الدم إلى المنطقة المصابة محدودًا بسبب تأثير العديد من السموم البكتيرية المشفرة وراثيًا. هذا هو السبب في أن النزيف عادة ما يكون ضئيلًا أو معدومًا نتيجة اختبار الشق. لسوء الحظ، تحد هذه السموم البكتيرية من فعالية المضادات الحيوية الوريدية في إزالة العدوى من الجلد والأنسجة الكامنة، مما يعني أن مقاومة المضادات الحيوية وحدها لا تفسر عدم فعالية علاج مارك. ومع ذلك، كان هناك ما يبرر العلاج بالمضادات الحيوية الوريدية للمساعدة في تقليل النتيجة المحتملة للإنتان، وهي نتيجة شائعة لالتهاب اللفافة الناخر. من خلال التحليل الجيني الذي أجراه مركز السيطرة على الأمراض للسلالة المعزولة من مارك، تبين أن العديد من جينات الضراوة المهمة مشفرة على نبوءات، مما يشير إلى أن النقل مهم في النقل الجيني الأفقي لهذه الجينات من خلية بكتيرية إلى أخرى.
المفاهيم الأساسية والملخص
- التعبير الجيني هو عملية منظمة بإحكام.
- يتم تنظيم التعبير الجيني في بدائيات النواة إلى حد كبير عند نقطة النسخ. بالإضافة إلى ذلك، يتم تنظيم التعبير الجيني في حقيقيات النوى بعد النسخ.
- غالبًا ما يتم تنظيم الجينات الهيكلية بدائية النواة للوظيفة ذات الصلة في عمليات، ويتم التحكم فيها جميعًا عن طريق النسخ من مروج واحد. تشمل المنطقة التنظيمية للشخص المروج نفسه والمنطقة المحيطة بالمروج التي يمكن أن ترتبط بها عوامل النسخ للتأثير على النسخ.
- على الرغم من التعبير عن بعض العمليات بشكل دستوري، إلا أن معظمها يخضع للتنظيم من خلال استخدام عوامل النسخ (الضاغطات والمنشطات). يرتبط القامع بالمشغل، بتسلسل الحمض النووي داخل المنطقة التنظيمية بين موقع ربط بوليميراز الحمض النووي الريبي في المروج والجين الهيكلي الأول، وبالتالي يمنع فعليًا نسخ هذه العوامل. يرتبط المنشط داخل المنطقة التنظيمية للأوبيرون، مما يساعد بوليميراز الحمض النووي الريبي على الارتباط بالمروج، وبالتالي تعزيز نسخ هذا المعامل. يؤثر المحفز على النسخ من خلال التفاعل مع الكابح أو المنشط.
- يعتبر عامل الرحلة مثالًا كلاسيكيًا لشخص يمكن كبته. عندما يتراكم التربتوفان، يرتبط التربتوفان بالكامع، الذي يرتبط بعد ذلك بالمشغل، مما يمنع المزيد من النسخ.
- يعتبر عامل الدانتيل مثالًا كلاسيكيًا وشخصًا مستحثًا. عندما يكون اللاكتوز موجودًا في الخلية، يتم تحويله إلى ألولاكتوز. يعمل Allolactose كمحفز وملزم للمكمع ويمنع القامع من الارتباط بالمشغل. هذا يسمح بنسخ الجينات الهيكلية.
- يخضع Operon lac أيضًا للتنشيط. عندما يتم استنفاد مستويات الجلوكوز، يتم تحويل بعض ATP الخلوي إلى CamP، الذي يرتبط ببروتين منشط الكاتابوليت (CAP). يقوم مجمع Camp-cap بتنشيط نسخ عملية النسخ الخاصة بـ Lac Operon. عندما تكون مستويات الجلوكوز مرتفعة، فإن وجودها يمنع نسخ اللاك أوبرون وغيره من العمليات عن طريق قمع الهدم.
- تُصنع جزيئات صغيرة داخل الخلايا تسمى الأرمونات استجابة للضغوط البيئية المختلفة، مما يسمح للبكتيريا بالتحكم في نسخ مجموعة من الأوبرونات، تسمى الريغولون.
- تمتلك البكتيريا القدرة على تغيير عامل من بوليميراز الحمض النووي الريبي الذي تستخدمه استجابةً للظروف البيئية لتغيير اللوائح التي يتم نسخها بسرعة وعلى مستوى العالم.
- تمتلك بدائيات النواة آليات تنظيمية، بما في ذلك التوهين واستخدام مفاتيح الريبو، للتحكم في وقت واحد في إكمال النسخ والترجمة من هذا النص. تعمل هذه الآليات من خلال تكوين الحلقات الجذعية في الطرف الخامس من جزيء mRNA الذي يتم تصنيعه حاليًا.
- هناك نقاط إضافية لتنظيم التعبير الجيني في بدائيات النواة وحقيقيات النوى. في حقيقيات النوى، يعد التنظيم اللاجيني عن طريق التعديل الكيميائي للحمض النووي أو الهستونات، وتنظيم معالجة الحمض النووي الريبي طريقتين.


