8.1: الطاقة والمادة والإنزيمات
- Page ID
- 194760
أهداف التعلم
- تعريف ووصف عملية التمثيل الغذائي
- مقارنة ومقارنة الأوتوتروفات والأشكال غير المتجانسة
- وصف أهمية تفاعلات تقليل الأكسدة في عملية التمثيل الغذائي
- وصف سبب أهمية ATP و FAD و NAD+ و NADP + في الخلية
- تحديد البنية والمكونات الهيكلية للإنزيم
- وصف الاختلافات بين مثبطات الإنزيم التنافسية وغير التنافسية
التركيز السريري: الجزء الأول
هانا فتاة تبلغ من العمر 15 شهرًا من ولاية واشنطن. تقضي الصيف في غامبيا، حيث يعمل والداها في منظمة غير حكومية. بعد حوالي 3 أسابيع من وصولها إلى غامبيا، بدأت شهية هانا تتضاءل ولاحظ والداها أنها تبدو بطيئة ومرهقة ومرتبكة بشكل غير عادي. كما بدت سريعة الانفعال عندما كانت في الهواء الطلق، خاصة خلال النهار. عندما بدأت تتقيأ، اكتشف والداها أنها أصيبت بفيروس على مدار 24 ساعة، ولكن عندما استمرت الأعراض، أخذوها إلى العيادة. لاحظ الطبيب المحلي أن ردود أفعال هانا بدت بطيئة بشكل غير طبيعي، وعندما فحص عينيها بالضوء، بدت حساسة للضوء بشكل غير عادي. يبدو أيضًا أنها تعاني من تصلب في الرقبة.
التمارين\(\PageIndex{1}\)
ما هي بعض الأسباب المحتملة لأعراض هانا؟
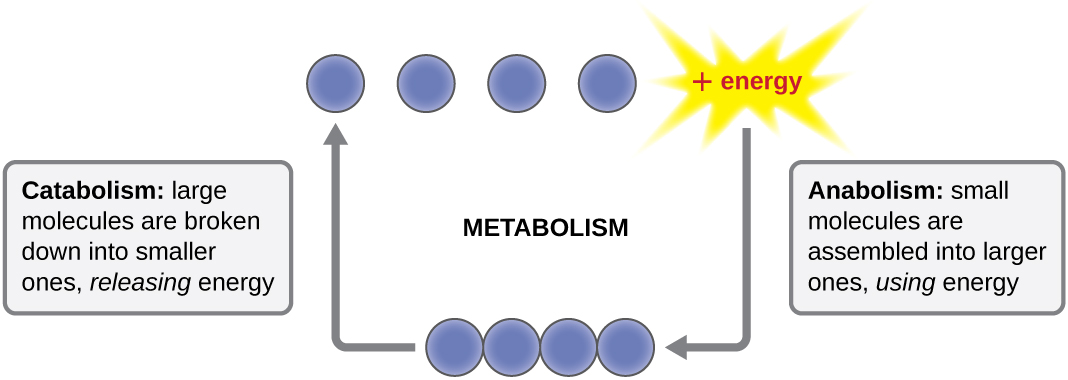
المصطلح المستخدم لوصف جميع التفاعلات الكيميائية داخل الخلية هو التمثيل الغذائي (الشكل\(\PageIndex{1}\)). تحدث العمليات الخلوية مثل بناء أو تكسير الجزيئات المعقدة من خلال سلسلة من التفاعلات الكيميائية المتدرجة والمترابطة التي تسمى مسارات التمثيل الغذائي. التفاعلات التلقائية التي تطلق الطاقة هي تفاعلات إجهادية، بينما تتطلب التفاعلات الإندرونية طاقة للمضي قدمًا. يشير مصطلح الأيض إلى مسارات التمثيل الغذائي الإندرونية التي تشارك في التخليق الحيوي، وتحويل كتل البناء الجزيئية البسيطة إلى جزيئات أكثر تعقيدًا، ويغذيها استخدام الطاقة الخلوية. على العكس من ذلك، يشير مصطلح الهدم إلى المسارات المجهدة التي تقسم الجزيئات المعقدة إلى جزيئات أبسط. يتم إطلاق الطاقة الجزيئية المخزنة في روابط الجزيئات المعقدة في مسارات تقويضية ويتم حصادها بطريقة يمكن استخدامها لإنتاج جزيئات عالية الطاقة، والتي تستخدم لدفع المسارات الابتنائية. وبالتالي، من حيث الطاقة والجزيئات، تعمل الخلايا باستمرار على موازنة الهدم مع الأيض.
التصنيف حسب الكربون ومصدر الطاقة
يمكن التعرف على الكائنات الحية وفقًا لمصدر الكربون الذي تستخدمه في عملية التمثيل الغذائي بالإضافة إلى مصدر الطاقة الخاص بها. تشير البادئات التلقائية («self») و hetero- («الأخرى») إلى أصول مصادر الكربون التي يمكن أن تستخدمها الكائنات الحية المختلفة. الكائنات الحية التي تحول ثاني أكسيد الكربون غير العضوي (CO 2) إلى مركبات كربون عضوية هي كائنات ذاتية. تعتبر النباتات والبكتيريا الزرقاء أمثلة معروفة على الأوتوتروفات. على العكس من ذلك، تعتمد العناصر غير المتجانسة على مركبات الكربون العضوية الأكثر تعقيدًا كمغذيات؛ يتم توفيرها لهم في البداية عن طريق autotrophs. العديد من الكائنات الحية، التي تتراوح من البشر إلى العديد من بدائيات النواة، بما في ذلك الإشريكية القولونية المدروسة جيدًا، هي كائنات غير متجانسة.
يمكن أيضًا التعرف على الكائنات الحية من خلال مصدر الطاقة الذي تستخدمه. يتم اشتقاق جميع الطاقة من نقل الإلكترونات، ولكن مصدر الإلكترونات يختلف بين أنواع مختلفة من الكائنات الحية. تشير البادئات الضوئية («الضوء») والعلاج الكيميائي («الكيميائي») إلى مصادر الطاقة التي تستخدمها الكائنات الحية المختلفة. تلك التي تحصل على طاقتها لنقل الإلكترون من الضوء هي فوتوتروفات، بينما تحصل المواد الكيميائية على الطاقة لنقل الإلكترون عن طريق كسر الروابط الكيميائية. هناك نوعان من المواد الكيميائية: النقوش العضوية والنقوش الحجرية. الكائنات العضوية، بما في ذلك البشر والفطريات والعديد من بدائيات النواة، هي مواد كيميائية تحصل على الطاقة من المركبات العضوية. Lithotrophs («litho» تعني «الصخور») هي مواد كيميائية تحصل على الطاقة من المركبات غير العضوية، بما في ذلك كبريتيد الهيدروجين (H 2 S) والحديد المخفض. تعتبر عملية التغذية الحجرية فريدة من نوعها في العالم الميكروبي.
يمكن الجمع بين الاستراتيجيات المستخدمة للحصول على كل من الكربون والطاقة لتصنيف الكائنات الحية وفقًا للنوع الغذائي. معظم الكائنات الحية هي كائنات كيميائية متغايرة لأنها تستخدم الجزيئات العضوية كمصادر للإلكترون والكربون. \(\PageIndex{1}\)يلخص الجدول هذا والتصنيفات الأخرى.
| التصنيفات | مصدر طاقة | مصدر الكربون | أمثلة | |
|---|---|---|---|---|
| الكيمياء الكيميائية | التوتوتروف الكيميائي | مادة كيميائية | غير عضوي | البكتيريا المؤكسدة للهيدروجين والكبريت والحديد والنيتروجين وأول أكسيد الكربون |
| هيتيروتروفس الكيميائية | مادة كيميائية | مركبات عضوية | جميع الحيوانات ومعظم الفطريات والبروتوزوا والبكتيريا | |
| فوتوتروفس | أوتوتوتروفس | ضوء | غير عضوي | جميع النباتات والطحالب والبكتيريا الزرقاء وبكتيريا الكبريت الخضراء والأرجوانية |
| الصور المتغايرة | ضوء | مركبات عضوية | البكتيريا الخضراء والأرجوانية غير الكبريتية والبكتيريا الشمسية | |
التمارين\(\PageIndex{2}\)
- اشرح الفرق بين الهدم والتمثيل الغذائي.
- اشرح الفرق بين autotrophs و hetrotrophs.
الأكسدة والاختزال في الأيض
يعد نقل الإلكترونات بين الجزيئات أمرًا مهمًا لأن معظم الطاقة المخزنة في الذرات والمستخدمة لتغذية وظائف الخلايا تكون في شكل إلكترونات عالية الطاقة. يسمح نقل الطاقة في شكل إلكترونات للخلية بنقل الطاقة واستخدامها بشكل تدريجي؛ أي في حزم صغيرة بدلاً من انفجار مدمر واحد. التفاعلات التي تزيل الإلكترونات من الجزيئات المانحة، وتتركها مؤكسدة، هي تفاعلات أكسدة؛ تلك التي تضيف الإلكترونات إلى الجزيئات المستقبلة، وتتركها منخفضة، هي تفاعلات اختزال. نظرًا لأن الإلكترونات يمكن أن تنتقل من جزيء إلى آخر، تحدث الأكسدة والاختزال جنبًا إلى جنب. تسمى هذه الأزواج من التفاعلات تفاعلات تقليل الأكسدة، أو تفاعلات الأكسدة والاختزال.
حاملات الطاقة: NAD + و NADP + و FAD و ATP
يمكن تخزين الطاقة المنبعثة من انهيار الروابط الكيميائية داخل العناصر الغذائية إما من خلال تقليل ناقلات الإلكترون أو في روابط الأدينوزين ثلاثي الفوسفات (ATP). في الأنظمة الحية، تعمل فئة صغيرة من المركبات كناقلات إلكترونية متنقلة، وهي جزيئات ترتبط بالإلكترونات عالية الطاقة وتنقلها بين المركبات في المسارات. حاملات الإلكترون الرئيسية التي سننظر فيها تنشأ من مجموعة فيتامين ب وهي مشتقات النيوكليوتيدات؛ وهي نيكوتيناميد أدينين ثنائي النوكليوتيد والنيكوتين والأدينين ثنائي النوكليوتيد وفوسفات فلافين أدينين ثنائي النوكليوتيد. يمكن تقليل هذه المركبات أو تأكدها بسهولة. نيكوتيناميد الأدينين ثنائي النوكليوتيد (NAD + /NADH) هو الناقل الإلكتروني المحمول الأكثر شيوعًا المستخدم في الهدم. NAD+ هو الشكل المؤكسد للجزيء؛ NADH هو الشكل المخفض للجزيء. فوسفات النيكوتين الأدينين ثنائي النوكليوتيد (NADP +)، وهو الشكل المؤكسد لمتغير NAD + الذي يحتوي على مجموعة فوسفات إضافية، هو ناقل إلكتروني مهم آخر؛ يشكل NADPH عند اختزاله. الشكل المؤكسد من فلافين أدينين ثنائي النوكليوتيد هو FAD، وشكله المخفض هو FADH 2. يتم استخدام كل من NAD + /NADH و FAD/FADH 2 على نطاق واسع في استخراج الطاقة من السكريات أثناء الهدم في المواد الكيميائية المتغايرة، بينما يلعب NADP + /NADPH دورًا مهمًا في التفاعلات الابتنائية والتمثيل الضوئي. بشكل جماعي، غالبًا ما يشار إلى FADH 2 و NADH و NADPH على أنها ذات طاقة مخفضة نظرًا لقدرتها على التبرع بالإلكترونات لتفاعلات كيميائية مختلفة.
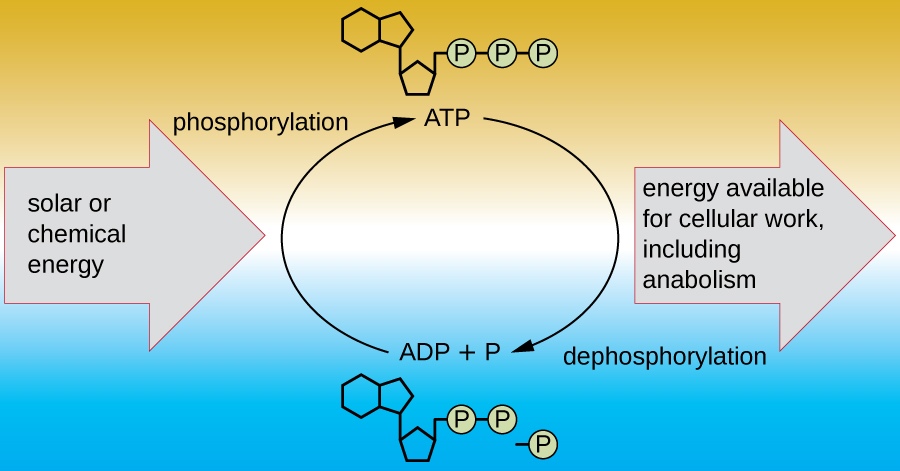
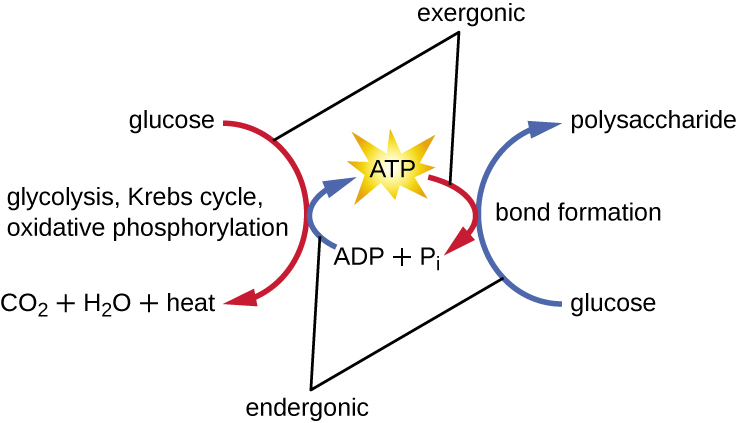
يجب أن تكون الخلية الحية قادرة على التعامل مع الطاقة المنبعثة أثناء الهدم بطريقة تمكن الخلية من تخزين الطاقة بأمان وإطلاقها للاستخدام فقط عند الحاجة. تحقق الخلايا الحية ذلك باستخدام مركب الأدينوزين ثلاثي الفوسفات (ATP). غالبًا ما يُطلق على ATP اسم «عملة الطاقة» للخلية، ومثل العملة، يمكن استخدام هذا المركب متعدد الاستخدامات لملء أي حاجة للطاقة للخلية. في قلب ATP يوجد جزيء من أحادي فوسفات الأدينوزين (AMP)، والذي يتكون من جزيء أدينين مرتبط بجزيء ريبوز ومجموعة فوسفات واحدة. الريبوز هو سكر خماسي الكربون موجود في الحمض النووي الريبي، و AMP هو أحد النيوكليوتيدات في الحمض النووي الريبي. تؤدي إضافة مجموعة الفوسفات الثانية إلى هذا الجزيء الأساسي إلى تكوين ثنائي فوسفات الأدينوزين (ADP)؛ تشكل إضافة مجموعة الفوسفات الثالثة ATP (الشكل\(\PageIndex{2}\)). تتطلب إضافة مجموعة الفوسفات إلى الجزيء، وهي عملية تسمى الفسفرة، طاقة. يتم شحن مجموعات الفوسفات بشكل سلبي وبالتالي صد بعضها البعض عندما يتم ترتيبها في سلسلة، كما هي في ADP و ATP. هذا التنافر يجعل جزيئات ADP و ATP غير مستقرة بطبيعتها. وبالتالي، فإن الروابط بين مجموعات الفوسفات (واحدة في ADP واثنتان في ATP) تسمى روابط الفوسفات عالية الطاقة. عندما يتم كسر هذه الروابط عالية الطاقة لإطلاق فوسفات واحد (يسمى الفوسفات غير العضوي [P i]) أو مجموعتين متصلتين من الفوسفات (تسمى البيروفوسفات [PP i]) من ATP من خلال عملية تسمى إزالة الفسفرة، يتم إطلاق الطاقة لدفع التفاعلات الإندرونية (الشكل\(\PageIndex{3}\)).
التمارين\(\PageIndex{3}\)
ما وظيفة حامل الإلكترون؟
هيكل الإنزيم ووظيفته
المادة التي تساعد على تسريع التفاعل الكيميائي هي محفز. لا يتم استخدام المحفزات أو تغييرها أثناء التفاعلات الكيميائية، وبالتالي فهي قابلة لإعادة الاستخدام. في حين أن الجزيئات غير العضوية قد تعمل كمحفزات لمجموعة واسعة من التفاعلات الكيميائية، فإن البروتينات التي تسمى الإنزيمات تعمل كمحفزات للتفاعلات البيوكيميائية داخل الخلايا. وهكذا تلعب الإنزيمات دورًا مهمًا في التحكم في التمثيل الغذائي الخلوي.
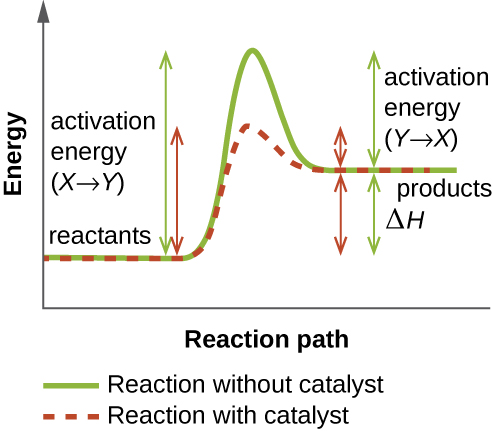
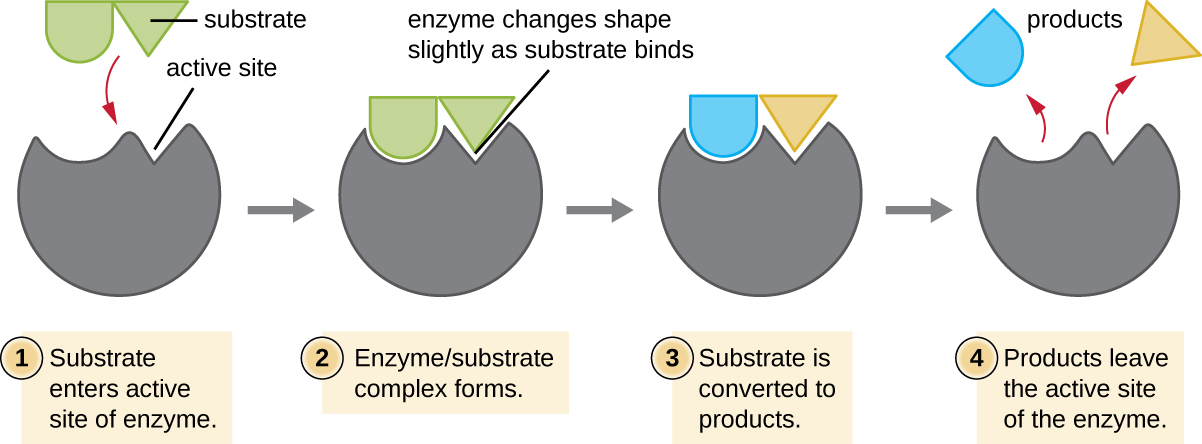
يعمل الإنزيم عن طريق خفض طاقة التنشيط للتفاعل الكيميائي داخل الخلية. طاقة التنشيط هي الطاقة اللازمة لتكوين الروابط الكيميائية أو كسرها وتحويل المواد المتفاعلة إلى منتجات (الشكل\(\PageIndex{4}\)). تعمل الإنزيمات على خفض طاقة التنشيط عن طريق الارتباط بالجزيئات المتفاعلة والاحتفاظ بها بطريقة تسرع التفاعل.
تسمى المفاعلات الكيميائية التي يرتبط بها الإنزيم بالركائز، والموقع داخل الإنزيم الذي ترتبط فيه الركيزة يسمى الموقع النشط للإنزيم. تخلق خصائص الأحماض الأمينية بالقرب من الموقع النشط بيئة كيميائية محددة جدًا داخل الموقع النشط تحفز الملاءمة للربط، ولو لفترة وجيزة، بركيزة معينة (أو ركائز). بسبب هذا التطابق الشبيه بأحجية الصور المقطوعة بين الإنزيم وركائزه، فإن الإنزيمات معروفة بخصوصيتها. في الواقع، عندما يرتبط الإنزيم بالركيزة (الركائز)، يتغير هيكل الإنزيم قليلاً للعثور على أفضل ملاءمة بين الحالة الانتقالية (الوسيط الهيكلي بين الركيزة والمنتج) والموقع النشط، تمامًا كما يتشكل القفاز المطاطي بيد يتم إدخاله فيه. يُطلق على هذا التعديل في الموقع النشط في وجود الركيزة، إلى جانب التكوين المتزامن للحالة الانتقالية، اسم الملاءمة المستحثة (الشكل\(\PageIndex{5}\)). بشكل عام، يوجد إنزيم متطابق بشكل خاص لكل ركيزة، وبالتالي لكل تفاعل كيميائي؛ ومع ذلك، هناك بعض المرونة أيضًا. بعض الإنزيمات لديها القدرة على العمل على العديد من الركائز المختلفة ذات الصلة بنيوياً.
تخضع الإنزيمات لتأثيرات الظروف البيئية المحلية مثل درجة الحموضة وتركيز الركيزة ودرجة الحرارة. على الرغم من أن زيادة درجة الحرارة البيئية تؤدي عمومًا إلى زيادة معدلات التفاعل أو تحفيز الإنزيم أو غير ذلك، فإن زيادة أو خفض درجة الحرارة خارج النطاق الأمثل يمكن أن يؤثر على الروابط الكيميائية داخل الموقع النشط، مما يجعلها أقل ملاءمة لربط الركائز. ستؤدي درجات الحرارة المرتفعة في النهاية إلى تغيير طبيعة الإنزيمات، مثل الجزيئات البيولوجية الأخرى، وفقدان هيكلها ثلاثي الأبعاد ووظيفتها. كما أن الإنزيمات مناسبة أيضًا لتعمل بشكل أفضل ضمن نطاق معين من الأس الهيدروجيني، وكما هو الحال مع درجة الحرارة، يمكن أن تتسبب قيم الأس الهيدروجيني البيئية المتطرفة (الحمضية أو الأساسية) في تغيير طبيعة الإنزيمات. تتميز السلاسل الجانبية للأحماض الأمينية في الموقع النشط بخصائصها الحمضية أو الأساسية التي تعتبر مثالية للحفز، وبالتالي فهي حساسة للتغيرات في درجة الحموضة.
هناك عامل آخر يؤثر على نشاط الإنزيم وهو تركيز الركيزة: يزداد نشاط الإنزيم بتركيزات أعلى من الركيزة حتى يصل إلى نقطة تشبع لا يستطيع الإنزيم عندها ربط أي ركيزة إضافية. بشكل عام، يتم تحسين الإنزيمات لتعمل بشكل أفضل في ظل الظروف البيئية التي تعيش فيها الكائنات الحية التي تنتجها. على سبيل المثال، في حين تحتوي الميكروبات التي تعيش في الينابيع الساخنة على إنزيمات تعمل بشكل أفضل في درجات الحرارة المرتفعة، فإن مسببات الأمراض البشرية لديها إنزيمات تعمل بشكل أفضل عند 37 درجة مئوية. وبالمثل، في حين أن الإنزيمات التي تنتجها معظم الكائنات الحية تعمل بشكل أفضل عند درجة حموضة محايدة، فإن الميكروبات التي تنمو في البيئات الحمضية تجعل الإنزيمات تعمل بشكل أفضل حتى تنخفض درجة الحموضة. الظروف، مما يسمح بنموها في تلك الظروف.
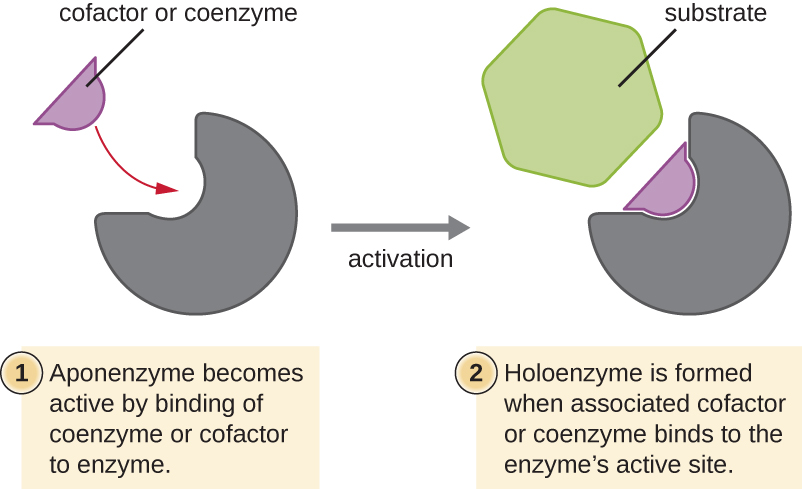
لا تعمل العديد من الإنزيمات على النحو الأمثل، أو حتى على الإطلاق، ما لم ترتبط بجزيئات مساعدة غير بروتينية محددة أخرى، إما مؤقتًا من خلال الروابط الأيونية أو الهيدروجينية أو بشكل دائم من خلال روابط تساهمية أقوى. يعزز الارتباط بهذه الجزيئات التوافق الأمثل ووظيفة الإنزيمات الخاصة بها. هناك نوعان من الجزيئات المساعدة هما العوامل المساعدة والإنزيمات المساعدة. العوامل المساعدة هي أيونات غير عضوية مثل الحديد (Fe 2+) والمغنيسيوم (Mg 2+) التي تساعد على استقرار تكوين الإنزيم ووظيفته. أحد الأمثلة على الإنزيم الذي يتطلب أيون معدني كعامل مساعد هو الإنزيم الذي يبني جزيئات الحمض النووي، وهو بوليميراز الحمض النووي، الذي يتطلب أيون الزنك المرتبط (Zn 2+) ليعمل.
الإنزيمات المساعدة هي جزيئات عضوية مساعدة مطلوبة لعمل الإنزيم. مثل الإنزيمات، لا يتم استهلاكها، وبالتالي فهي قابلة لإعادة الاستخدام. المصادر الأكثر شيوعًا للأنزيمات المساعدة هي الفيتامينات الغذائية. بعض الفيتامينات هي سلائف للأنزيمات المساعدة والبعض الآخر يعمل مباشرة كإنزيمات مساعدة.
غالبًا ما ترتبط بعض العوامل المساعدة والإنزيمات المساعدة، مثل الإنزيم المساعد A (CoA)، بالموقع النشط للإنزيم، مما يساعد في كيمياء انتقال الركيزة إلى المنتج (الشكل\(\PageIndex{6}\)). في مثل هذه الحالات، يُطلق على الإنزيم الذي يفتقر إلى العامل المساعد أو الإنزيم المساعد الضروري اسم الإنزيم المساعد ويكون غير نشط. على العكس من ذلك، يُطلق على الإنزيم الذي يحتوي على العامل المساعد أو الإنزيم المساعد الضروري اسم الإنزيم الهولوي وهو نشط. يعد كل من NADH و ATP أيضًا مثالين على الإنزيمات المساعدة شائعة الاستخدام التي توفر إلكترونات عالية الطاقة أو مجموعات الفوسفات، على التوالي، والتي ترتبط بالإنزيمات، وبالتالي تنشيطها.
التمارين\(\PageIndex{4}\)
ما الدور الذي تلعبه الإنزيمات في التفاعل الكيميائي؟
مثبطات الإنزيم
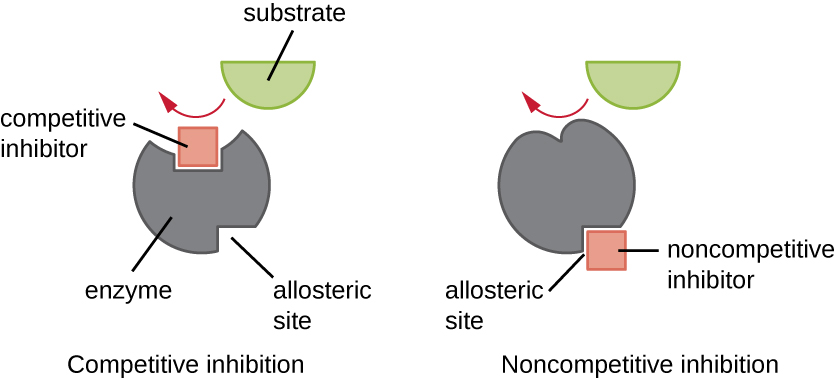
يمكن تنظيم الإنزيمات بطرق تعزز نشاطها أو تقلله. هناك العديد من الأنواع المختلفة من الجزيئات التي تمنع أو تعزز وظيفة الإنزيم، وتوجد آليات مختلفة للقيام بذلك (الشكل\(\PageIndex{7}\)). المثبط التنافسي هو جزيء مشابه بدرجة كافية للركيزة بحيث يمكنه التنافس مع الركيزة للربط بالموقع النشط ببساطة عن طريق منع الركيزة من الارتباط. لكي يكون المثبط التنافسي فعالًا، يجب أن يكون تركيز المثبط مساويًا تقريبًا لتركيز الركيزة. تقدم أدوية السلفا مثالاً جيدًا للمنافسة التنافسية. يتم استخدامها لعلاج الالتهابات البكتيرية لأنها ترتبط بالموقع النشط للإنزيم داخل مسار تخليق حمض الفوليك البكتيري. عند وجوده بجرعة كافية، يمنع دواء السلفا تخليق حمض الفوليك، وتكون البكتيريا غير قادرة على النمو لأنها لا تستطيع تخليق الحمض النووي والحمض النووي الريبي والبروتينات. لا يتأثر البشر لأننا نحصل على حمض الفوليك من وجباتنا الغذائية.
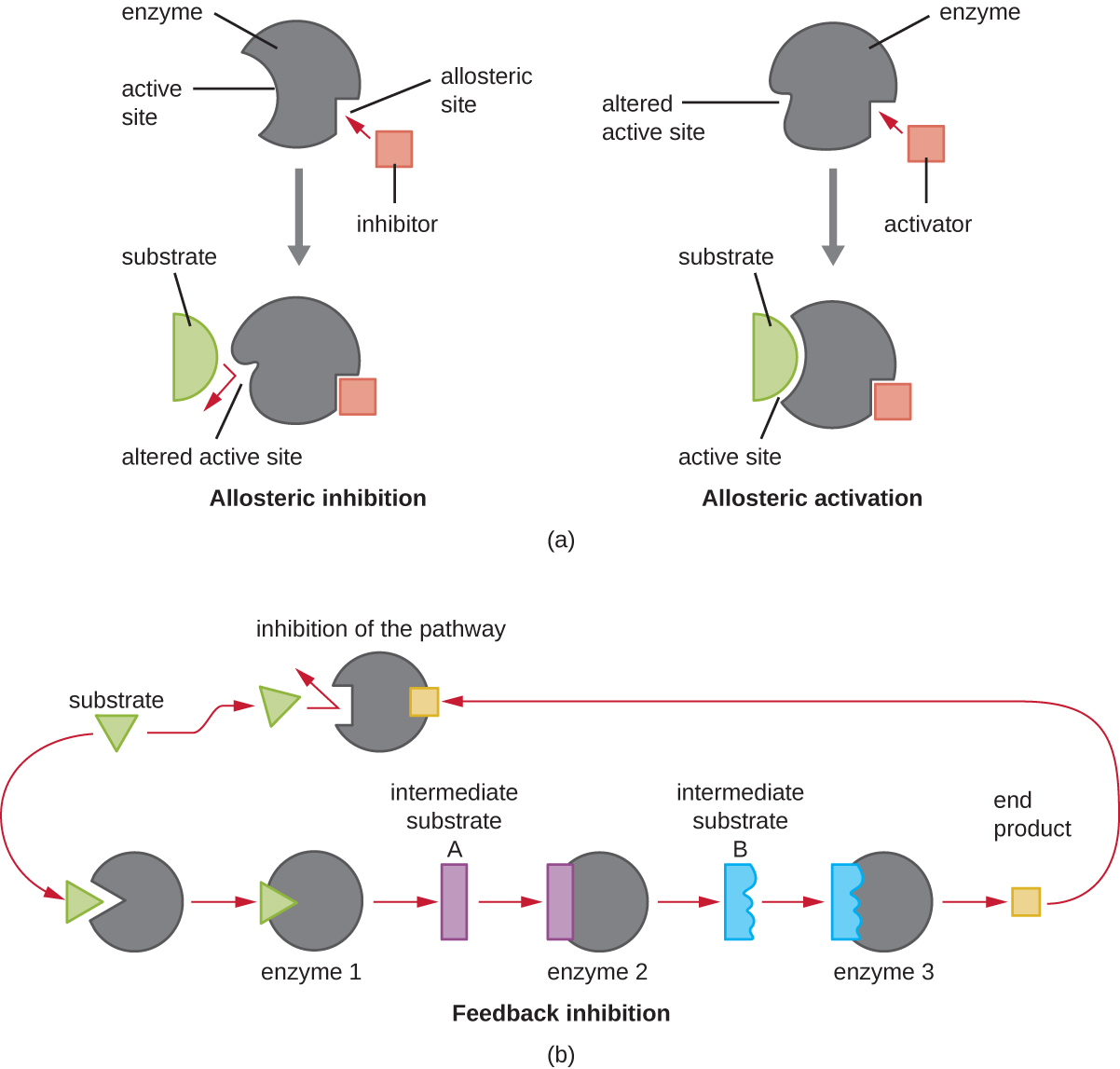
من ناحية أخرى، يرتبط مثبط غير تنافسي (ألوستيريك) بالإنزيم في موقع ألوستيريك، وهو موقع آخر غير الموقع النشط، ولا يزال قادرًا على منع ارتباط الركيزة بالموقع النشط عن طريق إحداث تغيير في التوافق يقلل من تقارب الإنزيم مع الركيزة (الشكل 1) \(\PageIndex{8}\)). نظرًا للحاجة إلى جزيء مثبط واحد فقط لكل إنزيم للتثبيط الفعال، فإن تركيز المثبطات اللازمة للتثبيط غير التنافسي عادة ما يكون أقل بكثير من تركيز الركيزة.
بالإضافة إلى مثبطات الألستيرية، هناك منشطات ألوستيريك ترتبط بمواقع الإنزيم بعيدًا عن الموقع النشط، مما يؤدي إلى تغيير في التوافق يزيد من تقارب الموقع (المواقع) النشطة للإنزيم مع ركازه (ركائزه).
يعتبر التحكم في الألستيرية آلية مهمة لتنظيم مسارات التمثيل الغذائي المشاركة في كل من الهدم والتمثيل الغذائي. بطريقة أكثر كفاءة وأناقة، تطورت الخلايا أيضًا لاستخدام منتجات التفاعلات الأيضية الخاصة بها لتثبيط التغذية الراجعة لنشاط الإنزيم. يتضمن تثبيط التغذية الراجعة استخدام منتج المسار لتنظيم إنتاجه الإضافي. تستجيب الخلية لوفرة منتجات معينة عن طريق إبطاء الإنتاج أثناء التفاعلات الابتنائية أو التقويضية (الشكل\(\PageIndex{8}\)).
التمارين\(\PageIndex{5}\)
اشرح الفرق بين المثبط التنافسي والمثبط غير التنافسي.
المفاهيم الأساسية والملخص
- يشمل التمثيل الغذائي التفاعلات الكيميائية التي تكسر الجزيئات المعقدة (الهدم) وتلك التي تبني جزيئات معقدة (الابتنائية).
- يمكن تصنيف الكائنات الحية وفقًا لمصدر الكربون. يقوم Autotrophs بتحويل ثاني أكسيد الكربون غير العضوي إلى كربون عضوي؛ تستخدم التغايرات مركبات الكربون العضوية الثابتة.
- يمكن أيضًا تصنيف الكائنات الحية وفقًا لمصدر الطاقة الخاص بها. تحصل الفوتوتروفات على طاقتها من الضوء. تحصل المواد الكيميائية على طاقتها من المركبات الكيميائية. تستخدم الأورجانوتروفس الجزيئات العضوية، وتستخدم الأحجار الحجرية مواد كيميائية غير عضوية.
- تقبل حاملات الإلكترون الخلوية الإلكترونات عالية الطاقة من الأطعمة وتعمل لاحقًا كمتبرعين للإلكترون في تفاعلات الأكسدة اللاحقة. FAD/FADH 2 و NAD + /NADH و NADP + /NADPH هي ناقلات إلكترونية مهمة.
- يعمل ثلاثي فوسفات الأدينوزين (ATP) كعملة طاقة للخلية، حيث يخزن الطاقة الكيميائية بأمان في رابطتي الفوسفات عالية الطاقة لاستخدامها لاحقًا لدفع العمليات التي تتطلب الطاقة.
- الإنزيمات هي محفزات بيولوجية تزيد من معدل التفاعلات الكيميائية داخل الخلايا عن طريق خفض طاقة التنشيط المطلوبة لاستمرار التفاعل.
- في الطبيعة، لا تتطلب التفاعلات المجهدة طاقة تتجاوز طاقة التنشيط للمضي قدمًا، كما أنها تطلق الطاقة. قد تستمر بدون إنزيمات، ولكن بمعدل بطيء. على العكس من ذلك، تتطلب التفاعلات الهوائية طاقة تتجاوز طاقة التنشيط حتى تحدث. في الخلايا، تقترن التفاعلات الإندرونية بتفاعلات الإجهاد، مما يجعل التركيبة مواتية للغاية.
- ترتبط الركائز بالموقع النشط للإنزيم. عادةً ما تؤدي هذه العملية إلى تغيير هياكل كل من الموقع النشط والركيزة، وتفضل تكوين الحالة الانتقالية؛ ويُعرف هذا بالتناسب المستحث.
- العوامل المساعدة هي أيونات غير عضوية تعمل على تثبيت تكوين الإنزيم ووظيفته. الإنزيمات المساعدة هي جزيئات عضوية مطلوبة لوظيفة الإنزيم المناسبة وغالبًا ما يتم اشتقاقها من الفيتامينات. الإنزيم الذي يفتقر إلى عامل مساعد أو أنزيم مساعد هو أنزيم مساعد؛ والإنزيم الذي له عامل مساعد مرتبط أو أنزيم مساعد هو إنزيم هولوانزيم.
- تعمل المثبطات التنافسية على تنظيم الإنزيمات عن طريق الارتباط بالموقع النشط للإنزيم، مما يمنع ارتباط الركيزة. ترتبط المثبطات غير التنافسية (الألوستيرية) بالمواقع الألاستيرية، مما يؤدي إلى تغيير توافقي في الإنزيم الذي يمنعه من العمل. يحدث تثبيط التغذية الراجعة عندما يرتبط منتج مسار التمثيل الغذائي بشكل غير تنافسي بالإنزيم في وقت مبكر من المسار، مما يمنع في النهاية تخليق المنتج.


