2.4: تلوين العينات المجهرية
- Page ID
- 195034
أهداف التعلم
- فرّق بين البقع البسيطة والتفضيلية
- وصف الميزات الفريدة للبقع شائعة الاستخدام
- شرح الإجراءات وتسمية التطبيقات السريرية لتلطيخ الجرام والإندوبور والدهون الحمضية والكبسولة السالبة والأسوط
في حالتها الطبيعية، تفتقر معظم الخلايا والكائنات الحية الدقيقة التي نلاحظها تحت المجهر إلى اللون والتباين. هذا يجعل من الصعب، إن لم يكن من المستحيل، اكتشاف الهياكل الخلوية المهمة وخصائصها المميزة دون معالجة العينات بشكل مصطنع. لقد أشرنا بالفعل إلى بعض التقنيات التي تتضمن البقع والأصباغ الفلورية، وفي هذا القسم سنناقش تقنيات محددة لإعداد العينات بمزيد من التفصيل. في الواقع، تم تطوير العديد من الطرق لتحديد ميكروبات معينة، أو هياكل خلوية، أو تسلسل الحمض النووي، أو مؤشرات العدوى في عينات الأنسجة، تحت المجهر. هنا، سنركز على التقنيات الأكثر صلة سريريًا.
إعداد العينات للفحص المجهري الضوئي
في البيئات السريرية، تعد مجاهر الضوء أكثر المجاهر استخدامًا. هناك نوعان أساسيان من التحضير يستخدمان لعرض العينات باستخدام المجهر الضوئي: حوامل رطبة وعينات ثابتة.
أبسط أنواع التحضير هو الحامل الرطب، حيث يتم وضع العينة على الشريحة في قطرة من السائل. بعض العينات، مثل قطرة البول، موجودة بالفعل في صورة سائلة ويمكن إيداعها على الشريحة باستخدام قطارة. يمكن وضع العينات الصلبة، مثل كشط الجلد، على الشريحة قبل إضافة قطرة من السائل لتحضير الحامل الرطب. في بعض الأحيان يكون السائل المستخدم مجرد ماء، ولكن غالبًا ما تتم إضافة البقع لتعزيز التباين. بمجرد إضافة السائل إلى الشريحة، يتم وضع غطاء في الأعلى وتكون العينة جاهزة للفحص تحت المجهر.
الطريقة الثانية لإعداد العينات للفحص المجهري الضوئي هي التثبيت. يشير «إصلاح» العينة إلى عملية ربط الخلايا بشريحة. غالبًا ما يتم التثبيت إما عن طريق التسخين (تثبيت الحرارة) أو المعالجة الكيميائية للعينة. بالإضافة إلى ربط العينة بالشريحة، فإن التثبيت يقتل أيضًا الكائنات الحية الدقيقة في العينة، ويوقف حركتها والتمثيل الغذائي مع الحفاظ على سلامة مكوناتها الخلوية للمراقبة.
لإصلاح العينة بالحرارة، يتم نشر طبقة رقيقة من العينة على الشريحة (تسمى اللطاخة)، ثم يتم تسخين الشريحة لفترة وجيزة فوق مصدر حرارة (الشكل\(\PageIndex{1}\)). غالبًا ما تكون المثبتات الكيميائية أفضل من التسخين لعينات الأنسجة. يمكن للعوامل الكيميائية مثل حمض الأسيتيك والإيثانول والميثانول والفورمالديهايد (الفورمالين) والغلوتارالديهيد تغيير طبيعة البروتينات ووقف التفاعلات البيوكيميائية وتثبيت هياكل الخلايا في عينات الأنسجة (الشكل\(\PageIndex{1}\)).

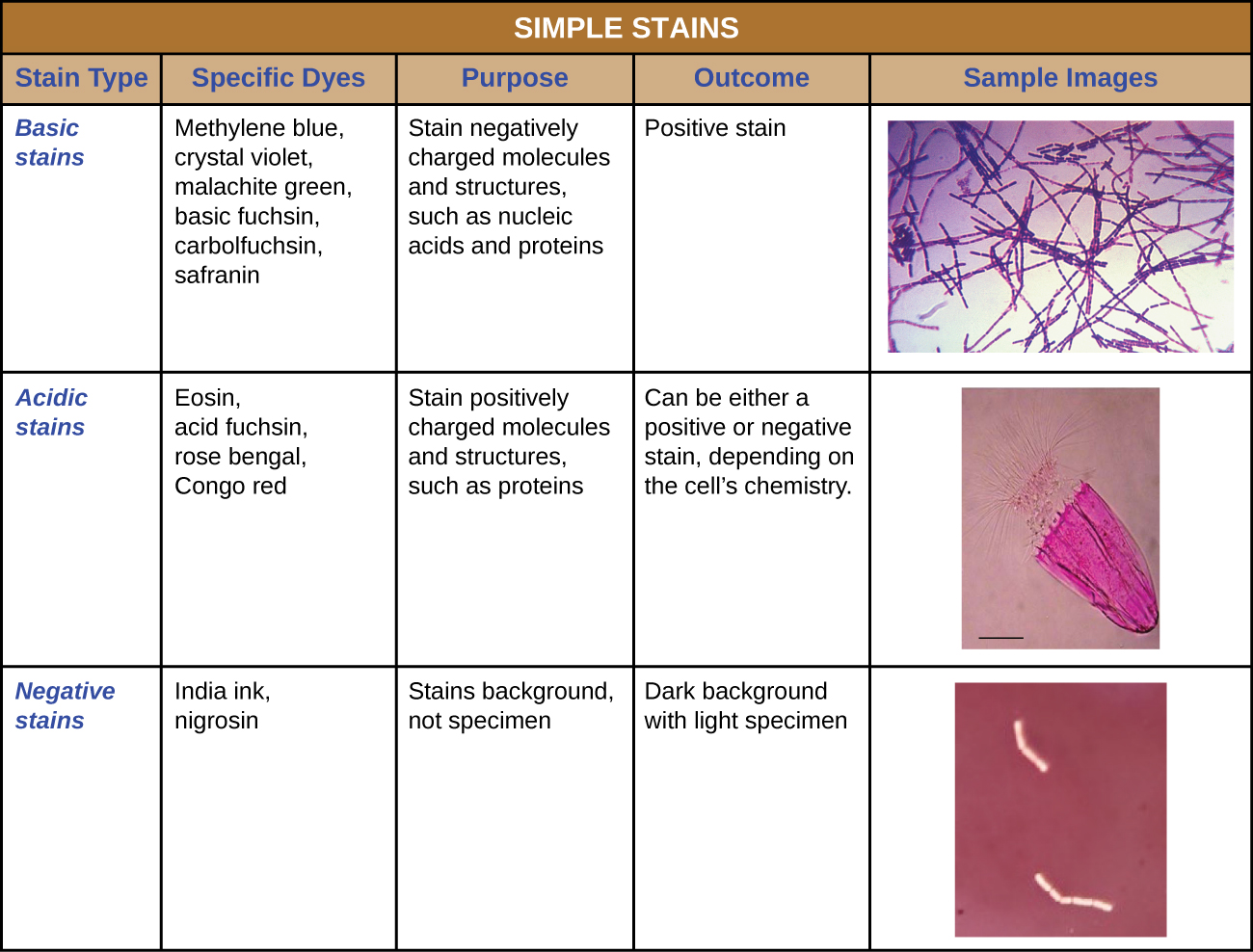
بالإضافة إلى التثبيت، يتم تطبيق التلوين دائمًا تقريبًا لتلوين ميزات معينة للعينة قبل فحصها تحت المجهر الضوئي. تحتوي البقع أو الأصباغ على أملاح تتكون من أيون إيجابي وأيون سالب. اعتمادًا على نوع الصبغة، قد يكون الأيون الموجب أو السالب هو الكروموفور (الأيون الملون)؛ أما الأيون الآخر غير الملون فيسمى الأيون المضاد. إذا كان الكروموفور هو الأيون الموجب الشحنة، يتم تصنيف البقعة كصبغة أساسية؛ وإذا كان الأيون السالب هو الكروموفور، فإن البقعة تعتبر صبغة حمضية.
يتم اختيار الأصباغ للتلطيخ بناءً على الخصائص الكيميائية للصبغة والعينة التي تتم ملاحظتها، والتي تحدد كيفية تفاعل الصبغة مع العينة. في معظم الحالات، يُفضل استخدام بقعة موجبة، وهي صبغة تمتصها الخلايا أو الكائنات الحية التي تتم ملاحظتها، مما يضيف لونًا إلى الأشياء المهمة لجعلها تبرز على الخلفية. ومع ذلك، هناك سيناريوهات يكون من المفيد فيها استخدام بقعة سلبية تمتصها الخلفية ولكن ليس الخلايا أو الكائنات الحية في العينة. ينتج التلوين السلبي مخططًا أو صورة ظلية للكائنات الحية على خلفية ملونة (الشكل\(\PageIndex{2}\)).

نظرًا لأن الخلايا تحتوي عادةً على جدران خلوية سالبة الشحنة، فإن الكروموفوريات الإيجابية في الأصباغ الأساسية تميل إلى الالتصاق بجدران الخلايا، مما يجعلها بقعًا إيجابية. وبالتالي، فإن الأصباغ الأساسية الشائعة الاستخدام مثل الفوشين الأساسي والبنفسجي البلوري والأخضر المالاكيت والأزرق الميثيلين والسفرانين عادة ما تكون بمثابة بقع إيجابية. من ناحية أخرى، يتم صد الكروموفوريات سالبة الشحنة في الأصباغ الحمضية بواسطة جدران الخلايا المشحونة سلبًا، مما يجعلها بقعًا سلبية. تشمل الأصباغ الحمضية الشائعة الاستخدام الفوشين الحمضي واليوزين والبنغال الوردي. \(\PageIndex{10}\)يوفر الشكل مزيدًا من التفاصيل.
تتضمن بعض تقنيات التلوين تطبيق صبغة واحدة فقط على العينة؛ بينما يتطلب البعض الآخر أكثر من صبغة واحدة. في التلوين البسيط، يتم استخدام صبغة واحدة للتأكيد على هياكل معينة في العينة. ستجعل البقعة البسيطة عمومًا جميع الكائنات الحية في العينة تبدو بنفس اللون، حتى لو كانت العينة تحتوي على أكثر من نوع واحد من الكائنات الحية. في المقابل، يميز التلوين التفاضلي الكائنات الحية بناءً على تفاعلاتها مع البقع المتعددة. بمعنى آخر، قد يبدو كائنان في عينة ملونة بشكل مختلف بألوان مختلفة بألوان مختلفة. تشمل تقنيات التلوين التفاضلي المستخدمة بشكل شائع في البيئات السريرية تلوين الجرام والتلوين السريع بالحمض وتلطيخ المسام وتلطيخ السوط وتلطيخ الكبسولة. \(\PageIndex{11}\)يوفر الشكل مزيدًا من التفاصيل حول تقنيات التلوين التفاضلي هذه.
التمارين\(\PageIndex{1}\)
- اشرح سبب أهمية إصلاح العينة قبل مشاهدتها تحت المجهر الضوئي.
- ما أنواع العينات التي يجب تثبيتها كيميائيًا بدلاً من التثبيت الحراري؟
- لماذا قد تتفاعل الصبغة الحمضية بشكل مختلف مع عينة معينة عن الصبغة الأساسية؟
- اشرح الفرق بين البقعة الإيجابية والبقعة السلبية.
- اشرح الفرق بين التلوين البسيط والتفاضلي.
تلوين غرام
عملية تلوين غرام هي إجراء تلطيخ تفاضلي يتضمن خطوات متعددة. تم تطويره من قبل عالم الأحياء الدقيقة الدنماركي هانز كريستيان جرام في عام 1884 كطريقة فعالة للتمييز بين البكتيريا ذات الأنواع المختلفة من جدران الخلايا، وحتى اليوم تظل واحدة من أكثر تقنيات التلوين استخدامًا. يتم سرد خطوات إجراء بقعة Gram أدناه وموضحة في الشكل\(\PageIndex{3}\).
- أولاً، يتم وضع اللون البنفسجي البلوري، وهو بقعة أساسية، على مسحة مثبتة بالحرارة، مما يمنح جميع الخلايا لونًا أرجوانيًا.
- بعد ذلك، يتم إضافة اليود الخاص بالغرام، وهو مادة ضارة. المادة اللزجة هي مادة تستخدم لتثبيت البقع أو الأصباغ أو تثبيتها؛ وفي هذه الحالة، يعمل اليود الموجود في الجرام كعامل محاصرة يتجمع مع البنفسج البلوري، مما يجعل مركب اليود والبنفسجي البلوري يتكتل ويبقى محتجزًا في طبقات سميكة من الببتيدوجليكان في جدران الخلايا.
- بعد ذلك، تتم إضافة عامل إزالة اللون، وعادة ما يكون الإيثانول أو محلول الأسيتون/الإيثانول. تكون الخلايا التي تحتوي على طبقات الببتيدوغليكان السميكة في جدران خلاياها أقل تأثراً بعامل إزالة اللون؛ فهي تحتفظ عمومًا بالصبغة البنفسجية الكريستالية وتبقى أرجوانية. ومع ذلك، فإن عامل إزالة اللون يغسل الصبغة بسهولة أكبر من الخلايا ذات طبقات الببتيدوجليكان الرقيقة، مما يجعلها عديمة اللون مرة أخرى.
- أخيرًا، تتم إضافة صبغة مضادة ثانوية، عادة سافرانين. يؤدي هذا إلى تلطيخ الخلايا غير الملونة باللون الوردي ويكون أقل وضوحًا في الخلايا التي لا تزال تحتوي على الصبغة البنفسجية الكريستالية.
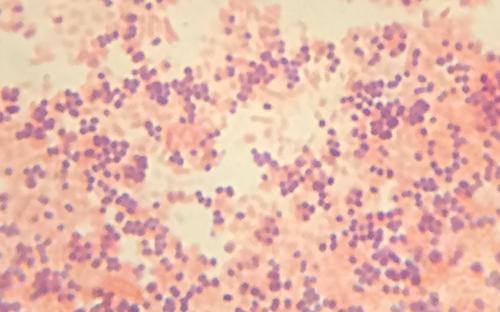
يُشار إلى الخلايا الملونة ذات اللون البنفسجي البلوري بالخلايا الموجبة للجرام، في حين أن الخلايا الحمراء المصبوغة بالسفرانين تكون سالبة الجرام (الشكل\(\PageIndex{4}\)). ومع ذلك، هناك العديد من الاعتبارات المهمة في تفسير نتائج بقعة الجرام. أولاً، قد تتعرض الخلايا البكتيرية القديمة للتلف في جدران خلاياها مما يجعلها تبدو سالبة الجرام حتى لو كانت الأنواع إيجابية الجرام. وبالتالي، من الأفضل استخدام مزارع بكتيرية جديدة لتلطيخ الجرام. ثانيًا، يمكن أن تؤثر الأخطاء مثل ترك أداة إزالة اللون لفترة طويلة جدًا على النتائج. في بعض الحالات، ستظهر معظم الخلايا موجبة الجرام بينما تظهر بعض الخلايا سالبة الجرام (كما في الشكل\(\PageIndex{4}\)). يشير هذا إلى تلف الخلايا الفردية أو ترك مزيل اللون لفترة طويلة جدًا؛ لا يزال يتعين تصنيف الخلايا على أنها موجبة الجرام إذا كانت جميعها من نفس الأنواع وليس ثقافة مختلطة.
إلى جانب تفاعلاتها المختلفة مع الأصباغ وعوامل إزالة اللون، فإن الاختلافات الكيميائية بين الخلايا الإيجابية بالجرام والخلايا السالبة للجرام لها آثار أخرى ذات أهمية سريرية. على سبيل المثال، يمكن أن يساعد تلوين الجرام الأطباء على تصنيف مسببات الأمراض البكتيرية في العينة إلى فئات مرتبطة بخصائص محددة. تميل البكتيريا سالبة الجرام إلى أن تكون أكثر مقاومة لمضادات حيوية معينة من البكتيريا إيجابية الجرام. سنناقش هذا وغيره من تطبيقات تلوين الجرام بمزيد من التفصيل في الفصول اللاحقة.
التمارين\(\PageIndex{2}\)
- اشرح دور اليود الموجود في غرام في إجراء البقع بالغرام.
- اشرح دور الكحول في إجراء بقعة غرام.
- ما لون الخلايا الموجبة بالجرام والخلايا سالبة الجرام، على التوالي، بعد إجراء بقعة الجرام؟
التركيز السريري: الجزء 3
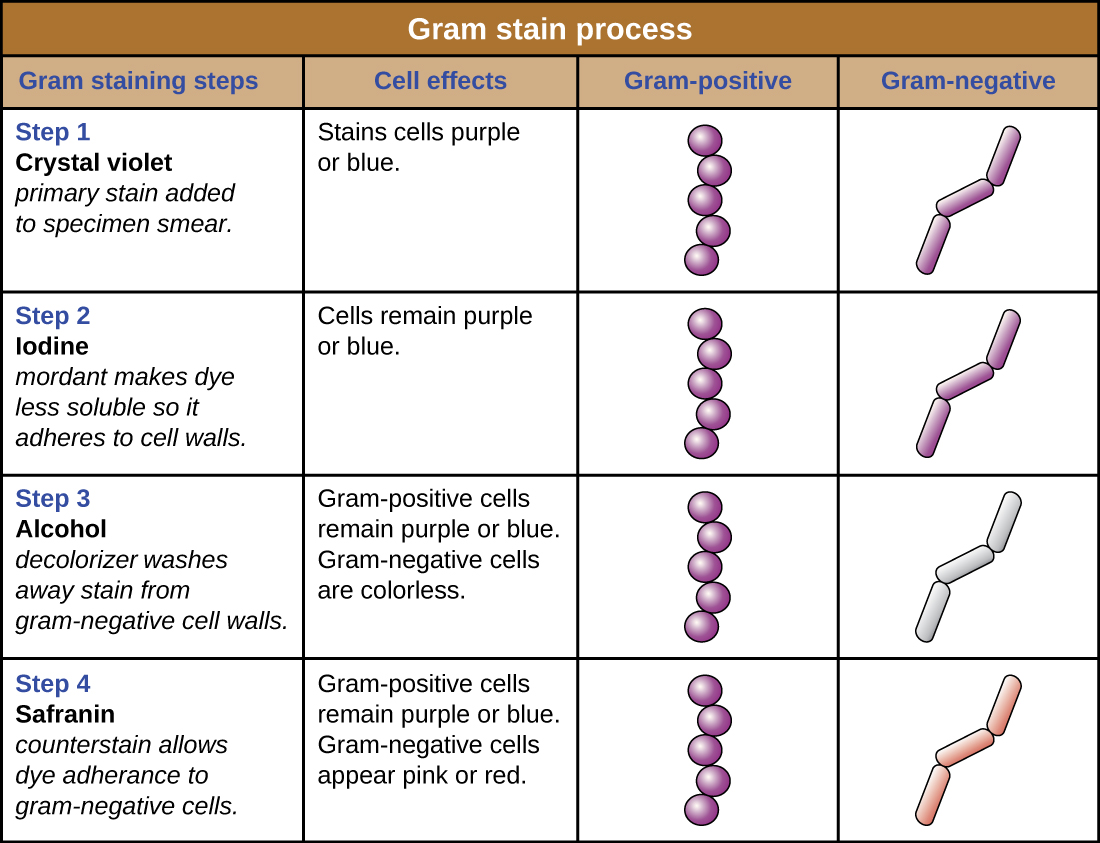
إن عرض عينة سيندي تحت مجهر الحقل المظلم قد زود الفني ببعض الأدلة المهمة حول هوية الميكروب الذي تسبب في إصابتها بالعدوى. ومع ذلك، هناك حاجة إلى مزيد من المعلومات لإجراء تشخيص قاطع. يقرر الفني عمل بقعة جرام من العينة. يشيع استخدام هذه التقنية كخطوة مبكرة في تحديد البكتيريا المسببة للأمراض. بعد الانتهاء من إجراء صبغ الغرام، يرى الفني الشريحة تحت مجهر برايتفيلد ويرى مجموعات أرجوانية تشبه العنب من الخلايا الكروية (الشكل\(\PageIndex{5}\)).
التمارين\(\PageIndex{3}\)
- هل هذه البكتيريا إيجابية الجرام أم سالبة الجرام؟
- ماذا يكشف هذا عن جدران زنزاناتهم؟
البقع الحمضية السريعة
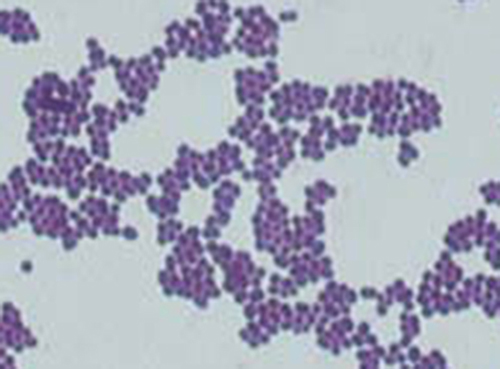
التلطيخ السريع بالحمض هو أسلوب آخر للتلوين التفاضلي شائع الاستخدام يمكن أن يكون أداة تشخيصية مهمة. يمكن للبقع سريعة الحموضة التمييز بين نوعين من الخلايا الإيجابية للجرام: تلك التي تحتوي على أحماض فلكية شمعية في جدران خلاياها، وتلك التي لا تحتوي عليها. هناك طريقتان مختلفتان للتلوين السريع بالحمض وهما تقنية Ziehl-Neelsen وتقنية Kinyoun. يستخدم كلاهما فوشين الكاربول كبقعة أساسية. تحتفظ الخلايا الشمعية سريعة الحمض بفوشين الكاربولفوسين حتى بعد تطبيق عامل إزالة اللون (محلول حمض الكحول). ثم يتم تطبيق صبغة مضادة ثانوية، وهي الميثيلين الأزرق، مما يجعل الخلايا غير المتحمسة للأحماض زرقاء.
الفرق الأساسي بين الطريقتين المعتمدتين على الكاربولفوشين هو ما إذا كانت الحرارة تستخدم أثناء عملية التلوين الأولية. تستخدم طريقة Ziehl-Neelsen الحرارة لبث الكاربولفوشين في الخلايا سريعة الحموضة، في حين أن طريقة Kinyoun لا تستخدم الحرارة. تعد كلتا التقنيتين أدوات تشخيصية مهمة لأن عددًا من الأمراض المحددة تسببها البكتيريا المقاومة للأحماض (AFB). إذا كان AFB موجودًا في عينة الأنسجة، فيمكن رؤية لونه الأحمر أو الوردي بوضوح على الخلفية الزرقاء لخلايا الأنسجة المحيطة (الشكل\(\PageIndex{6}\)).
التمارين\(\PageIndex{4}\)
لماذا تعتبر البقع سريعة الحموضة مفيدة؟
يمكن اكتشاف المتفطرة السلية، وهي البكتيريا المسببة لمرض السل، في العينات بناءً على وجود عصيات ثابتة الحمض. في كثير من الأحيان، يتم تحضير مسحة من عينة من بلغم المريض ثم تلوينها باستخدام تقنية Ziehl-Neelsen (الشكل\(\PageIndex{6}\)). إذا تم تأكيد البكتيريا سريعة الحمض، يتم استزراعها بشكل عام لتحديد هويتها بشكل إيجابي. يمكن استخدام الاختلافات في هذا النهج كخطوة أولى في تحديد ما إذا كانت بكتيريا السل أو غيرها من البكتيريا سريعة الحموضة موجودة، على الرغم من أن العينات من أماكن أخرى في الجسم (مثل البول) قد تحتوي على أنواع أخرى من المتفطرة.
النهج البديل لتحديد وجود مرض السل هو الفلورة المناعية. في هذه التقنية، ترتبط الأجسام المضادة التي تحمل علامة الفلوروكروم ببكتيريا السل، إن وجدت. يمكن استخدام الأصباغ الفلورية الخاصة بالأجسام المضادة لعرض البكتيريا الفطرية باستخدام المجهر الفلوري.
تلوين الكبسولة
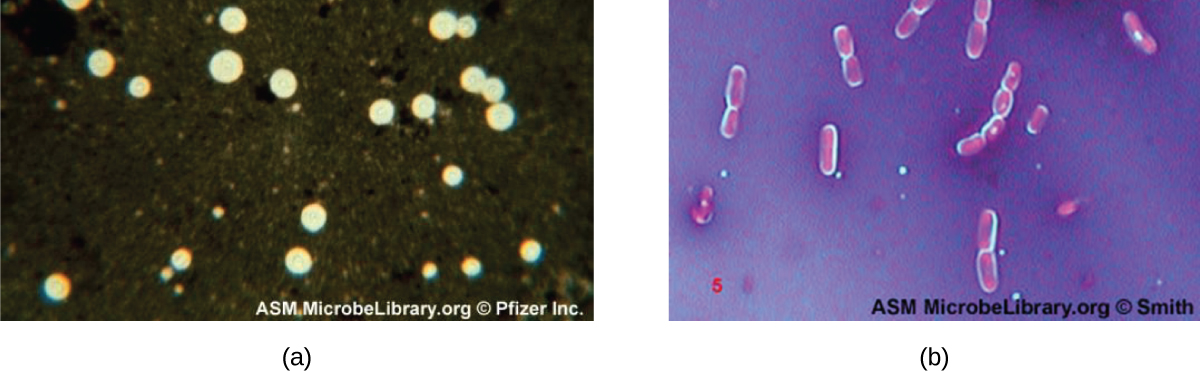
تحتوي بعض البكتيريا والخمائر على بنية خارجية واقية تسمى الكبسولة. نظرًا لأن وجود الكبسولة يرتبط ارتباطًا مباشرًا بضراوة الميكروب (قدرته على التسبب في المرض)، فإن القدرة على تحديد ما إذا كانت الخلايا في العينة تحتوي على كبسولات هي أداة تشخيصية مهمة. لا تمتص الكبسولات معظم الأصباغ الأساسية؛ لذلك، تُستخدم تقنية التلوين السلبي (التلوين حول الخلايا) عادةً لتلطيخ الكبسولة. تلطخ الصبغة الخلفية ولكنها لا تخترق الكبسولات التي تظهر مثل الهالات حول حدود الخلية. لا تحتاج العينة إلى تثبيت حراري قبل التلوين السلبي.
تتمثل إحدى تقنيات التلوين السلبي الشائعة لتحديد الخميرة والبكتيريا المغلفة في إضافة بضع قطرات من الحبر الهندي أو النيغروسين إلى العينة. يمكن أيضًا استخدام بقع الكبسولة الأخرى لتلطيخ الخلايا المغلفة سلبًا (الشكل\(\PageIndex{7}\)). بدلاً من ذلك، يمكن الجمع بين تقنيات التلوين الإيجابية والسلبية لتصور الكبسولات: البقع الإيجابية تلون جسم الخلية، والبقع السلبية تلون الخلفية ولكن ليس الكبسولة، مما يترك هالة حول كل خلية.
التمارين\(\PageIndex{5}\)
كيف يساعدنا التلوين السلبي على تصور الكبسولات؟
تلطيخ إندوسفور
المسام الداخلية عبارة عن هياكل يتم إنتاجها داخل خلايا بكتيرية معينة تسمح لها بالبقاء على قيد الحياة في الظروف القاسية. لا يمكن استخدام تلوين الجرام وحده لتصوير المسام الداخلية، والتي تبدو واضحة عند عرض الخلايا الملطخة بالجرام. يستخدم تلوين Endospore بقعتين لتمييز المسام الداخلية عن بقية الخلية. تستخدم طريقة Schaeffer-Fulton (تقنية تلوين المسام الأكثر استخدامًا) الحرارة لدفع البقعة الأولية (المالاكيت الأخضر) إلى داخل المسام. يؤدي الغسل بالماء إلى إزالة لون الخلية، لكن المسام الداخلية تحتفظ بالبقعة الخضراء. ثم يتم تلوين الخلية باللون الوردي باستخدام السفرانين. تكشف الصورة الناتجة شكل وموقع المسام الداخلية، إذا كانت موجودة. سوف تظهر المسام الخضراء إما داخل الخلايا النباتية الوردية أو منفصلة عن الخلايا الوردية تمامًا. في حالة عدم وجود مسامات داخلية، فلن تظهر سوى الخلايا النباتية الوردية (الشكل\(\PageIndex{8}\)).
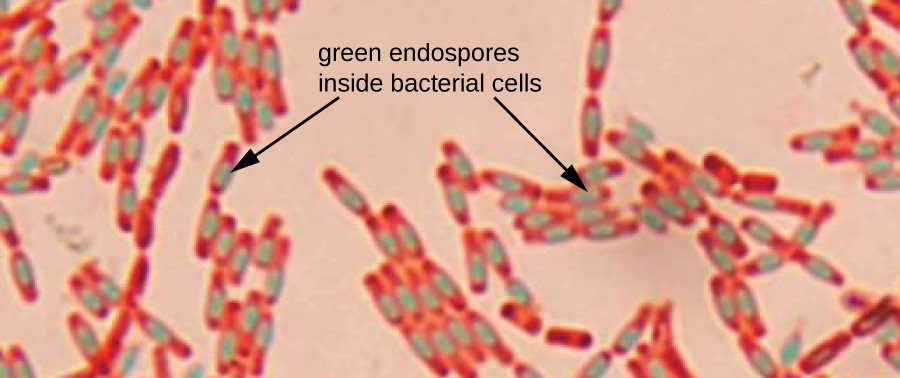
تعتبر تقنيات تلوين المسام مهمة لتحديد العصيات والكلوستريديوم، وهما جينان من البكتيريا المنتجة للأبواغ التي تحتوي على أنواع مهمة سريريًا. من بين أمور أخرى، كانت بكتيريا B. anthracis (التي تسبب الجمرة الخبيثة) ذات أهمية خاصة بسبب القلق من إمكانية استخدام جراثيمها كعامل إرهابي بيولوجي. المطثية العسيرة هي نوع مهم بشكل خاص مسؤول عن العدوى التي عادة ما يتم الحصول عليها من المستشفى والمعروفة باسم «C. diff».
التمارين\(\PageIndex{6}\)
هل تلوين إندوسبور مثال على التلوين الإيجابي أو السلبي أو التفاضلي؟
تلوين السوط
السوط (المفرد: السوط) عبارة عن هياكل خلوية تشبه الذيل تستخدمها بعض البكتيريا والأركيا وحقيقيات النوى للتنقل. نظرًا لكونها رقيقة جدًا، لا يمكن عادةً رؤية السوط تحت المجهر الضوئي دون استخدام تقنية متخصصة لتلطيخ السوط. يؤدي تلطيخ السوط إلى زيادة سماكة السوط عن طريق وضع اللطخات أولاً (حمض التانيك عمومًا، ولكن أحيانًا شبة البوتاسيوم)، التي تغطي السوط؛ ثم يتم تلطيخ العينة بالباراوسانيلين (الأكثر شيوعًا) أو الفوشين الأساسي (الشكل\(\PageIndex{9}\)).
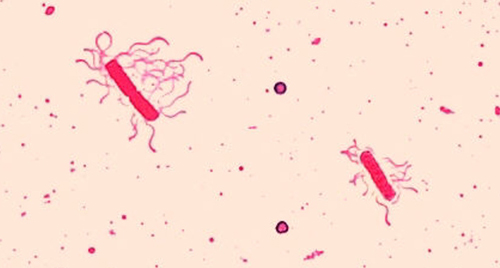
على الرغم من أن تلطيخ السوط غير شائع في البيئات السريرية، إلا أن هذه التقنية شائعة الاستخدام من قبل علماء الأحياء الدقيقة، حيث يمكن أن يكون موقع وعدد الأسواط مفيدًا في تصنيف البكتيريا وتحديدها في العينة. عند استخدام هذه التقنية، من المهم التعامل مع العينة بعناية فائقة؛ الأسواط عبارة عن هياكل دقيقة يمكن إتلافها أو سحبها بسهولة، مما يضر بمحاولات تحديد عدد الأسواط بدقة وإحصاء عددها.
إعداد العينات للفحص المجهري الإلكتروني
يجب أن تحتوي العينات المراد تحليلها باستخدام TEM على أقسام رقيقة جدًا. لكن الخلايا ناعمة جدًا بحيث لا يمكن قطعها بشكل رقيق، حتى باستخدام سكاكين الماس. لقطع الخلايا دون تلف، يجب دمج الخلايا في الراتنج البلاستيكي ثم تجفيفها من خلال سلسلة من النقع في محاليل الإيثانول (50٪، 60٪، 70٪، وما إلى ذلك). يستبدل الإيثانول الماء في الخلايا، ويذوب الراتنج في الإيثانول ويدخل الخلية، حيث يتصلب. بعد ذلك، يتم قطع المقاطع الرقيقة باستخدام جهاز متخصص يسمى Ultramicrotome (الشكل\(\PageIndex{12}\)). أخيرًا، يتم تثبيت العينات على الأسلاك النحاسية الدقيقة أو شبكات ألياف الكربون وتلطيخها - ليس بالأصباغ الملونة، ولكن بمواد مثل أسيتات اليورانيل أو رباعي أكسيد الأوزميوم، والتي تحتوي على ذرات معدنية ثقيلة كثيفة الإلكترون.

عندما يتم إعداد العينات للعرض باستخدام SEM، يجب أيضًا تجفيفها باستخدام سلسلة الإيثانول. ومع ذلك، يجب أن تكون أكثر جفافاً مما هو ضروري لـ TEM. يتم استخدام التجفيف عند النقاط الحرجة باستخدام ثاني أكسيد الكربون السائل الخامل تحت الضغط لإزاحة الماء من العينة. بعد التجفيف، يتم طلاء العينات بالمعدن عن طريق طرد الذرات من هدف البلاديوم، بجزيئات نشطة. يمنع طلاء الاخرق العينات من أن تصبح مشحونة بواسطة شعاع الإلكترون الخاص بـ SEM.
التمارين\(\PageIndex{7}\)
- لماذا من المهم تجفيف الخلايا قبل فحصها تحت المجهر الإلكتروني؟
- قم بتسمية الجهاز المستخدم لإنشاء أقسام رقيقة من العينات للفحص المجهري الإلكتروني.
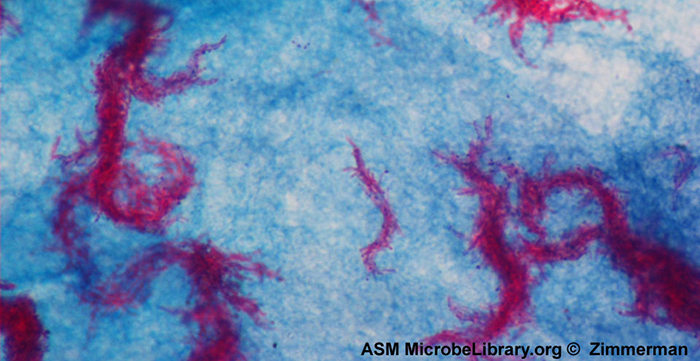
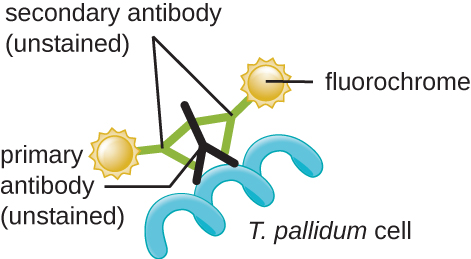
العامل المسبب لمرض الزهري هو Treponema pallidum، وهي خلية لولبية مرنة (spirochete) يمكن أن تكون رقيقة جدًا (<0.15 ميكرومتر) وتطابق معامل انكسار الوسط، مما يجعل من الصعب مشاهدتها باستخدام الفحص المجهري في المجال الساطع. بالإضافة إلى ذلك، لم يتم استزراع هذا النوع بنجاح في المختبر على وسط اصطناعي؛ لذلك، يعتمد التشخيص على التحديد الناجح باستخدام التقنيات المجهرية وعلم الأمصال (تحليل سوائل الجسم، غالبًا البحث عن الأجسام المضادة لمسببات الأمراض). نظرًا لأن التثبيت والتلطيخ من شأنه أن يقتل الخلايا، فإن الفحص المجهري المظلم يُستخدم عادةً لمراقبة العينات الحية ومشاهدة تحركاتها. ومع ذلك، يمكن أيضًا استخدام أساليب أخرى. على سبيل المثال، يمكن تكثيف الخلايا بجزيئات الفضة (في أقسام الأنسجة) ومراقبتها باستخدام المجهر الضوئي. من الممكن أيضًا استخدام الفلورة أو المجهر الإلكتروني لعرض التريبونيما (الشكل\(\PageIndex{13}\)).

في البيئات السريرية، غالبًا ما يتم استخدام الفلورة المناعية غير المباشرة لتحديد التريبونيما. يرتبط الجسم المضاد الأساسي غير الملون مباشرة بسطح العامل الممرض، بينما تلتصق الأجسام المضادة الثانوية «الموسومة» ببقع الفلورسنت بالجسم المضاد الأساسي. يمكن أن تلتصق الأجسام المضادة الثانوية المتعددة بكل جسم مضاد أساسي، مما يزيد من كمية البقع المرتبطة بكل خلية من خلايا Treponema، مما يسهل اكتشافها (الشكل\(\PageIndex{14}\)).
التحضير والتلوين للمجهر الأخرى
يتم تحضير عينات الفحص الفلوري والمجهر متحد البؤرة بشكل مشابه لعينات الفحص المجهري الضوئي، باستثناء أن الأصباغ هي الفلوروكرومات. غالبًا ما يتم تخفيف البقع في السائل قبل وضعها على الشريحة. تلتصق بعض الأصباغ بالجسم المضاد لتلطيخ بروتينات معينة على أنواع معينة من الخلايا (الفلورة المناعية)؛ وقد تلتصق بعض الأصباغ بجزيئات الحمض النووي في عملية تسمى التهجين الموضعي بالفلورة (FISH)، مما يتسبب في تلطيخ الخلايا بناءً على ما إذا كان لديها تسلسل DNA محدد.
يشبه تحضير العينة للفحص المجهري ثنائي الفوتون الفحص المجهري الفلوري، باستثناء استخدام أصباغ الأشعة تحت الحمراء. يجب أن تكون عينات STM على سطح نظيف جدًا وسلس ذريًا. غالبًا ما تكون مطلية بالميكا بـ Au (111). بخار التولوين هو مثبت شائع.
التمارين\(\PageIndex{8}\)
ما الفرق الرئيسي بين إعداد عينة للفحص المجهري الفلوري مقابل الفحص المجهري الضوئي؟
رابط إلى التعلم
تقدم دراسات الحالة بجامعة كورنيل في الفحص المجهري سلسلة من المشكلات السريرية بناءً على أحداث واقعية. ترشدك كل دراسة حالة إلى مشكلة سريرية باستخدام التقنيات المناسبة في الفحص المجهري في كل خطوة.
التركيز السريري: القرار
من نتائج بقعة غرام، يعرف الفني الآن أن عدوى سيندي ناتجة عن بكتيريا كروية إيجابية الجرام تشكل مجموعات تشبه العنب، وهي نموذجية لبكتيريا المكورات العنقودية. بعد إجراء بعض الاختبارات الإضافية، يحدد الفني أن هذه البكتيريا هي الأنواع ذات الأهمية الطبية المعروفة باسم Staphylococcus aureus، وهي السبب الشائع في التهابات الجروح. نظرًا لأن بعض سلالات S. aureus تقاوم العديد من المضادات الحيوية، فقد تنتشر العدوى الجلدية إلى مناطق أخرى من الجسم وتصبح خطيرة، وأحيانًا تؤدي إلى بتر الأطراف أو الوفاة إذا لم يتم استخدام المضادات الحيوية الصحيحة.
بعد اختبار العديد من المضادات الحيوية، أصبح المختبر قادرًا على تحديد مضاد فعال ضد هذه السلالة الخاصة من S. aureus. يصف طبيب سيندي الدواء بسرعة ويؤكد على أهمية تناول الدورة الكاملة للمضادات الحيوية، حتى لو بدا أن العدوى تزول قبل آخر جرعة مجدولة. هذا يقلل من خطر بقاء أي بكتيريا مقاومة بشكل خاص، مما يتسبب في عدوى ثانية أو تنتشر إلى شخص آخر.
ومع انتشار استخدام المضادات الحيوية في الطب، وكذلك الزراعة، تطورت الميكروبات لتصبح أكثر مقاومة. تشكل سلالات البكتيريا مثل بكتيريا S. aureus (MRSA) المقاومة للميثيسيلين، والتي طورت مستوى عاليًا من المقاومة للعديد من المضادات الحيوية، مشكلة مقلقة بشكل متزايد، لدرجة أن الأبحاث جارية لتطوير مضادات حيوية جديدة وأكثر تنوعًا.
يمكن أن يكون الفحص المجهري الفلوري مفيدًا في اختبار فعالية المضادات الحيوية الجديدة ضد السلالات المقاومة مثل MRSA. في اختبار لمضادات حيوية جديدة مشتقة من بكتيريا بحرية، MC21-A (بروموفين)، استخدم الباحثون الصبغة الفلورية SYTOX Green لتلطيخ عينات من MRSA. غالبًا ما يستخدم SYTOX Green لتمييز الخلايا الميتة عن الخلايا الحية باستخدام الفحص المجهري الفلوري. لن تمتص الخلايا الحية الصبغة، لكن الخلايا المقتولة بالمضادات الحيوية ستمتص الصبغة، لأن المضاد الحيوي قد أضر بغشاء الخلية البكتيرية. في هذه الحالة بالذات، ظهرت بكتيريا MRSA التي تعرضت لـ MC21-A بالفعل باللون الأخضر تحت المجهر الفلوري، مما دفع الباحثين إلى استنتاج أنها مضاد حيوي فعال ضد MRSA.
بالطبع، يزعم البعض أن تطوير المضادات الحيوية الجديدة لن يؤدي إلا إلى المزيد من الميكروبات المقاومة للمضادات الحيوية، والتي تسمى الجراثيم الخارقة التي يمكن أن تفرخ الأوبئة قبل أن يتم تطوير علاجات جديدة. لهذا السبب، بدأ العديد من المهنيين الصحيين في ممارسة المزيد من السلطة التقديرية في وصف المضادات الحيوية. في حين كان يتم وصف المضادات الحيوية بشكل روتيني للأمراض الشائعة دون تشخيص محدد، فمن المرجح أن يقوم الأطباء والمستشفيات بإجراء اختبارات إضافية لتحديد ما إذا كان المضاد الحيوي ضروريًا ومناسبًا قبل وصفه.
قد يعترض المريض بشكل معقول على هذا النهج البخل لوصف المضادات الحيوية. بالنسبة للمريض الذي يريد ببساطة أن يشعر بالتحسن في أسرع وقت ممكن، قد تبدو الفوائد المحتملة لتناول المضادات الحيوية تفوق أي مخاطر صحية فورية قد تحدث إذا كان المضاد الحيوي غير فعال. ولكن في أي مرحلة تحل مخاطر استخدام المضادات الحيوية على نطاق واسع محل الرغبة في استخدامها في الحالات الفردية؟
المفاهيم الأساسية والملخص
- يجب إعداد العينات بشكل صحيح للفحص المجهري. قد يشمل ذلك تلطيخ و/أو تثبيت و/أو قطع الأجزاء الرقيقة.
- يمكن استخدام مجموعة متنوعة من تقنيات التلوين مع الفحص المجهري الضوئي، بما في ذلك التلوين بالجرام، والتلوين السريع بالحمض، وتلطيخ الكبسولة، وتلطيخ المسام، وتلطيخ السوط.
- تتطلب عينات TEM أقسامًا رقيقة جدًا، بينما تتطلب عينات SEM طلاءًا بالرش.
- يشبه التحضير للفحص المجهري الفلوري ذلك الخاص بالمجهر الضوئي، باستثناء استخدام الفلوروكرومات.


