10.3: علم الجينوم والبروتيوميات
- Page ID
- 191364
بدأت دراسة الأحماض النووية باكتشاف الحمض النووي، وتقدمت إلى دراسة الجينات والشظايا الصغيرة، وانتقلت الآن إلى مجال علم الجينوم. علم الجينوم هو دراسة الجينوم بأكمله، بما في ذلك المجموعة الكاملة من الجينات، وتسلسل النوكليوتيدات وتنظيمها، وتفاعلاتها داخل الأنواع ومع الأنواع الأخرى. أصبح التقدم في علم الجينوم ممكنًا بفضل تقنية تسلسل الحمض النووي. مثلما أدت تكنولوجيا المعلومات إلى خرائط Google التي تمكننا من الحصول على معلومات مفصلة حول المواقع في جميع أنحاء العالم، يتم استخدام المعلومات الجينومية لإنشاء خرائط مماثلة للحمض النووي للكائنات الحية المختلفة.
جينومات رسم الخرائط
رسم خرائط الجينوم هو عملية العثور على موقع الجينات على كل كروموسوم. الخرائط التي تم إنشاؤها قابلة للمقارنة مع الخرائط التي نستخدمها للتنقل في الشوارع. الخريطة الجينية هي رسم توضيحي يسرد الجينات وموقعها على الكروموسوم. توفر الخرائط الجينية الصورة الكبيرة (على غرار خريطة الطرق السريعة بين الولايات) وتستخدم العلامات الجينية (على غرار المعالم). العلامة الجينية هي جين أو تسلسل على كروموسوم يُظهر ارتباطًا جينيًا بسمة مثيرة للاهتمام. تميل العلامة الجينية إلى أن تكون موروثة مع الجين محل الاهتمام، وأحد مقاييس المسافة بينهما هو تكرار إعادة التركيب أثناء الانقسام الاختزالي. أطلق علماء الوراثة الأوائل على تحليل الارتباط هذا.
تدخل الخرائط المادية في التفاصيل الدقيقة للمناطق الأصغر من الكروموسومات (على غرار خريطة الطريق التفصيلية) (الشكل\(\PageIndex{1}\)). الخريطة المادية هي تمثيل للمسافة المادية، في النيوكليوتيدات، بين الجينات أو العلامات الجينية. كل من خرائط الارتباط الجيني والخرائط المادية مطلوبة لبناء صورة كاملة للجينوم. إن وجود خريطة كاملة للجينوم يجعل من السهل على الباحثين دراسة الجينات الفردية. تساعد خرائط الجينوم البشري الباحثين في جهودهم لتحديد الجينات المسببة للأمراض البشرية المتعلقة بأمراض مثل السرطان وأمراض القلب والتليف الكيسي، على سبيل المثال لا الحصر. بالإضافة إلى ذلك، يمكن استخدام رسم خرائط الجينوم للمساعدة في تحديد الكائنات الحية ذات الصفات المفيدة، مثل الميكروبات التي لديها القدرة على تنظيف الملوثات أو حتى منع التلوث. قد تؤدي الأبحاث التي تتضمن رسم خرائط الجينوم النباتي إلى طرق تنتج عوائد أعلى للمحاصيل أو إلى تطوير نباتات تتكيف بشكل أفضل مع تغير المناخ.
![رسم تخطيطي يوضح كروموسوم بشري مع أشرطة تم الكشف عنها بصبغة Giemsa. يتم تسمية النطاقات بـ Xp ورقم على الذراع القصير و Xq ورقم على الذراع الطويل. تم العثور على جينات معينة داخل بعض النطاقات. تم تصنيف هذه الجينات على اليمين: فقر الدم فانكوني B، ومتلازمة ويسكوت ألدريتش، ومرض بيليزايوس-ميرزباتشر، ومتلازمة X الهشة، ونقص G6PD [0].](https://bio.libretexts.org/@api/deki/files/9384/Figure_10_03_01.jpg)
توفر الخرائط الجينية المخطط التفصيلي، بينما توفر الخرائط المادية التفاصيل. من السهل فهم سبب أهمية كلا النوعين من تقنيات رسم الخرائط الجينومية لإظهار الصورة الكبيرة. يتم استخدام المعلومات التي تم الحصول عليها من كل تقنية معًا لدراسة الجينوم. يتم استخدام رسم الخرائط الجينومية مع الكائنات الحية النموذجية المختلفة التي تستخدم للبحث. لا يزال رسم خرائط الجينوم عملية مستمرة، ومع تطوير تقنيات أكثر تقدمًا، من المتوقع حدوث المزيد من التقدم. رسم خرائط الجينوم يشبه إكمال لغز معقد باستخدام كل جزء من البيانات المتاحة. يتم إدخال معلومات رسم الخرائط التي تم إنشاؤها في المختبرات في جميع أنحاء العالم في قواعد البيانات المركزية، مثل المركز الوطني لمعلومات التكنولوجيا الحيوية (NCBI). يتم بذل الجهود لجعل المعلومات في متناول الباحثين والجمهور العام. مثلما نستخدم أنظمة تحديد المواقع العالمية بدلاً من الخرائط الورقية للتنقل عبر الطرق، يتيح لنا NCBI استخدام أداة عارض الجينوم لتبسيط عملية استخراج البيانات.
مفهوم في العمل

الوراثة المندلية في الإنسان (OMIM) على الإنترنت هو كتالوج يمكن البحث فيه على الإنترنت عن الجينات البشرية والاضطرابات الوراثية. يعرض هذا الموقع رسم خرائط الجينوم، ويفصل أيضًا تاريخ وأبحاث كل سمة واضطراب. انقر فوق الارتباط للبحث عن السمات (مثل استخدام اليدين) والاضطرابات الوراثية (مثل مرض السكري).
تسلسل الجينوم الكامل
على الرغم من حدوث تقدم كبير في العلوم الطبية في السنوات الأخيرة، لا يزال الأطباء في حيرة من أمرهم بسبب العديد من الأمراض ويستخدم الباحثون تسلسل الجينوم الكامل للوصول إلى جوهر المشكلة. تسلسل الجينوم الكامل هو عملية تحدد تسلسل الحمض النووي للجينوم بأكمله. تسلسل الجينوم الكامل هو نهج القوة الغاشمة لحل المشكلات عندما يكون هناك أساس وراثي في جوهر المرض. تقدم العديد من المختبرات الآن خدمات لتسلسل وتحليل وتفسير الجينوم بأكمله.
في عام 2010، تم استخدام تسلسل الجينوم الكامل لإنقاذ صبي صغير كانت أمعائه تعاني من عدة خراجات غامضة. خضع الطفل للعديد من عمليات القولون دون راحة. أخيرًا، كشف تسلسل جينوم كامل عن خلل في المسار الذي يتحكم في موت الخلايا المبرمج (موت الخلايا المبرمج). تم استخدام عملية زرع نخاع العظام للتغلب على هذا الاضطراب الجيني، مما أدى إلى علاج الصبي. كان أول شخص يتم تشخيصه بنجاح باستخدام تسلسل الجينوم الكامل.
كانت الجينومات الأولى التي تم تسلسلها، مثل تلك التي تنتمي إلى الفيروسات والبكتيريا والخميرة، أصغر من حيث عدد النيوكليوتيدات مقارنة بجينومات الكائنات الحية متعددة الخلايا. أصبحت جينومات الكائنات الحية النموذجية الأخرى، مثل الفأر (Mus musculus)، وذبابة الفاكهة (Drosophila melanogaster)، والديدان الخيطية (Caenorhabditis elegans) معروفة الآن. يتم إجراء قدر كبير من الأبحاث الأساسية في الكائنات الحية النموذجية لأن المعلومات يمكن تطبيقها على الكائنات الحية الأخرى. الكائن الحي النموذجي هو نوع يتم دراسته كنموذج لفهم العمليات البيولوجية في الأنواع الأخرى التي يمكن تمثيلها بواسطة الكائن الحي النموذجي. على سبيل المثال، يستطيع ذباب الفاكهة استقلاب الكحول مثل البشر، لذلك تمت دراسة الجينات التي تؤثر على الحساسية للكحول في ذباب الفاكهة في محاولة لفهم التباين في الحساسية للكحول لدى البشر. يساعد تسلسل جينومات كامل في جهود البحث في هذه الكائنات الحية النموذجية (الشكل\(\PageIndex{2}\)).

تم نشر أول تسلسل جينوم بشري في عام 2003. يزداد عدد الجينومات الكاملة التي تم تسلسلها بشكل مطرد وتشمل الآن مئات الأنواع وآلاف الجينومات البشرية الفردية.
تطبيق علم الجينوم
أدى إدخال تسلسل الحمض النووي ومشاريع تسلسل الجينوم الكامل، وخاصة مشروع الجينوم البشري، إلى توسيع نطاق تطبيق معلومات تسلسل الحمض النووي. يتم استخدام علم الجينوم الآن في مجموعة متنوعة من المجالات، مثل الميتاجينوميات وعلم الجينوم الدوائي وجينوميات الميتوكوندريا. التطبيق الأكثر شيوعًا لعلم الجينوم هو فهم وإيجاد علاجات للأمراض.
توقع مخاطر الأمراض على المستوى الفردي
يتضمن التنبؤ بمخاطر المرض فحص وتحديد الأفراد الأصحاء حاليًا عن طريق تحليل الجينوم على المستوى الفردي. يمكن التوصية بالتدخل في تغييرات نمط الحياة والأدوية قبل ظهور المرض. ومع ذلك، يكون هذا النهج أكثر قابلية للتطبيق عندما تنشأ المشكلة من طفرة جينية واحدة. مثل هذه العيوب لا تمثل سوى حوالي 5 في المائة من الأمراض الموجودة في البلدان المتقدمة. معظم الأمراض الشائعة، مثل أمراض القلب، متعددة العوامل أو متعددة الجينات، والتي تشير إلى خاصية النمط الظاهري التي يحددها جينان أو أكثر، وكذلك العوامل البيئية مثل النظام الغذائي. في أبريل 2010، نشر العلماء في جامعة ستانفورد تحليل الجينوم لفرد سليم (ستيفن كواك، عالم في جامعة ستانفورد، الذي قام بتسلسل الجينوم الخاص به)؛ تنبأ التحليل بميله إلى الإصابة بأمراض مختلفة. تم إجراء تقييم للمخاطر لتحليل نسبة خطر Quake لـ 55 حالة طبية مختلفة. تم العثور على طفرة جينية نادرة أظهرت أنه معرض لخطر الإصابة بنوبة قلبية مفاجئة. كما كان من المتوقع أن يكون لديه خطر الإصابة بسرطان البروستاتا بنسبة 23 في المائة وخطر الإصابة بمرض الزهايمر بنسبة 1.4 في المائة. استخدم العلماء قواعد البيانات والعديد من المنشورات لتحليل البيانات الجينومية. على الرغم من أن التسلسل الجيني أصبح ميسور التكلفة وأن الأدوات التحليلية أصبحت أكثر موثوقية، إلا أن القضايا الأخلاقية المحيطة بالتحليل الجيني على مستوى السكان لا تزال بحاجة إلى معالجة. على سبيل المثال، هل يمكن استخدام هذه البيانات بشكل شرعي لفرض رسوم أكثر أو أقل مقابل التأمين أو للتأثير على التصنيفات الائتمانية؟
دراسات الارتباط على مستوى الجينوم
منذ عام 2005، أصبح من الممكن إجراء نوع من الدراسة يسمى دراسة الارتباط على مستوى الجينوم، أو GWAS. GWAS هي طريقة تحدد الاختلافات بين الأفراد في تعدد أشكال النوكليوتيدات المفردة (SNPs) التي قد تكون متورطة في التسبب في الأمراض. هذه الطريقة مناسبة بشكل خاص للأمراض التي قد تتأثر بواحد أو أكثر من التغييرات الجينية في جميع أنحاء الجينوم. من الصعب جدًا تحديد الجينات المشاركة في مثل هذا المرض باستخدام معلومات التاريخ العائلي. تعتمد طريقة GWAS على قاعدة بيانات جينية قيد التطوير منذ عام 2002 تسمى مشروع HapMap الدولي. قام مشروع HapMap بتسلسل جينومات عدة مئات من الأفراد من جميع أنحاء العالم وحدد مجموعات من SNPs. تتضمن المجموعات SNPs التي تقع بالقرب من بعضها البعض على الكروموسومات لذلك تميل إلى البقاء معًا من خلال إعادة التركيب. إن حقيقة بقاء المجموعة معًا تعني أن تحديد علامة واحدة SNP هو كل ما هو مطلوب لتحديد جميع SNPs في المجموعة. تم تحديد عدة ملايين من SNPs، ولكن التعرف عليها في الأفراد الآخرين الذين لم يتم تسلسل جينومهم الكامل أسهل بكثير لأنه يجب تحديد علامة SNPs فقط.
في التصميم المشترك لـ GWAS، يتم اختيار مجموعتين من الأفراد؛ مجموعة واحدة مصابة بالمرض، والمجموعة الأخرى لا تعاني منه. تتم مطابقة الأفراد في كل مجموعة في خصائص أخرى لتقليل تأثير المتغيرات المربكة التي تسبب الاختلافات بين المجموعتين. على سبيل المثال، قد تختلف الأنماط الجينية لأن المجموعتين مأخوذتان في الغالب من أجزاء مختلفة من العالم. بمجرد اختيار الأفراد، وعادة ما تكون أعدادهم ألفًا أو أكثر حتى تعمل الدراسة، يتم الحصول على عينات من الحمض النووي الخاص بهم. يتم تحليل الحمض النووي باستخدام أنظمة آلية لتحديد الاختلافات الكبيرة في النسبة المئوية لـ SNPs معينة بين المجموعتين. غالبًا ما تفحص الدراسة مليون أو أكثر من SNPs في الحمض النووي. يمكن استخدام نتائج GWAS بطريقتين: يمكن استخدام الاختلافات الجينية كعلامات على القابلية للإصابة بالمرض لدى الأفراد غير المشخصين، ويمكن أن تكون الجينات المعينة المحددة أهدافًا للبحث في المسار الجزيئي للمرض والعلاجات المحتملة. كان أحد فروع اكتشاف الارتباطات الجينية بالمرض هو تشكيل الشركات التي تقدم ما يسمى بـ «علم الجينوم الشخصي» الذي سيحدد مستويات الخطر للأمراض المختلفة بناءً على مكمل SNP للفرد. العلم وراء هذه الخدمات مثير للجدل.
نظرًا لأن GWAS تبحث عن الارتباطات بين الجينات والمرض، توفر هذه الدراسات بيانات لأبحاث أخرى حول الأسباب، بدلاً من الإجابة على أسئلة محددة بنفسها. لا يعني الارتباط بين اختلاف الجينات والمرض بالضرورة وجود علاقة السبب والنتيجة. ومع ذلك، قدمت بعض الدراسات معلومات مفيدة حول الأسباب الوراثية للأمراض. على سبيل المثال، حددت ثلاث دراسات مختلفة في عام 2005 جينًا لبروتين يشارك في تنظيم الالتهاب في الجسم يرتبط بالعمى المسبب للمرض والذي يسمى التنكّس البقعي المرتبط بالعمر. هذا فتح إمكانيات جديدة للبحث في سبب هذا المرض. تم تحديد عدد كبير من الجينات المرتبطة بمرض كرون باستخدام GWAS، وقد اقترح بعضها آليات افتراضية جديدة لسبب المرض.
علم الجينوم الدوائي
يتضمن علم الصيدلة الجيني تقييم فعالية الأدوية وسلامتها على أساس المعلومات من التسلسل الجيني للفرد. يمكن استخدام معلومات تسلسل الجينوم الشخصي لوصف الأدوية التي ستكون أكثر فعالية وأقل سمية على أساس النمط الجيني للمريض الفردي. يمكن أن توفر دراسة التغييرات في التعبير الجيني معلومات حول ملف النسخ الجيني في وجود الدواء، والذي يمكن استخدامه كمؤشر مبكر لإمكانية حدوث تأثيرات سامة. على سبيل المثال، يمكن أن تؤدي الجينات المشاركة في النمو الخلوي وموت الخلايا المتحكم فيه، عند اضطرابها، إلى نمو الخلايا السرطانية. يمكن أن تساعد الدراسات على مستوى الجينوم أيضًا في العثور على جينات جديدة تشارك في سمية الأدوية. قد لا تكون التوقيعات الجينية دقيقة تمامًا، ولكن يمكن اختبارها مرة أخرى قبل ظهور الأعراض المرضية.
الميتاجينوميكس
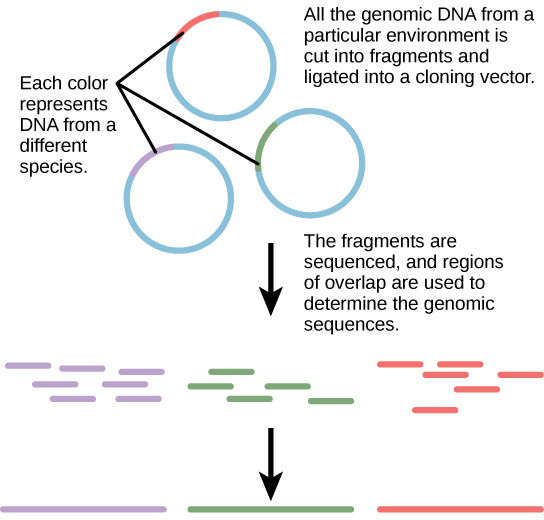
تقليديًا، تم تدريس علم الأحياء الدقيقة من وجهة نظر مفادها أنه من الأفضل دراسة الكائنات الحية الدقيقة في ظل ظروف الاستزراع النقي، والتي تتضمن عزل نوع واحد من الخلايا وزراعتها في المختبر. نظرًا لأن الكائنات الحية الدقيقة يمكن أن تمر عبر عدة أجيال في غضون ساعات، فإن ملفات تعريف التعبير الجيني الخاصة بها تتكيف مع بيئة المختبر الجديدة بسرعة كبيرة. من ناحية أخرى، تقاوم العديد من الأنواع الاستزراع في عزلة. لا تعيش معظم الكائنات الحية الدقيقة ككيانات معزولة، ولكن في المجتمعات الميكروبية المعروفة باسم الأغشية الحيوية. لكل هذه الأسباب، فإن الثقافة النقية ليست دائمًا أفضل طريقة لدراسة الكائنات الحية الدقيقة. Metagenomics هي دراسة الجينومات الجماعية لأنواع متعددة تنمو وتتفاعل في بيئة متخصصة. يمكن استخدام الميتاجينوميكس لتحديد الأنواع الجديدة بسرعة أكبر وتحليل تأثير الملوثات على البيئة (الشكل\(\PageIndex{3}\)). يمكن الآن أيضًا تطبيق تقنيات الميتاجينوميكس على مجتمعات حقيقيات النوى العليا، مثل الأسماك.
إنشاء وقود حيوي جديد
يتم استخدام المعرفة بجينوم الكائنات الحية الدقيقة لإيجاد طرق أفضل لتسخير الوقود الحيوي من الطحالب والبكتيريا الزرقاء. المصادر الأساسية للوقود اليوم هي الفحم والنفط والخشب والمنتجات النباتية الأخرى مثل الإيثانول. على الرغم من أن النباتات هي موارد متجددة، لا تزال هناك حاجة لإيجاد المزيد من مصادر الطاقة المتجددة البديلة لتلبية متطلبات الطاقة لسكاننا. يعد عالم الميكروبات أحد أكبر موارد الجينات التي تقوم بترميز الإنزيمات الجديدة وإنتاج مركبات عضوية جديدة، ولا يزال غير مستغل إلى حد كبير. هذا المورد الجيني الضخم يحمل القدرة على توفير مصادر جديدة للوقود الحيوي (الشكل\(\PageIndex{4}\)).

جينوم الميتوكوند
الميتوكوندريا هي عضيات داخل الخلايا تحتوي على الحمض النووي الخاص بها. يتحور الحمض النووي للميتوكوندريا بمعدل سريع وغالبًا ما يستخدم لدراسة العلاقات التطورية. ميزة أخرى تجعل دراسة جينوم الميتوكوندريا مثيرة للاهتمام هي أنه في معظم الكائنات متعددة الخلايا، ينتقل الحمض النووي للميتوكوندريا من الأم أثناء عملية الإخصاب. لهذا السبب، غالبًا ما تستخدم جينوم الميتوكوندريا لتتبع علم الأنساب.
علم الجينوم في التحليل الجنائي
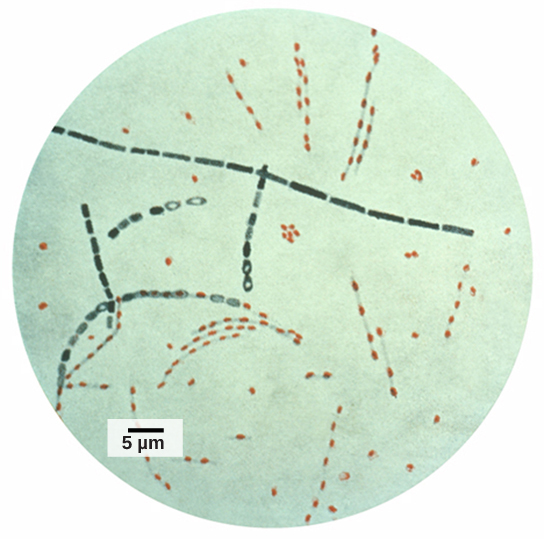
تم استخدام المعلومات والقرائن التي تم الحصول عليها من عينات الحمض النووي الموجودة في مسرح الجريمة كدليل في قضايا المحاكم، وتم استخدام العلامات الجينية في تحليل الطب الشرعي. أصبح التحليل الجيني مفيدًا أيضًا في هذا المجال. في عام 2001، تم نشر أول استخدام لعلم الجينوم في الطب الشرعي. لقد كان جهدًا تعاونيًا بين مؤسسات البحث الأكاديمي ومكتب التحقيقات الفيدرالي لحل الحالات الغامضة للجمرة الخبيثة (الشكل\(\PageIndex{5}\)) التي تم نقلها بواسطة خدمة البريد الأمريكية. تم تحويل بكتيريا الجمرة الخبيثة إلى مسحوق معدي وإرسالها بالبريد إلى وسائل الإعلام واثنين من أعضاء مجلس الشيوخ الأمريكي. أصاب المسحوق الموظفين الإداريين وعمال البريد الذين فتحوا الرسائل أو تعاملوا معها. مات خمسة أشخاص، وأصيب 17 بمرض من البكتيريا. باستخدام علم الجينوم الميكروبي، قرر الباحثون أنه تم استخدام سلالة معينة من الجمرة الخبيثة في جميع المراسلات؛ في نهاية المطاف، تم تتبع المصدر إلى عالم في مختبر الدفاع البيولوجي الوطني في ولاية ماريلاند.
علم الجينوم في الزراعة
يمكن أن يقلل علم الجينوم من التجارب والإخفاقات التي ينطوي عليها البحث العلمي إلى حد ما، مما قد يحسن جودة وكمية غلة المحاصيل في الزراعة (الشكل\(\PageIndex{6}\)). يساعد ربط السمات بالجينات أو التوقيعات الجينية على تحسين تربية المحاصيل لتوليد أنواع هجينة ذات أكثر الصفات المرغوبة. يستخدم العلماء البيانات الجينومية لتحديد الصفات المرغوبة، ثم ينقلونها إلى كائن حي مختلف لإنشاء كائن حي جديد معدل وراثيًا، كما هو موضح في الوحدة السابقة. يكتشف العلماء كيف يمكن للجينوم تحسين جودة وكمية الإنتاج الزراعي. على سبيل المثال، يمكن للعلماء استخدام السمات المرغوبة لإنشاء منتج مفيد أو تحسين منتج موجود، مثل جعل المحاصيل الحساسة للجفاف أكثر تحملاً لموسم الجفاف.

علم البروتيوميات
البروتينات هي المنتجات النهائية للجينات التي تؤدي الوظيفة المشفرة بواسطة الجين. تتكون البروتينات من الأحماض الأمينية وتلعب أدوارًا مهمة في الخلية. جميع الإنزيمات (باستثناء الريبوزيمات) هي بروتينات وتعمل كمحفزات تؤثر على معدل التفاعلات. البروتينات هي أيضًا جزيئات تنظيمية، وبعضها هرمونات. تساعد بروتينات النقل، مثل الهيموجلوبين، على نقل الأكسجين إلى الأعضاء المختلفة. الأجسام المضادة التي تدافع ضد الجسيمات الأجنبية هي أيضًا بروتينات. في الحالة المرضية، يمكن أن تتأثر وظيفة البروتين بسبب التغيرات على المستوى الجيني أو بسبب التأثير المباشر على بروتين معين.
البروتيوم هو مجموعة كاملة من البروتينات التي ينتجها نوع الخلية. يمكن دراسة البروتينات باستخدام معرفة الجينوم لأن الجينات ترمز إلى mRNAs، بينما تقوم mRNAs بترميز البروتينات. تسمى دراسة وظيفة البروتيومات بالبروتيوميات. تكمل البروتيوميات علم الجينوم وهي مفيدة عندما يريد العلماء اختبار فرضياتهم التي تستند إلى الجينات. على الرغم من أن جميع الخلايا في الكائن الحي متعدد الخلايا لها نفس مجموعة الجينات، إلا أن مجموعة البروتينات المنتجة في الأنسجة المختلفة مختلفة وتعتمد على التعبير الجيني. وبالتالي، فإن الجينوم ثابت، لكن البروتين يختلف وهو ديناميكي داخل الكائن الحي. بالإضافة إلى ذلك، يمكن تقسيم RNAs بدلاً من ذلك (قصها ولصقها لإنشاء مجموعات جديدة وبروتينات جديدة)، ويتم تعديل العديد من البروتينات بعد الترجمة. على الرغم من أن الجينوم يوفر مخططًا، إلا أن البنية النهائية تعتمد على عدة عوامل يمكن أن تغير تطور الأحداث التي تولد البروتين.
تتم دراسة جينومات وبروتينات المرضى الذين يعانون من أمراض معينة لفهم الأساس الجيني للمرض. المرض الأبرز الذي تتم دراسته باستخدام الأساليب البروتينية هو السرطان (الشكل\(\PageIndex{7}\)). يتم استخدام الأساليب البروتينية لتحسين الفحص والكشف المبكر عن السرطان؛ يتم تحقيق ذلك من خلال تحديد البروتينات التي يتأثر تعبيرها بعملية المرض. يُطلق على البروتين الفردي اسم العلامة الحيوية، في حين أن مجموعة البروتينات ذات مستويات التعبير المتغيرة تسمى توقيع البروتين. لكي يكون المؤشر الحيوي أو التوقيع البروتيني مفيدًا كمرشح للفحص المبكر والكشف عن السرطان، يجب إفرازه في سوائل الجسم مثل العرق أو الدم أو البول، حتى يمكن إجراء فحوصات واسعة النطاق بطريقة غير جراحية. المشكلة الحالية في استخدام المؤشرات الحيوية للكشف المبكر عن السرطان هي ارتفاع معدل النتائج السلبية الكاذبة. النتيجة السلبية الكاذبة هي نتيجة اختبار سلبية كان يجب أن تكون إيجابية. بعبارة أخرى، لا يتم اكتشاف العديد من حالات السرطان، مما يجعل المؤشرات الحيوية غير موثوقة. بعض الأمثلة على المؤشرات الحيوية البروتينية المستخدمة في الكشف عن السرطان هي CA-125 لسرطان المبيض و PSA لسرطان البروستاتا. قد تكون بصمات البروتين أكثر موثوقية من المؤشرات الحيوية للكشف عن الخلايا السرطانية. تُستخدم البروتيوميات أيضًا لتطوير خطط العلاج الفردية، والتي تتضمن التنبؤ بما إذا كان الفرد سيستجيب لأدوية معينة أم لا والآثار الجانبية التي قد يتعرض لها الفرد. يتم استخدام البروتيوميات أيضًا للتنبؤ بإمكانية تكرار المرض.

قام المعهد الوطني للسرطان بتطوير برامج لتحسين اكتشاف وعلاج السرطان. تعد التقنيات البروتينية السريرية للسرطان وشبكة أبحاث الكشف المبكر جهودًا لتحديد بصمات البروتين الخاصة بأنواع مختلفة من السرطانات. تم تصميم برنامج البروتينات الطبية الحيوية لتحديد بصمات البروتين وتصميم علاجات فعالة لمرضى السرطان.
ملخص
رسم خرائط الجينوم يشبه حل لغز كبير ومعقد مع أجزاء من المعلومات القادمة من المختبرات في جميع أنحاء العالم. توفر الخرائط الجينية مخططًا تفصيليًا لموقع الجينات داخل الجينوم، وهي تقدر المسافة بين الجينات والعلامات الجينية على أساس تردد إعادة التركيب أثناء الانقسام الاختزالي. توفر الخرائط المادية معلومات مفصلة حول المسافة المادية بين الجينات. تتوفر المعلومات الأكثر تفصيلاً من خلال رسم الخرائط التسلسلية. يتم دمج المعلومات من جميع مصادر رسم الخرائط والتسلسل لدراسة الجينوم بأكمله.
التسلسل الجيني الكامل هو أحدث مورد متاح لعلاج الأمراض الوراثية. يستخدم بعض الأطباء تسلسل الجينوم الكامل لإنقاذ الأرواح. يحتوي علم الجينوم على العديد من التطبيقات الصناعية، بما في ذلك تطوير الوقود الحيوي والزراعة والأدوية ومكافحة التلوث.
الخيال هو العائق الوحيد أمام تطبيق علم الجينوم. يتم تطبيق علم الجينوم في معظم مجالات علم الأحياء؛ يمكن استخدامه للطب الشخصي، والتنبؤ بمخاطر الأمراض على المستوى الفردي، ودراسة التفاعلات الدوائية قبل إجراء التجارب السريرية، ودراسة الكائنات الحية الدقيقة في البيئة بدلاً من المختبر. كما يتم تطبيقه على توليد الوقود الحيوي الجديد، وتقييم الأنساب باستخدام الميتوكوندريا، والتقدم في علم الطب الشرعي، والتحسينات في الزراعة.
علم البروتينات هو دراسة المجموعة الكاملة من البروتينات التي يعبر عنها نوع معين من الخلايا في ظل ظروف بيئية معينة. في الكائن الحي متعدد الخلايا، ستحتوي أنواع الخلايا المختلفة على بروتينات مختلفة، وستختلف هذه البروتينات مع التغيرات في البيئة. على عكس الجينوم، يكون البروتين ديناميكيًا ويخضع لتدفق مستمر، مما يجعله أكثر تعقيدًا وأكثر فائدة من معرفة الجينوم وحده.
مسرد المصطلحات
- المؤشرات الحيوية
- بروتين فردي يتم إنتاجه بشكل فريد في حالة مرضية
- خريطة جينية
- مخطط تفصيلي للجينات وموقعها على الكروموسوم الذي يعتمد على ترددات إعادة التركيب بين العلامات
- علم الجينوم
- دراسة الجينوم بأكمله، بما في ذلك المجموعة الكاملة من الجينات، وتسلسل النوكليوتيدات وتنظيمها، وتفاعلاتها داخل الأنواع ومع الأنواع الأخرى
- الميتاجينوميكس
- دراسة الجينومات الجماعية لأنواع متعددة تنمو وتتفاعل في مكانة بيئية
- كائن حي نموذجي
- نوع تمت دراسته واستخدامه كنموذج لفهم العمليات البيولوجية في الأنواع الأخرى التي يمثلها الكائن الحي النموذجي
- علم الجينوم الدوائي
- دراسة التفاعلات الدوائية مع الجينوم أو البروتيوم؛ وتسمى أيضًا علم السموم
- الخريطة المادية
- تمثيل المسافة المادية بين الجينات أو العلامات الجينية
- توقيع البروتين
- مجموعة من البروتينات الزائدة أو الناقصة التي تميز الخلايا في نسيج مريض معين
- علم البروتيوميات
- دراسة وظيفة البروتينات
- تسلسل جينوم كامل
- عملية تحدد تسلسل النوكليوتيدات للجينوم بأكمله


