10.3: التحكم في دورة الخلية
- Page ID
- 196400
مهارات التطوير
- افهم كيف يتم التحكم في دورة الخلية من خلال آليات داخلية وخارجية للخلية
- اشرح كيف تحدث نقاط التفتيش الثلاث للرقابة الداخلية في نهاية G 1، وعند انتقال G 2/M، وأثناء المرحلة الوصفية
- وصف الجزيئات التي تتحكم في دورة الخلية من خلال التنظيم الإيجابي والسلبي
طول دورة الخلية متغير للغاية، حتى داخل خلايا كائن حي واحد. في البشر، يتراوح تكرار دوران الخلايا من بضع ساعات في التطور الجنيني المبكر، إلى متوسط من يومين إلى خمسة أيام للخلايا الظهارية، وإلى عمر الإنسان بأكمله الذي تقضيه في G 0 بواسطة الخلايا المتخصصة، مثل الخلايا العصبية القشرية أو خلايا عضلة القلب. هناك أيضًا اختلاف في الوقت الذي تقضيه الخلية في كل مرحلة من مراحل دورة الخلية. عندما تنمو خلايا الثدييات سريعة الانقسام في الثقافة (خارج الجسم في ظل ظروف النمو المثلى)، يبلغ طول الدورة حوالي 24 ساعة. في حالة الانقسام السريع للخلايا البشرية مع دورة خلية مدتها 24 ساعة، تستمر المرحلة G 1 حوالي تسع ساعات، وتستمر المرحلة S لمدة 10 ساعات، وتستمر مرحلة G 2 حوالي أربع ساعات ونصف، وتستمر المرحلة M حوالي نصف ساعة. في الأجنة المبكرة لذباب الفاكهة، تكتمل دورة الخلية في حوالي ثماني دقائق. يتم التحكم في توقيت الأحداث في دورة الخلية من خلال آليات داخلية وخارجية للخلية.
تنظيم دورة الخلية من خلال الأحداث الخارجية
يتم تشغيل كل من بدء انقسام الخلايا وتثبيطه بسبب أحداث خارجية للخلية عندما تكون على وشك بدء عملية النسخ المتماثل. قد يكون الحدث بسيطًا مثل موت خلية قريبة أو كاسحًا مثل إطلاق الهرمونات المعززة للنمو، مثل هرمون النمو البشري (HGH). يمكن أن يمنع نقص هرمون النمو انقسام الخلايا، مما يؤدي إلى التقزم، في حين أن الكثير من هرمون النمو يمكن أن يؤدي إلى العملاق. يمكن أن يؤدي ازدحام الخلايا أيضًا إلى منع انقسام الخلايا. هناك عامل آخر يمكن أن يؤدي إلى انقسام الخلية وهو حجم الخلية؛ ومع نمو الخلية، تصبح غير فعالة بسبب انخفاض نسبة سطح إلى حجم. الحل لهذه المشكلة هو الانقسام.
مهما كان مصدر الرسالة، تستقبل الخلية الإشارة، وتسمح سلسلة من الأحداث داخل الخلية بالانتقال إلى الطور البيني. عند الانتقال من نقطة البدء هذه، يجب استيفاء كل معلمة مطلوبة خلال كل مرحلة من مراحل دورة الخلية وإلا لن تتمكن الدورة من التقدم.
التنظيم عند نقاط التفتيش الداخلية
من الضروري أن تكون الخلايا البنت المنتجة نسخًا مكررة تمامًا من الخلية الأم. تؤدي الأخطاء في تكرار الكروموسومات أو توزيعها إلى طفرات قد تنتقل إلى كل خلية جديدة تنتج من خلية غير طبيعية. لمنع الخلية المخترقة من الاستمرار في الانقسام، هناك آليات رقابة داخلية تعمل في ثلاث نقاط تفتيش رئيسية لدورة الخلية. نقطة التفتيش هي واحدة من عدة نقاط في دورة الخلية حقيقية النواة حيث يمكن إيقاف تقدم الخلية إلى المرحلة التالية من الدورة حتى تصبح الظروف مواتية. تحدث نقاط التفتيش هذه بالقرب من نهاية G 1، عند انتقال G 2/M، وأثناء المرحلة الوصفية (الشكل\(\PageIndex{1}\)).
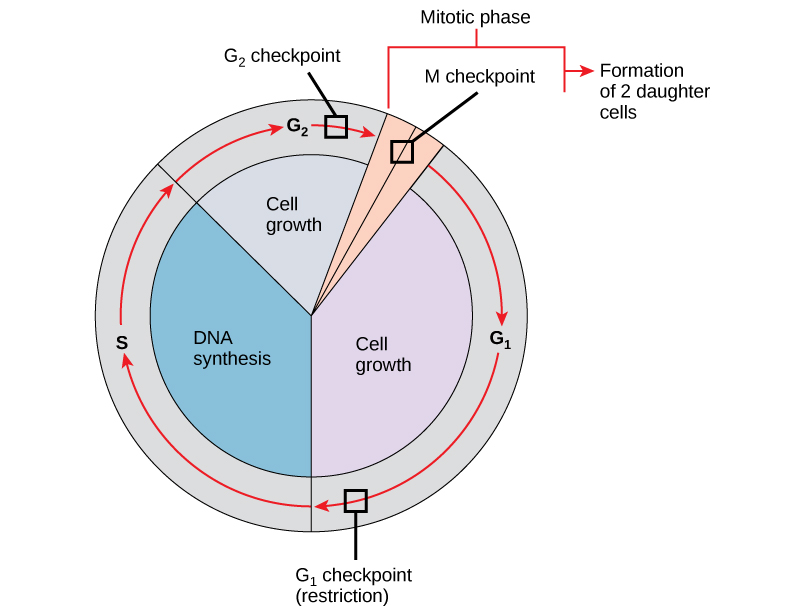
نقطة تفتيش جي 1
تحدد نقطة تفتيش G 1 ما إذا كانت جميع الشروط مواتية للمضي قدمًا في تقسيم الخلايا. نقطة تفتيش G 1، والتي تسمى أيضًا نقطة التقييد (في الخميرة)، هي نقطة تلتزم فيها الخلية بشكل لا رجعة فيه بعملية انقسام الخلايا. تلعب التأثيرات الخارجية، مثل عوامل النمو، دورًا كبيرًا في حمل الخلية عبر نقطة تفتيش G 1. بالإضافة إلى الاحتياطيات الكافية وحجم الخلية، هناك فحص لتلف الحمض النووي الجيني في نقطة تفتيش G 1. لن يُسمح للخلية التي لا تلبي جميع المتطلبات بالتقدم إلى المرحلة S. يمكن للخلية إيقاف الدورة ومحاولة علاج الحالة الإشكالية، أو يمكن للخلية التقدم إلى G 0 وانتظار المزيد من الإشارات عندما تتحسن الظروف.
نقطة تفتيش جي 2
تمنع نقطة تفتيش G 2 الدخول إلى المرحلة الانقسامية إذا لم يتم استيفاء شروط معينة. كما هو الحال في نقطة تفتيش G 1، يتم تقييم حجم الخلية واحتياطيات البروتين. ومع ذلك، فإن الدور الأكثر أهمية لنقطة تفتيش G 2 هو ضمان تكرار جميع الكروموسومات وعدم تلف الحمض النووي المنسوخ. إذا كشفت آليات نقطة التفتيش عن مشاكل في الحمض النووي، تتوقف دورة الخلية، وتحاول الخلية إما إكمال نسخ الحمض النووي أو إصلاح الحمض النووي التالف.
نقطة تفتيش إم
تقع نقطة التفتيش M بالقرب من نهاية مرحلة الميتافيز من تكوين النواة. تُعرف نقطة التفتيش M أيضًا باسم نقطة تفتيش المغزل، لأنها تحدد ما إذا كانت جميع الكروماتيدات الشقيقة متصلة بشكل صحيح بالأنابيب الدقيقة للمغزل. نظرًا لأن فصل الكروماتيدات الشقيقة أثناء مرحلة ما يعد خطوة لا رجعة فيها، فلن تستمر الدورة حتى يتم تثبيت الأعمال الحركية لكل زوج من الكروماتيدات الشقيقة بقوة على اثنين على الأقل من ألياف المغزل الناشئة عن القطبين المتقابلين للخلية.
رابط التعلم

شاهد ما يحدث عند نقاط التفتيش G 1 و G 2 و M من خلال زيارة موقع الويب هذا لمشاهدة رسم متحرك لدورة الخلية.
الجزيئات المنظمة لدورة الخلية
بالإضافة إلى نقاط التفتيش التي يتم التحكم فيها داخليًا، هناك مجموعتان من الجزيئات داخل الخلايا التي تنظم دورة الخلية. تعمل هذه الجزيئات التنظيمية إما على تعزيز تقدم الخلية إلى المرحلة التالية (التنظيم الإيجابي) أو إيقاف الدورة (التنظيم السلبي). قد تعمل جزيئات المنظم بشكل فردي، أو يمكن أن تؤثر على نشاط أو إنتاج البروتينات التنظيمية الأخرى. لذلك، قد لا يكون لفشل منظم واحد أي تأثير تقريبًا على دورة الخلية، خاصة إذا كانت هناك أكثر من آلية تتحكم في نفس الحدث. على العكس من ذلك، يمكن أن يكون تأثير المنظم الناقص أو غير العامل واسع النطاق وربما مميتًا للخلية إذا تأثرت عمليات متعددة.
التنظيم الإيجابي لدورة الخلية
مجموعتان من البروتينات، تسمى السيكلينات والكينازات المعتمدة على السيكلين (Cdks)، مسؤولتان عن تقدم الخلية عبر نقاط التفتيش المختلفة. تتقلب مستويات بروتينات السيكلين الأربعة طوال دورة الخلية بنمط يمكن التنبؤ به (الشكل 1)\(\PageIndex{2}\)). Increases in the concentration of cyclin proteins are triggered by both external and internal signals. After the cell moves to the next stage of the cell cycle, the cyclins that were active in the previous stage are degraded.
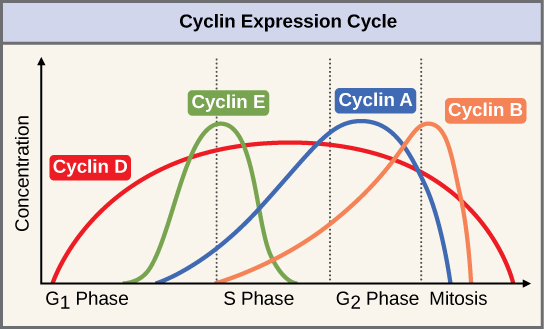
Cyclins regulate the cell cycle only when they are tightly bound to Cdks. To be fully active, the Cdk/cyclin complex must also be phosphorylated in specific locations. Like all kinases, Cdks are enzymes (kinases) that phosphorylate other proteins. Phosphorylation activates the protein by changing its shape. The proteins phosphorylated by Cdks are involved in advancing the cell to the next phase. (Figure \(\PageIndex{3}\)). The levels of Cdk proteins are relatively stable throughout the cell cycle; however, the concentrations of cyclin fluctuate and determine when Cdk/cyclin complexes form. The different cyclins and Cdks bind at specific points in the cell cycle and thus regulate different checkpoints.
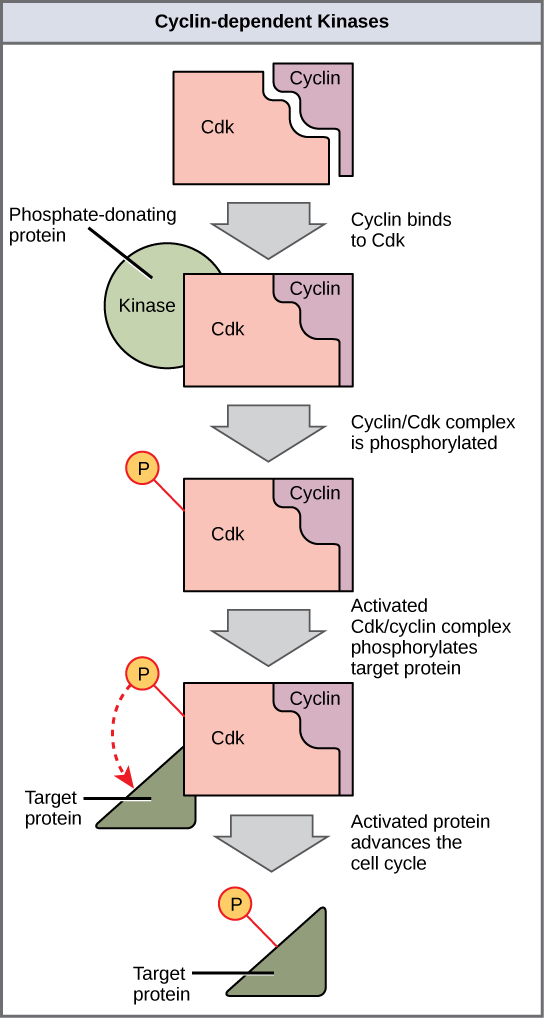
Since the cyclic fluctuations of cyclin levels are based on the timing of the cell cycle and not on specific events, regulation of the cell cycle usually occurs by either the Cdk molecules alone or the Cdk/cyclin complexes. Without a specific concentration of fully activated cyclin/Cdk complexes, the cell cycle cannot proceed through the checkpoints.
Although the cyclins are the main regulatory molecules that determine the forward momentum of the cell cycle, there are several other mechanisms that fine-tune the progress of the cycle with negative, rather than positive, effects. These mechanisms essentially block the progression of the cell cycle until problematic conditions are resolved. Molecules that prevent the full activation of Cdks are called Cdk inhibitors. Many of these inhibitor molecules directly or indirectly monitor a particular cell cycle event. The block placed on Cdks by inhibitor molecules will not be removed until the specific event that the inhibitor monitors is completed.
Negative Regulation of the Cell Cycle
The second group of cell cycle regulatory molecules are negative regulators. Negative regulators halt the cell cycle. Remember that in positive regulation, active molecules cause the cycle to progress.
The best understood negative regulatory molecules are retinoblastoma protein (Rb), p53, and p21. Retinoblastoma proteins are a group of tumor-suppressor proteins common in many cells. The 53 and 21 designations refer to the functional molecular masses of the proteins (p) in kilodaltons. Much of what is known about cell cycle regulation comes from research conducted with cells that have lost regulatory control. All three of these regulatory proteins were discovered to be damaged or non-functional in cells that had begun to replicate uncontrollably (became cancerous). In each case, the main cause of the unchecked progress through the cell cycle was a faulty copy of the regulatory protein.
Rb, p53, and p21 act primarily at the G1 checkpoint. p53 is a multi-functional protein that has a major impact on the commitment of a cell to division because it acts when there is damaged DNA in cells that are undergoing the preparatory processes during G1. If damaged DNA is detected, p53 halts the cell cycle and recruits enzymes to repair the DNA. If the DNA cannot be repaired, p53 can trigger apoptosis, or cell suicide, to prevent the duplication of damaged chromosomes. As p53 levels rise, the production of p21 is triggered. p21 enforces the halt in the cycle dictated by p53 by binding to and inhibiting the activity of the Cdk/cyclin complexes. As a cell is exposed to more stress, higher levels of p53 and p21 accumulate, making it less likely that the cell will move into the S phase.
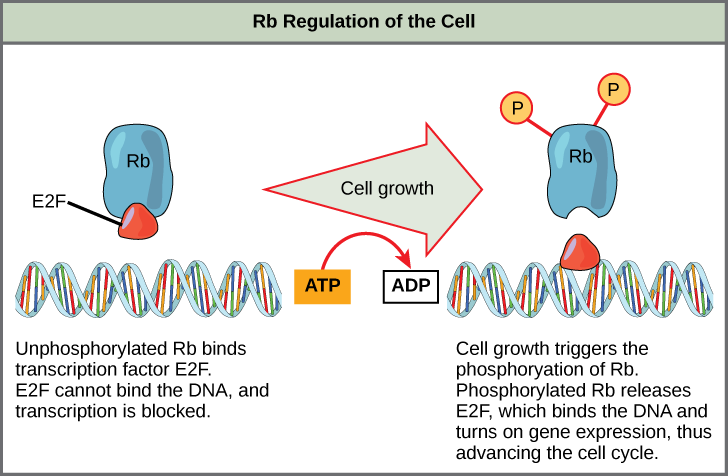
Rb exerts its regulatory influence on other positive regulator proteins. Chiefly, Rb monitors cell size. In the active, dephosphorylated state, Rb binds to proteins called transcription factors, most commonly, E2F (Figure \(\PageIndex{4}\)). Transcription factors “turn on” specific genes, allowing the production of proteins encoded by that gene. When Rb is bound to E2F, production of proteins necessary for the G1/S transition is blocked. As the cell increases in size, Rb is slowly phosphorylated until it becomes inactivated. Rb releases E2F, which can now turn on the gene that produces the transition protein, and this particular block is removed. For the cell to move past each of the checkpoints, all positive regulators must be “turned on,” and all negative regulators must be “turned off.”
Exercise \(\PageIndex{1}\)
Rb and other proteins that negatively regulate the cell cycle are sometimes called tumor suppressors. Why do you think the name tumor suppressor might be appropriate for these proteins?
- Answer
-
Rb and other negative regulatory proteins control cell division and therefore prevent the formation of tumors. Mutations that prevent these proteins from carrying out their function can result in cancer.
Summary
Each step of the cell cycle is monitored by internal controls called checkpoints. There are three major checkpoints in the cell cycle: one near the end of G1, a second at the G2/M transition, and the third during metaphase. Positive regulator molecules allow the cell cycle to advance to the next stage. Negative regulator molecules monitor cellular conditions and can halt the cycle until specific requirements are met.
Glossary
- cell cycle checkpoint
- mechanism that monitors the preparedness of a eukaryotic cell to advance through the various cell cycle stages
- cyclin
- one of a group of proteins that act in conjunction with cyclin-dependent kinases to help regulate the cell cycle by phosphorylating key proteins; the concentrations of cyclins fluctuate throughout the cell cycle
- cyclin-dependent kinase
- one of a group of protein kinases that helps to regulate the cell cycle when bound to cyclin; it functions to phosphorylate other proteins that are either activated or inactivated by phosphorylation
- p21
- cell cycle regulatory protein that inhibits the cell cycle; its levels are controlled by p53
- p53
- cell cycle regulatory protein that regulates cell growth and monitors DNA damage; it halts the progression of the cell cycle in cases of DNA damage and may induce apoptosis
- retinoblastoma protein (Rb)
- regulatory molecule that exhibits negative effects on the cell cycle by interacting with a transcription factor (E2F)


