9.3: الاستجابة للإشارة
- Page ID
- 196422
المهارات اللازمة للتطوير
- وصف كيفية توجيه مسارات الإشارات للتعبير عن البروتين والتمثيل الغذائي الخلوي ونمو الخلايا
- حدد وظيفة PKC في مسارات نقل الإشارة
- التعرف على دور موت الخلايا المبرمج في تطوير وصيانة كائن حي صحي
داخل الخلية، ترتبط الأربطة بمستقبلاتها الداخلية، مما يسمح لها بالتأثير بشكل مباشر على الحمض النووي للخلية وآلات إنتاج البروتين. باستخدام مسارات نقل الإشارة، تنتج المستقبلات في غشاء البلازما مجموعة متنوعة من التأثيرات على الخلية. تتنوع نتائج مسارات الإشارات بشكل كبير وتعتمد على نوع الخلية المعنية وكذلك الظروف الخارجية والداخلية. يتم وصف عينة صغيرة من الردود أدناه.
التعبير الجيني
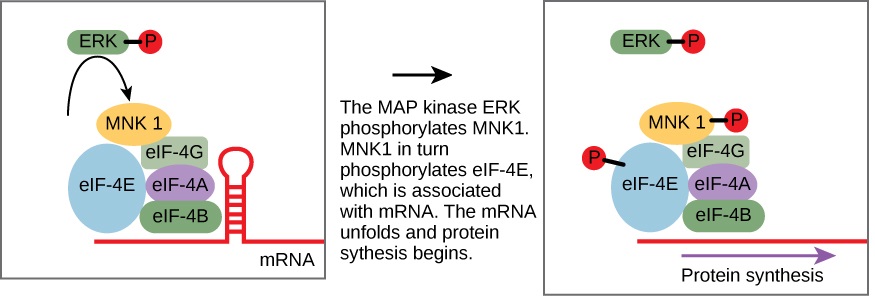
تنظم بعض مسارات نقل الإشارة نسخ الحمض النووي الريبي. ينظم البعض الآخر ترجمة البروتينات من mRNA. مثال على البروتين الذي ينظم الترجمة في النواة هو MAP kinase ERK. يتم تنشيط ERK في سلسلة الفسفرة عندما يربط عامل نمو البشرة (EGF) مستقبلات EGF (انظر الشكل 9.2.1). عند الفسفرة، يدخل ERK النواة وينشط كيناز البروتين الذي ينظم بدوره ترجمة البروتين (الشكل\(\PageIndex{1}\)).
النوع الثاني من البروتين الذي يمكن أن يتفاعل معه PKC هو بروتين يعمل كمثبط. المثبط هو جزيء يرتبط بالبروتين ويمنعه من العمل أو يقلل من وظيفته. في هذه الحالة، يكون المانع عبارة عن بروتين يسمى I-B، والذي يرتبط بالبروتين التنظيمي NF-b. (يمثل الرمز الحرف اليوناني kappa.) عندما يكون I-B مرتبطًا بـ nf-b، لا يمكن للمركب أن يدخل نواة الخلية، ولكن عندما يتم فوسفور I-B بواسطة PKC، لم يعد بإمكانه ربط NF-b، ويمكن لـ NF-b (عامل النسخ) دخول النواة وبدء نسخ الحمض النووي الريبي. في هذه الحالة، يكون تأثير الفسفرة هو تعطيل المثبط وبالتالي تنشيط عملية النسخ.
زيادة في التمثيل الغذائي الخلوي
تؤثر نتيجة مسار إشارة آخر على خلايا العضلات. يؤدي تنشيط مستقبلات بيتا الأدرينالية في خلايا العضلات بواسطة الأدرينالين إلى زيادة AMP الدوري (CamP) داخل الخلية. الأدرينالين، المعروف أيضًا باسم الإيبينيفرين، هو هرمون (تنتجه الغدة الكظرية المرتبطة بالكلية) يجهز الجسم لحالات الطوارئ قصيرة المدى. ينشط AMP الدوري PKA (بروتين كيناز A)، والذي بدوره يفسد إنزيمين. يعزز الإنزيم الأول تحلل الجليكوجين عن طريق تنشيط كيناز فوسفوريلاز الجليكوجين المتوسط (GPK) الذي بدوره ينشط فوسفوريلاز الجليكوجين (GP) الذي يحول الجليكوجين إلى جلوكوز. (تذكر أن جسمك يحول الجلوكوز الزائد إلى جليكوجين لتخزينه على المدى القصير. عند الحاجة إلى الطاقة، يتم إعادة تحويل الجليكوجين بسرعة إلى جلوكوز.) تثبط فسفرة الإنزيم الثاني، سينثاز الجليكوجين (GS)، قدرته على تكوين الجليكوجين من الجلوكوز. بهذه الطريقة، تحصل الخلية العضلية على مجموعة جاهزة من الجلوكوز عن طريق تنشيط تكوينها عن طريق تحلل الجليكوجين وتثبيط استخدام الجلوكوز لتكوين الجليكوجين، وبالتالي منع دورة غير مجدية من تحلل الجليكوجين وتوليفه. بعد ذلك يصبح الجلوكوز متاحًا للاستخدام من قبل خلية العضلات استجابة للارتفاع المفاجئ في الأدرينالين - منعكس «القتال أو الطيران».
نمو الخلايا
تلعب مسارات إشارات الخلايا أيضًا دورًا رئيسيًا في انقسام الخلايا. لا تنقسم الخلايا عادة ما لم يتم تحفيزها بإشارات من خلايا أخرى. تسمى الروابط التي تعزز نمو الخلايا بعوامل النمو. ترتبط معظم عوامل النمو بمستقبلات سطح الخلية المرتبطة بكينازات التيروزين. تسمى هذه المستقبلات الموجودة على سطح الخلية باسم كينازات التيروزين المستقبلية (RTKs). يؤدي تنشيط RTK إلى بدء مسار إشارة يتضمن بروتين G يسمى RAS، والذي ينشط مسار MAP kinase الموصوف سابقًا. ثم يحفز إنزيم MAP kinase التعبير عن البروتينات التي تتفاعل مع المكونات الخلوية الأخرى لبدء انقسام الخلايا.
الاتصال الوظيفي: عالم أحياء السرطان
يدرس علماء بيولوجيا السرطان الأصول الجزيئية للسرطان بهدف تطوير طرق الوقاية الجديدة واستراتيجيات العلاج التي من شأنها أن تمنع نمو الأورام دون الإضرار بالخلايا الطبيعية للجسم. كما ذكرنا سابقًا، تتحكم مسارات الإشارات في نمو الخلايا. يتم التحكم في مسارات الإشارات هذه عن طريق بروتينات الإشارة، والتي بدورها يتم التعبير عنها بواسطة الجينات. يمكن أن تؤدي الطفرات في هذه الجينات إلى خلل في بروتينات الإشارة. هذا يمنع الخلية من تنظيم دورة الخلية، مما يؤدي إلى انقسام الخلايا غير المقيد والسرطان. الجينات التي تنظم بروتينات الإشارة هي نوع واحد من الجينات الورمية وهو جين لديه القدرة على التسبب في السرطان. الجين الذي يشفر RAS هو جين سرطاني تم اكتشافه في الأصل عندما ارتبطت الطفرات في بروتين RAS بالسرطان. أشارت دراسات أخرى إلى أن 30 بالمائة من الخلايا السرطانية لديها طفرة في جين RAS تؤدي إلى نمو غير متحكم فيه. يمكن أن يؤدي الانقسام الخلوي غير المنضبط، إذا تُرك دون رقابة، إلى تكوين الورم والنقائل، ونمو الخلايا السرطانية في مواقع جديدة في الجسم.
تمكن علماء بيولوجيا السرطان من تحديد العديد من الجينات الورمية الأخرى التي تساهم في تطور السرطان. على سبيل المثال، HER2 هو مستقبل سطح الخلية الموجود بكميات كبيرة في 20 بالمائة من سرطانات الثدي البشرية. أدرك علماء بيولوجيا السرطان أن تكرار الجينات أدى إلى فرط التعبير HER2 في 25 بالمائة من مرضى سرطان الثدي وطوروا دواءً يسمى Herceptin (trastuzumab). Herceptin هو جسم مضاد أحادي النسيلة يستهدف HER2 لإزالته بواسطة جهاز المناعة. يساعد علاج Herceptin على التحكم في الإشارات من خلال HER2. ساعد استخدام هيرسيبتين مع العلاج الكيميائي على زيادة معدل البقاء الإجمالي لمرضى سرطان الثدي النقيلي.
موت الخلايا
عندما تكون الخلية تالفة أو زائدة عن الحاجة أو يحتمل أن تكون خطرة على كائن حي، يمكن للخلية أن تبدأ آلية لتحفيز موت الخلايا المبرمج أو موت الخلايا المبرمج. يسمح موت الخلايا المبرمج للخلية بالموت بطريقة خاضعة للرقابة تمنع إطلاق الجزيئات الضارة المحتملة من داخل الخلية. هناك العديد من نقاط التفتيش الداخلية التي تراقب صحة الخلية؛ إذا لوحظت تشوهات، يمكن للخلية أن تبدأ تلقائيًا عملية موت الخلايا المبرمج. ومع ذلك، في بعض الحالات، مثل العدوى الفيروسية أو الانقسام الخلوي غير المنضبط بسبب السرطان، تفشل الضوابط والتوازنات الطبيعية للخلية. يمكن أن تؤدي الإشارات الخارجية أيضًا إلى بدء موت الخلايا المبرمج. على سبيل المثال، تحتوي معظم الخلايا الحيوانية الطبيعية على مستقبلات تتفاعل مع المصفوفة خارج الخلية، وهي شبكة من البروتينات السكرية التي توفر الدعم الهيكلي للخلايا في الكائن الحي. يؤدي ربط المستقبلات الخلوية بالمصفوفة خارج الخلية إلى بدء سلسلة إشارات داخل الخلية. ومع ذلك، إذا ابتعدت الخلية عن المصفوفة خارج الخلية، تتوقف الإشارة، وتخضع الخلية لموت الخلايا المبرمج. يمنع هذا النظام الخلايا من الانتقال عبر الجسم والتكاثر خارج نطاق السيطرة، كما يحدث مع الخلايا السرطانية التي تنتقل.
مثال آخر للإشارات الخارجية التي تؤدي إلى موت الخلايا المبرمج يحدث في تطوير الخلايا التائية. الخلايا التائية هي خلايا مناعية ترتبط بالجزيئات الكبيرة والجسيمات الأجنبية، وتستهدفها للتدمير بواسطة جهاز المناعة. في العادة، لا تستهدف الخلايا التائية البروتينات «الذاتية» (تلك الخاصة بالكائن الحي الخاص بها)، وهي عملية يمكن أن تؤدي إلى أمراض المناعة الذاتية. من أجل تطوير القدرة على التمييز بين الذات وغير الذاتية، تخضع الخلايا التائية غير الناضجة للفحص لتحديد ما إذا كانت مرتبطة بما يسمى البروتينات الذاتية. إذا ارتبط مستقبل الخلايا التائية بالبروتينات الذاتية، تبدأ الخلية في موت الخلايا المبرمج لإزالة الخلية التي يحتمل أن تكون خطرة.
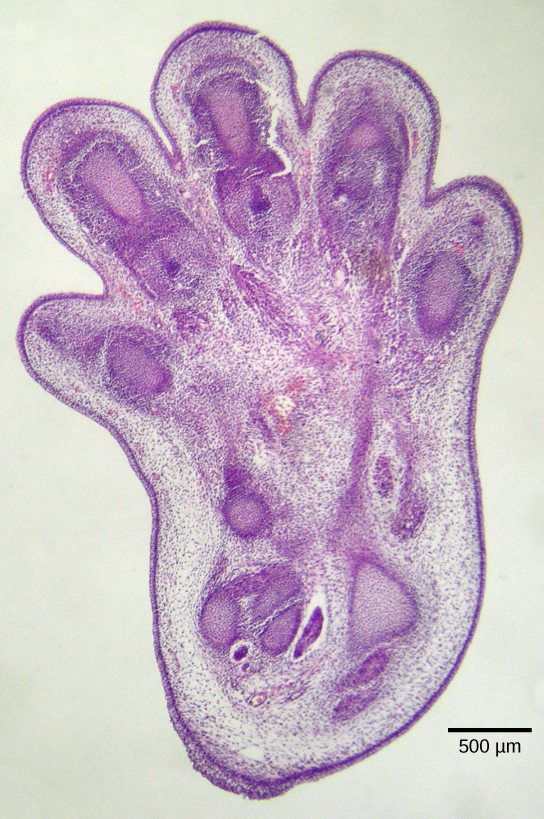
موت الخلايا المبرمج ضروري أيضًا للتطور الجنيني الطبيعي. في الفقاريات، على سبيل المثال، تشمل المراحل المبكرة من التطور تكوين أنسجة تشبه الويب بين أصابع وأصابع القدم الفردية (الشكل\(\PageIndex{2}\)). أثناء التطور الطبيعي، يجب التخلص من هذه الخلايا غير الضرورية، مما يتيح تكوين أصابع وأصابع القدم المنفصلة تمامًا. تؤدي آلية إشارات الخلايا إلى موت الخلايا المبرمج، الذي يدمر الخلايا بين الأرقام النامية.
إنهاء سلسلة الإشارة
تُعد الإشارة الشاذة التي تظهر غالبًا في الخلايا السرطانية دليلًا على أن إنهاء الإشارة في الوقت المناسب يمكن أن يكون بنفس أهمية بدء الإشارة. تتمثل إحدى طرق إيقاف إشارة معينة في تحلل الليجاند أو إزالته بحيث لا يعود بإمكانه الوصول إلى مستقبلاته. أحد الأسباب التي تجعل الهرمونات الكارهة للماء مثل الإستروجين والتستوستيرون تؤدي إلى أحداث طويلة الأمد هو أنها تربط البروتينات الحاملة. تسمح هذه البروتينات للجزيئات غير القابلة للذوبان بأن تكون قابلة للذوبان في الدم، ولكنها أيضًا تحمي الهرمونات من التحلل عن طريق الإنزيمات المتداولة.
داخل الخلية، تقوم العديد من الإنزيمات المختلفة بعكس التعديلات الخلوية الناتجة عن سلاسل الإشارات. على سبيل المثال، الفوسفاتاز عبارة عن إنزيمات تزيل مجموعة الفوسفات المرتبطة بالبروتينات بواسطة الكينازات في عملية تسمى إزالة الفسفور. يتحلل AMP الدوري (CamP) إلى AMP بواسطة فوسفوديستراز، ويتم عكس إطلاق مخازن الكالسيوم بواسطة مضخات Ca 2+ الموجودة في الأغشية الخارجية والداخلية للخلية.
ملخص
إن بدء مسار الإشارة هو استجابة للمحفزات الخارجية. يمكن أن تتخذ هذه الاستجابة العديد من الأشكال المختلفة، بما في ذلك تخليق البروتين، وتغيير التمثيل الغذائي للخلية، ونمو الخلايا، أو حتى موت الخلايا. تؤثر العديد من المسارات على الخلية من خلال بدء التعبير الجيني، والطرق المستخدمة كثيرة جدًا. تقوم بعض المسارات بتنشيط الإنزيمات التي تتفاعل مع عوامل نسخ الحمض النووي. يقوم البعض الآخر بتعديل البروتينات وحثها على تغيير موقعها في الخلية. اعتمادًا على حالة الكائن الحي، يمكن للخلايا الاستجابة عن طريق تخزين الطاقة على شكل جليكوجين أو دهون، أو إتاحتها في شكل جلوكوز. يسمح مسار نقل الإشارة لخلايا العضلات بالاستجابة للمتطلبات الفورية للطاقة في شكل جلوكوز. يتم تحفيز نمو الخلايا دائمًا عن طريق إشارات خارجية تسمى عوامل النمو. يؤدي نمو الخلايا غير المنضبط إلى الإصابة بالسرطان، وغالبًا ما توجد طفرات في الجينات التي ترمز إلى مكونات البروتين في مسارات الإشارة في خلايا الورم. يعد موت الخلايا المبرمج، أو موت الخلايا المبرمج، مهمًا لإزالة الخلايا التالفة أو غير الضرورية. يضمن استخدام الإشارات الخلوية لتنظيم تفكيك الخلية عدم إطلاق الجزيئات الضارة من السيتوبلازم في الفراغات بين الخلايا، لأنها في حالة موت ونخر غير متحكم فيه. يضمن موت الخلايا المبرمج أيضًا إعادة التدوير الفعال لمكونات الخلية الميتة. يعد إنهاء سلسلة الإشارات الخلوية أمرًا مهمًا للغاية بحيث تكون الاستجابة للإشارة مناسبة من حيث التوقيت والشدة. يعد تحلل جزيئات الإشارة وإزالة الفسفرة من المواد الوسيطة الفوسفورية في المسار بواسطة الفوسفاتاز طريقتين لإنهاء الإشارات داخل الخلية.
مسرد المصطلحات
- موت الخلايا المبرمج
- موت الخلايا المبرمج
- عامل النمو
- الليغند الذي يرتبط بمستقبلات سطح الخلية ويحفز نمو الخلايا
- مثبط
- جزيء يرتبط بالبروتين (عادة ما يكون إنزيمًا) ويمنعه من العمل
- الفوسفاتيز
- إنزيم يزيل مجموعة الفوسفات من جزيء تم تفسفه سابقًا
- فسفوديستراس
- الإنزيم الذي يحط من قدر CamP، وينتج AMP، لإنهاء إرسال الإشارات


