6.5: الإنزيمات
- Page ID
- 196318
المهارات اللازمة للتطوير
- وصف دور الإنزيمات في مسارات التمثيل الغذائي
- شرح كيفية عمل الإنزيمات كمحفزات جزيئية
- ناقش تنظيم الإنزيمات من خلال عوامل مختلفة
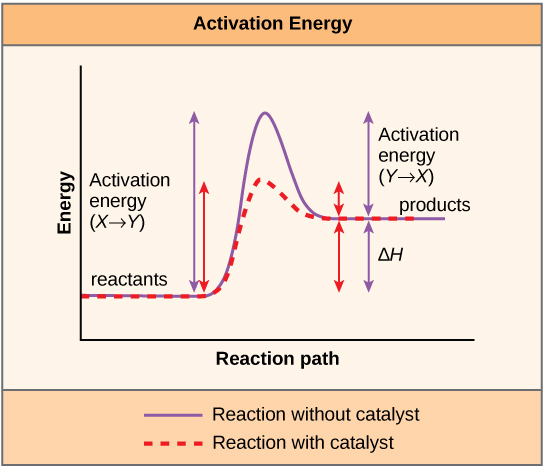
المادة التي تساعد على حدوث تفاعل كيميائي هي محفز، والجزيئات الخاصة التي تحفز التفاعلات الكيميائية الحيوية تسمى الإنزيمات. جميع الإنزيمات تقريبًا عبارة عن بروتينات تتكون من سلاسل من الأحماض الأمينية، وتؤدي المهمة الحاسمة المتمثلة في خفض طاقات التنشيط للتفاعلات الكيميائية داخل الخلية. تقوم الإنزيمات بذلك عن طريق الارتباط بالجزيئات المتفاعلة، والاحتفاظ بها بطريقة تجعل عمليات تكسير الروابط الكيميائية وتشكيل الروابط تتم بسهولة أكبر. من المهم أن تتذكر أن الإنزيمات لا تغير G للتفاعل. بعبارة أخرى، لا يتغيّرون ما إذا كان رد الفعل مجهودًا (عفويًا) أم مغنطينيًا. هذا لأنها لا تغير الطاقة الحرة للمفاعلات أو المنتجات. إنها تقلل فقط طاقة التنشيط المطلوبة للوصول إلى الحالة الانتقالية (الشكل\(\PageIndex{1}\)).
موقع الإنزيم النشط وخصوصية الركيزة
المواد المتفاعلة الكيميائية التي يرتبط بها الإنزيم هي ركائز الإنزيم. قد تكون هناك ركيزة واحدة أو أكثر، اعتمادًا على التفاعل الكيميائي المحدد. في بعض التفاعلات، يتم تقسيم الركيزة أحادية التفاعل إلى منتجات متعددة. في حالات أخرى، قد تجتمع ركيزتان معًا لإنشاء جزيء واحد أكبر. قد يدخل اثنان من المتفاعلين أيضًا في التفاعل، حيث يتم تعديل كلاهما، وترك التفاعل كمنتجين. يُطلق على الموقع داخل الإنزيم الذي ترتبط فيه الركيزة اسم الموقع النشط للإنزيم. الموقع النشط هو المكان الذي يحدث فيه «الإجراء»، إذا جاز التعبير. نظرًا لأن الإنزيمات عبارة عن بروتينات، فهناك مزيج فريد من بقايا الأحماض الأمينية (تسمى أيضًا السلاسل الجانبية أو مجموعات R) داخل الموقع النشط. تتميز كل بقايا بخصائص مختلفة. يمكن أن تكون المخلفات كبيرة أو صغيرة، أو حمضية ضعيفة أو أساسية، محبة للماء أو كارهة للماء، أو موجبة أو سالبة الشحنة، أو محايدة. إن المزيج الفريد من بقايا الأحماض الأمينية ومواقعها وتسلسلاتها وهياكلها وخصائصها يخلق بيئة كيميائية محددة للغاية داخل الموقع النشط. هذه البيئة المحددة مناسبة للربط، ولو لفترة وجيزة، بركيزة كيميائية معينة (أو ركائز). نظرًا لهذا التطابق الشبيه بأحجية الصور المقطوعة بين الإنزيم وركائزه الأساسية (التي تتكيف للعثور على أفضل ملاءمة بين الحالة الانتقالية والموقع النشط)، تُعرف الإنزيمات بخصوصيتها. ينتج «الملاءمة الأفضل» عن الشكل وجاذبية المجموعة الوظيفية للأحماض الأمينية إلى الركيزة. يوجد إنزيم متطابق بشكل خاص لكل ركيزة، وبالتالي لكل تفاعل كيميائي؛ ومع ذلك، هناك مرونة أيضًا.
إن حقيقة أن المواقع النشطة مناسبة تمامًا لتوفير ظروف بيئية محددة تعني أيضًا أنها تخضع لتأثيرات البيئة المحلية. صحيح أن زيادة درجة الحرارة البيئية تزيد عمومًا من معدلات التفاعل أو التحفيز بالإنزيم أو غير ذلك. ومع ذلك، فإن زيادة أو خفض درجة الحرارة خارج النطاق الأمثل يمكن أن يؤثر على الروابط الكيميائية داخل الموقع النشط بطريقة تجعلها أقل ملاءمة لربط الركائز. ستؤدي درجات الحرارة المرتفعة في النهاية إلى تغيير طبيعة الإنزيمات، مثل الجزيئات البيولوجية الأخرى، وهي عملية تغير الخصائص الطبيعية للمادة. وبالمثل، يمكن أن يؤثر الرقم الهيدروجيني للبيئة المحلية أيضًا على وظيفة الإنزيم. تحتوي بقايا الأحماض الأمينية في الموقع النشط على خصائصها الحمضية أو الأساسية التي تعتبر مثالية للحفز. هذه البقايا حساسة للتغيرات في درجة الحموضة التي يمكن أن تضعف طريقة ارتباط جزيئات الركيزة. تعتبر الإنزيمات مناسبة لتعمل بشكل أفضل ضمن نطاق معين من الأس الهيدروجيني، وكما هو الحال مع درجة الحرارة، يمكن أن تتسبب قيم الأس الهيدروجيني القصوى (الحمضية أو الأساسية) للبيئة في تغيير طبيعة الإنزيمات.
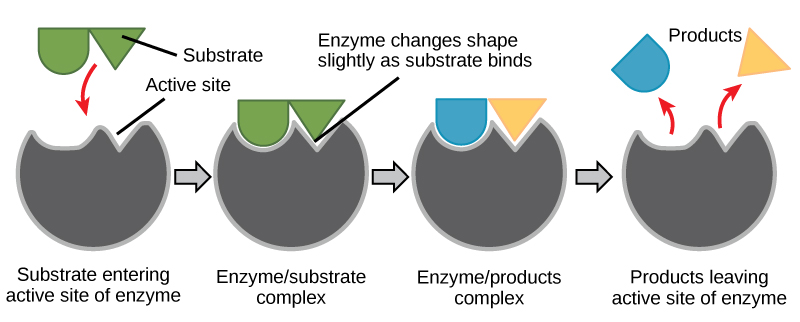
الملاءمة المستحثة ووظيفة الإنزيم
لسنوات عديدة، اعتقد العلماء أن ربط الركيزة الإنزيمية يحدث بطريقة «القفل والمفتاح» البسيطة. أكد هذا النموذج أن الإنزيم والركيزة يتناسبان تمامًا في خطوة فورية واحدة. ومع ذلك، تدعم الأبحاث الحالية وجهة نظر أكثر دقة تسمى الملاءمة المستحثة (الشكل\(\PageIndex{2}\)). يتوسع نموذج الملاءمة المستحثة في نموذج القفل والمفتاح من خلال وصف تفاعل أكثر ديناميكية بين الإنزيم والركيزة. عندما يجتمع الإنزيم والركيزة معًا، يؤدي تفاعلهما إلى تحول طفيف في بنية الإنزيم مما يؤكد ترتيب الربط المثالي بين الإنزيم والحالة الانتقالية للركيزة. يزيد هذا الارتباط المثالي من قدرة الإنزيم على تحفيز تفاعله.
عندما يربط الإنزيم ركيزه، يتشكل مركب ركيزة الإنزيم. يقلل هذا المركب من طاقة تنشيط التفاعل ويعزز تقدمه السريع بإحدى الطرق العديدة. على المستوى الأساسي، تعزز الإنزيمات التفاعلات الكيميائية التي تتضمن أكثر من ركيزة واحدة من خلال جمع الركائز معًا في اتجاه مثالي. يتم وضع المنطقة المناسبة (الذرات والروابط) لجزيء واحد جنبًا إلى جنب مع المنطقة المناسبة من الجزيء الآخر الذي يجب أن يتفاعل معه. هناك طريقة أخرى تعزز بها الإنزيمات تفاعل ركائزها وهي خلق بيئة مثالية داخل الموقع النشط لحدوث التفاعل. قد تستمر بعض التفاعلات الكيميائية بشكل أفضل في بيئة حمضية قليلاً أو غير قطبية. تخلق الخصائص الكيميائية التي تنشأ من الترتيب الخاص لبقايا الأحماض الأمينية داخل موقع نشط بيئة مثالية لركائز الإنزيم المحددة للتفاعل.
لقد تعلمت أن طاقة التنشيط المطلوبة للعديد من التفاعلات تتضمن الطاقة المستخدمة في معالجة الروابط الكيميائية أو تشويهها قليلاً بحيث يمكن كسرها بسهولة والسماح للآخرين بالإصلاح. يمكن للعمل الأنزيمي أن يساعد هذه العملية. يمكن لمجمع الركيزة الأنزيمية أن يخفض طاقة التنشيط عن طريق تحريف جزيئات الركيزة بطريقة تسهل كسر الروابط، مما يساعد على الوصول إلى الحالة الانتقالية. أخيرًا، يمكن للإنزيمات أيضًا خفض طاقات التنشيط من خلال المشاركة في التفاعل الكيميائي نفسه. يمكن أن توفر بقايا الأحماض الأمينية أيونات معينة أو مجموعات كيميائية تشكل بالفعل روابط تساهمية مع جزيئات الركيزة كخطوة ضرورية في عملية التفاعل. في هذه الحالات، من المهم أن تتذكر أن الإنزيم سيعود دائمًا إلى حالته الأصلية عند الانتهاء من التفاعل. تتمثل إحدى الخصائص المميزة للإنزيمات في أنها تظل في النهاية دون تغيير من خلال التفاعلات التي تحفزها. بعد أن ينتهي الإنزيم من تحفيز التفاعل، فإنه يطلق منتجه (منتجاته).
التحكم في التمثيل الغذائي من خلال تنظيم الإنزيمات
قد يبدو من المثالي أن يكون هناك سيناريو تكون فيه جميع الإنزيمات المشفرة في جينوم الكائن الحي موجودة بكميات وفيرة وتعمل على النحو الأمثل في جميع الظروف الخلوية، في جميع الخلايا، في جميع الأوقات. في الواقع، هذا بعيد عن الواقع. تضمن مجموعة متنوعة من الآليات عدم حدوث ذلك. تختلف الاحتياجات والظروف الخلوية من خلية إلى أخرى، وتتغير داخل الخلايا الفردية بمرور الوقت. تختلف الإنزيمات المطلوبة والمتطلبات النشطة لخلايا المعدة عن تلك الموجودة في خلايا تخزين الدهون وخلايا الجلد وخلايا الدم والخلايا العصبية. علاوة على ذلك، تعمل الخلية الهضمية بجهد أكبر لمعالجة العناصر الغذائية وتكسيرها خلال الوقت الذي يتبع الوجبة عن كثب مقارنة بساعات عديدة بعد الوجبة. نظرًا لاختلاف هذه المتطلبات والظروف الخلوية، تختلف أيضًا كميات ووظائف الإنزيمات المختلفة.
نظرًا لأن معدلات التفاعلات البيوكيميائية يتم التحكم فيها عن طريق طاقة التنشيط، وتنخفض الإنزيمات وتحدد طاقات التنشيط للتفاعلات الكيميائية، فإن الكميات النسبية وأداء مجموعة متنوعة من الإنزيمات داخل الخلية تحدد في النهاية التفاعلات التي ستستمر وبأي معدلات. يتم التحكم في هذا التصميم بإحكام. في بعض البيئات الخلوية، يتم التحكم في نشاط الإنزيم جزئيًا بواسطة عوامل بيئية، مثل درجة الحموضة ودرجة الحرارة. هناك آليات أخرى تتحكم الخلايا من خلالها في نشاط الإنزيمات وتحدد معدلات حدوث تفاعلات كيميائية حيوية مختلفة.
تنظيم الإنزيمات بالجزيئات
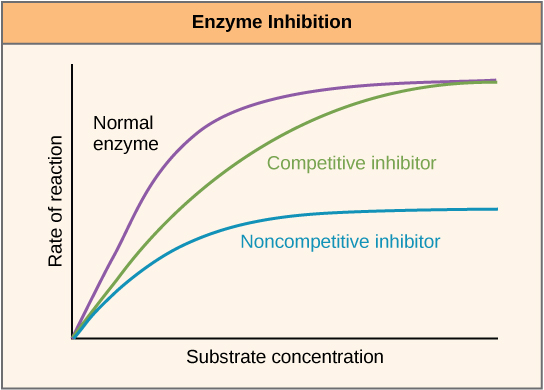
يمكن تنظيم الإنزيمات بطرق تعزز نشاطها أو تقلله. هناك العديد من الأنواع المختلفة من الجزيئات التي تمنع أو تعزز وظيفة الإنزيم، وتوجد آليات مختلفة للقيام بذلك. في بعض حالات تثبيط الإنزيم، على سبيل المثال، يكون الجزيء المثبط مشابهًا بدرجة كافية للركيزة بحيث يمكنه ربطها بالموقع النشط ومنع الركيزة ببساطة من الارتباط. عندما يحدث هذا، يتم تثبيط الإنزيم من خلال التثبيط التنافسي، لأن الجزيء المثبط يتنافس مع الركيزة لربط الموقع النشط (الشكل\(\PageIndex{3}\)). من ناحية أخرى، في حالة التثبيط غير التنافسي، يرتبط الجزيء المثبط بالإنزيم في مكان آخر غير الموقع الألاستيري ولا يزال قادرًا على منع ارتباط الركيزة بالموقع النشط.
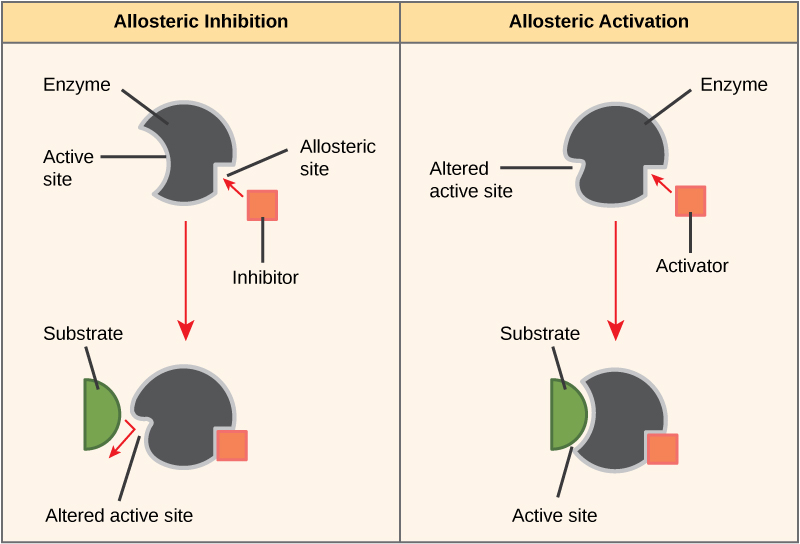
ترتبط بعض الجزيئات المثبطة بالإنزيمات في مكان يؤدي فيه ارتباطها إلى تغيير في التوافق يقلل من تقارب الإنزيم مع الركيزة. هذا النوع من التثبيط يسمى التثبيط الخيطي (الشكل\(\PageIndex{4}\)). تتكون معظم الإنزيمات الخاضعة للتنظيم الخيطي من أكثر من بولي ببتيد واحد، مما يعني أنها تحتوي على أكثر من وحدة فرعية بروتينية. عندما يرتبط مثبط ألوستيريك بإنزيم، يتم تغيير جميع المواقع النشطة على وحدات البروتين الفرعية بشكل طفيف بحيث تربط ركائزها بكفاءة أقل. هناك منشطات ألوستيريك وكذلك مثبطات. ترتبط المنشطات الألوستيرية بالمواقع الموجودة على الإنزيم بعيدًا عن الموقع النشط، مما يؤدي إلى تغيير في التوافق يزيد من تقارب الموقع (المواقع) النشطة للإنزيم مع ركازه (ركائزه).
الاتصال اليومي: اكتشاف الأدوية من خلال البحث عن مثبطات الإنزيمات الرئيسية في مسارات محددة

الإنزيمات هي المكونات الرئيسية لمسارات التمثيل الغذائي. إن فهم كيفية عمل الإنزيمات وكيفية تنظيمها هو مبدأ أساسي وراء تطوير العديد من الأدوية الصيدلانية (الشكل\(\PageIndex{5}\)) في السوق اليوم. يتعاون علماء الأحياء العاملون في هذا المجال مع علماء آخرين، عادة كيميائيين، لتصميم الأدوية.
ضع في اعتبارك الستاتين على سبيل المثال - وهو الاسم الذي يطلق على فئة الأدوية التي تقلل مستويات الكوليسترول. هذه المركبات هي في الأساس مثبطات لإنزيم HMG-CoA reductase. HMG-CoA reductase هو الإنزيم الذي يصنع الكوليسترول من الدهون في الجسم. من خلال تثبيط هذا الإنزيم، يمكن تقليل مستويات الكوليسترول المركب في الجسم. وبالمثل، فإن الأسيتامينوفين، الذي يتم تسويقه شعبيًا تحت اسم العلامة التجارية تايلينول، هو مثبط لإنزيم الأكسدة الحلقية. في حين أنها فعالة في توفير الراحة من الحمى والالتهابات (الألم)، إلا أن آلية عملها لا تزال غير مفهومة تمامًا.
كيف يتم تطوير الأدوية؟ يتمثل أحد التحديات الأولى في تطوير الدواء في تحديد الجزيء المحدد الذي يهدف الدواء إلى استهدافه. في حالة الستاتين، يكون اختزال HMG-CoA هو الدواء المستهدف. يتم تحديد أهداف الأدوية من خلال البحث المضني في المختبر. تحديد الهدف وحده ليس كافيًا؛ يحتاج العلماء أيضًا إلى معرفة كيفية عمل الهدف داخل الخلية وردود الفعل التي تنحرف في حالة المرض. بمجرد تحديد الهدف والمسار، تبدأ العملية الفعلية لتصميم الدواء. خلال هذه المرحلة، يعمل الكيميائيون وعلماء الأحياء معًا لتصميم وتصنيع الجزيئات التي يمكنها إما منع أو تنشيط تفاعل معين. ومع ذلك، هذه ليست سوى البداية: سواء عندما ينجح النموذج الأولي للدواء في أداء وظيفته، فيجب أن يخضع للعديد من الاختبارات من التجارب المختبرية إلى التجارب السريرية قبل أن يتمكن من الحصول على موافقة إدارة الغذاء والدواء (FDA) ليكون في السوق.
لا تعمل العديد من الإنزيمات على النحو الأمثل، أو حتى على الإطلاق، ما لم ترتبط بجزيئات مساعدة أخرى غير بروتينية محددة، إما مؤقتًا من خلال الروابط الأيونية أو الهيدروجينية أو بشكل دائم من خلال روابط تساهمية أقوى. هناك نوعان من الجزيئات المساعدة هما العوامل المساعدة والإنزيمات المساعدة. يعزز الارتباط بهذه الجزيئات التوافق الأمثل ووظيفة الإنزيمات الخاصة بها. العوامل المساعدة هي أيونات غير عضوية مثل الحديد (Fe ++) والمغنيسيوم (Mg ++). أحد الأمثلة على الإنزيم الذي يتطلب أيون معدني كعامل مساعد هو الإنزيم الذي يبني جزيئات الحمض النووي، وهو بوليميراز الحمض النووي، الذي يتطلب أيون الزنك المرتبط (Zn++) ليعمل. الإنزيمات المساعدة هي جزيئات عضوية مساعدة، ذات بنية ذرية أساسية تتكون من الكربون والهيدروجين، وهي ضرورية لعمل الإنزيم. المصادر الأكثر شيوعًا للأنزيمات المساعدة هي الفيتامينات الغذائية (الشكل\(\PageIndex{6}\)). بعض الفيتامينات هي سلائف للأنزيمات المساعدة والبعض الآخر يعمل مباشرة كإنزيمات مساعدة. فيتامين C هو إنزيم مساعد للعديد من الإنزيمات التي تشارك في بناء مكون النسيج الضام المهم، الكولاجين. يعد التحفيز بواسطة مركب متعدد الإنزيمات يسمى ديهيدروجينيز البيروفات خطوة مهمة في تكسير الجلوكوز لإنتاج الطاقة. نازعة البيروفات عبارة عن مركب من عدة إنزيمات تتطلب في الواقع عاملاً مساعدًا واحدًا (أيون المغنيسيوم) وخمسة إنزيمات عضوية مختلفة لتحفيز تفاعلها الكيميائي المحدد. لذلك، يتم تنظيم وظيفة الإنزيم جزئيًا من خلال وفرة من العوامل المساعدة والإنزيمات المساعدة المختلفة، والتي يتم توفيرها بشكل أساسي من خلال الأنظمة الغذائية لمعظم الكائنات الحية.
تقسيم الإنزيم
في الخلايا حقيقية النواة، عادة ما يتم تقسيم الجزيئات مثل الإنزيمات إلى عضيات مختلفة. هذا يسمح بمستوى آخر من تنظيم نشاط الإنزيم. يمكن وضع الإنزيمات المطلوبة فقط لعمليات خلوية معينة بشكل منفصل جنبًا إلى جنب مع ركائزها، مما يسمح بتفاعلات كيميائية أكثر كفاءة. تشمل الأمثلة على هذا النوع من تنظيم الإنزيمات بناءً على الموقع والقرب الإنزيمات المشاركة في المراحل الأخيرة من التنفس الخلوي، والتي تحدث حصريًا في الميتوكوندريا، والإنزيمات المشاركة في هضم الحطام الخلوي والمواد الغريبة، الموجودة داخل الليزوزومات.
تثبيط التغذية الراجعة في مسارات التمثيل الغذائي
يمكن للجزيئات تنظيم وظيفة الإنزيم بعدة طرق. ومع ذلك، يبقى السؤال الرئيسي: ما هي هذه الجزيئات ومن أين تأتي؟ بعضها عبارة عن عوامل مساعدة وإنزيمات مساعدة وأيونات وجزيئات عضوية، كما تعلمت. ما هي الجزيئات الأخرى في الخلية التي توفر التنظيم الأنزيمي، مثل التعديل الألستيري، والتثبيط التنافسي وغير التنافسي؟ الإجابة هي أن مجموعة متنوعة من الجزيئات يمكنها أداء هذه الأدوار. بعض هذه الجزيئات تشمل الأدوية الصيدلانية وغير الصيدلانية والسموم والسموم من البيئة. ربما تكون المصادر الأكثر صلة بالجزيئات التنظيمية للأنزيمات، فيما يتعلق بالأيض الخلوي، هي منتجات التفاعلات الأيضية الخلوية نفسها. بطريقة أكثر كفاءة وأناقة، تطورت الخلايا لاستخدام منتجات تفاعلاتها الخاصة لتثبيط التغذية الراجعة لنشاط الإنزيم. يتضمن تثبيط التغذية الراجعة استخدام منتج التفاعل لتنظيم إنتاجه الإضافي (الشكل\(\PageIndex{7}\)). تستجيب الخلية لوفرة منتجات معينة عن طريق إبطاء الإنتاج أثناء التفاعلات الابتنائية أو التقويضية. قد تمنع منتجات التفاعل هذه الإنزيمات التي حفزت إنتاجها من خلال الآليات الموضحة أعلاه.
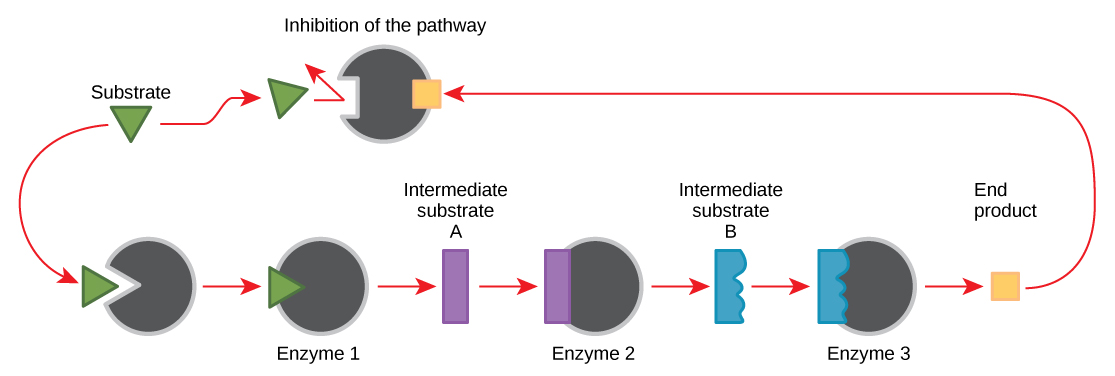
يتم التحكم في إنتاج كل من الأحماض الأمينية والنيوكليوتيدات من خلال تثبيط التغذية الراجعة. بالإضافة إلى ذلك، فإن ATP هو منظم ألوستيري لبعض الإنزيمات المشاركة في التحلل التقويضي للسكر، وهي العملية التي تنتج ATP. بهذه الطريقة، عندما يكون ATP وفيرًا، يمكن للخلية منع إنتاجها الإضافي. تذكر أن ATP هو جزيء غير مستقر يمكن أن ينفصل تلقائيًا إلى ADP. إذا كان هناك الكثير من ATP في الخلية، فسيضيع الكثير منه. من ناحية أخرى، يعمل ADP كمنظم ألوستيريك إيجابي (منشط ألوستيريك) لبعض الإنزيمات نفسها التي يثبطها ATP. وبالتالي، عندما تكون المستويات النسبية لـ ADP مرتفعة مقارنة بـ ATP، يتم تشغيل الخلية لإنتاج المزيد من ATP من خلال تقويض السكر.
ملخص
الإنزيمات هي محفزات كيميائية تعمل على تسريع التفاعلات الكيميائية في درجات الحرارة الفسيولوجية عن طريق خفض طاقة التنشيط. عادة ما تكون الإنزيمات عبارة عن بروتينات تتكون من سلسلة واحدة أو أكثر من سلاسل البولي ببتيد. تحتوي الإنزيمات على موقع نشط يوفر بيئة كيميائية فريدة تتكون من مجموعات معينة من الأحماض الأمينية R (المخلفات). هذه البيئة الفريدة مناسبة تمامًا لتحويل مفاعلات كيميائية معينة لهذا الإنزيم، والتي تسمى الركائز، إلى مواد وسيطة غير مستقرة تسمى حالات الانتقال. يُعتقد أن الإنزيمات والركائز ترتبط بملاءمة مستحثة، مما يعني أن الإنزيمات تخضع لتعديلات طفيفة في التوافق عند ملامسة الركيزة، مما يؤدي إلى الارتباط الكامل والأمثل. ترتبط الإنزيمات بالركائز وتحفز التفاعلات بأربع طرق مختلفة: جمع الركائز معًا في اتجاه مثالي، أو تعريض هياكل الروابط للركائز للخطر بحيث يمكن كسر الروابط بسهولة أكبر، أو توفير الظروف البيئية المثلى لحدوث رد فعل، أو المشاركة مباشرة في تفاعلها الكيميائي عن طريق تكوين روابط تساهمية عابرة مع الركائز.
يجب تنظيم عمل الإنزيم بحيث يتم تحفيز التفاعلات المرغوبة في خلية معينة في وقت معين ولا يتم تحفيز التفاعلات غير المرغوب فيها. يتم تنظيم الإنزيمات من خلال الظروف الخلوية، مثل درجة الحرارة ودرجة الحموضة. يتم تنظيمها أيضًا من خلال موقعها داخل الخلية، وأحيانًا يتم تقسيمها بحيث لا يمكنها تحفيز ردود الفعل إلا في ظل ظروف معينة. يعد تثبيط وتنشيط الإنزيمات عبر الجزيئات الأخرى طرقًا مهمة أخرى لتنظيم الإنزيمات. يمكن أن تعمل المثبطات بشكل تنافسي أو غير تنافسي أو حصري؛ وعادة ما تكون المثبطات غير التنافسية ألستيرية. يمكن للمنشطات أيضًا تعزيز وظيفة الإنزيمات بشكل ألوستيري. الطريقة الأكثر شيوعًا التي تنظم بها الخلايا الإنزيمات في مسارات التمثيل الغذائي هي من خلال تثبيط التغذية الراجعة. أثناء تثبيط التغذية الراجعة، تعمل منتجات المسار الأيضي كمثبطات (عادةً ما تكون ألستيرية) لواحد أو أكثر من الإنزيمات (عادةً أول إنزيم ملتزم في المسار) المشاركة في المسار الذي ينتجها.
مسرد المصطلحات
- موقع نشط
- منطقة محددة من الإنزيم الذي ترتبط به الركيزة
- تثبيط التخيصي
- التثبيط بحدث ملزم في موقع مختلف عن الموقع النشط، مما يؤدي إلى تغيير في التوافق ويقلل من تقارب الإنزيم مع الركيزة
- أنزيم مساعد
- جزيء عضوي صغير، مثل فيتامين أو مشتقه، وهو مطلوب لتعزيز نشاط الإنزيم
- عامل مساعد
- الأيونات غير العضوية، مثل أيونات الحديد والمغنيسيوم، اللازمة للتنظيم الأمثل لنشاط الإنزيم
- تثبيط تنافسي
- نوع التثبيط الذي يتنافس فيه المثبط مع جزيء الركيزة عن طريق الارتباط بالموقع النشط للإنزيم
- تشويه
- عملية تغير الخصائص الطبيعية للمادة
- تثبيط التغذية الراجعة
- تأثير منتج تسلسل التفاعل لتقليل إنتاجه الإضافي عن طريق تثبيط نشاط الإنزيم الأول في المسار الذي ينتجه
- نوبة مستحثة
- التوافق الديناميكي بين الإنزيم والركيزة، حيث يقوم كلا المكونين بتعديل هياكلهما للسماح بالربط المثالي
- الركيزة
- الجزيء الذي يعمل عليه الإنزيم


